Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.51 n.2 Ciudad de la Habana mayo-ago. 1999
INSTITUTO DE MEDICINA TROPICAL "PEDRO KOURÍ"
Análisis de ácidos grasos de cepas de Mycobacterium habana y Mycobacterium simiae
RESUMEN
Se analizan comparativamente las fracciones de ácidos grasos micobacterianos de cepas pertenecientes a las especies Mycobacterium habana y Mycobacterium simiae.En este estudio se emplea la técnica de cromatografía gas-líquido acoplada a espectrometría de masas. Se exponen y comparan los perfiles cromatográficos obtenidos por esta técnica, se demuestra su valor como elemento alternativo en la caracterización micobacteriana, con ella se analizan las posibles diferencias que puedan existir entre especies micobacterianas y llegar a identificar las fracciones de ácidos grasos presentes. Los resultados demuestran que las cepas en estudio presentan cantidades cuantificables de ácidos grasos con cadenas de más de 20 átomos de carbono. Entre las cepas existen pequeñas diferencias con respecto a estos componentes orgánicos, queda demostrado que cada una describe un patrón cromatográfico característico, aunque la composición de los ácidos grasos presentes es muy parecida en las 2 especies en estudio.
Descriptores DeCS: ACIDOS GRASOS; CROMATOGRAFIA EN CEPA DELGADA; MYCOBACTERIUM; MYCOBACTERIUM LEPRAE/ef drogas; MYCOBACTERIUM TUBERCULOSIS/ef drogas.
En la década de los 60, la cromatografía en capa fina ayudó a definir e identificar especies de micobacterias, a la vez que mostró la complejidad de los diferentes tipos de lípidos micobacterianos mediante el análisis de éstos en diferentes mezclas de solventes orgánicos. Esta técnica sigue usándose en la actualidad con los mismos fines.1
La aplicación de la cromatografía de gases en la identificación de micobacterias se desarrolló en forma paralela a la de la cromatografía en capa fina, al inicio combinada con pirólisis y posteriormente sola, como técnica analítica de ácidos grasos.2-5 Esta técnica se expandió con rapidez en las décadas de los 70 y 80, más tarde se incorporó a ella la espectrometría de masas, con el fin de conseguir una mayor resolución e información "cualitativa" de los perfiles cromatográficos. Esta combinación de técnicas se propone como método de detección rápida de algunos componentes celulares de micobacterias.6-8
Las especies Mycobacterium habana y Mycobacterium simiae han sido objeto de estudio de muchos investigadores pues presentan una taxonomía semejante, por su implicación patogénica se ha profundizado en el estudio de sus fracciones de lípidos. En el Mycobacterium habana se han encontrado 3 fracciones de antígenos proteicos que han reaccionado frente a sueros de pacientes enfermos de lepra y tuberculosis, lo que ha hecho que se piense en esta especie micobacteriana como posible candidato a vacuna contra estas enfermedades.9
En este trabajo se utilizan técnicas cromatográficas para el análisis de las fracciones de ácidos grasos de un grupo de cepas de Mycobacterium habana de la colección de laboratorio de los autores, las que habían sido caracterizadas por técnicas convencionales por Valdivia y otros en 1971,10 los perfiles cromatográficos de éstas son analizados comparativamente con los 2 serotipos del Mycobacterium simiae, especie descrita por Karasova y otros en 1965;11 en este caso las técnicas seleccionadas fueron cromatografía de gases acoplada a espectrometría de masas, con el objetivo de encontrar semejanzas o diferencias entre estas especies micobacterianas con respecto a estos componentes orgánicos, que tienen importantes funciones en este género microbiano.
MÉTODOS
Se analizaron 3 cepas pertenecientes a la especie M. habana aisladas de pacientes sintomáticos respiratorios (SR+14 d) éstas son las cepas 337, 220 y 493, además los 2 serotipos (I y II) de M. simiae, todas pertenecientes a la colección de cepas del Laboratorio Nacional de Referencias de Micobacterias y Tuberculosis del Instituto de Medicina Tropical "Pedro Kourí" (IPK). Las cepas fueron cultivadas en el medio de cultivo UIT-L durante un período de 3-4 semanas a 37 ° C.12,13
Para la técnica de cromatografía gas-líquido se utilizó: equipo JOEL, modelo JMS DX-300, columna capilar SRB-1 SUPELCO (30 m de largo, 0,32 mm d.), la temperatura de corrida fue de 80-280 °C, la temperatura del inyector de 280 °C.
Las condiciones de extracción y de trabajo empleadas fueron las referidas por Khoo y otros.9
RESULTADOS
Los resultados obtenidos por la técnica de cromatografía de gases acoplada a espectrometría de masas representados en las figuras 1, 2, 3, 4 y 5, son evaluados de forma cualitativa, de esta forma se compararon los perfiles cromatográficos de los ácidos grasos presentes en cada una de las cepas en estudio. En los anexos se muestran los ácidos grasos encontrados en cada cepa analizada.
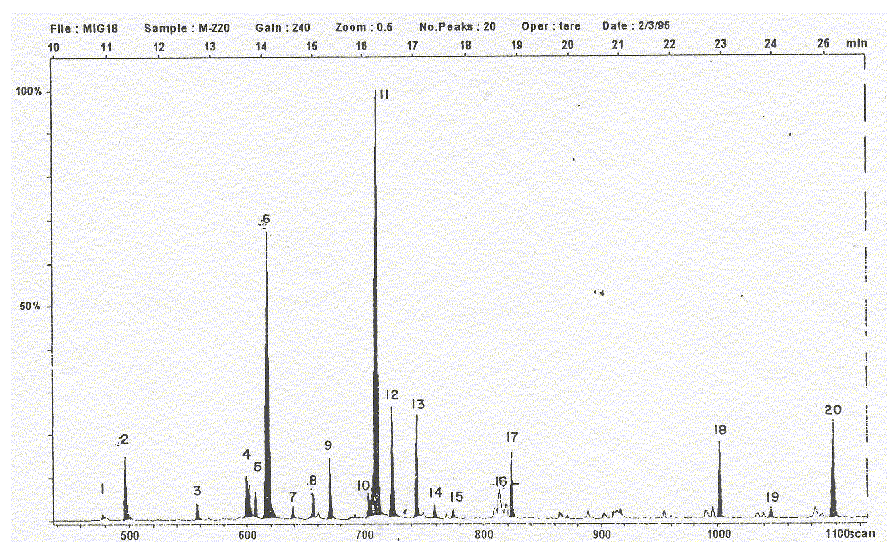
Fig. 1. Mycobacterium habana 220. Cromatograma obtenido al aplicar la técnica de cromatografía de gases acoplada a espectrometría de masas (GC-EM).
Para el análisis se tomó el criterio utilizado en la literatura de fragmentar los cromatogramas en 3 zonas. Una zona que incluye los ácidos grasos C14-17, otra el "pool de ácidos" C18 y una última zona que comprende los ácidos C24-26.14,15
Desde el punto de vista cualitativo los perfiles cromatográficos son muy similares, aunque se ponen de manifiesto diferencias puntuales entre el orden o presencia de determinados ácidos grasos micobacterianos.
Al observar en todas las figuras la primera zona a analizar (C14-17), ésta es bastante conservada en todas las cepas estudiadas; esta zona es la menos discutida por otros autores debido a que no muestra diferencias significativas,14 no obstante, llama la atención que en la cepa M. habana 337 (fig. 2) y M. simiae serotipo II (fig. 5) no presentan en esta zona el ácido miristoleico (C14:1), esto pudiera ser el primer criterio de diferenciación entre estas cepas.
Fig. 2. Mycobacterium habana 337. Cromatograma obtenido al aplicar la técnica de cromatografía de gases acoplada a espectrometría de masas (GC-EM).
Al observar la zona del "pool de ácidos C18" se observa una notable diferencia respecto al contenido del ácido araquídico (C20) sólo presente en 2 de las 5 cepas, M. habana 220 (fig.1) y M. habana 493 (fig. 3). Además, analizando de forma relativa las variaciones cuantitativas en esta zona, se pueden plantear ciertas relaciones de variación entre el contenido de diferentes ácidos grasos celulares de esta zona específica.
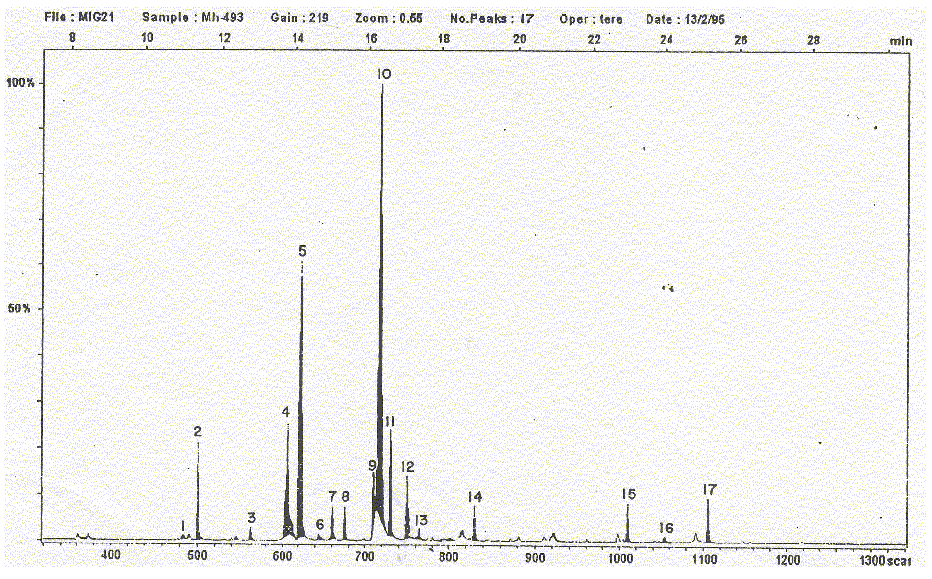
Fig. 3. Mycobacterium habana 493. Cromatograma obtenido al aplicar la técnica de cromatografía de gases acoplada a espectrometría de masas (GC-EM).
Por ejemplo, al analizar el coeficiente de ácido tuberculoesteárico/esteárico presente en la zona del "pool de ácidos" de C18, se llega a conclusiones importantes, pues el comportamiento más general es que el ácido esteárico sea un componente mayoritario con respecto al ácido tuberculo-esteárico,16 pero se hace significativa la inversión del cociente en las cepas M. habana 337 (cocien-te = 2,73) (fig. 2) y M. simiae I (cociente = 1,19) (fig. 4).
Fig. 4. Mycobacterium simiae (serotipo I). Cromatograma obtenido al aplicar la técnica de cromatografía de gases acoplada a espectrometría de masas (GC-EM).
La región más discutida en la literatura es la que comprende a los ácidos C24-26. Aunque en las cepas estudiadas el patrón general fue una mayor concentración de C26:0 con respecto a C24:0, estos perfiles pueden presentar variaciones en dependencia de la temperatura del inyector, que a su vez provocan una pirólisis de envergadura en los ácidos micólicos originando diferentes patrones en los perfiles cromatográficos respectivos, coincidimos con la literatura cuando describe esta zona importante para el establecimiento de un futuro diagnóstico.14,16
Por último otro detalle a destacar fue que la concentración de los ácidos palmítico (C26:0) y oleico (C18:1), sobresale del resto de las cepas estudiadas.
Mediante la cromatografía gaseosa es posible observar cómo, a excepción del Complejo Mycobacterium avium-Intracellulare, que no se diferencian entre sí, las demás micobacterias estudiadas muestran diferencias en su contenido de ácidos grasos de cadenas C12-C26.17
Por lo general, los cromatogramas o perfiles cromatográficos describen un patrón característico para las cepas estudiadas, la composición de ácidos grasos es bastante parecida para todas ellas. En todas es característico el alto contenido de ácidos palmítico y oleico, aunque pueden mencionarse algunas diferencias con respecto a otras especies de ácidos grasos: el ácido miristoleico (C14:1) no fue detectado en la cepa M. habana 337 (fig.2) y M. simiae II (fig.5), hecho que no permite afirmar su ausencia, por lo que trabajos futuros reafirmarán esta evidencia experimental. Además la inversión en el mayor contenido de ácido tuberculoesteárico que de esteárico encontrada en las cepas M.habana 337 (fig. 2) y M. simiae I (fig. 4), debe ser una característica a observar en todos los posibles trabajos encaminados a la obtención de una mejor clasificación taxonómica.
Fig. 5. Mycobacterium simiae (serotipo II). Cromatograma obtenido al aplicar la técnica de cromatografía de gases acoplada a espectrometría de masas (GC-EM).
Las cepas M. habana 220 y 493 (figs. 1 y 3, respectivamente) tienen diferencias respecto al ácido araquídico (C20:0) como especie particular de ambas cepas, además del ácido pentacosanoico (C25:0).
DISCUSIÓN
Según Casal,17 Mycobacterium tuberculosis especie típica de ese género, presenta sólo trazas de ácidos grasos de cadena C11 y no más largas que C20. Es característico un bajo contenido en mirístico (C14:0) y una cantidad relativamente escasa de palmitoleico (C16:1) siendo mayor el contenido en esteárico (C18:0), tuberculoesteárico (C19:0) y oleico (C18:1), que dan un aspecto tricúspide al cromatograma en esta zona, con predominio del tuberculoesteárico.17
De acuerdo con estos resultados, se puede plantear que las cepas estudiadas sí presentan cantidades cuantificables de ácidos grasos con cadenas de más de 20 átomos de carbono, en particular C24:0 y C26:0; también el contenido del ácido mirístico es semejante y oscila entre valores de 2,49 hasta 7,91 %, o sea, ni muy bajo pero tampoco muy alto. Con respecto al ácido palmitoleico (C16:1) se detectaron 2 isómeros cuyas relaciones cuantificables se comportaron con regularidad, mayor porcentaje del primero que del segundo; en la cepa M. habana 493 (fig.3), no fue posible la diferenciación de ambos isómeros y es el único caso donde se ve un aumento del porcentaje de área, es probable que sea debido a la columna que no es suficientemente específica para la separación de ácidos grasos.
La zona que comprende los ácidos C17 es extremadamente compleja en este género.16 Para estas cepas siempre fueron identificados 3 tipos de ácidos grasos, que en algunas se logró cuantificar y en otras sólo detectar; éstas fueron ácido metil-palmítico (C17:0), ácido heptadecenoico (C17:1) y ácido margárico (C17:0).
Se debe concluir que a pesar de que se ha planteado la similitud entre las especies M. habana y M. similae , en el estudio realizado se encuentran ciertas diferencias, no sólo entre estas 2 especies micobacterianas, sino también intraespecie.
Larson y otros, en 1985,14 plantearon la posibilidad de ejecutar en un grado razonable la reproductibilidad interlaboratorio de los perfiles de ácidos grasos, junto a la obtención de un banco de base de datos de cromatogramas de referencias con recomendaciones concernientes al cultivo, preparación de las muestras, condiciones analíticas, etcétera, que sin duda afectan la composición de ácidos grasos. Sin esto sería imposible aplicar la cromatografía gaseosa en el diagnóstico. Yassin y otros 18,19 emplearon la misma metodología para diferenciar especies dentro de este género. Se coincide con estos autores cuando recomiendan la utilización de la cromatografía de gases acoplada a espectrometría de masas para el análisis entre especies micobacterianas, tanto con fines taxonómicos o con diagnósticos.
ANEXO 1. Resultados obtenidos por la técnica de GLC para cada cepa utilizada
| CEPA Mycobacterium habana 220 | |||
| Pico | Nombre químico o trivial | Átomos de carbono | Área/total (%) |
| 1 | Ácido miristoleico | 14:1 | 0,22 |
| 2 | Ácido mirístico | 14:0 | 3,45 |
| 3 | Ácido pentadecanoico | 15:0 | 0,99 |
| 4 | Ácido palmitoleico | 16:1 | 3,77 |
| 5 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 1,07 |
| 6 | Ácido palmítico | 16:0 | 24,71 |
| 7 | Ácido metil-palmítico |
|
|
|
| (isómero) |
|
|
|
| (Probablemente 10-metil) | 17:0 | 0,56 |
| 8 | Ácido heptadecenoico | 17:1 | 1,30 |
| 9 | Ácido margárico | 17:0 | 2,69 |
| 10 | Ácido linoleico | 18:2 | 0,46 |
| 11 | Ácido oleico | 18:1 | 37,04 |
| 12 | Ácido esteárico | 18:0 | 5,73 |
| 13 | Ácido tubercoesteárico |
|
|
|
| (ácido 10-metil-esteárico) | 19:0 | 4,58 |
| 14 | Ácido nonadecenoico |
|
|
|
| (isómero) | 19:1 | 0,67 |
| 15 | Ácido metil-esteárico |
|
|
|
| (isómero) | 19:0 | 0,42 |
| 16 | No identificado (ND) | - | - |
| 17 | Ácido araquídico | 20:0 | 2,92 |
| 18 | Ácido lignocérico | 24:0 | 3,13 |
| 19 | Ácido pentacosanoico | 25:0 | 0,56 |
| 20 | Ácido cerotínico | 26:0 | 5,58 |
ANEXO 2. Ácidos grasos obtenidos en cada cepa estudiada
| Cepa Mycobacterium habana 337 | |||
| Pico | Nombre químico o trivial | Átomos de carbono | Área/total (%) |
| 1 | Ácido mirístico | 14:0 | 7,91 |
| 2 | Ácido pentadecanoico | 15:0 | 0,56 |
| 3 | Acido palmitoleico |
|
|
|
| (isómero) | 16:1 | 4,66 |
| 4 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 2,04 |
| 5 | Ácido palmítico | 16:0 | 26,06 |
| 6 | Ácido metil-palmítico |
|
|
|
| (isómero) |
|
|
|
| (probablemente 10-metil) | 17:0 | - |
| 7 | Ácido heptadecenoico |
|
|
|
| (isómero) | 17:1 | - |
| 8 | Ácido margárico | 17:0 | 0,88 |
| 9 | Ácido linoleico | 18:2 | 2,53 |
| 10 | Ácido oleico | 18:1 | 35,59 |
| 11 | Ácido esteárico | 18:0 | 4,13 |
| 12 | Ácido tuberculoesteárico |
|
|
|
| (ácido 10-metil-esteárico) | 19:0 | 11,30 |
| 13 | Ácido lignocérico | 24:0 | - |
| 14. | Ácido cerotínico | 26:0 | 0,76 |
ANEXO 3. CEPA Mycobacterium habana 493
| Pico | Nombre químico o trivial | Átomos de carbono | Área/total (%) |
| 1 | Ácido miristoleico | 14:1 | 0,11 |
| 2 | Ácido mirístico | 14:0 | 4,40 |
| 3 | Ácido pentadecanoico | 15:0 | 0,63 |
| 4 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 7,31 |
| 5 | Ácido palmítico | 16:0 | 23,02 |
| 6 | Ácido metil-palmítico |
|
|
|
| (isómero) |
|
|
|
| (probablemente 10-metil) | 17:0 | 0,21 |
| 7 | Ácido heptadecenoico |
|
|
|
| (isómero) | 17:1 | 1,46 |
| 8 | Ácido margárico | 17:0 | 1,22 |
| 9 | Ácido linoleico | 18:2 | 2,56 |
| 10 | Ácido oleico | 18:1 | 44,32 |
| 11 | Ácido esteárico | 18:0 | 4,97 |
| 12 | Ácido tuberculoesteárico |
|
|
|
| (ácido 10-metil-esteárico) | 19:0 | 2,91 |
| 13 | Ácido nonadecenoico |
|
|
|
| (isómero) | 19:1 | 0,53 |
| 14 | Ácido araquídico | 20:0 | 1,33 |
| 15 | Ácido lignocérico | 24:0 | 1,46 |
| 16 | Ácido pentacosanoico | 25:0 | - |
| 17 | Ácido cerotínico | 26:0 | 2,16 |
ANEXO 4. CEPA Mycobacterium simiae-I
| Pico | Nombre químico o trivial | Átomos de carbono | Área/total (%) |
| 1 | Ácido miristoleico | 14:1 | 0,15 |
| 2 | Ácido miristico | 14:0 | 3,60 |
| 3 | Ácido pentadecanoico | 15:0 | 0,45 |
| 4 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 6,60 |
| 5 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 3,35 |
| 6 | Ácido palmítico | 16:0 | 25,59 |
| 7 | Ácido metil-palmítico |
|
|
|
| (isomero) |
|
|
|
| (probablemente 10-metil) | 17:0 | 0,21 |
| 8 | Ácido heptadecenoico |
|
|
|
| (isomero) | 17:1 | 1,00 |
| 9 | Ácido margárico | 17:0 | 1,39 |
| 10 | Ácido linoleico | 18:2 | 1,15 |
| 11 | Ácido oleico | 18:1 | 39,17 |
| 12 | Ácido esteárico | 18:0 | 5,99 |
| 13 | Ácido tuberculoesteárico |
|
|
|
| (ácido 10-metil-esteárico) | 19:0 | 7,15 |
| 14 | No identificado (ND) | - | - |
| 15 | Ácido nonadecenoico |
|
|
|
| (isómero) | 19:1 | 0,36 |
| 16 | Ácido lignocérico | 24:0 | 0,92 |
| 17 | Ácido cerotínico | 26:0 | 1,40 |
ANEXO 5. CEPA Mycobacterium simiae II
| Pico | Nombre químico o trivial | Átomos de carbono | Área/total (%) |
| 1 | Ácido mirístico | 14:0 | 2,49 |
| 2 | Ácido pentadecanoico | 15:0 | 0,41 |
| 3 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 5,23 |
| 4 | Ácido palmitoleico |
|
|
|
| (isómero) | 16:1 | 2,34 |
| 5 | Ácido palmítico | 16:0 | 29,57 |
| 6 | Ácido metil-palmítico |
|
|
|
| (isómero) |
|
|
|
| (probablemente 10-metil) | 17:0 | - |
| 7 | Ácido heptadecenoico |
|
|
|
| (isómero) | 17:1 | 0,82 |
| 8 | Ácido margárico | 17:0 | 1,06 |
| 9 | Ácido linoleico | 18:2 | 2,41 |
| 10 | Ácido oleico | 18:1 | 43,76 |
| 11 | Ácido esteárico | 18:0 | 4,85 |
| 12 | Ácido tuberculoesteárico |
|
|
|
| (ácido 10-metil-estearico) | 19:0 | 4,01 |
| 13 | Ácido lignocérico | 24:0 | 0,87 |
| 14 | Ácido cerotínico | 26:0 | 1,46 |
SUMMARY
A comparative analysis of mycobacterial fatty acid fractions of Mycobacteriun habana and Mycobacterium sineae strains was made. This study used the gas-liquid chromatography coupled with mass spectrometry. Chromatographic profiles obtained from this technique were exposed and compared. This technique proves to be valuable as an alternative element in mycobacterial characterization and makes it possible to analyze the possible differences that may exist among mycobacterial species and to identify the present fatty acid fractions. The outcome proved that the studied strains had quantifiable quantities of over 20 C atom chain fatty acids. There are small differences among the strains in terms of these organic components. It was confirmed that each of then describes a characteristic chromatographic pattern although the composition of present fatty acids is very similar in both studied species.
Subject headings: FATTY ACIDS; CHROMATOGRAPHY; THIN LAYER; MYCOBACTERIUM TUBERCULOSIS/of drugs.
REFERENCIAS BIBLIOGRÁFICAS
- Brennan PJ, Shourhada M, Ullom B, McClatchy JK Gore MB Identification of atypical mycobacteria by thin-layer chromatography of their surface antigens. J Clin Microbiol 1978;8:374-9.
- Reiner E, Beam RE, Kubica P. Pyrolisis-gas liquid chromatography studies for the classification of mycobacteria. Am Rev Respir Dis 1969;99:750-9.
- Reiner E, Hicks JJ, Beam RE, Davis HL. Recent studies in mycobacterial differentiation by means of pyrolisis-gas-liquid-chromatography. Am Rev Respir Dis 1971;104:656-60.
- Thoen CO, Karlson AG, Ellefson RD, David HL. Fatty acids of Mycobacterium kansasii. Appl Microbiol 1971;21:628-32.
- Thoen CO, Karlson AG, Ellefson RD. Diferentiation between Mycobacterium kansasii and Mycobacterium marinum by gas-liquid chromatography analysis of cellular fatty acids. Appl Microbiol 1972;24:1009-10.
- Anderson O, Jantzen E, Closs O, Harbor M, Saxegaard F, Fosfadt F. Fatty acid and polar lipid analysis as tools in the identification of Mycobacterium leprae and some slow growing mycobacterial species. Ann Microbiol Inst Pasteur 1982;133B:29-37.
- Valero-Guillén PL. A thin-Layer chromatograpic method for separating methyl esters of mycobacteria mycolic acid. Acta Path Microbiol Immunol Scand Sect B, 1986;94:373-6.
- Valero-Guillén PL, Martín-Luengo F. Cromatografía de capa fina y cromatografía de gases en la identificación de micobacterias de interés clínico. Enf Infec Microbiol Clin 1987;5:361-6.
- Kay-Hooi K, Chatterjer D, Dell A, Morris HR, Brennan PJ, Draper P. Novel O-methyllated terminal glucuronic acid characterizes the polar glycopeptidolipids of Mycobacterium habana strain TMC 5135. J Biol Chem 1996; 271(21)12333-42.
- Valdivia JA, Suárez-Méndez R, Echemendía M. "Mycobacterium habana" probable nueva especie dentro de las especies no clasificadas. Bol Hig Epidm 1971;9:65-73.
- Karasova V, Weissfeiler JG, Krasnay J. Occurrence of atypical mycobacterial in Macaccus rhesus. Acta Microbiol Acad Sci Hung 1965;12:275-82.
- Mederos LM, Gutiérrez AM, Valdivia JA. Utilization of a new culture medium in biochemical tests for the mycobacterial classification. Mem Inst Oswaldo Cruz, Río de Janeiro 1990;87(3):441.
- Mederos LM, Ferrá C, Jiménez CA, Valdivia JA. Estudio de susceptibilidad en cepas de Mycobacterium intracellulare empleando el método de macrodilución en caldo. Rev Cubana Med Trop 1995;47(1):54-8.
- Larsson L, Jantzen E, Johnsson J. Gas chromatographic fatty acid profiles for characterization of Mycobacteria: an interlaboratory methodological evaluation. Eur J Clin Microbiol 1985;4(5):483-7.
- Valero-Guillén PL, Martín-Luengo F, Larsson L, Jiménez J, Juhlin Y, Portales F. Fatty acids mycolic acids of Mycobacterium malmoense. J Clin Microbiol 1988;26(1):153-4.
- Knisley CV. Rapid and sensitive identification of Mycobacterium tuberculosis. J Clin Microbiol 1985:22(5):761-7.
- Casal M. Microbiología clínica de las enfermedades por micobacterias. Córdoba: Facultad de Medicina, Ed. Universidad de Cordoba, 1990.
- Yassin AF, Binder C, Schaal KP. Identification of mycobacterial isolates by thin-layer and capillary gas-liquid chromatography under diagnostic routine conditions. Int J Med Microbiol Virol Parasitol Infec Dis 1993;279(1):34-48.
- Yassin AF, Binder C. Cellular fatty acid methyl ester profiles as a tool in the differentiation of members of the genus Mycobacterium. Int J Med Microbiol Virol Parasitol Infect Dis 1993;279(3):316-29.
Recibido: 7 de diciembre de 1999. Aprobado: 11 de mayo de 1999.
Lic. Lilian M. Mederos Cuervo. Intituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Licenciada en Microbiología. Investigadora Auxiliar. Instituto de Medicina Tropical "Pedro Kourí" (IPK).
2 Licenciado en Bioquímica. IPK.
3 Doctor en Ciencias Químicas. Investigador Titular. Centro Nacional de Investigaciones Científicas (CNIC).
4 Licenciada en Química. Investigador Auxiliar.
5 Técnico Químico. CNIC.
6 Especialista de II Grado en Microbiología. IPK.