Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.51 n.3 Ciudad de la Habana jul.-dic. 1999
Instituto de Medicina Tropical "Pedro Kourí"
Valoración de una novedosa tecnología para la detección de enterovirus en aguas negras
Resumen
Se reportó la valoración de una novedosa tecnología para la detección de enterovirus en aguas negras, basada en un método de recuperación viral que emplea el polietilenglicol como agente concentrador y el uso combinado del aislamiento viral y la reacción en cadena de la polimerasa, como técnicas de detección e identificación viral. Se confirmó que el método de recuperación viral es de alta eficiencia pues permite recuperar la totalidad de virus presentes en las aguas negras, y preservar su capacidad infectiva. Se demostró que la reacción en cadena de polimerasa (RCP) es menos sensible que el cultivo celular para la detección de enterovirus en aguas negras. También el método del isotiocianato de guanidina (GnTCN), cuyos componentes se pueden preparar en el laboratorio, es posible utilizarlo como alternativa para la extracción y purificación de ácidos nucleicos en sustitución del método comercial del TRIZOL, que es el recomendado por la Organización Mundial de la Salud en estos casos.
Descriptores DeCS: AGUAS RESIDUALES/virología; ENTEROVIRUS/aislamiento & purificación; REACCION EN CADENA POR POLIMERASA/métodos.
Poliomielitis anterior aguda o parálisis infantil epidémica son los términos con que se ha denominado a la infección aguda de la neurona motora de la médula espinal, que ha tenido como principales víctimas a los niños. Los poliovirus son los agentes causales y cualquiera de sus 3 serotipos puede provocarla.1
Como resultado del empleo de las vacunas, tanto inactivas como atenuadas, los casos de esta enfermedad han disminuido considerablemente y en la actualidad el poliovirus salvaje se encuentra circunscripto a zonas geográficas restringidas.2
Por causa de estos progresos la Organización Mundial de la Salud (OMS) se ha planteado para el año 2000 la erradicación del poliovirus salvaje, mediante la inmunización en forma de programas mantenidos y días nacionales de inmunización (campañas masivas). Una vez alcanzada la meta trazada será necesario seguir una estrategia para suspender la administración de la vacuna antipoliomielítica oral de virus vivo atenuado (VOP).3 Esta estrategia debe tener en consideración: el tiempo de circulación y la permanencia en el medio ambiente del poliovirus vacunal, su regresión a variantes más virulentas y la rápida acumulación de población susceptible.
La detección de poliovirus vacunales en las aguas negras puede brindar una información muy valiosa sobre la circulación de estos virus en la comunidad, ya que cantidades abundantes de poliovirus son excretadas en las heces fecales de las personas inmunizadas. Las aguas negras y otros desechos fecales pueden actuar como un vehículo de infección con las cepas vacunales, a la población susceptible que se acumula en los meses siguientes a la suspensión de la VOP.4
Por estas razones, en el presente trabajo se propone la valoración de una novedosa tecnología para la detección de enterovirus (EV) en aguas negras.
Métodos
Muestra de aguas negras
Una muestra de 1 L de aguas albañales fue colectada de una alcantarilla accesible seleccionada en la localidad de Punta Brava en la ciudad de La Habana, donde no existían contaminantes industriales que pudieran inactivar los virus. Ésta fue trasladada a 4 oC al laboratorio de enterovirus del Instituto de Medicina Tropical (IPK), donde se le adicionaron 0,4 mL de la cepa de poliovirus vacunal Sabin 1 con un título infectivo de 10-6TCID50/0,1 mL, previamente determinado por el método descrito por Melnick y otros.5
Recuperación del virus de las aguas negras
La recuperación viral a partir de las aguas negras se realizó con la metodología descrita por Shieh y otros.6 De forma general el método consistió en una separación inicial de los sólidos contenidos en la muestra, que fueron tratados 2 veces con extracto de carne a 3 % y cloroformo para eluir partículas virales asociadas con el material orgánico. El material resultante de este tratamiento fue unido con la muestra original y los virus fueron precipitados de esta solución con cloruro de sodio 0,3N y polietilenglicol 6 000 a 8 %. Por último, el sedimento fue resuspendido con tampón fosfato salino (PBS) y extracto de carne a 3 % para obtener el virus concentrado en un volumen final de casi 6 mL.
Para determinar la cantidad de poliovirus recuperado por este método se realizaron diluciones seriadas en base 10 (10-1 - 10-6) de la muestra concentrada con medio mínimo esencial (MEM) en un volumen de 5 mL y se sometieron a 2 métodos de detección viral: el aislamiento viral y la amplificación de ácidos nucleicos mediante la reacción en cadena de la polimerasa (RCP).
Aislamiento viral
La muestra concentrada y cada una de las diluciones correspondientes se inocularon por duplicado a razón de 200 mL por tubo en 2 sistemas celulares.
- Células de línea de Rhabdomiosarcoma humano (RD) en el rango de pases del 253 al 258.7
- Células de línea derivadas de la transfección de la línea celular L de ratón con el clon de ADNc (20B) del gen del receptor humano para poliovirus (L20B), en el rango de pases del 30 al 40.7,8
Como controles celulares se dejó un tubo de cada sistema sin inocular. Los cultivos se incubaron a 37 oC y se realizó la observación diaria hasta detectarse el efecto citopático (ECP) característico de enterovirus. La identificación de los aislamientos se realizó mediante la RCP.
Amplificación de ácidos nucleicos
Extracción de ácido ribonucleico (ARN): Para la obtención del ARN viral de la muestra concentrada y de cada una de las diluciones correspondientes se emplearon 2 metodologías.
- Método del isotiocianato de guanidina (GnTCN): Se realizó mediante el procedimiento empleado por Lanciotti y otros.9
- Método del TRIZOL: Se utilizó el método del TRIZOL LS Reagent comercial (BRL life thecnologies) según las instrucciones del fabricante.
RCP: Se tomó 1 m L de sobrenadante de cultivo celular o de ARN extraído, y se adicionó a una mezcla de reacción, preparada en un volumen de 17 m L que contenía 100 ng de cada uno de los cebadores a utilizar (tabla 1), tampón de amplificación 10 x (tris HCl 67 mM y pH 8,8, NH4SO4 17 mM, EDTA 6 m M, MgCl2 2 mM, 2-mercaptoetanol 1 mM) y 100 mM de cada deoxinucleótido trifosfatado (dATP, dGTP, dCTP, dTTP) (Pharmacia Biotech). Cada tubo de reacción se incubó durante 5 min a 95 oC en un bloque térmico (bioblock, Francia) para provocar la liberación del ARN viral. Al concluir esta incubación los tubos se colocaron inmediatamente en hielo y se adicionaron 32 mL de la mezcla de las enzimas que contenía 5 U de inhibidor de Rnasa (Promega), 1,66 U de transcriptasa inversa AMV (Promega), 1,26 U de Taq ADN Polimerasa (Promega). Los tubos fueron puestos en un termociclador (PTC 100 TM. MJ Research, Inc. Watertown Mass.) a las temperaturas de 42 oC durante 20 min, para la transcripción inversa, a lo que siguieron 30 ciclos con temperaturas de 95 oC por 45 s, 55 oC por 45 s y 70 oC durante 45 s, por último, la mezcla de reacción se dejó durante 5 min a 70 oC.
Tabla 1. Secuencia nucleotídica y posición en el genoma de los cebadores
| Código | Posición | Secuencia |
| EV/RCP-1 | (584-603) | 5ACCGACGAATACCACTGTTA 3' |
| EV/RCP-2 | (450-474) | 5CCTCCGGCCCCTGAATGCGGC TAAT 3' |
| Sabin 1/RCP-1 | (2584-2601) | 5TCCACTGGCTTCAGTGTT 3' |
| Sabin 1/RCP-2 | (2505-2523) | 5AGGTCAGATGCTTGAAAGC 3 |
EV/RCP1-2: Cebadores complementarios y paralelos que hibridan con sitios altamente conservados dentro de la región 5NTR del genoma de los enterovirus.
Sabin 1/RCP1-2: Cebadores complementarios y paralelos que permiten la amplificación de secuencias de la zona VP1 de la cepa vacunal Sabin 1.
Para la detección del producto amplificado se analizaron 10 mL de cada tubo de reacción en una electroforesis en gel de agarosa a 4 % con bromuro de etidio, a una concentración final de 0,1-0,2 mg/mL.
Resultados
Aislamiento viral
Se obtuvo ECP hasta la dilución 10-6, tanto en las células RD como en las L20B. Al identificar estos aislamientos mediante la RCP se pudo demostrar la presencia de agentes virales del género enterovirus, por la obtención de bandas de 154 pb con los cebadores EV/RCP-1 y EV/RCP-210 en ambas líneas celulares. Se pudo corroborar además que la cepa de Sabin 1 era la responsable del ECP producido, por la obtención de bandas de 97 pb en todas las diluciones con los cebadores Sabin 1/RCP-1 y Sabin 1/RCP-211 en ambas líneas celulares (tabla 2).
Tabla 2. Resultados de los aislamientos y su identificación por RCP
| Diluciones | Aislamiento | EV/RCP-1 | Sabin | 1/RCP-1 | ||
| Puro | + | + | + | + | + | + |
| 10-1 | + | + | + | + | + | + |
| 10-2 | + | + | + | + | + | + |
| 10-3 | + | + | + | + | + | + |
| 10-4 | + | + | + | + | + | + |
| 10-5 | + | + | + | + | + | + |
| 10-6 | + | + | + | + | + | + |
Amplificación de ácidos nucleicos
Los resultados de la detección de poliovirus presentes en la muestra de aguas albañales mediante la RCP, con el uso de los 2 métodos de extracción de ácidos nucleicos se muestran a continuación.
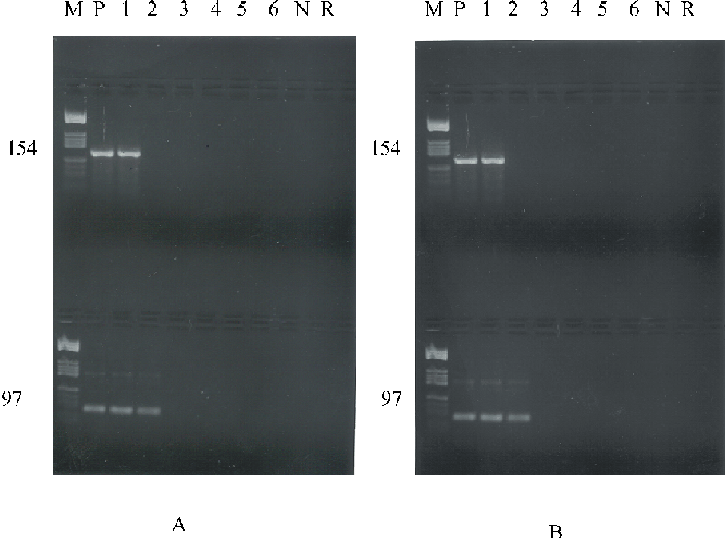
- GnTCN-RCP: Se obtuvieron bandas de amplificación de 154 pb hasta la dilución 10-1 con los cebadores EV/RCP-1 y EV/RCP-2, y de 97 pb hasta la dilución 10-1 con los cebadores Sabin 1/RCP-1 y Sabin 1/RCP-2 (fig. 1A).
- TRIZOL-RCP: Se obtuvieron fragmentos amplificados hasta la dilución 10-1 para los cebadores de Rotbart y hasta la dilución 10-2 para los cebadores de Yang (fig. 1B).
Leyenda: M: Patrón de peso molecular; P: productos de amplificación de la muestra concentrada; 1, 2, 3, 4, 5, 6:
productos de amplificación de las diluciones en base 10 (10-1 - 10-6) de la muestra concentrada
respectivamente: N: control celular; R: control de reactivos.
Fig.1. Eficiencia del método de concentración viral a partir de aguas negras
mediante la RCP. Parte superior de la figura, con el uso los cebadores EV/RCP-1
y EV/RCP-2 y parte inferior, utilizando los cebadores Sabin 1/RCP-1
y Sabin 1/RCP-2. A: Método del GnTCN-RCP. B: Método del TRIZOL-RCP.
Discusión
Han pasado más de 45 años desde que se iniciaron los primeros estudios intensivos sobre la presencia de virus entéricos humanos en el agua.12 Muchos estudios en aguas negras han demostrado la prevalencia estacional de los poliovirus, fundamentalmente en épocas de lluvia y su persistencia en este medio por algunos meses. En estos estudios se han usado distintos métodos que permiten concentrar los virus a partir de las muestras de agua como son la adsorción directa, floculación físico-química directa, hidroextracción, ultrafiltración y separación en 2 fases.13
En Cuba, en particular, se han efectuado investigaciones que indican de forma aproximada el tiempo de permanencia y circulación del poliovirus en la población; no obstante, no se ha definido con exactitud el tiempo de circulación y permanencia en el medio ambiente.14 Estos estudios se han basado en la búsqueda de dichos agentes en aguas negras mediante el método de adsorción-elución con sales de calcio, seguido del aislamiento en células Vero7 y MRC-57 e identificación con sueros hiperinmunes a poliovirus.15
Para estudiar el comportamiento de los poliovirus vacunales en el ambiente, en el presente trabajo se propuso la valoración de una novedosa tecnología basada en un método de recuperación viral, con el empleo del polietilenglicol como agente concentrador y el uso combinado del aislamiento viral y la RCP como técnicas de detección e identificación viral.
Se evaluó la eficiencia del método de recuperación viral mediante la determinación de la cantidad de poliovirus recuperado a partir de 1 L de aguas negras con una cantidad conocida de virus.
El aislamiento se realizó mediante las células RD y un nuevo sistema celular, las células L20B, que son altamente específicas para poliovirus. Los resultados obtenidos en las células RD indicaron que agentes virales del género enterovirus son responsables de los ECP obtenidos en cada una de las diluciones. Sin embargo, las células RD permitieron la multiplicación de un amplio número de enterovirus presentes en las aguas albañales, por lo que los ECP en este sistema celular no representaron la presencia de poliovirus en la muestra.
Por otro lado, el resultado obtenido con las células L20B permitió plantear que la presencia de poliovirus en la muestra concentrada era la responsable de los efectos obtenidos en cada una de las diluciones, pues las células L20B expresan el receptor humano para poliovirus y por tanto son susceptibles sólo a la infección por esos agentes.
Para corroborar estos hallazgos se procedió a la identificación de los aislamientos mediante el sistema de RCP con cebadores universales del género EV y cebadores específicos a la cepa Sabin 1. Los resultados de estos ensayos coincidieron con los obtenidos en ambas líneas celulares y permitieron afirmar que la presencia de la cepa de Sabin 1 en la muestra de aguas negras concentrada era la responsable de los ECP obtenidos, tanto en las células RD como las L20B.
De esta forma se demostró que el método de recuperación de virus a partir de las aguas albañales es altamente eficiente, pues brinda la posibilidad de recuperar la totalidad de virus en la muestra y preservar su capacidad infectiva. Estos resultados tienen una extraordinaria importancia pues numerosos estudios que utilizan los enterovirus como modelos, han demostrado que el tratamiento de las aguas negras no siempre es efectivo, y en muchos casos se obtiene una reducción de la concentración de virus.16
Al aplicar la RCP como método de detección de virus directamente en las aguas negras, se obtuvieron resultados que no están en correspondencia con los que deben esperarse al relacionar la sensibilidad del sistema17 y los resultados del aislamiento. Esta diferencia puede ser por causa de la presencia en las aguas negras de una gran cantidad de inhibidores de la amplificación, entre los que se pueden citar: compuestos orgánicos y fenólicos, metales pesados, urea y extractos bacterianos,18,19 que pueden actuar en uno o más pasos esenciales de la reacción de amplificación, ya sea al provocar interferencia con la extracción de ácidos nucleicos, degradarlos o impedir la actividad de las enzimas necesarias para la reacción.20
Aunque se aplicaron 2 métodos de extracción de ácidos nucleicos que usan reactivos potentes inhibidores de las Rnasas,9 el método de recuperación viral no elimina todos los inhibidores de la amplificación, lo que trae como consecuencia los niveles tan bajos de detección viral encontrados en la RCP con respecto al aislamiento viral. Este resultado está en correspondencia con el de otros investigadores si se tiene en cuenta que la presencia de inhibidores de la RCP es un hecho frecuente, encontrado en la mayoría de los métodos de recuperación viral a partir de aguas negras reportados en la literatura.6,21,22
Es de destacar que con ambos métodos de extracción de ácidos nucleicos se obtuvieron resultados similares. Esto es de gran importancia pues permite que el método del GnTCN, cuyos componentes se pueden preparar en el laboratorio, se pueda utilizar como alternativa para la extracción y purificación de ácidos nucleicos a partir de muestras de aguas negras, en sustitución del método comercial del TRIZOL que es el recomendado por la OMS en estos casos. La diferencia en los límites de detección al utilizar los cebadores Sabin 1 y EV puede ser explicada por la sensibilidad reportada para cada uno.10,11
Por último es necesario aclarar, que estos resultados no indican que la RCP se deje de utilizar como método de detección viral a partir de aguas negras. Tanto el aislamiento viral como la RCP deben ser utilizados para estudiar el comportamiento del poliovirus vacunal en el ambiente. Con el cultivo celular podemos detectar la presencia de virus infectivo en las aguas negras, esto es una alerta pues si el virus persiste en esta forma por largo tiempo en el ambiente, se corre el riesgo de que circulen en la población susceptible que se acumula después de suspendida la vacunación y reviertan a sus formas virulentas. Sin embargo, el cultivo celular no brinda toda la información necesaria sobre el comportamiento del virus en el ambiente, pues con la obtención de un cultivo celular negativo no se puede discernir si es por causa de la ausencia de poliovirus en la muestra o a la presencia de éste, pero sin capacidad infectiva. Con la RCP se pudiera llegar a demostrar, que las cepas de poliovirus vacunales pueden persistir en el ambiente sin capacidad infectiva, lo cual sería extremadamente valioso pues de esta forma se elimina el riesgo de que circulen en la población susceptible.
Los resultados de la evaluación de esta novedosa tecnología para la detección de EV en aguas negras demuestran que puede ser utilizada para estudiar la persistencia del poliovirus vacunal en el ambiente y poder brindar conocimientos básicos que le permitan a la OMS formular una estrategia mundial para la interrupción de la VOP una vez erradicada en el mundo la circulación del poliovirus salvaje. Además la tecnología queda disponible para acometer cualquier estudio relacionado con la circulación de enterovirus en el ambiente.
Summary
This paper reported the appraisal of a novel thechnology for the detection of enterovirus in sewage based on a viral recovery method using polyethilenglycol as a concentrating agent and on the combined use of viral isolation and polymerase chain reaction as viral detection and identification techniques. It was also confirmed that the viral recovery method is highly efficient since it allows to recover all viruses present in sewage and to preserve their infective capacity. It was proved that the polymerase chain reaction (PCR) is less sensitive than cell culture for detecting enteroviruses in sewage. It is also possible to use guadinine isothiocyanate, whose components can be prepared in the lab, as an alternative method for taking out and purifying nucleic acids instead of using the conventional TRIZOL method wich is the one recommended in these cases by the World Health Organization.
Subject headings: SEWAGE/virology; ENTEROVIRUS/isolation and purification; POLYMERASE CHAIN REACTION/methods.
Referencias bibliográficas
- Melnick JL. Enterovirus: Poliovirus, Coxsackievirus, Echovirus and newer enteroviruses. En: Fields BN, Knipe DM. Virology. 2nd ed. New York: Raven, 1990;549-609.
- Olen MK, Mick NM, Galina YL, Edson ES, Mark AP. Molecular epidemiology of poliovirus Semin Virol 1995;6:401-14.
- Cochi SL, Hull HF, Sutter RW, Wilfert CM, Katz SL. Commentary: the unfolding story of global Poliomielitis eradication. J Infect Dis 1997;175(Suppl 1):S1-S3.
- Hellen CU, Wimmer E. Enterovirus genetics. En: Rotbart HA, ed. Human enterovirus infections. Washington DC ASM, 1995;25-53.
- Melnick JL, Wimbert IL. Liophilized combination of the enterovirus equine antisera: new LBM pools prepared from reserves of antisera stored frozen for two decades. Bull World Health Organ 1985;63:543-50.
- Shieh YS, Wait D, Tai L, Sobsey MD. Methods to remove inhibitors in sewage and other fecal wastes for enterovirus detection by the polymerase chain reaction. J Virol Methods 1995;54(1):51-6.
- American Type Culture Collection. Catalogue of cell lines and hybridomas. 7ma. ed. Rockville: American Type Culture Collection, 1992:48.
- Mendelsohn CL, Johnson B, Leonetti KA, Nobis P, Wimmer E, Recaniello VR. Transformation of a human poliovirus receptor gene into mouse cells. Proc Natl Acad Sci 1986:83:7845-9.
- Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vordam V. Rapid detection typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol 1992;30:545-51.
- Rotbart HA. Enzymatic RNA amplification of the enteroviruses. J Clin Microbiol 1990;28:438-42.
- Yang CF, Lina De, Holloway BP, Pallansch MA, Kew OM. Detection and identification of vaccine related polioviurus by the polymerase chain reaction. Virus Res 1991;20:159-79.
- Melnick J. Poliomyelitis virus in urban sewage in epidemic and non epidemic times. Am J Hyg 1947;45:240-53.
- Hurst C, Benton W, Stetler R. Detecting viruses in water. J Am Water Assoc 1989;81(9):71-80.
- Más LP, Bravo JR, Andrus JK, Comellas MM. Galindo MA, Cuadros CA de, et al. Lesson from Cuba: mass campaign administration of trivalent oral polio vaccine and seroprevalence of Poliovirus neutralizing antibodies. Bull World Health Organ 1994;72(2):221-55.
- Más LP, Resik AS, Comellas MM, Galindo MA, Balmaseda A. Marcador serológico como indicador de no circulación de Poliovirus en Cuba. Rev Cubana Med Trop 1992;44:177-80.
- Walter R, Maureen EB. The biological principles of poliovirus eradication. J Infect Dis 1997;175:286-92.
- Kilpatrick DR, Nottay B, Yang SJ, Silva E da, Peñaranda S, Pallansch M, et al. Serotype-specific identification of polioviruses buy PCR using primers containing mixed-base of deoxyinosine residues at positions of codon degeneracy. J Clin Microbiol 1998;36(2):352-7.
- Saulnier P, Andremont A. Detection of genes in feces by booster polymerase chain reaction. J Clin Microbiol 1992;30:2080-3.
- Schwab KJ, De L, Sobsey MD. Immunoaffinity concentration of waterborne enteric viruses for detection by reverse transcriptase PCR. Appl Environ Microbiol infect 1996;62:2086-94.
- Wilson IG. Inhibition and Facilitation of nucleic acid amplification. Invair Microbiol 1997;63(10):3741-51.
- Reynolds KA, Gerba CP, Pepper IL. Detection of infectious enteroviruses by an integrated cell - PCR procedure. Appl Environ Microbiol infect 1996;62(4):1424-7.
- Gantzer C, Senouci S, Maul A, Levi Y, Schwartzbrod L. Enterovirus genome in wastewater: concentration on glass wool and glass powder and detection by RT-PCR. J Virol Methods 1997;65(2):265-71.
Recibido: 23 de junio de 1999. Aprobado: 19 de julio de 1998.
Lic. Luis Sarmiento Pérez. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.
1 Máster en Virología. Licenciado en Microbiología. Aspirante a Investigador.
2 Doctor en Ciencias Médicas. Especialista de II Grado en Microbiología. Investigador de Mérito.
3 Máster en Virología. Especialista de I Grado en Microbiología.
4 Técnica en Microbiología.
5 Especialista de I Grado en Microbiología.
6 Máster en Virología. Licenciada en Microbiología. Investigadora Auxiliar.