My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.51 n.3 Ciudad de la Habana July-Dec. 1999
Instituto de Medicina Tropical "Pedro Kourí"
Vacuna VA-MENGOC-BC: su repercusión sobre la enfermedad meningocócica en niños de 1 a 4 años
Dr. Antonio Pérez Rodríguez1 y Dr. Félix O. Dickinson Meneses2
Resumen
La vacuna VA-MENGOC-BC ha sido aplicada a lactantes en Cuba desde 1991 mediante el Programa Nacional de Inmunizaciones (PNI) por lo que resultaba necesario evaluar sus efectos en los niños de 1 a 4 años incluidos en el grupo de mayor riesgo. Para esto se realizó un estudio descriptivo del comportamiento de morbimortalidad por enfermedad meningocócica (EM), se tuvieron en cuenta los antecedentes vacunales de los 145 casos ocurridos entre 1991 y 1996. Entre los resultados más importantes estuvo la tendencia decreciente de la densidad de incidencia (DI) de EM en todos los grupos de edad del período estudiado, el mayor descenso se destacó en los niños de 1 año con una DI de 10,8/100 000 niños/años al inicio del período y 0,68/100 000 niños/años al final. La distribución porcentual de la ocurrencia fue con predominio de los niños de 1 año al inicio de la ejecución del programa, con un cambio hacia los de 3 y 4 años al final. Un alto porcentaje de niños enfermos vacunados tenían más de un año de inmunizados (promedio de 697,5 d). Hubo 35 fallecidos durante el período, el mayor descenso de la densidad de mortalidad (<1/100 000 niños/año) se observó a partir de 1993, y correspondió a los niños de 2 años el mayor riesgo de morir. De los fallecidos vacunados 73,1 % tenían más de 1 año de inmunizados. La letalidad general resultó de 24,1 % y la más baja de 14,3 % en niños de 1 año de edad. Los cambios experimentados en el comportamiento de la EM en un grupo de tan alto riesgo atribuibles a la aplicación de la vacuna como parte del PNI, justifican plenamente su continuidad.
Descriptores DeCS: INFECCIONES MENINGOCOCICAS/epidemiología; INFECCIONES MENINGOCOCICAS/mortalidad; VACUNAS BACTERIANAS/uso terapéutico; NEISSERIA MENINGITIDIS/inmunología.
En la actualidad la enfermedad meningocócica (EM) constituye un tema de gran interés sanitario mundial, sobre todo para aquellos países en vías de desarrollo.1
Las variantes clínicas más graves de la enfermedad, la meningococcemia (MC) y la meningoencefalitis (MM), provocan con frecuencia serias secuelas y una alta mortalidad, afectan con mayor frecuencia a las edades extremas de la vida, sobre todo la población infantil menor de 5 años.2
De las vacunas existentes para la prevención de esta enfermedad,3-5 VA-MENGOC-BC es la que hasta el momento ha mostrado una mayor eficacia y efectividad contra el serogrupo B6-9 y se aplica desde 1991 a menores de 1 año con una primera dosis a los 3 ½ 12; meses y la segunda a los 5 ½ 12; meses mediante el Programa Nacional de Inmunizaciones (PNI), lo que convierte a Cuba en el único país en el mundo que aplica esta estrategia preventiva. Por esta razón resulta de interés evaluar sus efectos sobre el comportamiento de la morbimortalidad por EM en los niños de 1 a 4 años de edad que fueron vacunados en su etapa de lactantes, más aún cuando han transcurrido 6 años de ejecución de este programa.
Métodos
Se realizó el estudio descriptivo de 145 niños comprendidos entre 1 y 4 años de edad con diagnóstico de EM ocurridos entre el 1ro. de enero de 1991 y el 31 de diciembre de 1996 y notificados al Instituto "Pedro Kourí" mediante el Sistema de Información Directa (SID). Toda la información fue obtenida de la vigilancia y encuestas epidemiológicas confeccionadas en el control de foco establecido nacionalmente.
Se consideró enfermo o caso a todo aquel con manifestaciones clínicas compatibles con enfermedad meningocócica con uno o más de los criterios siguientes: 1. aislamiento de Neisseria meningitidis de la sangre o líquido cefalorraquídeo (LCR), 2. una microscopia directa positiva a diplococos arriñonados gramnegativos, 3. una prueba de antígeno positiva para meningococo.
Se definió vacunado a todo el que hubiera recibido 2 dosis de la vacuna VA-MENGOC-BC, y vacunación incompleta, al que sólo recibió una dosis.
La población para el cálculo de la densidad de incidencia (DI) y densidad de mortalidad (DM)10 se obtuvo en el Centro Nacional de Estudios de Población y Desarrollo, y fue considerada como población-año a estos efectos.
Se realizó además la distribución porcentual de casos EM por edades simples por año de ocurrencia, y se calculó la letalidad y el porcentaje de formas clínicas según antecedente vacunal. Se determinó el tiempo transcurrido entre la segunda dosis y el comienzo de la enfermedad, de esta forma se obtuvo una distribución de frecuencias absolutas y relativas. Se aplicó la prueba de comparación de proporciones para identificar diferencias significativas entre las formas clínicas ocurridas en vacunados y no vacunados.
Para el procesamiento y la presentación de los datos se utilizaron los paquetes EPINFO 6.0, Harvard Graphics y Microsoft Word 97 para WINDOWS.
Resultados
En el período de estudio ocurrió un total de 145 enfermos; correspondieron 49 a 1 año, 38 a 2 años, 34 a 3 años, y 24 a 4 años de edad.
En general hubo una tendencia decreciente de la DI de EM, observable por edad, se destaca que tanto la DI máxima (10,8/100 000 niños/año durante 1991) como las mínimas (0,67 y 0,68/100 000 niños/año en 1995 y 1996 respectivamente) se registraron en los niños de 1 año de edad (tabla 1).
Tabla 1. Enfermedad meningocócica en niños de 1-4 años. Número de enfermos y densidad de incidencia por edad simple según años de ocurrencia. Cuba, 1991-1996
| 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | |||||||
| Edad | No. | DI | No. | DI | No. | DI | No. | DI | No. | DI | No. | DI |
| 1 | 20 | 10,83 | 16 | 9,3 | 5 | 3,20 | 6 | 3,41 | 1 | 0,67 | 1 | 0,68 |
| 2 | 11 | 6,02 | 9 | 4,86 | 8 | 4,60 | 4 | 2,25 | 4 | 2,63 | 2 | 1,36 |
| 3 | 16 | 8,65 | 7 | 3,76 | 2 | 1,07 | 3 | 1,69 | 3 | 1,91 | 3 | 1,97 |
| 4 | 7 | 3,98 | 6 | 3,24 | 3 | 1,63 | 5 | 2,72 | 0 | 0 | 3 | 1,91 |
| Total | 54 | 7,41 | 38 | 5,22 | 18 | 2,57 | 18 | 2,51 | 8 | 0,98 | 9 | 1,33 |
DI: densidad de incidencia.
Fuente: Sistema de información directa.
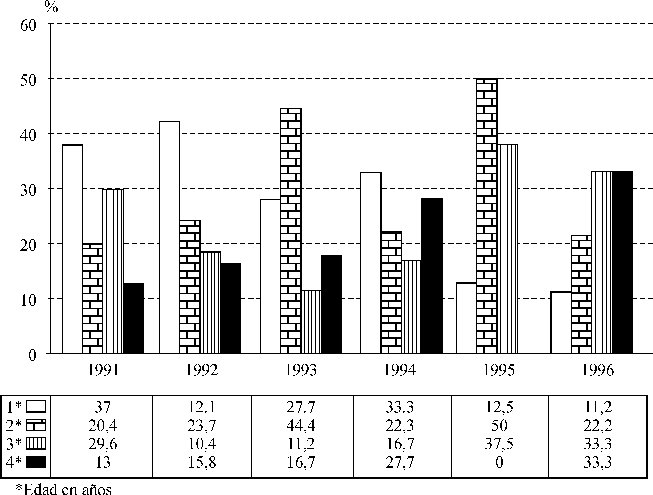
En la distribución porcentual del número de enfermos por edad y año de ocurrencia, tuvieron mayores porcentajes los de 1 año en 1991, 1992 y 1994, mientras que los de 2 años lo hicieron durante 1993 y 1995; en 1996 predominaron los porcentajes en niños de 3 y 4 años, se apreció que estos últimos mantuvieron un ascenso constante en el porcentaje con el decursar de los años (con excepción del año 1995 los niños de 4 años), contrario a lo apreciado en los de 1 año (fig. 1).
Fig. 1. Enfermedad meningocócica en niños de 1 a 4 años. Distribución porcentual
por edad y años de ocurrencia. Cuba, 1991-1996.
Del total de 145 enfermos, 108 (74,5 %) estaban vacunados y en general la forma clínica predominante fue la meningoencefalitis (62,8 %), aunque en menor proporción (56,5 %) entre los vacunados, de tal manera que al comparar las proporciones de meningococcemia entre vacunados (43,5 %) y no vacunados (17,6 %), la diferencia resultó significativa (p < 0,01) (tabla 2).
Tabla 2. Enfermedad meningocócica en niños de 1 a 4 años según forma clínica
y antecedentes vacunales. Cuba, 1991-1996
| Vacunación | ||||||||
| Forma | No | Sí | Incompleta | Total | ||||
| No. | % | No. | % | No. | % | No | % | |
| MC | 6 | 17,6 | 47 | 43,5 | 1 | 33,3 | 54 | 37,2 |
| MM | 28 | 82,3 | 61 | 56,5 | 2 | 66,7 | 91 | 62,8 |
| Total | 34 | 100,0 | 108 | 100,0 | 3 | 100,0 | 145 | 100,0 |
Test de diferencia de proporciones X2 = 8,48 p = 0,0035
MC: meningococcemia. MM: meningoencefalitis.
Fuente: Sistema de información directa.
En los enfermos vacunados, 61,1 % tuvo un intervalo de tiempo transcurrido a partir de la segunda dosis y el comienzo de la enfermedad por encima de 365 d, con un promedio de 697,5. Por años de ocurrencia se comportó similar, fluctuó entre 80,0 % (1995) y 50,0 % (1996).
Durante 1991 y 1992 ocurrió el mayor número de fallecidos con DM discretamente superior a 1/100 000 niños/año observados; correspondió el mayor riesgo de morir a los de 2 años de edad con DM 2/100 000 niños/año observados. En todos los grupos se observó una importante reducción de la DM, en especial a partir del año 1993 (tabla 3).
Tabla 3. Enfermedad meningocócica en niños de 1-4 años. Número de fallecidos y densidad de mortalidad por edad simple según años de ocurrencia. Cuba 1991-1996
| 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | |||||||
| Edad (años) | No. | DM | No. | DM | No. | DM | No. | DM | No | DM | No | DM |
| 1 | 3 | 1,6 | 2 | 1,2 | 0 | 0 | 1 | 0,6 | 1 | 0,6 | 0 | 0 |
| 2 | 5 | 2,7 | 4 | 2,2 | 3 | 1,7 | 1 | 0,6 | 0 | 0 | 0 | 0 |
| 3 | 3 | 1,6 | 3 | 1,6 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 1,3 |
| 4 | 2 | 1,1 | 3 | 1,6 | 0 | 0 | 1 | 0,5 | 0 | 0 | 1 | 0,6 |
| Total | 13 | 1,4 | 12 | 1,3 | 3 | 0,4 | 3 | 0,3 | 1 | 0,1 | 3 | 0,4 |
DM: densidad de mortalidad.
Fuente: Sistema de información directa.
La letalidad general resultó de 24,1 % (35/145), se observó también su valor más alto a los 2 años de edad con 34,2 % (13/38) y el menor entre los de 1 año de edad con 14,3 % (7/49). La letalidad en los niños de 3 años fue de 23,5 % (8/34) y de 29,1 % (7/24) para los de 4 años de edad.
Se debe destacar que 19 (73,1 %) de los 26 fallecidos vacunados, enfermaron después del año de aplicada la segunda dosis, con una media de 752,6 d. No tenían antecedentes de vacunación 8 fallecidos y en 1 se comprobó la vacunación incompleta.
Un total de 61 vacunados (56,5 %) tuvieron errores en el intervalo de aplicación de las interdosis de la vacuna, es decir estaban fuera del rango de 42 a 56 d establecido como óptimo.
Por último, se debe señalar que en 82 enfermos (17 no vacunados y 2 con vacunación incompleta) se identificó Neisseria meningitidis del serogrupo B y sólo en 2 casos el serogrupo A.
Discusión
La aplicación por primera vez en el mundo de la vacuna antimeningocócica B-C a los menores de 1 año mediante un PNI como política de salud, se acomete en Cuba desde 1991 con el objetivo de alcanzar cambios en el comportamiento de la enfermedad en niños de alto riesgo (< 5 años). Como consecuencia de esta estrategia se produjo un rápido descenso de la DI y DM en el país para las edades comprendidas entre 1 y 4 años. Por tanto el riesgo de enfermar disminuyó en este grupo, con un cambio o desplazamiento de la mayor ocurrencia a la edad de 1 año al inicio del período, hacia 3 y 4 años al final. Este cambio del comportamiento se debe a que la protección alcanzada a partir de los 6 meses de edad de acuerdo con el esquema de aplicación de la vacuna alcanza su máxima expresión a la edad de 1 año, y constituye así el grupo que recibe los mayores beneficios.
Existen reportes de que en vacunas antimeningocócicas contra los serogrupos A y C, catalogadas como más inmunogénicas,11 los niveles de anticuerpos disminuyen a partir de los 2 años de aplicada, y contra el B se demostraron títulos de anticuerpos bactericidas altos a los 20 meses de vacunados, al contrario de los niveles de anticuerpos determinados por la técnica ELISA que descendieron a los 6 meses.12 Estos datos, unidos a que más de 70 % de los niños vacunados enfermaron a partir del año de aplicada la segunda dosis con un promedio de 25 meses, pudiera justificar la utilidad de una tercera dosis o una reactivación al año de aplicada la segunda dosis, para mantener los niveles adecuados de anticuerpos y alcanzar una mejor protección.
Por otra parte no es recomendada la inmunización rutinaria con las vacunas antimeningocócicas polisacarídicas disponibles, por el corto período de duración de la inmunidad y los fracasos en la protección contra las infecciones del serogrupo B.13 En contraposición, los resultados evidencian que esta estrategia de vacunación sistemática produce un cambio favorable en el comportamiento de la EM en niños menores de 5 años, aun sin considerar que estas experiencias pudieran ser mejoradas con la aplicación de una dosis de refuerzo.
La alta cobertura vacunal alcanzada en Cuba y otras cuestiones ya señaladas antes relacionadas con la duración de la inmunidad, unidas al hecho de que alrededor de 57 % de los vacunados tuvieron errores en el intervalo entre las dosis aplicadas, explica en parte que la enfermedad paradójicamente tenga alta frecuencia en niños vacunados. Todo ello sin tener en cuenta además, que pudieran existir algunos problemas relacionados con la cadena de frío, las técnicas incorrectas de aplicación y otros propios de la ejecución de un programa de tal magnitud.
En 1983, momento del pico epidémico de la EM, los niños de 1-4 años presentaban elevadas tasas de morbilidad; se destacaron máximas de 40,1/100 000 niños de 1 año y mínimas de 25/100 000 niños de 4 años de edad14 en plena correspondencia con los riesgos encontrados por edad al inicio del programa, pero con cifras inferiores. Esto reafirma que el desplazamiento del riesgo a edades mayores fue el resultado del efecto de 6 años de aplicación sistemática de la vacuna a los lactantes. De esta manera, al concluir 1996, sólo 11,2 % de los enfermos del grupo en estudio eran de 1 año de edad contra 66,6 % para los de 3 y 4 años.
La forma clínica predominante fue la meningoencefalitis, esto coincidió con otros estudios.15 Una alta proporción de los enfermos vacunados presentaron meningococcemia, lo que pudiera estar relacionado con una mayor protección de la vacuna para las formas meníngeas o con factores inherentes al huésped susceptible16-18 y en menor cuantía con la circulación de cepas dado que no se ha encontrado cambio en el serogrupo circulante. El predominio en la circulación del serogrupo B confirma también lo importante de haber mantenido la inmunización sistemática.
La DM comenzó a tener una reducción importante a partir de 1993, ocurrió en 71,4 % de los 35 fallecidos entre 1991 y 1992, es decir los primeros años de ejecución del programa y donde hubo un franco predominio en niños de 2 años; edad donde también se concentró la mayor letalidad (34,2 %) en concordancia con lo expresado antes, respecto a la posible disminución de la inmunidad a partir del año de aplicada la última dosis. El hecho de que la letalidad en los niños de 1 año haya sido la menor con 14,3 %, está en concordancia con los resultados antes expresados, que ubican al grupo de 1 año como el que mayor beneficio ha recibido con la vacunación de los lactantes mediante el PNI.
La letalidad también es un indicador muy relacionado con la calidad de la atención médica y con la virulencia del agente, aspectos que no fueron abordados en este estudio.
Un elemento a destacar fue que 73,1 % de los 26 fallecidos que estaban vacunados enfermaron y murieron después de 365 d de aplicada la última dosis.
Esta experiencia permite concluir que los cambios experimentados en el comportamiento de la EM a niveles bajos de incidencia, unidos con el desplazamiento del mayor riesgo a las edades de 3 y 4 años constituyen un importante aval para continuar la aplicación de la vacuna en el PNI, más aún si se incorpora al esquema una dosis de refuerzo.
Agradecimientos
A los epidemiólogos de unidades y centros municipales y provinciales de Higiene y Epidemiología que participan en la vigilancia epidemiológica de la enfermedad meningocócica.
Summary
VA-MENGOC-BC vaccine has been administered to Cuban infants since 1991 through the National Immunization Program (NIP) so it was necessary to evaluate its effects on 1-4 years-old children included in the highest risk group. To this end, a descriptive study of the morbidity and mortality from meningoccocal disease was carried out taking the vaccine histories of 145 cases occured from 1991 to 1996 inro account. The decreasing trend of the incidence density (ID) of meningococcal disease in all the age groups in the studied period was among the most important results, the highest decline was observed in one-year old infants with an ID of 10.8 per 100 000 children /years at the end of the period. The percen distribution of occurence showed a predominance of one-year old group at the beginning of the program. Implementation, and a change to 3-4 years old group at the end of the period. A high of percent of vaccinated sick children had been immunized against MD over one year ago (697.5 days as average). 35 children died during the period and the highest mortlity density decline (1 per 100 000 children a year) was observed as of 1993; 2 years-old children were at highest risk of death. Seventy three percent (73.1 %) of those vaccinated had been immunized for over once year. The general lethality was 24.1 %, the lowest was 14.3 % in one year old children. The changes occured in meningococcal disease behaviour within this high risk group, which are atrributed to the administration of vaccine as part of the NIP fully justifies the continuation of the application of this vaccine.
Subject headings: MENINGOCOCCAL INFECTIONS/epidemiology; MENINGOCOCCAL INFECTIONS/mortality; BACTERIAL VACCINES/therapeutic use; NEISSERIA MENINGITIDIS/immunology.
Referencias bibliográficas
- Nósof SD. Infecciones por meningococo. En: Enfermedades infecciosas infantiles. Moscú: Editorial MIR, 1980:302-12.
- Martínez E. Enfermedad meingocócica. Fisiopatología, cuadro clínico y pronóstico. Rev Hosp Niños Baires 1994;36(158/159):204-14.
- Gómez LF. Vacunas contra Neisseria meningitidis B y C. Memorias del XX Congreso Colombiano de Pediatría, Medellín, editor Álvaro Posada Díaz, 1997:98-103.
- Vacunas contra la meningitis meningocócica: situación actual. Bol PAI 1994;15(2):13-5.
- Froholm LO, Berdal BP, Bovre K. Meningococcal group B vaccine in Norway 1981-1982. NIPH Ann 1991;6:133-8.
- Sierra G, Campa C, Varcárcel M. Vaccine against group B. Neisseria meningitidis. Protection trial and mass vaccination results in Cuba. NIPH Ann 1991;14(2):195-210.
- Sierra G, Campa C, García I. Efficacy evaluation of the Cuban vaccine VAMENGOC-BC against disease caused by serogroup BN. Meningitidis. En: Achtman M, Marchal C, Morelli, G, Seiler A, Thiesen B, eds. Neisseria 1990, Berlin: Walter de Gruyter, 1991:129-34.
- Almeida L, Rico O. Información general sobre la enfermedad meningocócica en Cuba. Vacuna para su prevención y alcance. Rev Hosp Niños Baires 994;36(158/159):234-41.
- Noronha CP, Struchiner CJ, Halloran ME. Assessment of the direct effectiveness of BC meningococcal vaccine in Río de Janeiro, Brazil: a case-control study. Int J Edpidemiol 1995;24(5):1050-7.
- Rothman KJ. Mediciones de frecuencia de una enfermedad. Epidemiología moderna. Madrid: Editorial Díaz de Santos, 1987:30-6.
- Zangwill KM, Stout RW, Carlone GM, País L, Harekeh H, Mitchell S, et al. Duration of antibody response after meingococcal polysaccharide vaccination in US Air Force personnel. J Infect Dis 1994;169(4):847-52.
- Boslego J, García J, Cruz C, Zollinger W, Brandt B, Ruiz S, et al. Efficacy, safety and immunogenicity of a meningococcal group B(15:P1.3) outer membrane protein vaccine in Iquique, Chile. Chilean National Committee for Meningococcal Disease. Vaccine 1995;13(9):821-9.
- WHO. Other vaccines that can be used as a part of EPI. Immunization Policy WHO/EPI/GEN 1995;03 rev 1:34-6.
- Pérez A, Menéndez MC. Algunas consideraciones epidemiológicas sobre la enfermedad meningocócica en niños de 1 a 4 años de edad en Cuba. Rev Cubana Hig Epidemiol 1986;24(4):467-74.
- Echeverry ML, Malberty JA, Galeano LA, Sotolongo FT, Galguera MA, Montoya CM, et al. Respuesta inmune humoral a las proteínas de una vacuna antimeningocócica BC en un ensayo realizado en Antioquía, Colombia. Bol Of Sanit Panam 1995;118(4):285-94.
- Deuren M van, Ven Jongekrijg J van der, Bartelink AK, Dalen R van, Sauerwien RW, Meer JW van der. Correlation between proinflammatory cytokines and antiinflammatory mediators and the severity of disease in meningococcal infections. J Infect Dis 1995;172(2):433-9.
- Guftormsen HK, Wetzler IM, Solberg CO. Humoral immuneresponse to class 1 outer membrane protein during the course of meningococcal disease. Infect Immunol 1994;62(4):1437-43.
- Scholten RJ, Bijlmer HA, Valkenburg HA, Denkert J. Patient and strain characteristics in relation to the outcome of meningococcal disease a multivariate analysis. Epidemiol Infect 1994;112(1):115-24.
Recibido: 19 de abril de 1999. Aprobado: 10 de junio de 1999.
Dr. Antonio Pérez Rodríguez. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. Correo electrónico:antonio@ipk.sld.cu
1 Especialista de II Grado en Epidemiología. Profesor Asistente. Investigador Titular.
2 Máster y Especialista de II Grado en Epidemiología. Especialista de I Grado en Higiene Escolar. Profesor Asistente. Investigador Agregado.