My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.52 n.2 Ciudad de la Habana May-Aug. 2000
INSTITUTO DE MEDICINA TROPICAL " PEDRO KOURÍ"
Necesidad del uso de cromógenos para cuantificar promastigotes de Leishmania en placas de 96 pozos
Lic. Ana Margarita Montalvo,1 Dr. Sergio Sifontes,2 Téc. Ivón Montano3 y Dra. Ana Margarita Espino4
RESUMEN
Las dificultades que aún persisten en el tratamiento de las leishmaniosis justifican el ensayo de la acción de nuevos productos sobre formas del parásito, en la búsqueda de una alternativa terapéutica a esta parasitosis. Dada la necesidad de establecer un procedimiento para evaluar la actividad in vitro de productos naturales y sintéticos en las condiciones cubanas, el propósito de este trabajo fue definir la utilidad del uso del p-nitrofenilfosfato como sustancia cromógena para la cuantificación de parásitos en placas de 96 pozos. Para normalizar este método colorimétrico se establecieron las etapas de la curva de crecimiento del parásito. El estudio de linealidad y selección del volumen de muestra que resultaba óptimo para la realización de los ensayos mostró que con 200 mm se obtuvo el máximo coeficiente de determinación lineal. Asimismo, se comparó el coeficiente de variación en presencia y ausencia del cromógeno y se estudió la influencia de los cambios del medio de cultivo en la lectura de las absorbancias. El límite de cuantificación establecido demostró la necesidad del uso del cromógeno para los propósitos de este trabajo y los resultados en general permiten recomendar esta metodología, menos subjetiva, simple de ejecutar y rápida, para ensayar los productos que resulten de interés en este campo.
Descriptores DeCS: COMPUESTOS CROMOGENICOS/farmacología; NITROFENOLES/análogos y derivados;NITROFENOLES/farmacología; LEISHMANIA/efectos de drogas.
Leishmania existe en 2 estructuras diferentes en su morfología y fisiología: promastigote, forma en que se presenta en los vectores, y amastigote, estadio que existe en los hospederos vertebrados.1 La enfermedad es transmitida por la picadura de moscas chupadoras de sangre (géneros Phlebotomus y Lutzomyia) contaminadas a partir de humanos (leishmaniosis antropozoonótica) o animales infectados (leishmaniosis zoonótica). Existe en todos los continentes habitados, excepto Australia.2 Se presentan anualmente 1 500 000 a 2 000 000 de casos nuevos de esta parasitosis, se estima que existan más de 12 000 000 de enfermos en el mundo y 350 000 000 con riesgo de contraer la enfermedad cada año.3
Durante más de 50 años los derivados de antimonio pentavalente han sido los medicamentos de elección.4 En la actualidad, el pentostam Ò (gluconato sódico de antimonio)Ò y el glucantime (antimoniato de meglumina) son las formas de antimonio pentavalente existentes en el mercado. Éstas no son eficaces contra todas las especies, resultan en particular poco sensibles L. aethiopica y L. major.5,6Su eficacia contra las especies normalmente susceptibles no es de 100 %, y es cada vez mayor el número de cepas que desarrollan resistencia a los derivados de antimonio pentavalente.7 Su uso ha sido limitado por los efectos adversos, y es causa frecuente de interrupción del tratamiento. Se asocian con los derivados de antimonio pentavalente la pancreatitis subclínica (31 %), la cardiotoxicidad (15 %) y la nefrotoxicidad en 5 % de los casos.8 Los pacientes con SIDA coinfectados con Leishmania son en particular sensibles a la pancreatitis, al punto de ser considerada una causa potencial de muerte en estos individuos.9
La anfotericina B y la pentamidina son los otros 2 medicamentos disponibles para el tratamiento de la leishmaniosis. Por causa de su toxicidad se reservan para los casos resistentes a los derivados de antimonio pentavalente.6,10 De la anfotericina B se han desarrollado formulaciones en lípidos (alphocil Òy ambisoneÒ) con menor toxicidad y adecuada eficacia, pero el precio no es asequible a la mayoría de la población afectada.6 La anfotericina B es un antifúngico de potente actividad in vitro e in vivo contra Leishmania,6,11,12 no obstante, puede causar anafilaxis, trombocitopenia, dolor generalizado, convulsiones, fiebre, escalofríos, flebitis, anorexia, anemia, insuficiencia renal (glomerulolubular) e hipocalcemia.6
Muchos productos han demostrado efectividad in vitro, unos pocos en modelos animales y algunos se encuentran en evaluación clínica.7 Se han ensayado derivados naturales de plantas13 y productos sintéticos,14-16 para esto se han empleado diversas metodologías.
El indicador más común utilizado para medir la actividad in vitro de un principio activo, es la concentración de éste que es capaz de inhibir el crecimiento de los parásitos en 50 %. Para ello se enfrentan cultivos del parásito a diferentes concentraciones de droga y se determina la cantidad de éstos luego de un período de incubación predeterminado. El conteo de los parásitos en cámara de Neubauer es la metodología clásica empleada para determinar las concentraciones celulares que alcanzan los cultivos. No obstante, por ser un procedimiento laborioso y algo subjetivo se ha sustituido por contadores celulares electrónicos y se han desarrollado técnicas colorimétricas y radiactivas. Dentro de los métodos colorimétricos se han empleado como cromógenos sales de metiltetrazolium que tienen el inconveniente de ser insolubles en agua, por lo que requieren de extracciones alcohólicas que hacen la técnica más compleja.17 Recién se ha adaptado el uso del pnitrofenilfosfato (pNPP) al conteo de tripanosomatídeos. Este es un cromógeno incoloro que por la acción de las fosfatasas ácidas de los parásitos cambia a p-nitrofenol, de color amarillo. Tiene la ventaja de ser soluble en agua, lo que permite realizar el ensayo en un solo paso.15
En ensayos preliminares se encontró que al leer una suspensión de promastigotes en un espectrofotómetro de luz ultravioleta-visible, se obtuvieron valores relativamente altos de absorbancia, que disminuían en la medida en que aumentaba la longitud de onda. Además se encontró que existía una relación lineal entre la concentración de promastigotes y los valores de absorbancia obtenidos. Se utilizó como base esto para conocer si podían realizarse lecturas en placas de 96 pozos a las mínimas longitudes de onda disponibles sin emplear cromógeno, con la finalidad de definir la necesidad de su uso en la cuantificación de promastigotes. Esta meta está relacionada con la necesidad de establecer un procedimiento objetivo y rápido para la evaluación de la actividad in vitro de productos naturales o sintéticos en las condiciones estudiadas.
MÉTODOS
Para la realización de los ensayos se empleó la cepa de Leishmania amazonensis MHOM/77//LTB0016, gentilmente cedida por el Departamento de Inmunología de la Fundación Oswaldo Cruz, Río de Janeiro, Brasil.
Curva de crecimiento: Para conocer las distintas etapas del crecimiento de la cepa utilizada se estudió su curva de crecimiento, se tuvo en cuenta la necesidad de emplear promastigotes en fase exponencial de multiplicación. Partiendo de un cultivo de Leishmania amazonensis con 48 h de incubación se sembraron frascos para cultivos celulares (Nunc, Denmark), de 25 cm2 con 1,25 x 105 promastigotes/ mL en medio de Schneider, suplementado con 10 % de suero fetal bovino (WL, Inmunoquímica, Río de Janeiro, Brasil), 200 UI de penicilina y 200 mg/mL de estreptomicina. Fueron incubados a 26 oC durante 7 d. Se tomaron muestras diarias por duplicado, que fueron fijadas en solución de formaldehído 1 %, para realizar diariamente, durante los 7 d, el conteo del número de parásitos en cámara de Neubauer. Se realizaron 3 experi-mentos de 2 réplicas cada uno y se dibujó la curva de crecimiento de este parásito, en estas condiciones. Se determinó cuándo comienza y termina cada fase del crecimiento y se estimó el tiempo medio de generación.
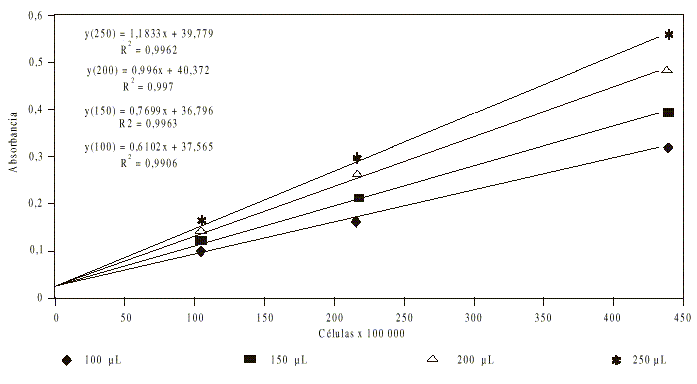
Estudio de linealidad y selección del volumen de muestra óptimo: Para realizar un estudio de linealidad y seleccionar el volumen de muestra que resulta óptimo para la cuantificación de los promastigotes en los cultivos, se realizaron diluciones seriadas 1/2 de éstos, se abarcó el rango de 1,6 x 105 a 8,5 x 107 células/mL. Los parásitos, en distintas concentraciones, fueron transferidos a placas de cultivo Nunc de 96 pozos, de fondo plano. Los volúmenes de muestra evaluados fueron 100, 150, 200 y 250 µL. Las placas fueron leídas en un lector de ELISA (EMS Reader MF Versión 2,4-0) a 405 nm. A partir de los datos, se obtuvieron la curvas de absorbancia en función de las concentraciones de parásitos, para los diferentes volúmenes de muestra.
Coeficientes de variación: Una vez evaluado el volumen de muestra óptimo se compararon los coeficientes de variación en presencia o ausencia de pNPP, con el objetivo de conocer las variaciones que introducía esta sustancia cromógena al ser adicionada a los cultivos. Siguiendo el protocolo anterior fueron transferidos a los pozos 200 µL de las mismas diluciones de promastigotes, la placa se leyó a 405 nm. Después se agregaron en cada pozo 20 mL de pNPP ( 20 mg/mL) en Tritón X-100 1 % en acetato de sodio 1 M, pH 5,5. Se incubó la placa durante 5 h a 37 °C, tiempo tras el cual se efectuó la lectura a 405 nm.
Cambios en el medio de cultivo: Con el objetivo de conocer si el crecimiento de los parásitos producía cambios en el medio de cultivo que pudieran falsear las lecturas de las absorbancias, se sembraron tubos que contenían 1,25 x 105 promastigotes/mL en medio de Schneider completo y fueron incubados a 26 °C por 5 d. De forma similar, se incubaron en iguales condiciones tubos con medio de cultivo sin inocular. Luego de ese tiempo se centrifugaron todos los tubos a 1 700 gravedades, durante 20 min, con la finalidad de obtener los sobrenadantes y determinar sus absorbancias a 405 nm, una vez transferidos a una placa a razón de 200 µL por pozo.
Determinación del límite de cuantificación: El límite de cuantificación es uno de los indicadores de sensibilidad de los métodos analíticos y representa, en este caso, la mínima concentración de promastigates que el método es capaz de medir o cuantificar con exactitud. Para determinar el límite de cuantificación se partió de un tubo de cultivo en fase logarítmica de crecimiento, se centrifugó a 1 700 gravedades durante 10 min y se resuspendió en la mitad del volumen con medio fresco. Se realizó el conteo en cámara de Neubauer y se ajustó a 107 promastigotes/mL a partir de lo cual se prepararon diluciones con medio para obtener 10 concentraciones entre 107 y 104 promastigotes/mL. Las distintas diluciones fueron transferidas a placas de 96 pozos, de aplicaron las concentraciones de parásitos en las columnas 1-10 y en las 11 y 12 se aplicó medio de cultivo para determinar la absorbancia media y la desviación estándar de éstos. Las placas fueron leídas inmediatamente a 405 nm. Después se aplicó el pNPP según se describió en ensayos anteriores; la placa se incubó a 37oC durante diferentes tiempos, de manera que las lecturas fueron realizadas cada 1 h, entre las 2 y 6 h.
Se obtuvieron las ecuaciones de regresión lineal para determinar los límites de detección y cuantificación mediante la fórmula siguiente: 18
Lc= media blanco + 10 x DE blanco
pendiente
RESULTADOS
Curva de crecimiento: Luego de las primeras horas de evolución del cultivo (fig.1) en que se observó un crecimiento sostenido de parásitos, se obtuvo una fase logarítmica de crecimiento que se extendió entre las 24 y 96 h posteriores a la inoculación. A partir de aquí, se observó una desaceleración de casi 24 h de duración, que condujo a la fase estacionaria, en la que no se produjeron nuevas divisiones de los parásitos. Esta última fase se extendió hasta las 168 h, final del período estudiado. El tiempo de generación fue de 12,4 h.
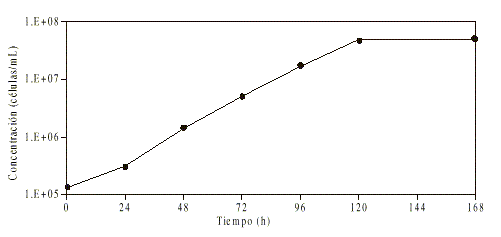
Fig. 1. Curva de crecimiento de L. amazonensis en medio de Schneider + SFB 10 %.
Estudio de linealidad y selección del volumen de muestra óptimo: La evaluación de los diferentes volúmenes de muestra (fig. 2) evidenció que al emplear 250 µL se obtuvo la mayor pendiente de la curva. Sin embargo, el intervalo lineal resultó más estrecho, pues se observó una caída de la pendiente superior a 5 % por encima de 2 x 105 promastigotes/mL con lo que se reduce el intervalo de linealidad. Con 200 mL se obtuvo el máximo coeficiente de determinación lineal y el intervalo de linealidad se extendió hasta 4,2 x 107 promastigotes/mL, por lo que este volumen fue escogido para la realización de los trabajos posteriores.
Fig. 2. Curvas de absorbancia en función de las concentraciones celulares con el empleo de diferentes volúmenes de muestra.
Coeficiente de variación: El coeficiente de variación medio y el rango en que oscilan éstos para las diferentes concentraciones de promastigotes fue similar (tabla) para los pozos en que se evaluó el medio de cultivo libre de cromógeno y en aquéllos que contenían esta sustancia.
TABLA. Coeficientes de variación y límites de cuantificación antes y después de aplicar el p-nitrofenilfosfato
| Tiempo de incubación | Coeficientes de variación media (%) | mínimo-máximo | Absblanco | DEblanco | Pendiente(x10-7) | intercepto | LC (células/mL) |
| sin pNPP | 1,3 | 0,3-3,8 | 0,147 | 0,001 | 1,0617 | 0,150 | 9,9E+05 |
| 2h | 1,9 | 0,7-4,0 | 0,266 | 0,006 | 5,6487 | 0,265 | 1,9E+05 |
| 3h | 1,7 | 0,6-3,2 | 0,276 | 0,006 | 7,5934 | 0,277 | 8,4E+04 |
| 4h | 1,6 | 0,5-3,0 | 0,279 | 0,004 | 9,4676 | 0,282 | 2,0E+04 |
| 5h | 2,1 | 0,7-2,9 | 0,292 | 0,009 | 11,206 | 0,294 | 4,8E+04 |
| 6h | 2,0 | 0,7-3,3 | 0,294 | 0,008 | 12,564 | 0,300 | -4,9E+03 |
LC: límites de cuantificación. Absblanco: absorbancia del blanco; DEblanco: desviación estándar del blanco.
Cambios en el medio de cultivo: El sobrenadante del medio de cultivo en que se sembraron parásitos mostró una absorbancia media (0,160) algo menor (p < 0,05) a la del medio no inoculado (0,166).
Determinación del límite de cuantificación: El límite de cuantificación (tabla ) sin aplicar pNPP fue de casi 106 promastigotes/mL. Por el contrario, pudo comprobarse que cuando éste se adicionaba, el límite de cuantificación disminuía en función del tiempo: a las 2 h, resultó aún superior a 10,5 pero luego de 3 h pudieron hacerse mediciones con suficiente confiabilidad a concentraciones inferiores a ésta.
DISCUSIÓN
En el estudio de la curva de crecimiento de los promastigotes en medio de Schneider se evidenciaron las fases características del desarrollo de estos microorganismos en los cultivos in vitro.19 La lectura de los ensayos de inhibición del crecimiento se realiza generalmente durante la fase exponencial, de forma tal que su delimitación permitió seleccionar cultivos con 24-96 h de incubación para el diseño de los demás ensayos.
El estudio de los diferentes volúmenes de muestra evidenció una mayor sensibilidad al emplear 250 µL. Sin embargo, el intervalo lineal es más reducido que al aplicar 200 µL, volumen con el que se obtuvo el máximo coeficiente de determinación lineal; de ahí que fuera escogido como volumen de muestra óptimo.
El estudio de los coeficientes de variación con el empleo o no de pNPP demostró que, en este aspecto, ambas técnicas son similares. Asimismo, para todas las concentraciones de promastigotes los coeficientes de variación fueron inferiores a 5 %, de manera que la variabilidad mostrada por las 2 técnicas es aceptable.18 Además, estos valores son similares a los obtenidos por Bodley y otros20 al emplear el procedimiento descrito para el pNPP.
Al evaluar la influencia del crecimiento de los parásitos sobre las propiedades colorimétricas del medio de cultivo pudo comprobarse que se producía una disminución de su absorbancia. No obstante, la diferencia entre las medias de los grupos fue sólo de 0,006. Lo anterior sugiere que es posible realizar las lecturas de las placas de cultivo sin necesidad de centrifugarlas para eliminar el medio, con lo que se simplifica la realización del ensayo.
Sin aplicar pNPP el límite se cuantificación no fue lo suficientemente bajo, si se tiene en cuenta que la mínima cantidad de células que podrían estar presentes en los ensayos in vitro es de 105 promastigotes/mL, inóculo del cual se parte con mayor frecuencia. No obstante, se reporta el uso de inóculos iniciales superiores (5 x 105- 5 x 106) a esta cifra,14,21,22 lo que sugiere la posibilidad de prescindir del pNPP si se modifica la concentración inicial de parásitos en los ensayos.
Según los coeficientes de determinación lineal, los intervalos de linealidad y los coeficientes de variación, ambos procedimientos son similares. Sin embargo, el límite de cuantificación sin usar pNPP resultó 10 veces superior al requerido; mientras que al emplear pNPP se logran mediciones exactas en todo el rango de concentraciones posibles de promastigotes. Por lo tanto, se concluye que si se parte de 105 promastigotes/mL en los ensayos de actividad de drogas sí es necesario el uso de cromógenos. Se evidenció además que la cuantificación en placas de 96 pozos con el empleo del pNPP como cromógeno es un método preciso y práctico para el estudio de la actividad de productos naturales o sintéticos sobre promastigotes de Leishmania, condición indispensable en la búsqueda de nuevas alternativas terapéuticas contra la leishmaniosis.
SUMMARY
The existing difficulties in the treatment of leishmaniosis justify the testing of the effect of new products on parasite forms in the search of a therapeutic alternative for the parasitosis. Given the need of establishing a method to evaluate the activity of natural synthetic products in vitro under the Cuban conditions, this paper was aimed at defining the usefulness of p-nitrophenilphosphate as a chromogenic substance for quantification of parasites in plaques from 96 wells. To standardize this colorimetric method the stages of the parasite growth curve were set. The study of linearity and selection of the sample size, which was optional for these assays, showed that it was possible to obtain maximum linear determination coefficient with 20 mm. Likewise, the variation coefficient was compared with and without the chromogen and the effect of changes in culture medium on the reading of absorbences was analyzed. The set limit of quantification proved the need of using chromogen for the purposes of this paper and the general results allow to recommend this less subjective, simpler and quicker methodology to test products of interest in this field.
Subject headings: CHROMOGENIC COMPOUNDS/pharmacology; NITROPHENOLS/ analogs and derivatives; NITROPHENOLS/ pharmacology; LEISHMANIA/drug effects.
REFERENCIAS BIBLIOGRÁFICAS
- Botero D, Restrepo M. Parasitosis humana. 2. ed. Medellín: Corporación para investigaciones biológicas, 1992:213-29.
- Locksley RM, Plorde IJ. Leishmaniasis. En: Harrison, ed. Principios de medicina interna. 11th ed México: editorial interamericana, McGraw-Hill,1989:962-5.
- World Health Organization. Tropical Disease Research. Progress 1975-94,highlights 1993-94. Twelfth Programme Report of the UNDP/World Bank/ WHO Special Programme for Research and Training in Tropical Disease (TDR). Geneva: WHO, 1995:135-46.
- -- Progress1 1995-96. Thirteenth Programme Report of the UNDP/World Bank/WHO Special Programme for Research and Training in Tropical Disease (TDR). Geneva:WHO, 1997:100-12.
- Goodwin LG. Pentostam(R) ( sodium stibogluconate); a 50 year personal reminiscence. Trans R Soc Trop Med Hyg 1995;89:339-41.
- Molyneux DH. Current public health status of the trypanosomiasis and leishmaniasis. En: Hide G, Moltram JC, Coombs GH, Holmes PH, eds.Trypanosomiasis and Leishmaniasis: biology and control. Wallingford: CAB International,1997:39-50.
- Olliaro PL, Bryceson ADM. Practical progress and new drugs for changing patterns of Leishmaniasis. Parasitol Today 1993;9(9):323-8.
- Marsden PD. Mucosal Leishmaniasis ("espundia" Escomel, 1911). Trans R Soc Trop Med Hyg 1986;80:859-76.
- Croft SL, Urbina JA, Brun R. Chemotherapy of human leishmaniasis and trypanosomiasis. En: Hide G, Moltram JC, Coombs GH, Holmes PH, eds. Trypanosomiasis and leishmaniasis: biology and control. Wallingford: CAB International, 1997:245-58.
- Laguna F, Pulido F, López-Vélez R, Salas A, Torre Cisneros l, Torres E. Antimonials (Sb6+)versus Amphotericin B (AB) in the treatment of visceral leishmaniasis (VL) in HIV- infected patients. Proceedings of the 37th International Conference on Antimicrobial Agents and Chemotherapy. Toronto: Abstracts on Disk ,(R)1997.
- Pintado V, Miralles P, Moreno S, Rodríguez Creixems M, Bouza E. Antimonial-induced pancreatitis during treatment of visceral Leishmaniasis. Proceedings of the 37th International Conference on Antimicrobial Agents and Chemotherapy. Toronto: Abstracts on Disk ,(R) 1997.
- Berman JD. Chemotherapy for leishmaniasis: Biochemical mechanism, clinical efficacy and future strategies. Rev Infect Dis 1988;10(3):560-86.
- Bodley AL, McGarry M, Shapiro TA. Drug citotoxicity assay for African Trypanosomes and Leishmania species. J Infect Dis 1995;172:1157-9.
- Al-Abdely H, Graybill JR, Bocanegra R, Najvar L, Montalbo E, Regen SL., Efficacies of Ky62 against L. amazonensis and visceral leishmaniasis. Antimicrob Agents Chemother 1998;42(10):2542-8.
- Fourret A, Barrios AA, Muñoz V, Hocquemiller R, Cave A. Effect of some bisbenzylisoquinoline alkaloids on American Leishmania sp. in BALB/c mice.Phytother Res 1993;7(4):281-4.
- Fournet A, Ferreira ME, Rojas AA, Torres OS, Fuentes S, Nakayama H, et al.In vivo efficacy of oral and intralesional administration of 2-substituted quinollines in experimental treatment of new world cutaneous leishmaniasis caused by Leishmania amazonensis Antimicrob Agents Chemother 1996;40(11):2447-51.
- Bourass J, Loiseau PM, Bories C, Letourn Y. Antileishmanial activity of rac-1-dodecyl-octanamido-glicerophosphocholine, a new dialkylglycerophosphocholine, in vitro. Ann Trop Med Parasitol 1996;90(5):559-61.
- Castro C, Gascón F, Pujol F, Sans Vicente P. Validación de métodos analíticos. Monografía AEFl. Asociación Española de Farmacéuticos de la Industria. ed. Hewlett Packard, 1989.
- Bodley AL, Shapiro TA. Molecular and cytotoxic effects of camptothecin, a topoisomerase l inhibitor, on Trypanosomes and Leishmania. Proc Natl Acad Sci USA 1995;92:3726-30.
- Stowe RP, Koeing DW, Mishra SK, Pierson DL. Nondestructive and continuous spectrophotometric measurement of cell respiration using a tetrazolium formazan microemulsion. J Microbiol Methods 1995;22:283-92.
- Phelouzat MA, Lawrence F, Moulay L, Borot C, Schaverbeke J, Schaverbeke M. Leishmania donovani : antagonistic effect of s-adenosyl methionine on ultrastructural changes and growth inhibition induced by sinefugin. Exp Parasitol 1992;74:177-87.
- Majester SB, Elías R, Díaz LAM, Balansard G, Gasquet M, Delmas F. Saponins of the ivy plant, Hedera helix, and their leishmanicidis activity. Planta Med 1991;57(3):260-2.
Recibido: 20 de octubre de 1999. Aprobado: 21 de mayo del 2000.
Lic: Ana Margarita Montado. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. Correo electrónico: ipk@ciipk.sld.cu
1 Investigadora Agregada. Instituto de Medicina Tropical "Pedro Kourí".
2 Aspirante a Investigador. Centro de Bioactivos Químicos, Universidad Central de Las Villas.
3 Técnica de Parositología. Instituto de Medicina. Tropical "Pedro Kourí".
4 Doctora en Ciencias Médicas. Instituto de Medicina Tropical "Pedro Kourí".