Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.53 n.1 Ciudad de la Habana ene.-abr. 2001
Instituto de Medicina Tropical "Pedro Kourí"
Adaptación de los métodos en placas de microtitulación para la cuantificación de la actividad de esterasas y glutation-s-transferasa en Aedes aegypti
Lic. María M. Rodríguez,1 Lic. Juan A. Bisset,2 Lic. Darjaniva Molina,3 Lic. Cristina Díaz4 y Téc. Lázaro A. Soca5
RESUMEN
Se modificaron las técnicas de detección de la actividad de esterasas inespecíficas y de la glutation-s-transferasa, utilizadas en Culex quinquefasciatus, para su detección en Aedes aegypti (L.). Se determinaron para cada una de las enzimas, los valores de concentración óptima de sustrato (concentración saturante) y de tiempo óptimo de lectura de la reacción, mediante la utilización de 4 cepas de Aedes aegypti, 1 de Cuba, 2 de Venezuela y 1 cepa susceptible de referencia. La frecuencia de esterasas inespecíficas resultó ser en MIRANDA de 0,76 en ARAGUA 0,42 y en SANTIAGO DE CUBA se obtuvo el valor máximo de frecuencia de este mecanismo. Para el mecanismo de glutation-s-transferasa la frecuencia resultó ser de 0,45 en ARAGUA, 0,043 en MIRANDA y en SANTIAGO de CUBA de 1. Por primera vez en Cuba se pudo disponer de una batería de técnicas bioquímicas para la detección de los mecanismos de resistencia en Aedes aegypti, esto permitió conformar una base sólida para la detección rápida y temprana de la resistencia en esta especie, principal vector del dengue en las Américas.
DeCs: AEDES/enzimología; ESTERASAS/análisis; GLUTATION TRANSFERASA/análisis.
Dentro del gran número de especies perjudiciales al hombre se encuentran los culícidos como Aedes spp y Culex spp, que desempeñan un papel importante en la transmisión de más de 200 arbovirosis al hombre y a los animales.1
El Aedes aegypti (L.) continúa siendo el principal vector del dengue en las Américas y su control es todavía la única opción para prevenir o reducir la transmisión de la enfermedad. Aunque el control de Ae. aegypti es llevado a cabo mediante la activa participación comunitaria al eliminar los sitios de cría del mosquito, el uso de insecticidas es en ocasiones necesario en las operaciones de control. De ahí la importancia de conocer los mecanismos de resistencia a los insecticidas, para realizar un uso correcto de estos.
Los bioensayos han sido utilizados tradicionalmente, en el estudio de la resistencia a insecticidas, pero estos requieren de un gran número de mosquitos para producir una base de datos minuciosa. Estos métodos permiten cuantificar el nivel de resistencia a insecticidas, pero no detectan los mecanismos responsables de esta.
Los métodos de detección de los mecanismos de resistencia permiten conocer los fenotipos multirresistentes mediante el uso de ensayos replicados,2 además proveen más información por insecto sobre el estado de la resistencia a insecticidas en una población de mosquitos y sus patrones de resistencia cruzada y detectan con precisión el nivel genotípico. Esto diferencia los individuos resistentes homocigóticos de los heterocigóticos. Por consiguiente en estos ensayos bioquímicos se puede evaluar el efecto de un tratamiento con plaguicidas en el campo, al medir la frecuencia de genes de los mecanismos de resistencia específicos, y la posible disminución de la frecuencia de estos genes en ausencia de presión selectiva con plaguicidas. Toda esta información es importante a la hora de tomar decisiones sobre la política de uso de insecticidas en los programas de control de Ae. aegypti.
MÉTODOS
Santiago de Cuba fue colectada en 1997, al igual que las 2 cepas de Venezuela (Miranda y Aragua). Todas las cepas fueron mantenidas sin presión de selección con insecticidas.
Rockefeller: cepa de referencia de laboratorio, susceptible a insecticidas, suministrada por el Centro de Control de Enfermedades (CDC), de San Juan, Puerto Rico.
Estandarización de los métodos bioquímicos
Los métodos de detección de la actividad de esterasas y glutation-s-transferasa (GST) fueron modificados a partir de los métodos ya descritos para Culex quinquefasciatus por Peiris y Hemingway,3 y Booth4 respectivamente. Los métodos fueron modificados mediante la metodología de Fersht.5
Medida de la actividad de esterasas
La concentración saturante de ß-naftil acetato y el tiempo óptimo de reacción fueron determinados con la utilización de las cepas de Ae. aegypti de Rockefeller y Santiago de Cuba. La densidad óptica de formación del producto para cada concentración de ß-naftil acetato (1,0; 0,66; 0,44; 0,29; 0,195 y 0,13 mmol) fue analizada a 1 min de intervalo (desde 1 hasta 25 min) para determinar el tiempo óptimo de la reacción. Los valores de velocidad inicial (Vo) (pendiente de la curva de DO vs.tiempo de reacción) fueron ploteados contra cada concentración de ß-naftil acetato, mencionadas anteriormente, para obtener la concentración de sustrato saturante, que resultó ser 70 mmol y el tiempo óptimo de reacción de 10 min.
Descripción de la técnica de detección de esterasas con sus nuevas variantes: 20 mL de cada homogenato individual se añadieron a una placa de microtitulación de 96 pocillos, seguidamente se añadieron 200 mL de 70 mmol de ß-naftil acetato. Se dejó transcurrir la reacción durante 10 min y se añadió el colorante (fast blue) y se leyó la DO a 570 nm en un lector de placas de ELISA Labsystems iMS.
Medida de la actividad de la GST
La concentración saturante de 1-cloro-2,4-dinitrobenzeno (CDNB) se determinó utilizando diferentes concentraciones del sustrato (15, 20, 30, 40, 50 y 60 mmol) y manteniendo constante la concentración de glutation reducido (30 mmol). La concentración saturante de glutation reducido fue encontrada subsecuentemente, al variar su concentración (30, 25, 20, 15, 10 y 5 mmol) y al mantener la concentración de CDNB, antes establecida. La concentración saturante de glutation reducido y CDNB resultó ser de 20 y 50 mmol respectivamente. El tiempo óptimo de reacción fue de 10 min.
La actividad de la glutation-s-transferasa fue determinada de acuerdo con las modificaciones del método de Booth:4 20 mL de cada homogenato de larvas fueron añadidos a una placa de 96 pocillos, que contenía una mezcla de reacción de 250 mL de CDNB 50 mmol y 5 mL de glutation reducido 20 mmol. La reacción se dejó transcurrir por 3 min y se leyó la DO a 340 nm en un lector de placas de ELISA Labsystems iMS.
RESULTADOS
Se logró, con las modificaciones realizadas a la técnica de detección de esterasas y glutation-s-transferasa, ya descritas para Cx. quinquefasciatus,3,4 poder discriminar en Aedes aegypti entre individuos susceptibles (baja actividad de estas enzimas) y resistentes a insecticidas (alta actividad enzimática).
Se determinó la concentración de ß-naftil acetato saturante para la detección de esterasas, que fue 70 mmol, y el tiempo óptimo de 10 min.
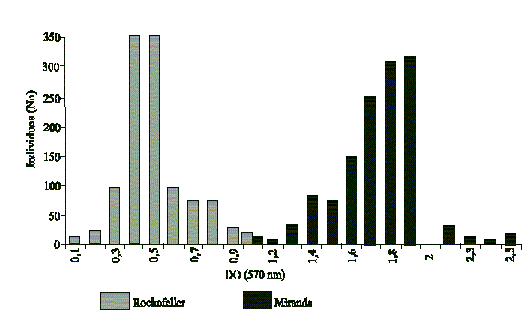
Una vez incluidas las nuevas variantes a los métodos se establecieron los valores límites, hasta donde podían ser considerados como baja actividad enzimática. Para esto se evaluaron 11 108 larvas individuales de la cepa de referencia susceptible ROCKEFELLER, para la detección de actividad de esterasas, que resultó ser de un valor medio de 0,528 y la desviación estándar de ± 0,233. Valores por encima de 1,227 (media + 3DE) fueron considerados valores de alta actividad enzimática. En la figura 1 se muestra el patrón de distribución de los valores de actividad de esterasas, expresada como DO/min en las cepas de Miranda y Rockefeller.
Fig. 1. Patrones de distribución de actividad de esterasas en la cepa susceptible ROCKEFELLER y la cepa de laboratorio de Aedes aegypti de MIRANDA.
En la detección de GST, se utilizaron valores de concentraciones saturantes que lograran discriminar bien entre cepas susceptibles (Rockefeller) y resistentes a insecticidas (Santiago de Cuba), se utilizaron 30 mmol de glutation reducido y 50 mmol de CDNB y se tomó como tiempo óptimo de reacción de 3 min.
Se establecieron los rangos de baja actividad de GST, con la evaluación de 288 larvas de la cepa Rockefeller, cuyo valor medio de actividad específica, expresado como mmol/mg/min y la DE fue de 0,37 ± 0,0998. Valores por enzima de 0,6694 mmol/mg/min (media + 3DE) fueron considerados como elevada actividad de esterasas. En la figura 2 se muestra la distribución de actividad de GST en las cepas Rockefeller y Santiago de Cuba. Asumiendo estos rangos, se determinó la frecuencia de la presencia de alta actividad de estos mecanismos de resistencia en las cepas Aragua, Miranda y Santiago de Cuba (tabla). La frecuencia fue calculada, teniendo en cuenta el número de individuos susceptibles y asumiendo que la población se encontraba en equilibrio Hardy Weinberg. Con respecto a las esterasas, la cepa de Miranda presentó 10 individuos susceptibles para un total de 171, su frecuencia fue igual a 0,76. En comparación, la cepa de Aragua resultó tener una menor frecuencia (0,45), pues de 179 indi-viduos, 60 resultaron susceptibles. La cepa de Santiago de Cuba presentó el valor más alto de frecuencia de esterasas. En la cepa susceptible ROCKEFELLER la frecuencia fue 0.
Fig. 2. Patrones de distribución de la actividad glutation-s-transferasa en Aedes aegypti de la cepa susceptible ROCKEFELLER y de la cepa de laboratorio Santiago de Cuba.
Tabla. Valores de frecuencia para los mecanismos mediados por esterasas y glutation-s-transferasa (GST) observados en cepas de Aedes aegypti de 2 estados de Venezuela y Santiago de Cuba. La cepa ROCKEFELLER, la frecuencia es 0
| Mecanismos |
ROCKEFELLER | ARAGUA | MIRANDA | SANTIAGO DE CUBA |
| Esterasas |
0 | 0,42 | 0,76 |
1 |
| GST |
0 | 0,45 |
0,04 | 0,8042 |
Con respecto a la actividad de la GST, la cepa de Miranda presentó 88 individuos susceptibles, de un total de 95, lo que resultó una frecuencia de 0,04. Sin embargo la cepa de Aragua mostró 29 individuos susceptibles de un total de 95 y su frecuencia fue de 0,45 y la cepa de Santiago de Cuba, también mostró el valor más elevado de frecuencia de este mecanismo.
DISCUSIÓN
La incorporación de técnicas apropiadas para monitorear los cambios en la frecuencia de los mecanismos de resistencia a insecticidas en los programas de control de Aedes aegypti es un factor esencial para realizar un uso correcto de estos, pues es el medio más efectivo para evitar o retardar la aparición de la resistencia a insecticidas.
Los ensayos bioquímicos se han ido adaptando, en la medida en que ha aumentado la frecuencia de los mecanismos de resistencia específicos en las diferentes especies vectoras. Peiris y Hemingway3 establecieron un micrométodo para la detección de esterasas elevadas en Cx. quinquefasciatus. Brogdon y Dickinson,6 reportaron micrométodos para determinar la actividad de las enzimas esterasas en Anopheles albimanus, pero el procedimiento y la concentración de ß-naftil acetato saturante y los reactivos utilizados se distinguen mucho de los utilizados para Ae. aegypti y Cx. quinquefasciatus.
Van Asperen,7 diseñó un ensayo en placas de microtitulación para determinar la actividad de enzimas esterasas en Musca domestica. Mazarri (Mazarri MB. Insecticide resistance in two field populations of Aedes aegypti from Venezuela [Tesis de Máster] University of California, Riverside, California, 1994) también utilizó un método diferente para evaluar la actividad de estas enzimas en adultos de A. aegypti.
Calvo8 estandarizó la técnica de detección de GST para cepas cubanas de Cx. quinquefasciatus, que resultó completamente diferente en cuanto a los parámetros establecidos para Ae. aegypti.Además la técnica descrita por Booth4 para determinar la actividad de esta enzima en Culex pipiens también resultó diferente de las descritas antes.
Por primera vez en Cuba se estandarizaron estos métodos para cepas de Aedes aegypti, lo que permitió diferenciar entre individuos la presencia o no de estos mecanismos de resistencia. Estos métodos no solo pueden ser aplicados en Cuba, sino que puede ser extendida su utilización para la detección de estos mecanismos en la especie Aedes aegypti.
SUMMARY
The detection techniques for the activity of non-specific esterases and glutathione-s-transferase in Culex quinquefasciatus were modified to detect such enzymes in Aedes aegypti(L). The optimal concentration values of substrate (saturating concentration) and the optimum reading time for reaction were determined for each enzyme by using 4 Aedes aegypti strains: one from Cuba 2 from Venezuela and one susceptible reference strain. The frequency of non-specific esterases turned out to be 0.76 in MIRANDA 0.42 in ARAGUA and 1 in SANTIAGO DE CUBA in which the highest frequency value of this mechanisms was reached. The frequency of glutathione-s-transferase mechanism was 0.45 in ARAGUA 0,043 in MIRANDA and 1 in SANTIAGO DE CUBA. For the first time in Cuba a set of biochemical techniques was available for detecting the resistance mechanisms of Aedes aegypti which made it possible to create sound foundations for the easy rapid detection of the resistance of this species the main dengue vector in the Americas.
Subject headings: AEDES/enzimology; ESTERASES//analysis; GLUTATHIONE TRANSFERASE/ analysis.
REFERENCIAS BIBLIOGRÁFICAS
- Lehane MJ. Biology of blood-sucking insects. London: Harper Collins Academic, 1991:288.
- Chan KL. Singapore´s dengue hemorrhagic fever control program. A case study on the successful of Aedes aegypti and Aedes albopictus using mainly environmental measures as a part of integrated vector control. Tokyo:Southeast Asian medical information Center, 1985:114.
- Peiris HTR, Hemingway J. Mechanism of insecticide resistance in a temephos selected Culex quinquefasciatus (Diptera: Culicidae) strain from Sri Lanka. Bull Entomol Res 1990;80:453-7.
- Booth J, Boyland E, Sims P. An enzyme from the rat liver catalyzing conjugation with glutathione. Biochemistry 1961;79:516-23.
- Fersht A. Measurement and magnitude of enzymatic rate constants chapter. En: Enzyme structure and mechanism. 2ed. New York: W. H. Freeman, 1985:121-4.
- Brogdon WG, Dickinson CM. A microassay system for measuring esterase activity and protein concentration in small samples and in a high pressure liquid chromatography eluate fractions. Anal Biochem 1983;131:499-503.
- Van Asperen K. A study of housefly esterases by means of a sensitive colorimetric method. J Insect Physiol 1962;8:410-5.
- Calvo E, Díaz C, Rodríguez MM, Milá L, Bisset JA. Determinación de la actividad glutation-s-transferasa en cepas de Culex quinquefasciatus de Cuba y otros países de Latinoamérica. Rev Cubana Med Trop 2000 (en prensa).
Recibido: 29 de septiembre del 2000. Aprobado: 6 de noviembre del 2000. Lic. María M. Rodríguez. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana. Correo electrónico: ciipk@ipk.sld.cu