My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.54 no.2 Ciudad de la Habana May-Aug. 2002
Laboratorio de Investigaciones del SIDA
Legionella pneumophila: extracción de la proteína principal de la membrana externa (p 29)
Lic. Nibaldo L. González Sosa,1 Dr. Lázaro Regalado Alfonso,2 Dra. Martha J. Alfonso González,3 Lic. Madeline Blanco de Armas4 y Lic. Otto Cruz Sui5
Resumen
Se trabajó con la Legionella pneumophila, importante patógeno pulmonar oportunista que ocasiona el cuadro clínico conocido como enfermedad de los legionarios. En la membrana externa de la bacteria se encuentra una proteína de peso molecular 29 kD (p 29) que además de constituir un antígeno único de la especie, se reconoce como la proteína principal y más importante de la membrana externa, que puede constituir un factor de patogenicidad de la bacteria. La extracción y purificación de esta proteína mediante el tratamiento de la membrana externa con agentes químicos, fue el objetivo de este trabajo. Se obtuvo un extracto antigénico semipurificado rico en p29, que permitió disponer de este importante antígeno para posteriores estudios en el desarrollo de técnicas para el inmunodiagnóstico, así como para la obtención de un anticuerpo monoclonal con igual propósito.
DeCS: PROTEINAS DE LA MEMBRANA BACTERIANA EXTERNA/aislamiento & purificación; LEGIONELLA PNEUMOPHILA; ANTIGENOS BACTERIANOS; TESTS INMUNOLOGICOS; ANTICUERPOS MONOCLONALES.
Legionella pneumophila, agente etiológico de la enfermedad de los legionarios,1 fue caracterizado por primera vez en 19772 y es reconocido desde entonces como un importante patógeno pulmonar, responsable de gran número de infecciones nosocomiales en la actualidad.3-5
La bacteria presenta una envoltura celular típica de microorganismos gramnegativos, que consiste en membrana citoplasmática, peptidoglicano y membrana externa, donde los lipopolisacáridos y proteínas desempeñan una importante actividad antigénica. Tal es el caso de la proteína de peso molecular de 29 kD (p29) que se encuentra parcialmente expuesta en la superficie celular y es común en la especie.6 La p29 se reconoce como la proteína mayor de la membrana externa y la principal proteína de Legionella pneumophila, al constituir la mayor cantidad dentro del total de proteínas de la bacteria.7,8 La p29 es una porina que forma canales de permeabilidad para iones8 y se le atribuyen otras propiedades relacionadas con la patogénesis y virulencia de la bacteria, al actuar como molécula de enlace con las células del hospedero.9,10
El método ideal para el diagnóstico de Legionelosis es el cultivo de la bacteria, sin embargo, al ser un microorganismo que necesita requerimientos especiales para su crecimiento,11 se dificulta su aislamiento en los medios microbiológicos comúnmente usados, por lo que desafortunadamente muchos laboratorios no la cultivan y otros lo hacen inadecuadamente,12 por esto su diagnóstico descansa en métodos serológicos, fundamentalmente la inmunofluorescencia.13
El empleo de anticuerpos policlonales tiene asociado el inconveniente de las reacciones cruzadas, así como la necesidad de múltiples anticuerpos para identificar todos los serogrupos de la especie, por lo que resulta más ventajoso el empleo de un anticuerpo monoclonal capaz de reaccionar únicamente con el antígeno común (p29), presente en todos los serogrupos y que no reaccione con otras bacterias. La extracción de esta proteína de la membrana externa de Legionella pneumophila fue el objetivo fundamental de este trabajo, para posteriormente utilizarla en esquemas de inmunización para la obtención de clones secretores de anticuerpos monoclonales, y como antígeno para el desarrollo de técnicas de inmunodiagnóstico como ELISA e immunoblot.
Métodos
Microorganismo y condiciones de cultivo
Legionella pneumophila serogrupo 1, cepa Philadelphia 1 (ATCC 331529), fue cultivada en huevos embrionados, para facilitar la mayor expresión antigénica de la bacteria en una morfología de bacilos cortos y con la aplicación de modificaciones a los procedimientos descritos por Gabay y Blake,6 que consistieron en inocular las colonias aisladas de los huevos en medio sólido en vez del medio caldo extracto de levadura-albúmina, empleado por los autores antes mencionados. Para ello se inocularon frascos de cultivo tipo Roux con medio agar base Legionella enriquecido con suplemento de crecimiento Legionella BCYE OXOID SR 110 y se incubaron a 35 °C en una atmósfera con CO2 a 2,5 % durante 48 h, para la producción de mayor biomasa bacteriana. El crecimiento fue controlado para comprobar su pureza y la presencia de formas cortas de la bacteria, mediante la tinción de Gram y el cultivo en medio de agar sangre, donde no crece Legionella pneumophila, pero sí cualquier otro posible contaminante.
Extracción de proteínas de la membrana externa
Las proteínas de la membrana externa fueron extraídas aplicando el método de Boissinot y otros,13 realizando variaciones a la técnica, principalmente en cuanto a las soluciones empleadas para cosechar el cultivo y tratar el precipitado. En lugar de utilizar buffer fosfato salino (PBS), el cultivo se recolectó empleando buffer Hepes 10 mM (pH 7,4) con EDTA 10 mM y PMSF 0,1 mM. Se sonicó en un desintegrador ultrasónico SONIPRPEP 150 (MSE Scientific Instruments) en cuatro ciclos de 30 s a una amplitud máxima a 0 °C y posteriormente se centrifugó a 5 000 g durante 30 min para eliminar células completas y otros detritos. El sobrenadante se ultracentrifugó 1 h a 100 000 g y el precipitado obtenido se resuspendió en buffer Tris 1 M (pH 6,8) con 1 % de sarkosil, a diferencia del método de Bossinot y otros que resuspendieron el precipitado en buffer Hepes 5 mM con EDTA 7 mM y sarkosil a 1 %. Esta mezcla se incubó 20 min a 20 °C, a diferencia de los autores antes mencionados que prefirieron una temperatura de 4 °C para disolver la membrana citoplasmática. Finalmente se ultracentrifugó a 100 000 g durante 1 h para resuspender el pellet en agua destilada estéril. Se tomaron fracciones del preparado antigénico presente en el sobrenadante de la centrifugación posterior a la sonicación, así como, del sobrenadante de la ultracentrifugación y del precipitado obtenido, posterior al tratamiento con sarkosil. En este precipitado es donde se deben concentrar las proteínas de la membrana externa. Las fracciones se sometieron a un análisis cualitativo mediante electroforesis en gel de poliacrilamida.
Análisis cualitativo
El análisis cualitativo de las fracciones, incluido el antígeno obtenido en el producto precipitado de la ultracentrifugación, se realizó mediante electroforesis en gel de poliacrilamida a 10 % en presencia de SDS.14 Las muestras se solubilizaron en el buffer de lisado con 2 mercaptoetanol y se calentaron a 100 °C durante 5 min. Se empleó como revelador tinción con nitrato de plata.15 El peso molecular de las proteínas separadas en la electroforesis se infirió por la comparación de estas con el patrón de peso molecular conocido (LMW Electrophoresis Calibration Kit Pharmacia).
La concentración de proteínas se determinó por el método de Lowry.16 También se realizó inmunoelectrotransferencia17 con la utilización de un anticuerpo monoclonal anti p29 (Genetic System Corp.) con el objetivo de demostrar la inmunorreactividad del antígeno.
Resultados
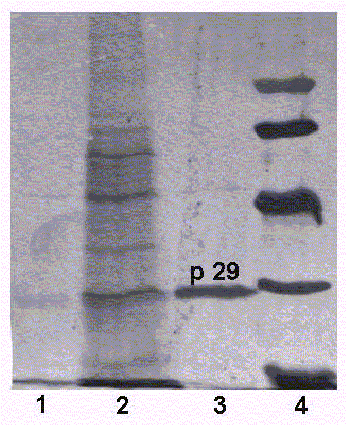
La fracción de la membrana externa obtenida en el precipitado de la ultracentrifugación después del tratamiento con sarkosil, mostró en la electroforesis 2 bandas de proteínas (fig.1). Una mejor definida y de mayor amplitud que aparece al nivel de los 29 kD, que puede corresponder a la proteína principal de la membrana externa (p29) y otra menos definida, de un peso molecular aproximado de 45 kD, que puede corresponderse con la p45, otra proteína presente en la membrana externa de la bacteria y descrita por otros investigadores para el serogrupo 1 de Legionella pneumophila18 y para todos los serogrupos de la especie.7,13 La fracción correspondiente al preparado antigénico sometido a sonicación y sin tratar con el detergente sarkosil, reveló un mayor número de bandas correspondientes a proteínas de la membrana externa y citoplasmática.
Leyenda: 1. Sobrenadante del antígeno tratado con sarkosil, 2. Perfil de proteínas de la célula después de la sonicación y sin tratamiento con sarkosil, 3. Antígeno de membrana externa tratado con sarkosil (obsérvese la banda más ancha que corresponde a la p29,
4. Patrón de pesos moleculares.
Fig. 1. Electroforesis en gel de poliacrilamida de los antígenos obtenidos.
En la inmunoelectrotransferencia (fig. 2) realizada a la fracción antigénica tratada con sarkosil se reveló una banda específica que se encuentra al nivel esperado de la p29 y otra banda de proteína situada por debajo de los 29 kD, aproximadamente a los 26 kD.
Leyenda: 1. Antígeno de membrana externa (p29) revelado con anticuerpos anti p29, 2. Patrón de calibración de proteínas de bajo peso molecular.
Fig. 2. Inmunoelectrotransferencia del preparado antigénico obtenido con sarkosil.
Discusión
Los resultados observados en la electroforesis en gel de poliacrilamida, permiten aseverar que el proceso de solubilización selectiva de la membrana citoplasmática para la obtención y la separación de la membrana externa fue exitoso. Las proteínas de la membrana externa de Legionella pneumophila se extrajeron del paquete celular con un elevado grado de pureza, gracias al tratamiento químico realizado utilizando las ventajas del sarkosil, dada la relativa insolubilidad de las proteínas de la membrana externa en este detergente y la capacidad de disolver proteínas de la membrana interna de preparados de envoltura celular de bacterias gramnegativas.19 El grado de pureza obtenido con el extracto antigénico tratado con detergente fue mucho mayor que el observado con el extracto antigénico sonicado no tratado, lo cual se constató en la electroforesis al comparar ambas fracciones en relación con el número de bandas de proteínas observadas (fig. 1). El análisis de los resultados obtenidos en la inmuno-electrotransferencia, al enfrentar el preparado antigénico de la membrana externa con el anticuerpo anti p29, confirma la presencia de la proteína mayor de la membrana externa y su inmunorreactividad. La otra banda de proteína que se observa por debajo de los 29 kD (aproximadamente a los 26 kD) se ha descrito por otros autores como una proteína menor de la membrana externa (fig. 2), que aparece como una modificación de la proteína principal de la membrana externa ante una acción proteolítica, además de ser inmunorreactiva.20 La reacción de esta proteína con un aparente peso molecular de 26 kD, con un anticuerpo anti p29 se observó también en los resultados de Nolte y Conlin, quienes demostraron inmunorreactividad de la proteína (26 kD) frente a un anticuerpo monoclonal (LP3IIG2, Genetic Systems Corp.) dirigido contra epitopes especie específicos de L. pneumophila.20
El tratamiento de la membrana externa de la bacteria realizado en esta investigación, permitió obtener un antígeno con la pureza adecuada para la producción de un anticuerpo monoclonal dirigido contra la proteína principal de la membrana externa (p29), antígeno considerado específico de Legionella pneumophila, especie más relacionada con la enfermedad de los legionarios, fiebre de Pontiac y otras patologías asociadas.4,21-23
Se puede concluir que los métodos empleados permitieron extraer la proteína principal de la membrana externa (p29) de la envoltura celular de Legionella pneumophila conservando sus propiedades inmunogénicas, para su utilización como antígeno, en el desarrollo de técnicas para el inmunodiagnóstico de las enfermedades producidas por esta especie y en la producción de clones secretores de anticuerpos contra la p29 para ser utilizados como reactivos diagnóstico en su identificación.
Summary
Legionella pneumophila is an important opportunistic pulmonary pathogen that causes Legionaires´diseases. In the outer membrane of the bacterium, there is a protein with molecular weight of 29 kd(p 29), which is not only an specific antigen of the species but also the major outer membrane protein; it may also be a factor of pathogenecity in the bacterium. The main objective of this paper was the extraction and purification of this protein by treating the outer membrane with chemical agents. A p 29-rich semipurified antigen extract was obtained that can be used as an important antigen for the development of immunodiagnostic techniques in future studies and also for obtaining a monoclonal antibody to be used for the same purpose.
Subject headings: BACTERIAL OUTER MEMBRANE PROTEINS/isolation & purification; LEGIONELLA PNEUMOPHILA; ANTIGENS, BACTERIAL; IMMUNOLOGIC TESTS; ANTIBODIES, MONOCLONAL.
Referencias bibliográficas
- Meyer RD. Legionella infections: a review of five years of research. Rev Infect Dis 1983;2:258-60.
- Mc Dade JE, Shepard ChC, Fraser DW, Tsai TR, Redus MA, Dowdle WR,. Legionaires diseases. Isolation of a bacterium and demonstration of its role in other respiratory disease. N Engl J Med 1977;297:1197-1203.
- Stout JE, Yu VL. Legionellosis. N Engl J Med 1997;337(10):682-7.
- Roig J, Domingo C, Morera J. Legionaires´disease. Chest 1994;105:1817-25.
- Regalado L, Alfonso MJ. Enfermedad de los legionarios en un paciente con SIDA. Rev Cubana Med 1998;37(1):52-5.
- Flesher AR, Jennings HJ, Lugowski C, Kasper DL. Isolation of serogroup 1 specific antigen from Legionella pneumophila. J Inf Dis 1982;145(3):224-33.
- Ehret W, Ruckdesdul G. Species specific membrane proteins of Legionellaceae. Zb1 Bakt Hyg A 1983:255:33-8.
- Gabay JE, Blade M, Niles WD, Horwitz MA. Purification of Legionella pneumophila major outer membrane protein and demonstration that is a prion. J Bacteriol 1985;162:85-91.
- Krinos C, High AS, Rodgers FG. Role of the 25 kda major outer membrane protein of Legionella pneumophila in attachment to U-937 cells and its potential as a virulence factor for chick embryos. J Appl Microbiol 1999;86(2):237-44.
- Garduño RA, Garduño E, Hoffman PS. Surface-associsated Hsp 60 chaperonin of Legionella pneumophila mediates invasion in HeLa Cell Model. Infect Immun 1998;66(10)4602-10.
- Feeley JC. Charcoal-yeast extract agar: primary isolation medium for Legionella pneumophila. J Clin Microbiol 1979;10:437-441.
- Edelstein HP. Legionaries´disease. Clin Infect Dis 1993;16:741-7.
- Boissinot M, Ramsay D, Barthe C, Joly JR. Antigenic variability of the outer membrane antigens of Legionella pneumophila. Can J Microbiol 1987;33:607-13.
- Laemmli UK. Cleveage of structural proteins during the assembly of the head of bacteriophage T4 Nature (London) 1970;227:680-5.
- Merril CR. Ultrasensitive stain from proteins in polyacrylamide gels shows regional variations in cerebrospinal fluid proteins. Science 1981;211:1437-8.
- Lowry OH, Rosebrought NJ, Farr AL, Randall RJ. Protein measurement with the folin phenol reagent. J Biol Chem 1951;193:265-75.
- Tsang VCW. The Enzyme linked immunoelectro-transfer blot techniques (ETTB) for studying the specificities of antigens and antibodies separated by gel electrophoresis. Methods Enzymol 1983;92:377-391.
- Hindall MS, Iglewski BH. Isolation and characterization of Legionella pneumophila outer membrane. J Bacteriol 1984;159:107-13.
- Filip C, Fletcher G, Wulff JL, Earhart CR. Solubilization of citoplasmic membrane of Escherichia coli by the ionic detergent Sodium – Lauryl Sarcosinate. J Bacteriol 1973;115:717-22.
- Nolte FS, Conclin CA. Major outer membrane protein of Legionella pneumophila carries a species specific epitope. J Clin Microbiol 1986;23(3):643-6.
- Nelson D, Rensimer E, Raffin T. Legionella pneumophila pericarditis without pneumonia. Arch Intern Med 1985;145:926.
- Marston BJ, Lipman HBm Breiman RF. Surveillance for Legionaries´diseases: risk factors for morbidity and mortality. Arch Intern Med 1994;154:2417-22.
- Luck PC, Dinger E, Helbig JH. Analysis of Legionella pneumophila strains associated with nosocomial pneumonia in a neonatal intensive care unit. Eur J Clin Microbiol Infect Dis 1994;13:565-71.
Recibido: 12 de abril de 2000. Aprobado: 22 de diciembre de 2001.
Lic. Nibaldo L. González Sosa. Laboratorio de Investigaciones del SIDA. Apartado 23031, Ciudad de La Habana, Cuba. Correo electrónico: cicdc@infomed.sld.cu
1 Licenciado en Microbiología. Investigador Auxiliar.
2 Especialista de II Grado en Microbiología. Investigador Auxiliar.
3 Especialista de I Grado en Microbiología. Investigadora Auxiliar.
4 Licenciada en Bioquímica. Investigadora Agregada.
5 Licenciado en Ciencias Biológicas. Investigador Auxiliar.