Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.54 n.2 Ciudad de la Habana Mayo-ago. 2002
Instituto de Inmunología Clínica, ULA. Mérida-Venezuela
Evaluación de la actividad de polimorfonucleares neutrófilos frente a antígenos
de cepas patógenas de Entamoeba histolytica
Dr. Osbert Rosales Manrique,1 Dra. Haideé Urdaneta Romero,2 Dr. Manuel Hernández Barrios2 y Dr. José Francisco Muñoz3
Resumen
Se evaluó la producción de superóxido como indicador de la actividad de los neutrófilos de individuos sanos, estimulados con antígenos de membrana de Entamoeba histolytica, con activadores químicos y con antígenos de otros parásitos. Se empleó la prueba de reducción cinética del nitroazul de tetrazolium. No se observaron diferencias significativas con el grupo control en cuanto a la producción de superóxido por parte de los neutrófilos cuando fueron estimulados con antígenos de Entamoeba histolytica, ni con antígenos de Cisticercus cellulosae, Toxoplasma gondii, y Giardia lamblia. Estos resultados permiten afirmar que los antígenos de membrana de Entamoeba histolytica no inducen la producción de superóxido en neutrófilos, lo cual contradice las afirmaciones previas sobre supresión en la actividad de los neutrófilos, después del contacto con la Entamoeba histolytica.
DeCS: ENTAMOEBA HISTOLYTICA/aislamiento & purificación; NEUTROFILOS/ inmunología; SUPEROXIDOS.
La amebiasis es una importante enfermedad parasitaria causada por el protozoario entérico Entamoeba histolytica, ampliamente difundido en el mundo, que ocasiona una morbilidad y mortalidad muy significativa.1 El parásito ocasiona infecciones intestinales, pudiendo alcanzar la circulación y llegar a otros órganos, produciendo, entre otras lesiones, abscesos extraintestinales.2
Existen 2 mecanismos implicados en la necrosis tisular amebiana, uno mediado por el contacto célula-célula y otro que depende directamente de los efectos de sus productos tóxicos sobre los componentes tisulares. En la lisis mediada por contacto, la E. histolytica muestra una potente quimiotaxis para los leucocitos polimorfonucleares neutrófilos y una gran capacidad para destruirlos. Una de las moléculas responsables del efecto quimiotáctico de la ameba sobre los neutrófilos es la proteína de adherencia que es inhibida por la galactosa,3,4 y otros componentes solubles que estimulan la producción de IL-8 por parte de las células del colon.5
La invasión de los tejidos por los trofozoítos de E. histolytica induce una respuesta inmunológica humoral fácilmente demostrable,6 esta puede persistir por años a bajos títulos después de la cura de la enfermedad.7 Diversos autores coinciden en señalar que los títulos de anticuerpos no están necesariamente correlacionados con la protección del hospedero, y sugieren que la inmunidad humoral no protege contra la infección por E. histolytica.6
Al contrario de la respuesta inmunológica humoral, la respuesta inmunológica celular ha mostrado ser importante en el control y la resistencia a la infección, como lo sugieren estudios de transferencia pasiva y experimentos de inmunosupresión selectiva.6-9 Se ha observado incremento en la gravedad del cuadro clínico y en la invasión de tejidos de animales de experimentación por supresión de la inmunidad mediada por células.
Existen evidencias de que las amebas son destruidas in vitro por linfocitos T obtenidos de pacientes curados de abscesos hepáticos amebianos, señalándose al linfocito CD-8 citotóxico como responsable de la lisis.10 Para ejercer su acción amebicida, los linfocitos requieren, no solo del contacto célula-célula, sino también de la acción de ciertas citoquinas como la interleuquina 2 (IL-2) y el interferón g(IFN-g), cuya producción es inducida por proteínas de adhesión, obtenidas de trofozoítos amebianos.11,12
En el contexto de la respuesta celular frente a la ameba, algunos autores han señalado el posible papel de los polimorfonucleares (PMN) para sugerir que la medición de su actividad pueda ser útil como herramienta diagnóstica.13 Sin embargo, a pesar de la innegable implicación de los PMN en los procesos inflamatorios de toda índole y particularmente debido a la constante presencia de estas células en las descripciones del proceso inflamatorio local, bien sea intestinal o extra-intestinal,14 es importante describir posibles alteraciones funcionales en neutrófilos estimulados con ciertas cepas de E. histolytica.
Métodos
Obtención de leucocitos PMN: Los PMN fueron aislados de 40 mL de sangre periférica con citrato de sodio 3,8 %, como anticoagulante y Dextranâ 6 %, para favorecer la sedimentación de los glóbulos rojos. Se incubaron por 45 min a 37 °C, se obtuvo la capa contentiva de linfocitos y neutrófilos, se diluyó 1:2 en solución salina balanceada de Hank y se colocó sobre Ficoll Histopaqueâ-1077, a una relación 2:1 para separar las células mononucleares de sangre periférica de los neutrófilos. Se centrifugó a 1 000 g por 30 min a 20 °C y se obtuvo el sedimento con los neutrófilos, los cuales se resuspendieron con solución salina balanceada de Hank a pH 7.0, se agregó 1 mL de agua destilada estéril durante 30 s, para lisar los eritrocitos restantes, se lavaron 3x con solución balanceada de Hank. Los neutrófilos se resuspendieron a una concentración de 4 x 107/mL en tampón Tyrodes con Ca++ y Mg++ y BSA al 0,35 % realizándose las pruebas de pureza y viabilidad de los neutrófilos recuperados.
Cepas de E. histolytica. Las cepas de E. histolytica usadas en este trabajo, fueron obtenidas del cepario existente en el Laboratorio de Inmunoparasitología del Instituto de Inmunología Clínica (IDIC) de la Facultad de Medicina de la Universidad de los Andes: IDICULA:1092:1 e IDICULA:0593:2 aisladas y axenizadas por Urdaneta y otros (1995)15 de zimodemo II, patogenicidad demostrada por la reacción en cadena de la polimerasa (RCP).16
Producción y obtención de antígenos: Para la producción de antígenos, se utilizaron cultivos axénicos de E. histolytica, mantenidos en medio TYI-S-33,17 las amebas fueron lavadas 3 veces con tampón fosfato salino (PBS) a 4 °C. Las masas de parásitos se fraccionaron en presencia de MgCl 10 mM y 1 mg/mL de Concanavalina A (Con A), se incubaron por 5 min, luego se centrifugaron a 50 g por 1 min a 4 °C para remover el exceso de Con A. El sedimento se resuspendió en tampón tris-HCl 10 mM pH 7,5 y se incubó a 4 °C por 10 min, luego se rompió por sonicación en baño de hielo, la suspensión se centrifugó en gradiente de sacarosa 0,58 M y manitol 0,5 M a una velocidad de 250 g por 30 min a 4 °C, se eliminó el sobrenadante y el sedimento fue resuspendido en 1 mL de tampón tris-HCl con a-metil-manoside 1 M e incubado en baño de hielo, a 4 °C, agitándose ocasionalmente; 40 min después, la suspensión diluida en 3 mL de tris-HCl fue sonicada por 3 ciclos de 1 min a una frecuencia de 40 Hz y centrifugada en gradiente de sacarosa 20 % en tris-HCl a 250 g por 30 min a 4 °C, se obtuvo el sedimento que contenía las membranas externas de los trofozoítos de E. histolytica las cuales fueron utilizadas en este trabajo.
Medición del superóxido producido por neutrófilos por medio de la reducción cinética del nitroazul de tetrazolium (NBT). En una placa de poliestireno de 96 pozos, se colocaron los neutrófilos sin sensibilizar o previamente sensibilizados a razón de 1 x 106 células por pozo resuspendido en tampón Tyrodes con Ca++ y Mg++ y albúmina sérica bovina 0,35 % y se incubaron con acetato mirístico de forbol (PMA) (2,5 µL de una solución diluida 1:10 en dimetil sulfóxido a 20 %) y antígeno de ameba a diferentes concentraciones (20, 10, 5 y 2,5 µg/pozo en PBS estéril) e inmunobeadsâ sensibilizadas con la fracción II de Cohn; estas partículas inertes recubiertas con Fab de IgG de conejo, son capaces de inducir la activación de la NADPH oxidasa a través de la estimulación de receptores Fc. Los neutrófilos con los diferentes estimuladores fueron incubados en presencia del NBT (50 mL de una solución de 2 mg/mL) en PBS estéril. Las placas fueron leídas en un lector cinético de ELISA a 492 nm 25 min, por lo cual se obtuvo la variación de densidad óptica por minuto designada como miliunidades de densidad óptica por minuto (mUDO/min).
Sensibilización de los neutrófilos con los diferentes antígenos. A los polimorfonucleares neutrófilos se les agregaron concentraciones de 80, 40, 20, 10, 5 y 2,5 mg de los antígenos (E. histolytica, Cisticercus cellulosae, Giardia lamblia y Toxoplasma gondii), se completó a 1 mL con tampón tyrodes con Ca++ y Mg++ y BSA a 0,35 % y se incubó por 45 min a 4 °C en agitación constante, se centrifugó a 700 g por 10 min a 20 °C y se descartó el sobrenadante, y el sedimento que contenía los neutrófilos fue resuspendido en la cantidad suficiente de Tyrodes para ajustarlos a 40 x 106 células/mL o 1 x 106 células/25 mL.
Adsorción del antígeno con suero humano. El antígeno de E. histolytica fue mezclado con suero de paciente con colitis disentérica con título de IgG anti-ameba de 1:2560 y mezclado en proporciones iguales con el antígeno a las diferentes concentraciones, manteniéndose en agitación constante durante toda la noche a 4 °C, se centrifugó y el sedimento se utilizó para intentar la activación de los neutrófilos.
Resultados
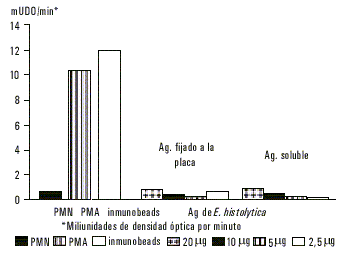
Los neutrófilos estimulados con PMA e immunobeads mostraron una alta producción de superóxido (10,96 y 12,56 mUDO/min) respectivamente. Cuando se usaron diferentes concentraciones de antígeno de E. histolytica fijado a la placa o antígeno soluble no se observó producción significativa de superóxido (fig. 1).
Fig.1. Producción de superóxido por parte de neutrófilos estimulados con antígeno de membranas de E. histolytica.
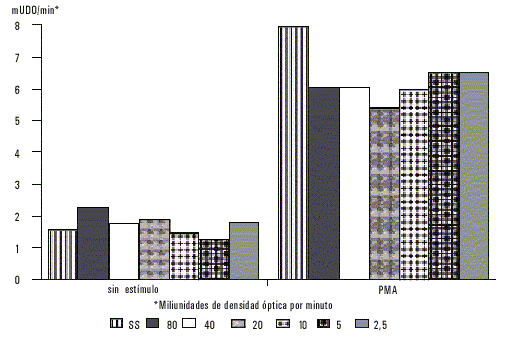
Los neutrófilos sensibilizados previamente con diferentes concentraciones de antígeno de E. histolytica incrementaron la producción de manera significativa. Cuando estos neutrófilos fueron además, estimulados con PMA se observó un incremento aún mayor en la producción de superóxido (fig. 2); puede observarse que la actividad oxidativa de los neutrófilos fue similar independientemente de la concentración de antígeno usada.
Fig. 2. Producción de superóxido por parte de neutrófilos previamente sensibilizados con antígeno de membranas de E. histolytica a diferentes concentraciones.
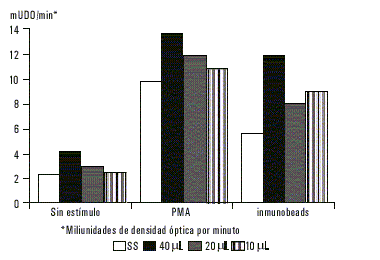
En los PMN que fueron sensibilizados con antígeno de ameba y previamente sometidos al proceso de adsorción con suero humano de pacientes con colitis amebiana, tampoco se observó variación significativa en la producción de superóxido (fig. 3).
Fig.3. Producción de superóxido por parte de neutrófilos previamente sensibilizados con antígeno de membranas de E. histolytica a diferentes concentraciones, donde el antígeno fue adsorbido antes con suero inmune.
Los neutrófilos sensibilizados con antígeno de C. cellulosae, G. lamblia y T. gondii a las concentraciones de 20; 10; 5; 2,5 mg por millón de células, tampoco indujeron diferencias en la producción de superóxido.
Discusión
Existen numerosas evidencias que señalan a la inmunidad mediada por células como protectora ante la enfermedad y/o reinfección por E. histolytica. Algunos autores han sugerido que cuando este tipo de respuesta inmunológica se encuentra deprimida se observa un incremento en la invasión por parte del parásito y un aumento en la severidad del cuadro clínico.6,8,9,18 De igual forma se ha reseñado el papel de las células fagocíticas, como los macrófagos, en la respuesta frente a la infección amebiana, ya sea controlando la infección, colaborando con los linfocitos en la respuesta inmunológica humoral y resistiendo a la reinfección.8,10,11
En el presente estudio se evaluó la producción de superóxido, por parte de leucocitos polimorfonucleares neutrófilos obtenidos de individuos sanos. Se observó que los neutrófilos no produjeron superóxido cuando fueron estimulados con antígenos de E. histolytica comparado con los estimulados con PMA o con inmunobeads (fig. 1).
Tampoco se observó alteración en la producción de superóxido, en los neutrófilos previamente sensibilizados con antígenos de membrana y con antígenos de otros parásitos. Esto indica una respuesta estereotipada de los neutrófilos frente a antígenos parasitarios. De acuerdo con estos hallazgos pudiera especularse que son los productos solubles del parásito, más que los de membranas, los que inhibirían la producción de metabolitos tóxicos del oxígeno.6,19
En este caso, se puede afirmar que los extractos de membrana de E. histolytica no son capaces de inducir modificaciones significativas en el funcionamiento de los neutrófilos, por lo que se podría sugerir que serían otras las proteínas del parásito las que producirían la alteración en estas células. Se requiere el estudio de los neutrófilos de pacientes con diferentes cuadros clínicos de la amebiasis, para poder tener una visión global del efecto que ejerce el parásito sobre estas células. Igualmente es necesario proponer estudios de la función de los neutrófilos utilizando distintas fracciones antigénicas del parásito.
Summary
This paper evaluates the production of superoxide as an indicator of the activity of neutrophils from healthy individuals, stimulated with Entamoeaba histolytica membrane antigens, chemical stimulators and antigens from other parasites. The kinetic nitroblue tetrazolium reduction test was used. No significant differences were observed in the control group as to superoxide production by neutrophils primed with Entamoeba histolytica antigens or Cisticercus cellulosae, Toxoplasma gondii and Giardia lamblia antigens. These results allow us to conclude that Entamoeba histolytica membrane antigens do not induce superoxide production by neutrophils, which contradicts previous statements on suppresed activity of neutrophils after they get in contact with Entamoeaba histolytica antigens.
Subject headings: ENTAMOEBA HISTOLYTICA/isolation & purification; NEUTROPHILS/immunology; SUPEROXIDES.
Referencias bibliográficas
- Walsh JA. Problems in recognition and diagnosis of amebiasis: estimation of the global magnitude of morbility and mortality. Rev Infect Dis 1986;8:228-38.
- Matijasevic AE. Actualizaciones amibianas. Bogotá: Tribuna Médica, 1996.
- Ravdin JI, Murphy CF, Salata RA, Guerrant RL, Hewlett EL. N-Acetyl-D-Galactosamide-Inhibitable adherence lectin of Entamoeba histolytica. I. Partial purification and relation to amoebic virulence in vitro. J Infect Dis 1985;151:804.
- Radvin JI, Murphy CF. Characterization of the galactose-specific binding activity of a purified soluble Entamoeba histolytica adherence lectin. J Protozool 1992;39:319-23.
- Yi Yu, Chadee K. Entamoeba histolytica stimulates interleukin 8 from human colonic epithelial cells without parasite-enterocyte contact. Gastroenterology 1997; 112:1536-47.
- Pérez MR, Kretschmer RR. Respuesta de inmunidad humoral. En: Kretschmer RR, ed. Amibiasis infección y enfermedad. México, DF. Editorial Trillas, 1994:299.
- Isibasi A, González C, Ortiz B, Muy M, Paniagua J, Blanco F. Seroepidemiología de la amibiasis en la región norte de la República Mexicana. Arc Invest Med 1990;21:163-74.
- Denis M, Chadee K. Cytokine activation of murine macrophages for in vitro killing of Entamoeba histolytica trophozoites. Infec Immun 1989;57:1750-6.
- Wang W, Keller K, Chadee K. Modulations of tumor necrosis factor production by macrophages in Entamoeba histolytica infection. Infect Immun 1992;60:3169-74.
- Salata RA, Cox JG, Rawdin JI. The interaction of human T-lymphocytes and Entamoeba histolytica: killing of virulent amoebate by lectin-dependent lymphocytes. Parasite Immunol 1987;9:249-61.
- Salata RA, Murray HW, Rubin BY, Ravin JI. The role of gamma interferon in the generation of human macrophages cytotoxic for Entamoeba histolytica trophozoites. Am J Trop Med Hyg 1987;37:72-8.
- Schain DC, Salata RA, Ravdin JI. Human T-lymphocytes proliferation lymphokine production and amoebic activity elicited by the galactose-inhibitable adherence protein of Entamoeba histolytica. Infect Immun 1992;60:2143-6.
- Gandhi BM, Acharya SK, Irshad M, Gupta H, Chawla TC, Tandon BN. Entamoeba histolytica: elevated nitroblue tetrazolium reduction activity in polymorphs during amoebic liver abscess. Trans Roy Soc Med Hyg 1987;81:283-5.
- Salata RA, Martínez-Palomo A, Canales L, Murray HW, Treviño N, Ravdin JI. Supression of T-Lymphocyte responces to Entamoeba histolytica antigen by immune sera. Infect Immun 1990;58:3941-6.
- Urdaneta H, Rondon M, Muñoz M, Hernández M. Isolation and axenization of two Entamoeba histolytica strains. GEN 1995;49:23-8.
- Aguirre A, Molina S, Urdaneta H, Cova JA, Guhl F. Characterization of two Venezuelan Entamoeba histolytica strains using Electrophoretic Isoenzyme patterns and PCR-SHELA. Arch Med Res 1997;28:285-7.
- Diamond L. Techniques of axenic cultivation of Entamoeba histolytica Schaudinn, 1903, and E. histolytica like amebae. J Parasitol 1968;54:1047-56.
- Ghadirian E, Meerovitch E, Kongshavn P. Role of macrophage in host defense against experimental hepatic amebiasis in hamster. Infect Immun 1983;42:1017. 19. Bruckner DA. Amebiasis. Clin Microbiol Rev 1992;5:356.
Recibido: 17 de septiembre de 2001. Aprobado: 10 de enero de 2002.
Dr. Osbert Rosales Manrique. Instituto de Inmunología Clínica, Edificio Louis Pasteur, Mérida, Venezuela. Telef. 074-403211. Correo electrónico: hurdaneta84@hotmail.com
1 Máster de Inmunología.
2 Doctor en Ciencias. Profesor Titular.
3 Especialista en Inmunología. Profesor Titular.