Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.56 n.2 Ciudad de la Habana Mayo-ago. 2004
Instituto de Medicina Tropical Pedro Kourí
Determinación de la actividad glutatión-S-transferasa en cepas de Culex quinquefasciatus de Cuba y otros países de América Latina
Lic. Cristina Díaz,1 Lic. María Magdalena Rodríguez,1 Téc. Mario Fresneda2 y Dr. Juan A. Bisset3
Resumen
Se optimizó el micrométodo para la determinación de la actividad específica de glutatión S-transferasa en una cepa seleccionada en el laboratorio con lambdacialotrina por 6 generaciones (SP6). Los valores de saturación para glutatión reducido y 1-cloro 2,4-dinitrobenceno fueron 15 mM y 40 mM, respectivamente; el tiempo óptimo de lectura de la reacción que permitió diferenciar la cepa resistente SP6 de la susceptible de referencia SLAB resultó de 3 min. A través del micrométodo ya optimizado se probaron 4 cepas procedentes de Cuba (SANTIAGO DE CUBA, SD4, QUIBÚ y SP6), una de Venezuela (MIRANDA), una de Colombia (MEDELLÍN) y una de Brasil (RÍO DE JANEIRO). Los más altos valores de actividad de la enzima fueron observados en la cepa MIRANDA. Sin embargo, este mecanismo de destoxificación se encontró a muy baja frecuencia en todas las cepas, indicando que no desempeña un papel importante en la resistencia a insecticidas en las cepas de estudio. Se compararon los valores de GST con las frecuencias de esterasas inespecíficas y acetilcolinesterasa modificada para cada una de las cepas estudiadas.
Palabras clave: Optimización, mecanismos de resistencia a insecticidas, glutatión S-transferasa.
El desarrollo de la resistencia a insecticidas ha sido quizás la más seria consecuencia de su amplio uso indiscriminado. Durante las últimas décadas muchos insectos han desarrollado resistencia a estos; hasta 1990 se reportaron 500 especies de insectos resistentes a una o más clases de los tóxicos.1 La resistencia es heredada y ha demostrado ser uno de los mayores obstáculos en el control de los insectos. Los insecticidas han contribuido a disminuir males como la malaria, la fiebre amarilla, filariosis, encefalitis y arbovirosis, adquiridas o transmitidas por vectores; y a su vez han mejorado la producción agrícola en todo el mundo, pero se han visto limitados por la evolución de la resistencia en muchas especies de insectos.
Entre los mecanismos bioquímicos que confieren resistencia a un amplio grupo de insecticidas se encuentra la familia de la glutatión S-transferasa.2-4
La glutatión S-transferasa (GST) es una familia de enzimas que catalizan la conjugación del glutatión endógeno a una variedad de compuestos electrofílicos, protegiendo las macromoléculas biológicas como las proteínas y los ácidos nucleicos de las consecuencias tóxicas de una reacción covalente con el insecticida. Estas enzimas han sido implicadas en la destoxificación y biotransformación de muchos xenobióticos, incluidos varios carcinógenos y un número considerable de medicamentos. La conjugación incrementa la solubilidad del compuesto electrofílico (e.g. insecticidas), facilitando la excreción de la molécula del organismo.5
La GST citosólica, encontrada tanto en plantas como animales, es una proteína dimérica, cada una compuesta de 2 subunidades las cuales pueden ser homodímeros o heterodímeros. Pueden ser clasificadas además, de acuerdo con su estructura y especificidad de sustrato. Esta enzima es inducible por algunos compuestos químicos, tanto en mamíferos como en insectos.6
La GST de insectos ha sido clasificada como clase theta. Se ha propuesto a esta clase como precursora de las clases alfa, miu y pi, basados en la distribución aparente de esta en un rango diverso de organismos que incluyen bacterias, levaduras, plantas e insectos.7
Varios estudios han correlacionado la resistencia a insecticidas con niveles incrementados de actividad GST y la producción de diferentes isoformas.8,9 Las diferentes actividades catalíticas de GST y el número de enzima individual presente en las cepas de insectos susceptibles y resistentes han demostrado ser el factor responsable de la resistencia a varios insecticidas.10,11
Este sistema enzimático generalmente está involucrado en la resistencia a insecticidas organofosforados y proveen la forma más importante de resistencia metabólica al organoclorado DDT a través de la dehidroclorinación a DDE, en insectos.12,13
Los objetivos del presente trabajo fueron optimizar y aplicar este micrométodo para determinar la actividad de GST en Culex quinquefasciatus y precisar si este mecanismo estaba influyendo en la resistencia a insecticidas en cepas de este vector, procedentes de Cuba y otros países de Latinoamérica.
Para optimizar este método fue necesario determinar los valores de saturación de sustrato (glutatión reducido y 1-cloro 2,4-dinitrobenceno) y el tiempo óptimo de lectura de la reacción, lo cual permitió diferenciar la cepa resistente SP6 de la susceptible de referencia SLAB, así como conocer el estado de este mecanismo (GST) en otras cepas de Latinoamérica.
Métodos
Para el estudio se utilizaron las cepas siguientes:
SLAB: cepa susceptible de referencia de la especie Culex quinquefasciatus, donada por la Universidad de Montpellier, Francia.
QUIBÚ y SANTIAGO DE CUBA: cepas de Culex quinquefasciatus de Cuba, colectadas en el terreno en las ciudades de Ciudad Habana y Santiago de Cuba respectivamente y mantenidas en el Insectario.
SP6: cepa de Culex quinquefasciatus presionada en el laboratorio con el insecticida piretroide lambdacialotrina por 6 generaciones a partir de la cepa SANTIAGO DE CUBA.
SD4: cepa de Culex quinquefasciatus presionada en el laboratorio con el insecticida piretroide deltametrina por 4 generaciones, a partir de la cepa SANTIAGO DE CUBA.
MIRANDA: cepa de Culex quinquefasciatus de Venezuela mantenida en el Insectario.
MEDELLÍN: cepa de Culex quinquefasciatus de Colombia mantenida en el Insectario.
RÍO DE JANEIRO: Cepa de Culex quinquefasciatus de Brasil mantenida en el Insectario.
Optimización del ensayo
Para la optimización del micrométodo se utilizó la cepa SP6, seleccionada con lambdacialotrina por 6 generaciones, con un FR de 141,4 x para este insecticida comparada con la cepa susceptible SLAB.13 Las larvas individuales de cuarto estadio de SP6 fueron homogeneizadas en 200 mL de tampón fosfato 0,1 M, pH 7,4.
La actividad GST fue determinada utilizando 1-cloro-2,4-dinitrobenceno (CDNB) y glutatión reducido (GSH), como sustratos; en todos los ensayos se utilizaron controles negativos (blancos) además de individuos de la cepa susceptible SLAB que fue tomada como referencia. El ensayo consistió de una mezcla de trabajo de 25 mL de GSH y 125 mL de CDNB. Las concentraciones de cada uno de los sustratos se variaron de forma independiente, para determinar las concentraciones saturantes de cada sustrato. Las concentraciones variaron entre 5-70 mM para CDNB y 1-40 mM para GSH. Los reactivos fueron preparados diariamente antes de su utilización.
A cada pocillo de la placa de microtitulación se le adicionaron 200 mL de la mezcla de reacción y 20 mL del homogenato de las larvas. Las reacciones fueron llevadas a cabo a 25 °C y leídas en un lector de ELISA (Labsystems iEMS Reader MF) a 340 nm cada 30 s, durante 5 min. Luego se realizaron 3 lecturas más cada 5 min.
Las concentraciones saturantes de CDNB y GSH se determinaron a partir de los gráficos de actividad enzimática (Vo) contra concentraciones, teniendo en cuenta la cinética enzimática de Michaelis-Menten.
El tiempo óptimo de lectura de la reacción para discriminar entre la cepa resistente y la susceptible de referencia SLAB, se determinó como el punto dentro de la linealidad que difiriera significativamente, mediante una prueba t de Student.
El valor de corte para determinar la frecuencia de aparición de este mecanismo de resistencia se determinó como el valor máximo de actividad GST que se observó en los individuos de la cepa susceptible de referencia SLAB.
Determinación de la actividad GST en las cepas de campo
A partir de los resultados obtenidos en la optimización del micrométodo, se ensayaron 282 larvas para la actividad GST en las cepas QUIBÚ, SANTIAGO DE CUBA, SD4, MIRANDA, MEDELLÍN, RÍO DE JANEIRO y SLAB. El estimado de la frecuencia de los genes de GST se obtuvo del número de individuos susceptibles para cada cepa, asumiendo que la población se encontraba en equilibrio Hardy-Weinberg.
La concentración de proteínas se determinó según el método BCA protein assay, utilizando BSA como patrón.14
Análisis estadístico de los resultados. Los valores de actividad GST para todas las cepas se probaron para la normalidad. Las diferencias estadísticas entre las cepas se determinaron mediante un análisis de varianza de clasificación simple y una prueba de Duncan.
Resultados
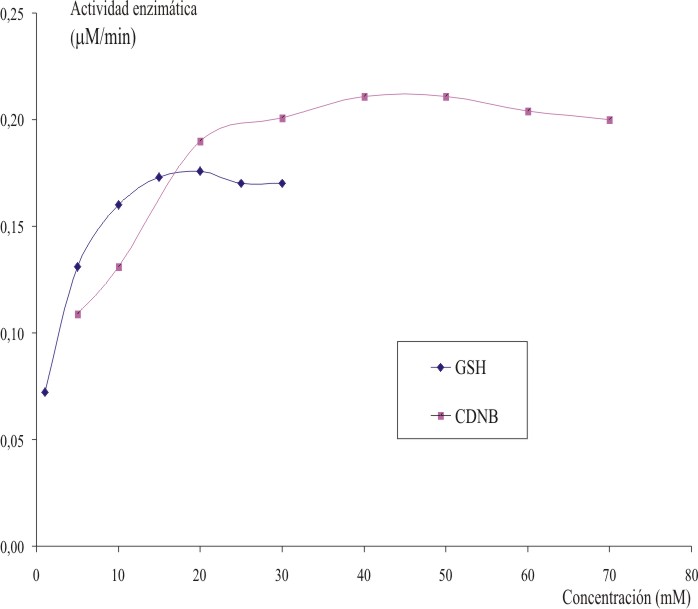
Las concentraciones saturantes de los sustratos CDNB y GSH resultaron 40 y 15 mM, respectivamente (fig. 1). Estas concentraciones resultaron adecuadas para diferenciar de forma significativa los valores de actividad específica de GST de las poblaciones de SP6 de la cepa susceptible de referencia SLAB. La formación de DNP-GSH, producto de la conjugación del CDNB y el GSH por la enzima GST, mantuvo la linealidad hasta los 5 min. Brogdon y Barber (1990) obtuvieron resultados similares al ensayar esta enzima en mosquitos Anopheles arabiensis.15 El tiempo óptimo mínimo para la lectura de la reacción fue de 3 min (fig. 2).
Fig. 1. Concentración saturante para los sustratos CDNB y GSH (40 y 15 mM, respectivamente).
Fig. 2. Tiempo óptimo mínimo para la lectura de la reacción (3 min).
El valor de corte para determinar la presencia del mecanismo de destoxificación mediada por GST fue de 0,5 µM/min., que correspondió al valor máximo de actividad GST observado en los individuos de la cepa SLAB (fig. 3). No se encontró correlación entre la concentración de proteínas y la actividad GST en las cepas estudiadas, por lo que los valores de GST están reportados como actividad enzimática y no como actividad específica.
Fig. 3. Valor de corte para determinar la presencia del mecanismo de destoxificación mediada por GST (0,5 µM/min).
En las poblaciones ensayadas para la actividad GST (tabla 1) se observa que este mecanismo de destoxificación no se presenta con alta frecuencia, oscilando entre 0,047 (QUIBÚ y SANTIAGO DE CUBA) y 0,095 (RIO DE JANEIRO). La cepa MIRANDA, resultó la de mayor frecuencia de individuos con actividad incrementada de GST. Sin embargo, los valores promedio de actividad enzimática GST de las poblaciones de campo difirieron significativamente de la cepa susceptible de referencia SLAB (tabla 2).
Tabla 1. Frecuencia del mecanismos de glutatión S-transferasa (GST) en las cepas de Culex quinquefasciatus estudiadas
| Cepa | GST |
| MIRANDA | 0,373 |
| RÍO DE JANEIRO | 0,095 |
| SP6 | 0,085 |
| MEDELLÍN | 0,067 |
| SD4 | 0,052 |
| SANTIAGO CUBA | 0,047 |
| QUIBÚ | 0,047 |
| SLAB | 0 |
Tabla 2. Actividad enzimática promedio de glutatión S-transferasa (GST) en las poblaciones de Culex quinquefasciatus estudiadas
| Cepa | Actividad enzimática (µM/min) promedio* |
| Miranda | 0,533 a |
| SP6 | 0,405 b |
| Medellín | 0,393 b |
| SD4 | 0,322 c |
| Río de Janeiro | 0,308 c |
| Quibú | 0,299 c |
| Santiago de Cuba | 0,263 c |
| Slab | 0,171 d |
* Medias con letras diferentes difieren significativamente entre sí a p< 0,05 según una prueba de Duncan.
Discusión
Con el desarrollo de la resistencia a insecticidas se han incrementado las investigaciones sobre los mecanismos que la producen y ha sido necesario adecuar los métodos para su detección, lo que facilita el uso de insectidas de forma correcta por los programas de control.15
Peiris y Hemingway (1990) establecieron un micrométodo para la detección de esterasas elevadas en Culex quinquefasciatus,16 y Brogdon y Dickinson (1983) lo reportaron en Anopheles albimanus;17 en todo caso difieren las concentraciones de sustrato y colorante, así como el tiempo de lectura.
El micrométodo para detectar actividad GST incrementada, optimizado y descrito en este trabajo logró diferenciar significativamente poblaciones de campo y seleccionadas en el laboratorio bajo presión de selección con insecticidas, que presentan un factor de resistencia a insecticidas organofosforados elevado; por lo que este micrométodo resulta útil para estudios comparativos de poblaciones de mosquitos Culex quinquefasciatus. La actividad GST, según este método, puede ser detectada en pequeñas fracciones de homogenato de larvas, lo que permitirá estudiar en un mismo individuo varios mecanismos bioquímicos de resistencia, así como electroforesis en geles de poliacrilamida.
En Cuba se desarrolló la optimización del método para determinar GST en Aedes aegypti y se realizó la determinación de los valores en cepas de varios países.18,19
El análisis de los resultados obtenidos en las cepas de campo estudiadas muestra que la frecuencia de aparición del mecanismo GST es muy baja. Esto puede deberse a que este mecanismo de destoxificación interviene generalmente en la resistencia a organofosforados, pero en las cepas estudiadas el mecanismo de esterasas elevadas fue el de mayor frecuencia en estas poblaciones y principal responsable de la resistencia a organofosforados, aunque también se encontró una acetilcolinesterasa alterada.20,21 Sin embargo, estos autores no reportaron actividad GST debido a la ausencia de un método adecuado para su detección. Teniendo en cuenta que la GST posee actividad esterasa no específica,22,23 este mecanismo pudo estar incrementando, en aquel momento, por la alta frecuencia de esterasas inespecíficas encontrada por Bisset y otros (1990)20. El cambio de organofosforados por piretroides ha resultado en una disminución de la frecuencia de genes de esterasas inespecíficas elevadas y acetilcolinesterasa modificada y probablemente también los genes de GST elevada.
Actualmente en Venezuela se continúan utilizando insecticidas organofosforados para el control de poblaciones de mosquitos vectores, lo que ha resultado en la selección del mecanismo de esterasas elevadas18 y posiblemente esté comenzando a seleccionarse el mecanismo de resistencia metabólica mediado por GST, aunque aún se encuentra en baja frecuencia (0,37).
Un problema potencial para la detección de GST en el campo es que no se pueden discriminar visualmente individuos con alta o baja actividad de GST, con este método optimizado es posible diferenciarlo al nivel de laboratorio.
En general se puede afirmar que estas adecuaciones permiten, por primera vez en Cuba, diferenciar entre individuos y entre cepas susceptibles y resistentes a insecticidas mediante GST en Culex quinquefasciatus. Este método puede ser extendido para su utilización a otros países.
Summary
In the present paper, we standardized a microtitration assay for the determination of specific activity of glutathione-S-transferase using a Culex quinquefasciatus strain selected in lab with pyrethroid insecticide lambdacyhalothrin for 6 generations (SP6). The saturation values for reduced glutathione and 1-chlorine 2,4-dinitrobenzene were 15 mM and 40 mM, respectively; we also estimated that 3 minutes was the optimal time in order to differentiate resistant strain SP6 from the susceptible reference strain S-Lab (p>0.05). Additionally, the optimized microtitration method allowed testing 4 Culex strains from Cuba (SANTIAGO DE CUBA, SD4, QUIBU AND SP6), one from Venezuela (MIRANDA), one from Colombia (MEDELLIN) and the other from Brazil (RIO DE JANEIRO) for glutathione-S-transferase activity. MIRANDA showed the highest activity for this detoxifying enzyme. However, the mechanism of detoxyfication in all the strains was very unfrequent, which indicates that its role in resistance to insecticide for all the studied strains is not so important. Glutathione-S-transferase values were compared with non-specific esterase and altered acetylcholinesterase frequencies for each of the studied strains.
Key words: Optimization, mechanisms of insecticide resistence, gluthation- S-transferase.
Referencias bibliográficas
- Feyereisen R. Molecular biology of insecticide resistance. Toxicol Lett 1995;82/83:83-90.
- Dauterman WC. The role of hydrolases and glutathione S-transferases in insecticide resistance. In Georghiou GP, Saito T eds. Pest resistance to pesticides. New York: Plenum, 1983: pp. 229-48.
- Yunchuan D, Ortelli F, Rossiter L, Hemingway J, Ranson H. The Anopheles gambiae glutathione transferase supergene family: annotation, phylogey and expression profiles. BMC Genomics 2003;4(1):35-43.
- Board PG, Coggan M, Chelvanayagam G, Easteal S, Jermiin LS, Schulte GK, et al. Identification, characterisation, and crystal structure of the Omega class glutathione transferases. J Biol Chem 2000;275:24798-806.
- Board P, Russell RJ, Marano RJ, Oakeshott JG. Purification, molecular cloning and heterologous expression of a glutathione s-transferase from Australian sheep blowfly (Lucilia cuprina). Biochem J 1994;299:425-30.
- Mannervik B, Alin P, Guthenberg C, Jenson H, Kalim Tahir M, Warholm M, et al. Identification of three classes of cytosolic glutathione S-transferase common to several mammalian species: Correlation between structural data and enzymatic properties. Proc Natl Acad Sci USA 1985;82:7202-7206.
- Wilce MCJ, Board PG, Feil SC, Parker MW. Crystal structure of a theta-class glutathione transferase. EMBO J 1995;14(10):2133-43.
- Ku SS, Chiang FM, Hsin CY, Yao YE, Sun CN. Glutathione transferase isozymes involved in insecticide resistance of diamondback moth larvae. Pest Biochem Physiol 1994;50:191-7.
- Ranson H, Claudianos C, Ortelli F, Abgrall C, Hemingway J, Sharakhova MV, et al. Evolution of supergene families associated with insecticide resistance. Science 2002;298:179-81.
- Paton MG, Karunaratne SHPP, Giakoumaki E, Roberts N, Hemingway J. Quantitative analysis of gene amplification in insecticide resistant Culex mosquitoes. Biochem J 2000;346:17-24.
- Brattsten LB, Holyoke CV, Leeper JR, Raffa KF. Insectide resistance: challenge to pest management and basic research. Science 1986;12:1255‑60.
- Ortelli F, Rossiter LC, Vontas J, Ranson H, Hemingway J. Heterologous expression of four glutathione transferase genes genetically linked to a major insecticide-resistance locus from the malaria vector Anopheles gambiae. Biochem J 2003;373(Pt 3):957-63.
- Rodríguez MM, Bisset JA, Rodríguez I, Díaz C. Selección de una cepa de Culex quinquefasciatus resistente a lambdacialotrina y su espectro de resistencia cruzada a otros insecticidas. Rev Cubana Med.Trop 1998;50(2):129-32.
- Stoscheck CM. Quantitation of Protein. Methods in Enzymology 1990;182:50-69.
- Brogdon WG, Barber AM. Microplate assay of glutathione s-transferase activity for resistance detection in single mosquito triturates. Comp Biochem Physiol 1990;96B(2):339-42.
- Peiris HTR, Hemingway J. Mechanisms of insecticide resistance in a temephos selected Culex quinquefasciatus Say (Diptera : Culicidae ) strain from Sri Lanka. Bull Entomol Res 1990;80:359-65.
- Brogdon WG, Dickinson CM. A microassay system for measuring esterase activity and protein concentration in small samples and high pressure liquid chromatography eluate fractions. Annal Biochem 1983;131:499-503.
- Rodríguez MM., Bisset JA, de Fernández DM, Lauzán L, Soca A. Detection of insecticide resistance in Aedes aegypti (Diptera: Culicidae) from Cuba and Venezuela. J Med Entomol 2001;38(5):623-8.
- Rodríguez MM, Bisset JA, Molina D, Díaz C, Soca LA. Adaptation of microtitration plate methods for quantification of the activity of esterases and glutathione-s-transferase in Aedes aegypti. Rev Cubana Med Trop 2001;53(1):32-6.
- Bisset JA, Rodríguez MM, Díaz C, Ortiz E. The mechanisms of organophosphate and carbamate resistance in Culex quinquefasciatus (Diptera: Culicidae) from Cuba. Bull Entomol Res 1990;80:245‑50.
- Ganesh KN, Urmila J, Vijayan VA. Pyrethroid susceptibility & enzyme activity in two malaria vectors, Anopheles stephensi (Liston) &. A. culicifacies (Giles) from Mysore, India. Indian J Med Res 2003;117:30-8.
- Lalah JO, Chien CI, Motoyama N, Dauterman WC. Glutathione S-transferase: a-Naphthyl acetate activity and possible role in insecticide resistance. J Econ Entomol 1995;88(4):768-70.
- Chareonviriyaphap T, Rongnoparut P, Chantarumporn P, Bangs MJ. Biochemical detection of pyrethroid resistance mechanisms in Anopheles minimus in Thailand. J Vector Ecol 2003;28:108-16.
Recibido: 2 de octubre de 2003. Aprobado: 10 de febrero de 2004.
Lic. Cristina Díaz. Instituto de Medicina Tropical Pedro Kourí. Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. Teléf: 2020426. Correo electrónico: ciipk@ipk.sld.cu
2 Maestro Agrícola. Técnico A en Investigación y Servicios.
3 Doctor en Ciencias. Licenciado en Biología. Investigador Titular.