Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.56 n.3 Ciudad de la Habana sep.-dic. 2004
Instituto de Medicina Tropical Pedro Kourí
Mecanismo de acción del anticuerpo monoclonal ES-78 contra la fasciolosis
Lic. Ricardo Marcet Sánchez,1 Téc. Mabel Figueredo Pino2 y Dr. Jorge Sarracent Pérez3
Resumen
Se reportó recientemente que el anticuerpo monoclonal ES-78 es capaz de conferir protección pasiva contra fasciolosis. Se realizó la identificación de uno de los mecanismos mediante el cual ejerce su acción protectora contra la enfermedad. Este anticuerpo monoclonal fue capaz de realizar citotoxicidad mediada por anticuerpo tanto sobre células Raji marcadas con el antígeno de excreción-secreción de Fasciola hepatica como sobre parásitos recién desenquistados. Este anticuerpo monoclonal no inhibió la actividad de cisteíno proteinasa utilizando azocaseína como sustrato.
Palabras clave: Fasciola hepatica, protección pasiva, anticuerpo monoclonal ES-78, citotoxicidad mediada por anticuerpos.
La infección causada por el trematodo Fasciola hepatica es considerada como una enfermedad de importancia médico veterinaria. Sin embargo, el interés en esta parasitosis es creciente debido al elevado número de casos reportados en humanos en algunos países de zonas tropicales y subtropicales.1 En Cuba, la fasciolosis es una enfermedad presente en el ganado, y en los últimos años, se ha observado un incremento del número de personas infectadas. Esta tendencia puede estar relacionada con que es una importante enzootia en el ganado.2 La fasciolosis en rumiantes domésticos causa pérdidas económicas significativas al nivel mundial en las comunidades agrícolas rurales y en el sector comercial, con un estimado de hasta 3 000 000 000 de dólares por año.3 A pesar de que no siempre existe una plena coincidencia entre las áreas hiperenzoóticas de fasciolosis en el ganado doméstico, con las áreas donde se presenta la mayor cantidad de casos en el humano, está claro que el control de la fasciolosis en el hombre se puede realizar a través del control de esta en el ganado.1
Diferentes estudios han mostrado que la infección con Fasciola hepatica puede inducir una respuesta inmune en el bovino, capaz de provocar la muerte del parásito y conferir protección. Se han estudiado diferentes candidatos vacunales de naturaleza proteica que han mostrado resultados promisorios; entre estos se pueden mencionar la Fh12, que es una proteína asociada a ácidos grasos (FABP), la glutatión S transferasa (GST), la hemoglobina (Hb) y las cisteíno proteasas del tipo de las catepsinas L (CatL). Algunas, además de la reducción de la carga parasitaria en el ganado, pueden reducir la producción y maduración de huevos del parásito.
En 1990 se informó la obtención del anticuerpo monoclonal (AcM) ES-78 dirigido contra antígenos de excreción-secreción (AgES) de parásitos adultos mantenidos in vitro. Este anticuerpo es utilizado con éxito en la detección de antígenos en heces en todas las etapas de la infección.2,4 y es capaz de conferir altos niveles de protección en ratones Balb/c (especie altamente susceptible) cuando es administrado pasivamente 24 h antes de un reto con metacercarias de Fasciola hepatica.5 El objetivo de este trabajo consistió en conocer sobre los posibles mecanismos de acción del AcM ES-78 en un modelo experimental.
Métodos
Animales
Se utilizaron ratones Balb/c hembras de 20-25 g de peso.
Anticuerpos monoclonales
El anticuerpo monoclonal ES-78 fue purificado a partir de líquido ascítico a través de cromatografía de intercambio iónico usando una columna Mono Q HR16/5.2 Como control se utilizó un anticuerpo monoclonal purificado obtenido contra antígenos de virus dengue de la misma clase y subclase que el ES-78 (IgG2a) y que fue gentilmente donado por el laboratorio de virología del Instituto de Medicina Tropical, IPK.
Metacercarias de Fasciola hepatica
Fueron obtenidas a partir de su hospedero intermediario (Fossaria cubensis) y donadas para esta investigación por el Laboratorio de Malacología del Instituto de Medicina Tropical Pedro Kourí (IPK).
Parásitos recién desenquistados de Fasciola hepatica
Se infectaron ratones Balb/c por vía oral con 400 metacercarias de este parásito; 2 d después de la infección, los ratones fueron sacrificados por asfixia con halotano y colectados de la cavidad peritoneal y lavados con solución salina tamponada con fosfato (PBS pH 7,2), que contenía antibióticos (1 u/mL de penicilina, 1 mg/mL de estreptomicina) y antimicótico (2,5 ng/mL de anfotericina B).
Inhibición de la actividad proteinasa por el acm ES-78
Fueron preincubados a 37 ºC durante 2 h, 100 mL de AgES de adulto de Fasciola hepatica purificado (1 mg/mL), e igual volumen de AcM ES-78, IgG2a (2 mg/mL) o AcM IgG2a (2 mg/mL) no relacionado, obtenido contra virus Dengue. A 50 mL de esta mezcla, se añadieron 25 mL de 0,1 M de solución salina tamponada con fosfatos que contenían 0,5 mM de DTT, pH 6,5 y 25 mL de azocaseina (Sigma Chemical Co.) como sustrato cromógeno. La mezcla fue incubada a 37 ºC durante 1 h y la proteólisis fue detenida por la adición de 100 mL de ácido tricloro acético (TCA) 20 %. La muestra fue enfriada a 4 ºC y centrifugada a 3 000 g por 10 min. La absorbancia de los sobrenadantes fue monitoreada a 336 nm en un espectrofotómetro. Este ensayo fue realizado 2 veces.
Ensayo de citotoxicidad mediada por anticuerpo (CMA) sobre células Raji
Se utilizó un juego de reactivos de la Boehringer Mannheim que mide liberación de lactato deshidrogenasa (LDH) como un indicador de daño celular. Se utilizaron como células efectoras macrófagos peritoneales y células de bazo de ratones Balb/c, machos, libres de patógenos. Las células blanco (células Raji ATCC CCL86) fueron cubiertas con AgES de adultos de Fasciola hepatica usando como agente condensante el SMCC (succinimidyl-4-maleimido methyl cyclohexane 1 carboxylated).6 Las células blanco (104 cél.ulas/mL) fueron suspendidas en medio de cultivo completo (RPMI 1 640 con 10 % de suero fetal bovino) y dispensado en volúmenes de 0,1 mL/pozo, por triplicado, en placas de cultivos (Nunc). Las células efectoras se añadieron en volúmenes de 0,1 mL a proporciones efector:blanco de 100:1, 50:1, 20:1 y 10:1. La mezcla de células fue incubada a 37 ºC en atmósfera a 5 % de CO2 por 18 h, en presencia del AcM ES-78 (400 mg/mL) o el AcM no relacionado. Después de la incubación, 0,1 mL del sobrenadante fue removido de cada pozo para realizar la detección de LDH. El porcentaje de lisis para cada anticuerpo se calculó utilizando la fórmula siguiente:

La liberación espontánea se obtuvo por la incubación de las células blancos en medio completo. La liberación máxima se obtuvo incubando las células blanco con medio completo en presencia de tritón 2 %. El porcentaje de lisis específica por CMA se calculó usando la fórmula:
Lisis específica por CMA (ES-78) = % de lisis producida por el AcM ES-78 - % de lisis producida por el anticuerpo no relacionado
Ensayo de citotoxicidad sobre parásitos recién desenquistados
Dos grupos de 10 parásitos recién desenquistados fueron mantenidos in vitro en medio completo e incubados en presencia de 400 mg/mL del AcM ES-78 o 400 mg/mL de un AcM no relacionado (grupo control). Se utilizaron como células efectoras 4 x 106 esplenocitos/pozo, mezcladas con 1 x 106 células/pozo obtenidas de exudado peritoneal de ratones Balb/c libres de patógenos. La citotoxicidad mediada por anticuerpo se determinó bajo microscopio de fase por observación directa. El criterio de muerte del parásito incluyó, pérdida total de movilidad y de los detalles celulares. Este experimento fue realizado 2 veces.
Resultados
Ensayo de inhibición de actividad de proteinasa utilizando el AcM ES-78
En este ensayo no se encontró inhibición de la actividad proteinasa del AgES de Fasciola hepatica utilizando azocaseína como sustrato, tanto para el AcM no relacionado, como para el AcM ES-78.
Ensayo de citotoxicidad mediada por anticuerpo sobre células Raji
En este ensayo se evaluó la capacidad del AcM ES-78 de inducir citotoxicidad sobre células Raji cubiertas con AgES de adulto de F. hepatica en presencia de esplenocitos y células peritoneales de ratones no estimulados. Después de 18 h de cultivo se encontró citotoxicidad específica en las diferentes relaciones células efectoras/células blanco (100:1, 50:1, 20:1, 10:1). A mayor relación, células efectoras/células blanco, se encontró mayor porcentaje de lisis por CMA (fig.1).
Fig. 1. Liberación de LDH expresada como porcentaje de lisis específica sobre células Ragi utilizando AcM ES-78.
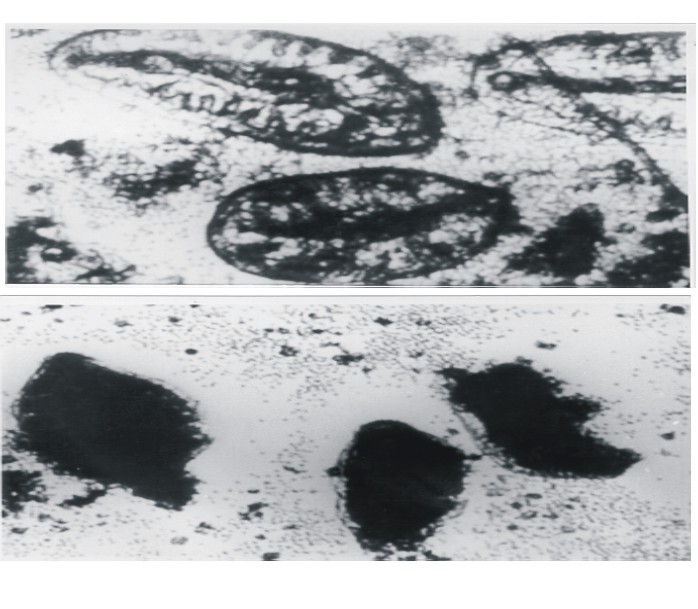
Citotoxicidad mediada por anticuerpos sobre parásitos recién desenquistados
La CMA se evaluó por el efecto directo de esplenocitos y células peritoneales de ratones no estimulados sobre parásitos recién desenquistados durante 7 d in vitro. Se observó que las células efectoras cultivadas en presencia del AcM ES-78 desarrollaron efectos adversos sobre los parásitos, mostrando señales evidentes de muerte. La media del porcentaje de los parásitos muertos (2 experimentos) en presencia del AcM ES-78 fue de 85 % (figs. 2A y 2B)
AcM no relacionado
AcM ES-78
Fig. 2. Ensayo de citotoxicidad mediada por anticuerpo sobre parásitos recién desenquistados.
Discusión
Hasta el momento, no existe en el mercado una vacuna efectiva contra la fasciolosis en el ganado. El hallazgo de un candidato vacunal, además de aminorar las pérdidas económicas causadas por la infección de este trematodo, sería de gran utilidad para el control de la fasciolosis humana.
Recientemente, se informó la identificación de un epítope protector utilizando el AcM ES-78.5 Las moléculas reconocidas por este AcM, fueron purificadas por cromatografía de afinidad y administradas como inmunógenos y no fueron capaces de reducir la carga parasitaria ante un reto con 15 metacercarias/ratón (datos no mostrados). Sin embargo, se demostró que la administración pasiva del AcM ES-78 previa al reto produce una reducción significativa de la carga parasitaria en el hígado de los ratones. De la protección que produce el AcM en los ratones, se infiere que el epítope reconocido por este debe desempeñar un papel importante en la protección del huésped contra el parásito. Este AcM reconoce fundamentalmente estructuras presentes en el sistema digestivo del parásito.5 Las moléculas que reconoce el AcM presentan actividad de cisteíno proteinasa y se ha reportado que en los trematodos, estas moléculas, están involucradas en varias funciones como la penetración a través de los tejidos del huésped, la adquisición de nutrientes, la evasión de la respuesta inmune del huésped y la participación en la producción de huevos.
Otros estudios han demostrado que anticuerpos anti-catepsinas L originados en conejos son capaces de inactivar las funciones de estas enzimas in vitro.7 Sin embargo, en el ensayo de inhibición de actividad de proteinasa utilizando el AcM ES-78 no se encontró inhibición de la actividad de estas enzimas en presencia del AcM, empleando azocaseína como sustrato. Esto sugiere que el efecto protector de este AcM no es debido a la inhibición de la actividad enzimática.
La utilización de células Raji marcadas con el AgES en presencia de células efectoras y el AcM evidenciaron que la citotoxicidad celular mediada por anticuerpo es uno de los mecanismos posibles a través del cual este AcM puede ejercer su acción protectora. Este resultado fue reafirmado cuando se realizó el mismo diseño utilizando parásitos recién desenquistados como células blanco, demostrándose que el AcM ES-78 (IgG2a) está involucrado en el desarrollo de una respuesta citotóxica, efectiva en los estadios tempranos del parásito.
El epítope reconocido por este AcM es conformacional, glicoproteico y presenta al menos un puente disulfuro, y ß- galactosa en su estructura, posiblemente en forma del disacárido galactosa - ß (1-3)-N acetil galactosamina.8 La obtención de esta estructura por la vía clásica del ADN recombinante es difícil. La utilización de la tecnología de AcMs anti-idiotipos y de péptidos recombinantes o sintéticos9 son variantes posibles para mimetizar los epítopes con estas características, lo que permitiría en el futuro lograr un posible candidato vacunal.
Agradecimientos
A la International Foundation for Science, IFS (Research grant No. B/3097-1) por el soporte económico para la realización del presente estudio.
Summary
It was recently reported that the ES-78 monoclonal antibody is capable of giving passive protection against fasciolosis. One of the mechanisms by which it exerts its protective action against the disease was identified. We also demonstrated in this report the capability of this monoclonal antibody to produce antibody dependent cell citotoxicity on Raji cells coated with excretory-secretory antigens, as well as on newly disencysted parasites.. No inhibition of proteinase activity was found in presence of this monoclonal antibody when azocasein substrate was used.
Keywords: Fasciola hepatica, passive protection, ES-78 monoclonal antibody, dependent cell citotoxicity.
Referencias bibliográficas
- Mas-Coma S, Esteban JG, Bargues MD. Epidemiology of human fascioliasis: A review and proposed new classification. Bull WHO 1999;77:340-6.
- Espino AM, Marcet R, Finlay CM. Detection of circulating excretory secretory antigens in human fasciolasis by Sandwich Enzyme Linked Immunosorbent Assay J Clin Microbiol 1990;28:2637‑40.
- Boray JC. In Parasites, Pest and Predators, eds Gaafar, SM, Howard, WE, Marsh, RE. New York: Elsevier 1985;179-218.
- Espino AM, Finlay CM. Sandwich enzyme-linked immunosorbent assay for the detection of excretory secretory antigens in human with Fasciolosis. J Clin Microbiol 1994;32:190-3.
- Marcet R, Díaz A, Arteaga E, Finlay CM, Sarracent J. Passive protection against Fasciolosis in mice by immunisation with a monoclonal antibody (ES-78 MoAb). Parasite Immunol 2002;24:103-8.
- Jefrey EC, Gallardo D, Burnside SS, Nelson AA, Sears DW. Rapid covalent Coupling of Proteins to cell surfaces: Immunological characterization of viable protein-cell conjugates. J Immunol Methods 1984;74:229-39.
- Smith AM, Dowd AJ, Heffernan M, Robertson CD, Dalton JP. Fasciola hepatica a secreted cathepsin 1-like proteinase cleaves host immunoglobulin. Int J Parasitol 1993;23:977-83.
- Díaz A, Espino AM, Marcet R, Otereo O, Torres D, Finlay CM, Sarracent J. Partial characterization of epitope on excretory-secretory products of F. hepatica recognized by monoclonal antibody ES78. J Parasitol 1998;84:51-61.
- Maitta RW, Datta K, Lees A, Belouski SS, Pirofski L. Immunogenicity and efficacy of Cryptococcus neoformans capsular polysaccharide glucuronoxylomannan peptide mimotope-protein conjugates in human immunoglobulin transgenic mice. Infect. Immun. 2004;72:196-208.
Recibido: 28 de marzo de 2004. Aprobado: 15 de septiembre de 2004.
Lic. Ricardo Marcet Sánchez. Instituto de Medicina Tropical Pedro Kourí. Autopista Novia del Mediodía Km 6 ½., La Lisa. AP 601, Marianao 13, Ciudad de La Habana, Cuba. Teléf. 202 0426-45. Correo electrónico: marcet@ipk.sld.cu; sarracent@ipk.sld.cu
1 Licenciado en Bioquímica. Investigador Agregado.
2 Técnica en Química. Técnico A en Laboratorio.
3 Doctor en Ciencias Biológicas. Investigador Auxiliar.