My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.57 no.2 Ciudad de la Habana May-Aug. 2005
Universidad del Quindio, Armenia, Colombia
Evaluación de la respuesta IgG anti-Toxoplasma y su avidez por western-blot en pacientes infectados por VIH
Lic. María Cristina Sarmiento,1 Dr. Jorge Enrique Gómez Marín2 y Dr. Jhon Carlos Castaño Osorio3
Resumen
Se utilizó la técnica de western blot IgG anti- Toxoplasma en 25 casos con VIH y 8 sueros control de pacientes sin infección por VIH, con la finalidad de evaluar la respuesta humoral en estos pacientes, porque l a toxoplasmosis cerebral es una patología frecuente en ellos. Los pacientes se dividieron en 3 grupos: 14 casos VIH positivo con toxoplasmosis cerebral y títulos serológicos IgG anti- Toxoplasma ; 11 casos VIH positivo sin toxoplasmosis cerebral y con títulos IgG anti- Toxoplasma ; y 8 pacientes VIH negativos con títulos IgG anti- Toxoplasma . Se encontró que a mayores títulos séricos de IgG anti- Toxoplasma mayor número de bandas en el western-blot. La intensidad de las bandas medida por densitometría varió de manera significativa para las proteínas de 66 y 31 kDa. Los resultados señalan que estas proteínas son de interés para evaluar su papel en la reactivación de la toxoplasmosis en los pacientes con infección por VIH.
Palabras clave : Toxoplasmosis, toxoplasmosis cerebral, western blot , avidez, IgG, diagnóstico, proteínas antigénicas.
La toxoplasmosis es la infección oportunista más frecuente del sistema nervioso central en pacientes infectados por el virus de inmunodeficiencia humana (VIH). Los pacientes seropositivos para Toxoplasma gondii y con recuentos de CD4+ menores que 200/mL tienen un riesgo elevado de desarrollar la enfermedad.1 De los individuos con anticuerpos séricos IgG anti-Toxoplasma e infección por VIH, 30 % termina presentando formas cerebrales severas de toxoplasmosis en algún momento de la enfermedad.2 En el Hospital "San Juan de Dios" en Bogotá, se encontró que 63 % de los pacientes con VIH poseen anticuerpos séricos anti-Toxoplasma y la toxoplasmosis cerebral (TC) fue la primera manifestación de la infección por VIH en 66 %. El tratamiento específico llevó a la mejoría en 13 de 15 casos, o sea, 86 % de estos.3
Los criterios diagnósticos actuales para TC son los hallazgos clínicos, la evaluación radiológica y la serología positiva para IgG anti-Toxoplasma.4 Sin embargo, los 2 primeros no siempre esclarecen el diagnóstico. Los estudios serológicos indican que la respuesta humoral es un dato valioso para el diagnóstico y pronóstico de la TC.5 La utilidad de los estudios serológicos es que permiten un diagnóstico precoz, los estudios radiológicos revelan daños ya existentes, mientras que los niveles altos de IgG pueden encontrarse varios meses antes al desarrollo del daño. Se ha encontrado que las variaciones en los títulos de IgG preceden la aparición de TC en 1 a 17 meses.6
Estudios recientes utilizando la técnica de western-blot para IgG anti-Toxoplasma han mostrado que la presencia de bandas de 25, 22 y 69 kDa son útiles para predecir la aparición de una TC.7,8 También de manera reciente se ha aplicado una técnica de western-blot de avidez en toxoplasmosis que permite poner en evidencia proteínas marcadoras de infección crónica y aguda.9 No existen estudios que evalúen la utilidad de la avidez por western blot en pacientes con infección por VIH.
El estudio de marcadores moleculares por western-blot en pacientes con VIH, también tiene como interés poder demostrar cuales proteínas son candidatas para el diseño de pruebas ELISA que usen estos antígenos, así como para poner en evidencia si existen diferencias geográficas en la respuesta inmune humoral específica. En el presente estudio se evaluó la respuesta de anticuerpos IgG anti-Toxoplasma por la técnica de western-blot en sueros de pacientes colombianos infectados o no por VIH con TC o sin esta, y la evaluación de 5 casos de seguimiento VIH positivos y con intervalos en la toma de muestra de 5 a 9 meses. Se aplica por primera vez la técnica de western-blot de avidez para IgG a sueros de pacientes infectados por VIH con TC y a los 5 casos de seguimiento, que incluyen 4 pacientes VIH positivos que no desarrollaron TC. Los objetivos del presente trabajo fueron: 1. determinar cuáles proteínas son específicas de un episodio de TC y compararlas con las reportadas en otros estudios y 2. determinar por la técnica de western-blot de avidez si se trataban de anticuerpos de aparición reciente o neoanticuerpos.9
Métodos
Pacientes: se estudiaron un total de 25 personas del programa VIH/SIDA en 2 hospitales de Bogotá: 20 procedentes del Hospital “San Juan de Dios” y 5 del Hospital “Simón Bolívar”. Los pacientes firmaron un consentimiento informado para participar en el estudio y se recolectaron datos en un formato de historia clínica en el cual se consignó la información siguiente: identificación, datos clínicos, síntomas al ingreso, enfermedades infecciosas previas, títulos séricos de IgG anti-Toxoplasma, recuento de células CD4, resultado de la prueba ELISA para VIH y confirmatoria por western-blot para VIH-1.
Como controles se usaron 8 sueros de mujeres gestantes VIH negativas que tenían pruebas serológicas positivas para IgG anti-Toxoplasma.
Los sueros de los pacientes fueron clasificados en 3 grupos.
Grupo 1: 14 casos VIH positivos con TC confirmada. Los criterios de inclusión para este grupo fueron presencia de síntomas neurológicos compatibles, imágenes diagnósticas que mostraran una o más lesiones cerebrales hipodensas o isodensas con anillo hipercaptante alrededor, respuesta al tratamiento específico anti-Toxoplasma y presencia de anticuerpos IgG específicos anti-Toxoplasma en suero por la técnica de inmunofluorescencia indirecta (IFI). Uno de ellos tuvo una segunda muestra 9 meses después del episodio.
Grupo 2: 11 casos VIH positivos sin TC y con presencia de anticuerpos IgG anti-Toxoplasma. En 4 casos hubo muestras adicionales tomadas en el curso de varios meses (entre 1 y 9 meses después).
Grupo 3: 8 casos de pacientes embarazadas, con criterios de toxoplasmosis reciente (títulos IFI IgG anti-Toxoplasma ³ 1:1024 y la IgM e IgA específicas anti-Toxoplasma positivas) y serología negativa para VIH.
Las muestras de suero fueron conservadas a – 20 °C y procesadas en las mismas condiciones de trabajo a cada uno de los sueros de acuerdo con la prueba aplicada: western-blot IgG o western-blot avidez IgG.
Preparación del antígeno soluble total de Toxoplasma gondii: se utilizó la metodología descrita previamente por Leport y otros, con algunas modificaciones.7 Se inocularon por vía intraperitoneal ratones ICR hembras de 21 d con taquizoítos de cepa RH de Toxoplasma gondii y el exudado peritoneal se recuperó 72 h después, mediante lavado con solución salina adicionada con gentamicina 10 mg/mL y penicilina 100 U/mL. Los taquizoítos fueron lavados con PBS pH 7,2 por 3 períodos de 10 min a 3 500 rpm y temperatura de 4 °C. Luego se filtró a través de una membrana de policarbonato de 3 mm. La concentración final se ajustó a 1 x 109 taquizoítos por mL. Luego de una nueva centrifugación, se desechó el sobrenadante y el botón de sedimentación fue resuspendido en agua destilada estéril y se adicionó una mezcla de los inhibidores de proteasas siguientes: EDTA 0,5 mM, pepstatina 0,1 mM, APMSF 0,1 mM y azida sódica 0,1 mM como bactericida. Posteriormente el antígeno se sometió a ciclos sucesivos de congelación en nitrógeno líquido y descongelación. Luego se realizó sonicación por 3 ciclos de 30 s a 50 watts. Por último se centrifugó por 10 min a 3 500 rpm y temperatura de 4 °C. La concentración final de proteínas medida por el método de Lowry fue de 1,3 mg/mL.
Western-blot IgG: la metodología se realizó de acuerdo con lo descrito por otros autores.7,9 Se realizó electroforesis del antígeno soluble total de T. gondii a una concentración de 10 mg por pozo diluido en tampón de carga en condiciones no reductoras y esta solución se sometió a calentamiento en baño María a 100 °C por 5 min. Se usó un patrón de proteínas de pesos moleculares medios de BIO-RAD (USA). Las proteínas fueron separadas mediante electroforesis de poliacrilamida (SDS-PAGE), en sistema discontinuo y concentración de gel de 10 %. La primera fase corrió a 75 v por 15 min, la segunda fase a 125 v por 1 h en temperatura de 4 °C. La electrotransferencia a membrana de nitrocelulosa se hizo a 200 mA por 1 h 15 min a temperatura de 4 °C. Posteriormente se colocaron las membranas en solución bloqueadora de sitios inespecíficos (PBS-Tween 20 más leche semidescremada 5 %) por 1 h a temperatura ambiente y se lavó 3 veces con PBS-Tween 0,1 % en agitación constante. Después de lavar con PBS-Tween 0,1 % se colocaron nuevamente en solución bloqueadora que contenía el anticuerpo primario (suero o plasma) en dilución 1/100. Se incubó 16 h a 4 °C y se lavó 3 veces con PBS-Tween. Finalmente el anticuerpo secundario (anti-IgG humana marcada con fosfatasa alcalina, Sigma, USA) se diluyó 1:4.000 en solución bloqueadora de sitios inespecíficos de unión y se incubó con la membrana por 1 h a 37 °C. Se repitieron los lavados con PBS-Tween y se reveló la reacción con sustrato BCIP-NBT (Sigma, USA).
Western-blot-Avidez IgG: los protocolos de preparación de la muestra, electroforesis y electrotransferencia se desarrollaron como fue descrito previamente.7,9 En resumen, en el immunoblot se tuvieron en cuenta las mismas condiciones para bloqueo de sitios inespecíficos de unión e incubación con el anticuerpo primario (suero), tal como se realizó en el western blot tradicional. Después del tercer lavado con PBS-Tween, se hizo un cuarto lavado con urea 6 M por 15 min. Un quinto lavado se hizo para retirar los residuos de urea. La incubación con el anticuerpo secundario y el revelado de la reacción fue descrito antes.
Inmunofluorescencia indirecta (IFI)-IgG: Se utilizó la técnica estandarizada por el Instituto Nacional de Salud para cuantificar los títulos serológicos de IgG anti-Toxoplasma en suero.10 Se obtuvieron taquizoítos de T. gondii a partir de exudado peritoneal de ratón inoculado 3 d antes y se fijaron con formaldehído 1 % sobre láminas de vidrio. Se probaron diluciones al doble del suero a partir de 1:2, se incubó durante 1 h a 37 °C en cámara húmeda y se lavó 2 veces con solución de fosfato salina 150 mM pH 7,2. Posteriormente se incubó por 30 min con anti-IgG conjugado a isotiocianato de fluoresceína (Fluoline H. Biomérieux), diluido 1:320 en Azul de Evans y se llevó a lectura en microscopio de fluorescencia. El resultado se consideró reactivo cuando se observó fluorescencia alrededor del parásito a partir de una dilución de suero 1:16.
Cuantificación de bandas antigénicas en perfiles western-blot: la cuantificación en unidades de absorbancia de la intensidad de visualización de las bandas antigénicas obtenidas en western-blot se hizo con el equipo GS-700 Imaging Densitometer y el programa de software Quantity One (BIO-RAD, USA). El peso molecular fue calculado de acuerdo con los estándares de peso molecular que se corrieron junto con las muestras para cada membrana.
Pruebas estadísticas: el análisis de los datos se realizó con el programa Epinfo 2002 (CDC, Atlanta). Se calcularon los promedios o la mediana de las frecuencias y se utilizó la prueba t de Student para determinar diferencias entre los promedios y también para las mediciones de absorbancia densitometría entre 2 grupos.
Resultados
Resultados de serología IFI-IgG y western-blot: el promedio de edad en el grupo 1 fue de 32,8 ± 6,6 (rango 23-52), para el grupo 2 de 34,6 ± 5,7 (rango 24-39) y para el grupo 3 de 32 ± 5,8 (rango 22-36). En el grupo 1 la mediana de títulos IgG fue de 1:1024 (rango 1:64 a 1:8000), en el grupo 2 la mediana fue de 1:256 (rango: 1:64 a 1:8000) y en el grupo 3 la mediana fue de 1:8000 (rango 1:1024 a 1:32000). Los resultados de western-blot se muestran en las figuras 1, 2 y 3. La mediana del número de bandas del grupo 1 fue de 11 (rango 3-15), en el grupo 2 de 4 (rango 1-11) y en el 3 de 11 (rango 7 a 14). La mediana del número de bandas aumentó significativamente en concordancia con los niveles de anticuerpos determinados por IFI y fue de 4 (rango 1-13) en los sueros con resultados IFI-IgG menores que 1:1024 y de 11 (rango 7-15) en los sueros con títulos mayores o iguales que 1:1024 (prueba t de Student p= 0,0083).
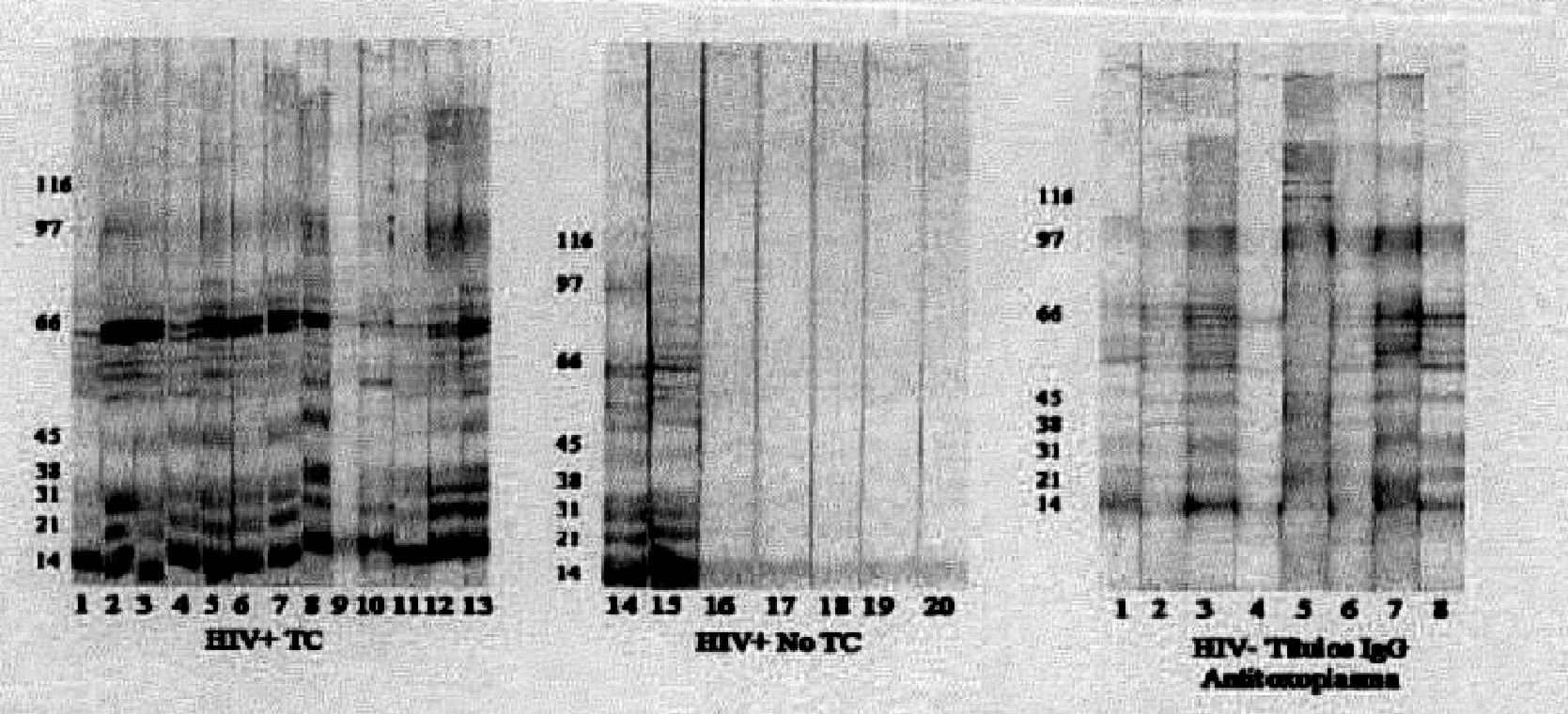
Fig 1. Imagen de los resultados de western-blot para los grupos de estudio 1 (VIH+ TC), 2I (VIH+ No TC) y 3 (VIH - Títulos IgG anti-Toxoplasma). Las proteínas de lisado total de Toxoplasma se corrieron en condiciones no reductoras y en un sistema discontinuo, como se describió en métodos. Luego de inmunotransferencia a membrana de nitrocelulosa se incubaron con los sueros de los pacientes en dilución 1:100. La reacción se reveló con BCIP-NBT. Los números señalan que las membranas fueron incubadas en presencia del suero del paciente correspondiente de acuerdo con la tabla.
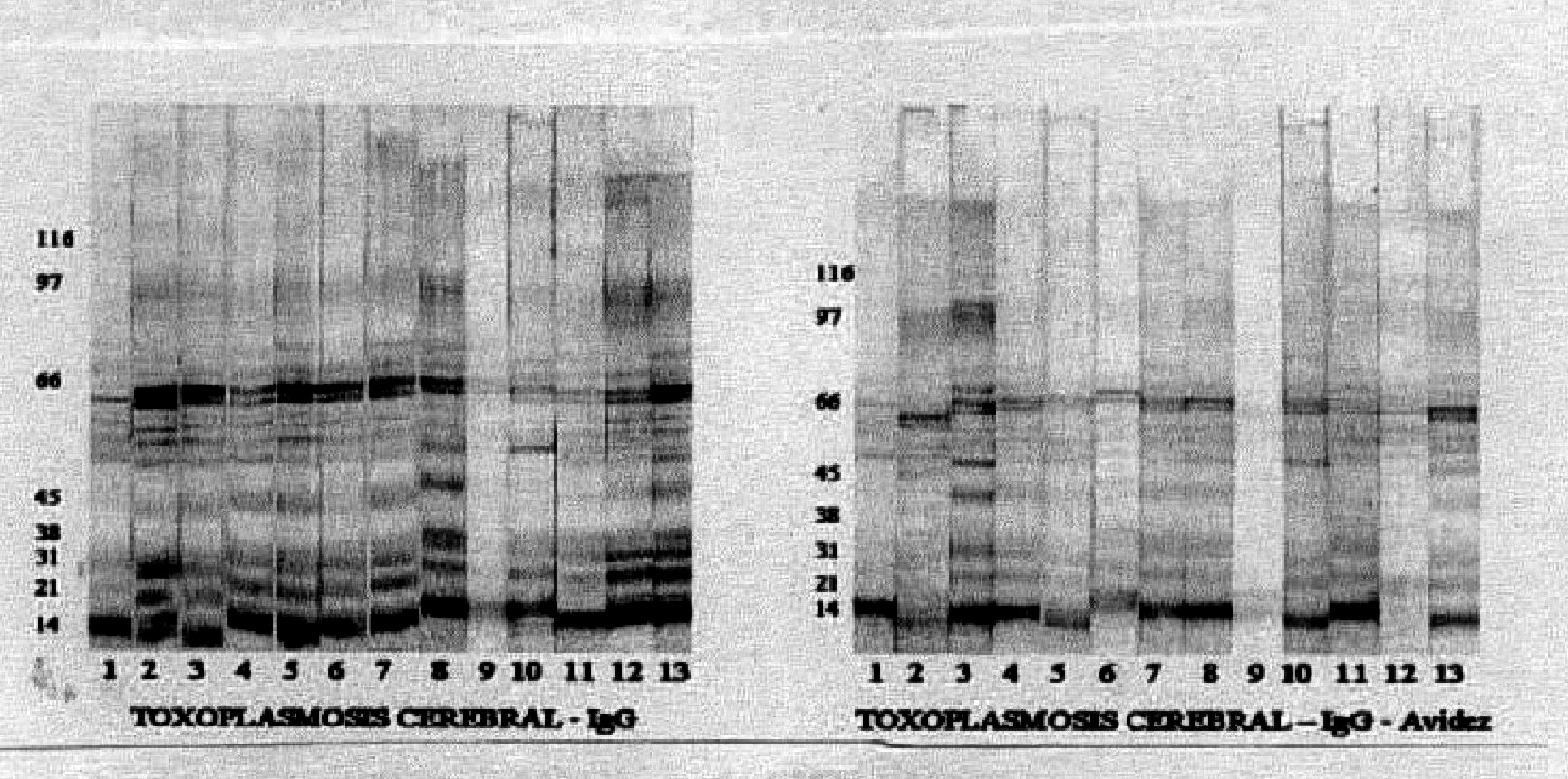
Fig. 2. Imagen de los resultados de western-blot para el grupo de estudio 1 lavados en ausencia o en presencia de urea 6M. Las proteínas de lisado total de toxoplasma se corrieron en condiciones no reductoras y en un sistema discontinuo, como se describió en métodos. Luego de inmunotransferencia a membrana de nitrocelulosa se incubaron con los sueros de los pacientes en dilución 1:100. La reacción se reveló con BCIP-NBT. Los números señalan que las membranas fueron incubadas en presencia del suero del paciente correspondiente de acuerdo con la tabla.
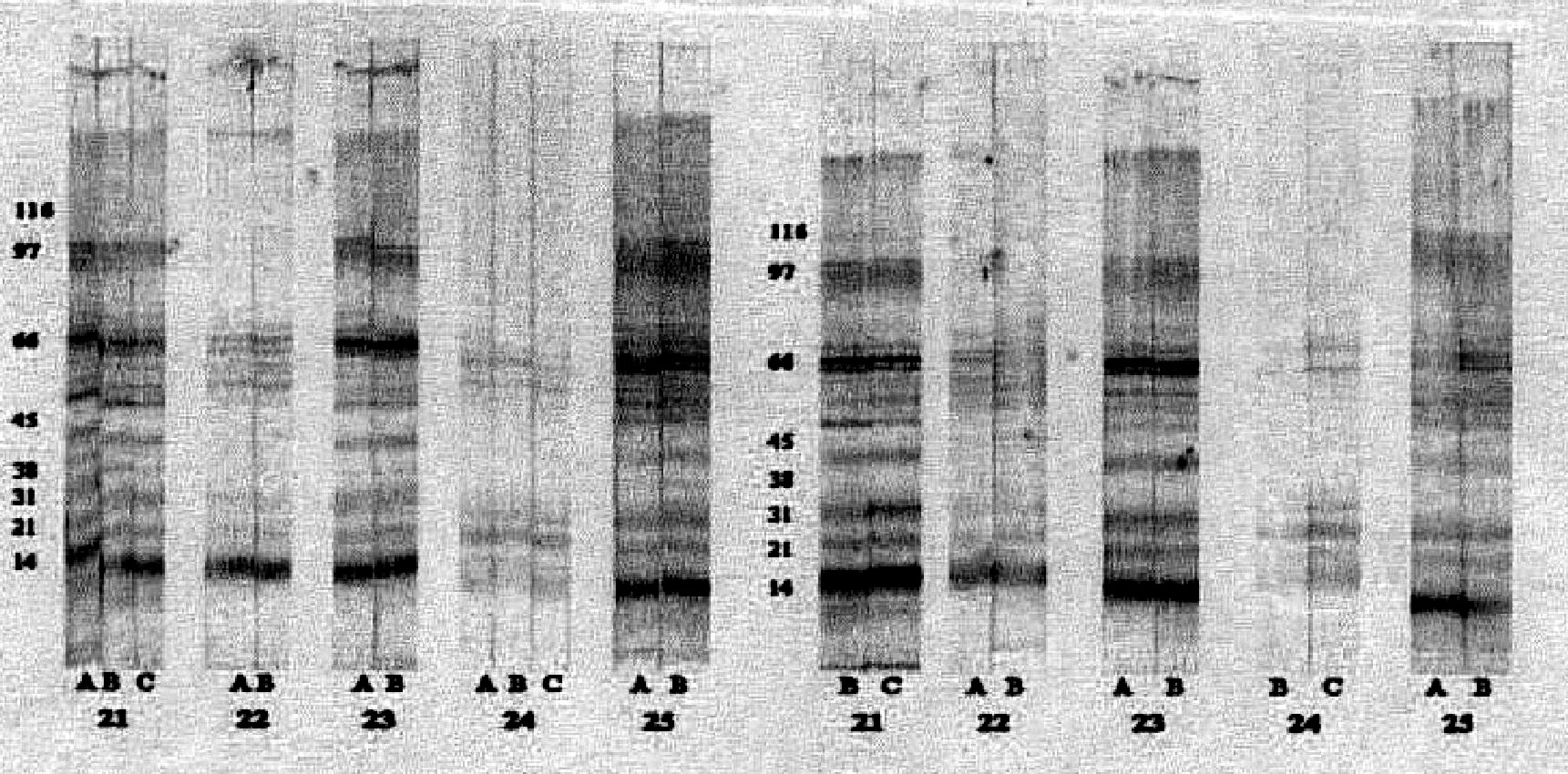
Fig. 3. Imagen de los resultados de western-blot para un grupo de pacientes VIH positivos que tuvieron seguimiento (pacientes 21 al 24 sin TC y paciente 25 que desarrolló TC 2 años después) lavados en ausencia (imágenes a la izquierda) o en presencia de urea 6M (imágenes a la derecha). Las proteínas de lisado total de Toxoplasma se corrieron en condiciones no reductoras y en un sistema discontinuo, como se describió en métodos. Luego de inmunotransferencia a membrana de nitrocelulosa se incubaron con los sueros de los pacientes en dilución 1:100. Los números señalan que las membranas fueron incubadas en presencia del suero correspondiente de acuerdo con la tabla.
Con la finalidad de obtener datos objetivos y semicuantitativos, estas membranas fueron analizadas por densitometría. Se comparó el porcentaje de pacientes de cada grupo que reconoce cada una de las proteínas (tabla). Los porcentajes de sueros con presencia de cualquiera de las bandas no son muy diferentes entre el grupo 1 y 3 que tienen títulos altos. Se realizó entonces un análisis de las diferencias en la intensidad de cada banda correspondiente a una proteína del lisado total de taquizoítos de Toxoplasma utilizado como antígeno en el western blot entre los grupos. De manera importante existen diferencias significativas en la intensidad de reconocimiento medido por densitometría para 2 proteínas: la de 66 y la de 31 kDa, sobre todo entre el grupo 1 y 3 que comparten títulos de IgG similares o aun mayores. Esta diferencias se ilustran en las figuras 4 y 5 que muestran los valores de absorbancia entre cada uno de los grupos.
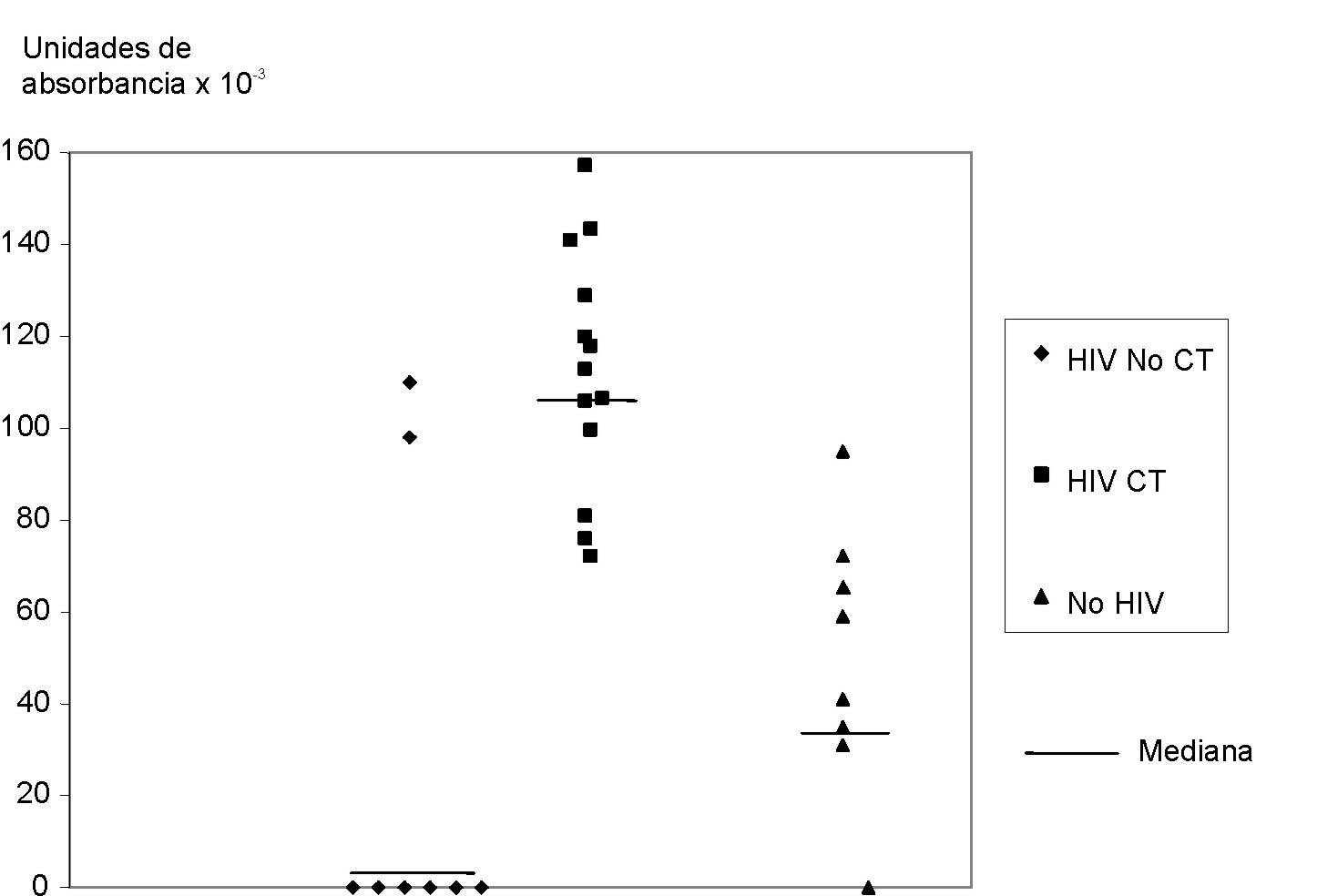
Fig. 4. Distribución de los valores de absorbancia (unidades de absorbancia o UA) para la proteína de 66 kDa luego de lectura por densitómetro (GS-700 imaging densitometer, Biorad USA) en las membranas mostradas en la figura 1. El peso molecular también fue calculado por el mismo densitómetro, de acuerdo con el control de peso molecular de cada membrana en la cual se realizó la electroforesis. Los valores de absorbancia son obtenidos luego de substracción del ruido de fondo. Cada punto señala el valor de absorbancia para la tira de membrana incubada con uno de los sueros correspondientes a los grupos 1 (VIH CT), 2 (VIH No CT) y 3 (No VIH). Se encuentran diferencias estadísticamente significativas en la intensidad entre grupo 1 (mediana 113 UA) y 2 (mediana 0 UA) con un nivel de p= 0,001 y el 3 (mediana 35) con una p= 0,003 por la prueba t de Student.
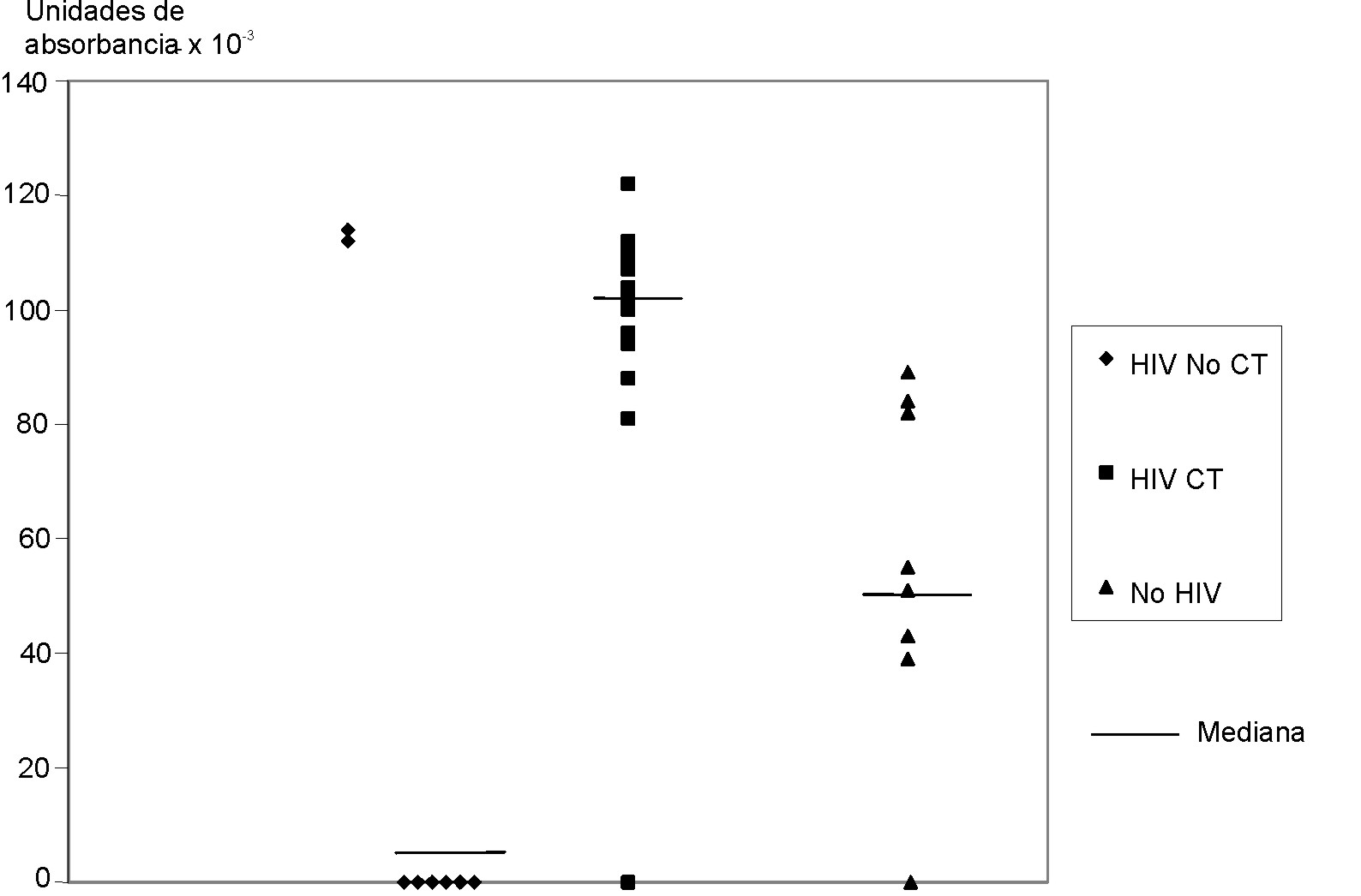
Fig. 5. Distribución de los valores de absorbancia para la proteína de 31 kDa luego de lectura por densitómetro (GS-700 imaging densitometer, Biorad USA) en las membranas mostradas en la figura 1. El peso molecular también fue calculado por el mismo densitómetro, de acuerdo con el control de peso molecular de cada membrana en la cual se realizó la electroforesis. Los valores de absorbancia son obtenidos luego de sustracción del ruido de fondo. Cada punto señala el valor de absorbancia para la tira de membrana incubada con uno de los sueros correspondientes a los grupos 1 (VIH CT), 2 (VIH No CT) y 3 (No VIH). Se encuentran diferencias estadísticamente significativas en la intensidad entre grupo 1 (mediana 102 UA) y 1 (mediana 0 UA) con un nivel de p= 0,009 y con el 3 (mediana 55) con una p= 0,013 por la prueba t de Student.
Tabla. Porcentaje de pacientes con presencia de la banda reconocida por la IgG específica anti-Toxoplasma por la técnica de western-blot en los grupos de estudio 1, 2, y 3.
| Proteína | % de pacientes con la proteína Grupo 1 | % de pacientes con la proteína Grupo 2 | % de pacientes con la proteína Grupo 3 |
| 21 | 100 | 42 | 100 |
| 31 | 92 | 28 | 87 |
| 38 | 46 | 14 | 87 |
| 45 | 61 | 28 | 87 |
| 58 | 92 | 29 | 75 |
| 66 | 100 | 29 | 87 |
| 97 | 46 | 14 | 75 |
Resultados del western-blot avidez: se consideró significativa la desaparición de la banda luego del tratamiento con urea. En el grupo 1 al observar los 2 resultados se encontró desaparición luego del tratamiento con urea de las bandas de 38, la de 45 y la de 97 kDa. La primera desaparece en 4 de 13 casos (46 % de pacientes la reconocen sin urea vs. 15 % luego de urea), la segunda en 2 de 13 casos (61 % de pacientes la reconocen sin urea vs. 46 % luego de urea) y la tercera en 4 de 13 casos (46 % de pacientes la reconocen sin urea vs. 15 % luego de urea).
En 5 casos en quienes hubo muestras adicionales de seguimiento y que eran VIH positivo se compararon los perfiles antigénicos antes y después de tratamiento con urea (fig. 3). En el caso 21 se tomaron muestras A, B y C con intervalos de 1 y 9 meses. Hay descenso de los títulos de 1:16000 a 1:2048 y sin embargo las bandas conservan la misma intensidad, el tratamiento con urea disminuye la intensidad de la banda de 38 kDa, las demás se conservan. El caso 22 tiene los mismos títulos de IgG en A y B pero al tratamiento con urea desaparecen las bandas 38 y 45 kDa. El intervalo de toma de muestra fue de 7 meses. En el caso 23 las muestras A y B tienen títulos serológicos 1:16 y 1:4096 y muestran perfiles con intensidades muy similares. Las muestras se tomaron con diferencia de 5 meses. En avidez la banda 38 kDa desaparece en ambas muestras. El resto del perfil se conserva. El caso 24 tiene muestras A, B y C antes de aplicar la urea y después solo B y C por insuficiencia de muestra y con intervalo de tiempo de 1 y 2 meses después de la primera muestra. Los títulos IgG son bajos: 1:64, 1:16 y 1:16. A la aplicación de la urea la intensidad de las bandas se conserva. La paciente no desarrolló TC. El caso 25 muestra títulos serológicos 1:2048 y 1:256, valores distanciados y perfiles antigénicos conservados. Al tratamiento con la urea el perfil no mostró cambios significativos. El paciente desarrolló TC 2 años después. Los intervalos de toma de muestra fueron de 9 meses.
Discusión
En este estudio se encontró una relación entre los títulos IgG anti-Toxoplasma por la técnica IFI y los perfiles antigénicos, pues a mayores niveles de IgG se reconoce un mayor número de bandas. Estos hallazgos muestran que el aumento de los niveles de anticuerpos en el caso de la infección toxoplásmica se realiza contra una variedad mayor de antígenos y no contra un antígeno en particular. Estos resultados son similares a los reportados previamente por Leport y otros.7
Una característica novedosa de este trabajo con respecto a los realizados previamente, es que se utilizó la técnica de densitometría, la cual permite, de una parte, estimar el peso molecular de las proteínas identificadas por los sueros y, de otra parte, realizar una cuantificación de la intensidad del marcaje de esas proteínas. Esta técnica permite eliminar el ruido de fondo evitando los problemas por la diferencia en tiempos de revelado de una membrana a otra. Una de las observaciones más importantes es que los valores de absorbancia en pacientes con toxoplasmosis cerebral para las proteínas de 31 y 66 kDa difieren de manera significativa con respecto a los sueros de paciente VIH negativos, aun con niveles de IgG mayores. Por tanto, este trabajo aporta evidencia de que esas proteínas pueden estar desempeñando un papel importante durante la estimulación antigénica humoral en el caso de la toxoplasmosis cerebral. Estas 2 proteínas de 31 y 66 kDa son del mayor interés para estudiar su papel durante la reactivación de una infección toxoplásmica. Estudios posteriores deberán establecer si la mayor antigenicidad que se observa se debe a una producción mayor durante una reactivación durante la fase aguda, como lo sugiere el hecho de ser de menor intensidad su reconocimiento durante la fase aguda de pacientes inmunocompetentes en estado de embarazo, característica principal del grupo 3 en este estudio. Otra posibilidad que se debería estudiar es si la respuesta inmune alterada en los pacientes VIH favorece la expresión o el reconocimiento particular de estas 2 proteínas.
En una segunda parte del estudio se aplicó la técnica de avidez utilizando urea 6 M después de la fijación de la IgG al antígeno sobre la membrana de nitrocelulosa. Al comparar los perfiles antigénicos encontrados en el grupo 1 antes y después de la aplicación de urea, se consideró como significativa la desaparición de la banda. Las proteínas de 38, 45 y 97 kDa desaparecieron con mayor frecuencia que las otras. Esto indica que son anticuerpos de baja avidez y puede significar su aparición reciente.9 Sin embargo, en los casos de seguimiento la banda 38 kDa desaparece en varios casos que no desarrollaron toxoplasmosis cerebral, por lo que su importancia como marcador de toxoplasmosis cerebral sería relativa. En un estudio reciente la avidez de IgG no sirvió para el diagnóstico de toxoplasmosis cerebral,11 por lo tanto, la baja avidez del anticuerpo contra estas proteínas puede ser una característica intrínseca de la respuesta inmune humoral durante la infección por VIH y confirma su poca utilidad para predecir una toxoplasmosis cerebral en los pacientes con VIH.
En conclusión, este trabajo permitió poner en evidencia que existen diferencias significativas en la intensidad de la respuesta humoral entre pacientes con VIH que sufren toxoplasmosis cerebral frente a pacientes sin toxoplasmosis cerebral y con niveles de anticuerpos específicos similares. Los resultados muestran que la proteína de 66 y 31 kDa son candidatos importantes para iniciar estudios encaminados a conocer en detalle los cambios en la inmunidad contra antígenos específicos en esta población. Su producción por tecnología recombinante y su utilización en estudios in vitro de inmunidad celular y humoral serían del mayor interés.
Agradecimientos
A la doctora Consuelo López del Instituto de Salud en el Trópico por la realización de las pruebas de inmunofluorescencia indirecta.
2. Katlama C. Diagnosis and treatment of toxoplasmosis of the CNS in patients with AIDS. CNS Drugs 1996;5:331-43.
3. Gómez Marín JE, Alvarado F, Hernández C, Cuervo S, Saravia J. Tratamiento de la fase aguda de la toxoplasmosis cerebral con Clindamicina- Falcidar (pirimetamina-sulfadoxina) en pacientes infectados por VIH. Infectio 2001;5:163-9.
4. Gómez Marín JE. Diagnóstico de la toxoplasmosis humana: nuevos conceptos y técnicas. Medicina & Laboratorio 2000;9:167-85.
5. Gómez Marín JE, Corredor CA, Murcia MI, López MC, Alvarado F, Anzola I, et al. Valor diagnóstico de la medición de IgG, IgM e IgA anti-Toxoplasma en pacientes infectados por VIH. Infectio 2000;4:4-10.
6. Pinon JM, Foudrinier F, Mougeot G, Marx C, Aubert D, Toupance O, et al. Evaluation of risk and diagnostic value of quantitative assays for anti-Toxoplasma gondii Immunoglobulin A (IgA), IgE and IgM and analytical study of specific IgG in immunodeficient patients. J Clin Microbiol 1995;33:878-84.
7. Leport C, Franck J, Chene G, Derouin F, Ecobichon JL, Pueyo S, et al. Immunoblot profile as predictor of toxoplasmic encephalitis in patients infected with human immunodeficiency virus. Clin Diagn Lab Immun 2001;8: 579-84.
11. Mechain B, Garin YJF, Robert-Gagneux F, Dupoy J, Derouin F. Lack of utility of specific immunoglobulin G antibody avidity for serodiagnosis of reactivated toxoplasmosis in immunocompromised patients. Clin Diagn Lab Microbiol 2000;7:703-5.
Recibido: 23 de junio de 2004. Aprobado: 24 de diciembre de 2004.
Dr. Jorge Enrique Gómez Marín. Facultad de Ciencias de la Salud, Universidad del Quindio, Armenia (Quindio), Colombia. Tel/Fax: +57-67-460168. Correo electrónico: gepamol2@uniquindio.edu.co
1 Magíster en Ciencias. Bacterióloga. Instituto de Salud en el Trópico. Facultad de Medicina- Universidad Nacional de Colombia, Bogotá, Colombia.
2 Doctor en Ciencias Básicas Médicas. Médico. Profesor Asociado. Centro de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad del Quindio, Armenia, Colombia.
3 Doctor en Ciencias Básicas Médicas. Médico. Profesor Asistente. Centro de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad del Quindio, Armenia, Colombia.
 All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License
All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License













