Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.58 n.2 Ciudad de la Habana Mayo-ago. 2006
Centro Nacional de Biopreparados
Caracterización de la peptona de soya para el cultivo de microorganismos
Ing. Raisa Zhurbenko,1 Dr. Claudio Rodríguez Martínez,2 Lic. Marilyn Díaz Pérez,3 Lic. Anabel Durán Vila,4 Ing. Orestes Darío López Hernández5 y Lic. Diana Rosa Viera Oramas6
Resumen
Se caracterizó una peptona de soya, obtenida con enzima papaína como agente hidrolizante. La evaluación físico-química de la base nutritiva obtenida a escala piloto e industrial mostró las características físico-químicas siguientes: pérdida por desecación 1,93 %, nitrógeno amínico 1,71 %, nitrógeno total 8,63 %, cloruros (como NaCl) 5,45 % y pH 6,94. Para la evaluación funcional de los lotes piloto e industriales (3 lotes), se incorporó la peptona de soya desarrollada y una tomada como referencia, procedente de la firma Biotécnica Internacional (México) a una mezcla de bases La evaluación mostró que no existieron diferencias significativas (p<0,05) en los valores de absorbancia a 640 nm obtenidos en la promoción del crecimiento entre el producto desarrollado y el de referencia para Staphylococcus aureus ATCC 25923. Para Streptococcus pyogenes ATCC 19615, se observó una ligera superioridad (diferencia significativa para p<0,05), a partir de la quinta hora de incubación a favor de los lotes industriales en comparación con la peptona de soya de referencia. Se comprobó, que la promoción del crecimiento en los medios agar y caldo triptona soya y agar extracto de malta, para los microorganismos evaluados resultó similar o superior (diferencias significativas para p<0,05) en los elaborados con la peptona de soya experimental, en comparación con los formulados con la base de referencia.
Palabras clave: Peptona de soya, medio de cultivo, incremento de absorbancia, recuento microbiano.
En la actualidad la obtención de los hidrolizados y extractos proteicos tiene gran importancia para la elaboración de medios de cultivo con vistas a su utilización en el diagnóstico clínico, veterinario y control de la calidad de aguas, alimentos y medio ambiente.1 Con estos fines se utilizan las proteínas convencionales y se buscan, a su vez, otras alternativas.
Desde hace muchos años el frijol de soya está considerado como una importante fuente de proteína de origen vegetal. Ello se debe al alto contenido de proteína de su grano (40-50 %). Contiene además vitaminas del grupo B, hierro, potasio, vitamina K y calcio. Se ha comprobado que la proteína de esta oleoleguminosa es superior a la de otras especies vegetales y por su contenido en aminoácidos esenciales es la que más se aproxima a la animal.2-5
Debido al incremento de la frecuencia de los brotes de encefalopatía espongiforme bovina y fiebre aftosa en diferentes países, el peligro de transmisión de estas enfermedades al hombre a través de las proteínas derivadas de los subproductos de los animales y las regulaciones para el comercio, importación y el uso de estos productos, el interés de la utilización de las fuentes de proteínas de origen no animal en la industria se ha convertido en una práctica común.6-9
De manera tradicional, para la obtención de hidrolizados a partir de la soya se utilizan, preferiblemente, los métodos bioquímicos de hidrólisis, empleando proteínas proteolíticas exógenas como la papaína.10-12
En general, la peptona de soya contiene un amplio rango de nutrientes como son proteínas, carbohidratos y vitaminas, por lo que constituye una excelente base nutritiva para el cultivo de los microorganismos fastidiosos.13 Por estas razones la peptona de soya continúa siendo un componente indispensable de muchos medios de cultivo para la detección y enumeración de los contaminantes microbianos en alimentos, crecimiento de importantes patógenos en el diagnóstico veterinario y clínico, así como en los medios para las fermentaciones en las industrias farmacéutica y biotecnológica.
Zhurbenko (Zhurbenko R. Metodología para el aprovechamiento de los subproductos de la industria alimenticia y otras proteínas en la evaluación de la calidad sanitaria de los alimentos. Tesis en opción al grado científico de Doctor en Ciencias de los Alimentos. IFAL. UH; 2004) desarrolló un método de obtención de la peptona de soya con la utilización de la papaína, determinando un conjunto de valores para los parámetros críticos de los procesos y operaciones, sobre todo referidos a la hidrólisis y la purificación. Específicamente fueron optimizados parámetros como el pH de hidrólisis, relación enzima:sustrato, hidromódulo, pH y temperatura de purificación, así como las operaciones de filtración y concentración del hidrolizado, que permitieron reducir la duración del proceso hidrolítico de 12-24 y hasta 48 h, como es común en otras industrias, hasta solo 3-4 h.
El objetivo del presente trabajo consistió en la evaluación de las características y capacidad de promoción del crecimiento microbiano de la base nutritiva, procedente de la soya, obtenida por este método a escala industrial.
Métodos
Preparación de la base nutritiva mixta. Se formuló la base nutritiva mixta (peptona especial) con el objetivo de evaluar la capacidad de promoción del crecimiento microbiano mediante el incremento de la absorbancia en el tiempo de los microorganismos: hidrolizado enzimático de caseína (BioCen) 43,5 %; hidrolizado enzimático de proteínas de tejido animal (BioCen) 42,2 % y peptona de soya (BioCen) 14,3 %, obtenida a escala piloto y escala industrial (lotes 101, 102 y 103). La base nutritiva mixta utilizada como producto de referencia incluyó en su composición, en las proporciones mencionadas, el hidrolizado enzimático de caseína (BioCen); hidrolizado enzimático de proteínas de tejido animal (BioCen) y peptona de soya de Biotécnica Internacional (México).
Preparación de medios de cultivo: la evaluación microbiológica de la peptona de soya del BioCen (lotes industriales 101, 102 y 103) se realizó en los medios de cultivo de diferentes propósitos.14 El agar triptona soya tuvo la composición siguiente: hidrolizado enzimático de caseína (15 g/L); peptona de soya (5 g/L); cloruro de sodio (5 g/L) y agar (15 g/L). El caldo triptona soya del BioCen contenía los ingredientes siguientes: hidrolizado enzimático de caseína (17 g/L); peptona de soya (3 g/L); dextrosa (2,5 g/L); fosfato básico de potasio (2,5 g/L) y cloruro de sodio (5 g/L). La composición del agar extracto de malta consistió en: extracto de malta (30 g/L); peptona de soya (3 g/L) y agar (15 g/L).
Materiales de referencia y cepas microbianas: en calidad de producto de referencia se empleó la peptona de soya (Biotécnica Internacional, México, lote 140913PS). Como formulaciones de referencia se utilizaron:14 agar triptona soya, caldo triptona soya y agar extracto de malta elaborados con la peptona de soya de la firma Biotécnica Internacional de México.
En el estudio de la promoción del crecimiento microbiano en los medios de cultivo fueron utilizadas las cepas microbianas recomendadas por aseguramiento de la calidad para los ensayos de los medios de cultivo: Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, Streptococcus faecalis ATCC 19433, Candida albicans ATCC 17111, Saccharomyces cerevisiae ATCC 9763 y Saccharomyces uvarum ATCC 9080. Las cepas fueron mantenidas en cuñas de agar cerebro corazón (BioCen) a 5 °C y activadas en caldo triptona soya por 24 h a 35 °C antes de su uso.
Procedimientos de ensayos: el análisis fisico-químico del producto obtenido a escala industrial (lotes 101, 102 y 103) comprendió la determinación del contenido de nitrógeno amínico (Nam) por el método de valoración potenciométrica en presencia de formaldehído;15 contenido de nitrógeno total (Nt) por el método de Kjeldahl, utilizando el sistema automático Kjeltec System de la firma TECATOR (Alemania);16 la pérdida por desecación (PD) por el método gravimétrico y el contenido de cloruros (Cl), en forma de cloruro de sodio, por el método de Volhard.15 Los valores de pH se determinaron a una solución del producto a 2 % (p/p) después de esterilizar en autoclave a 121 °C por 15 min por el método potenciométrico con un pH-metro (PHM 83 AUTOCAL, Radiometer, Dinamarca).14
Se estudió el incremento de la absorbancia en el tiempo de 2 microorganismos seleccionados: Staphylococcus aureus ATCC 25923, recomendado para el control de la calidad de diferentes medios de cultivo que emplean peptona de soya y Streptococcus pyogenes ATCC 19615, representante de la flora exigente de difícil cultivo, para lo cual se empleó una mezcla de bases nutritivas. Los valores obtenidos se compararon con las absorbancias de cultivos en una mezcla similar formulada con la peptona de soya de la firma Biotécnica Internacional (México).
Los inóculos se prepararon partiendo de los cultivos frescos de los microorganismos de referencia tomados en la superficie inclinada de agar triptona soya (BioCen).14 Las muestras de los microorganismos se traspasaron a los tubos de ensayo con la solución salina estéril 0,85 % (p/v) (NaCl, grado analítico; Merck, Alemania). Las suspensiones microbianas se homogeneizaron bien en el agitador de tubos. La concentración de células microbianas se ajustó adicionando solución salina estéril 50% de transmitancia a 580 nm (espectrofotómetro PU 8620, PHILIPS), correspondiendo aproximadamente a 3,0 x 108 células/mL. Posteriormente se prepararon diluciones decimales seriadas, las cuales se inocularon en los medios de cultivo en dependencia de la capacidad de promover el crecimiento microbiano. Los recuentos se expresaron en unidades formadoras de colonias (UFC) por mililitro.
Análisis estadístico: los ensayos se ejecutaron por triplicado y la diferencia entre las medias fue calculada empleando la prueba de rangos múltiples de Duncan (p< 0,05), utilizando para ello el programa STATISTICA 6.0 (Statsoft. Inc., 1996). La diferencia entre los valores obtenidos en todos los experimentos se calculó para p< 0,05.
Resultados
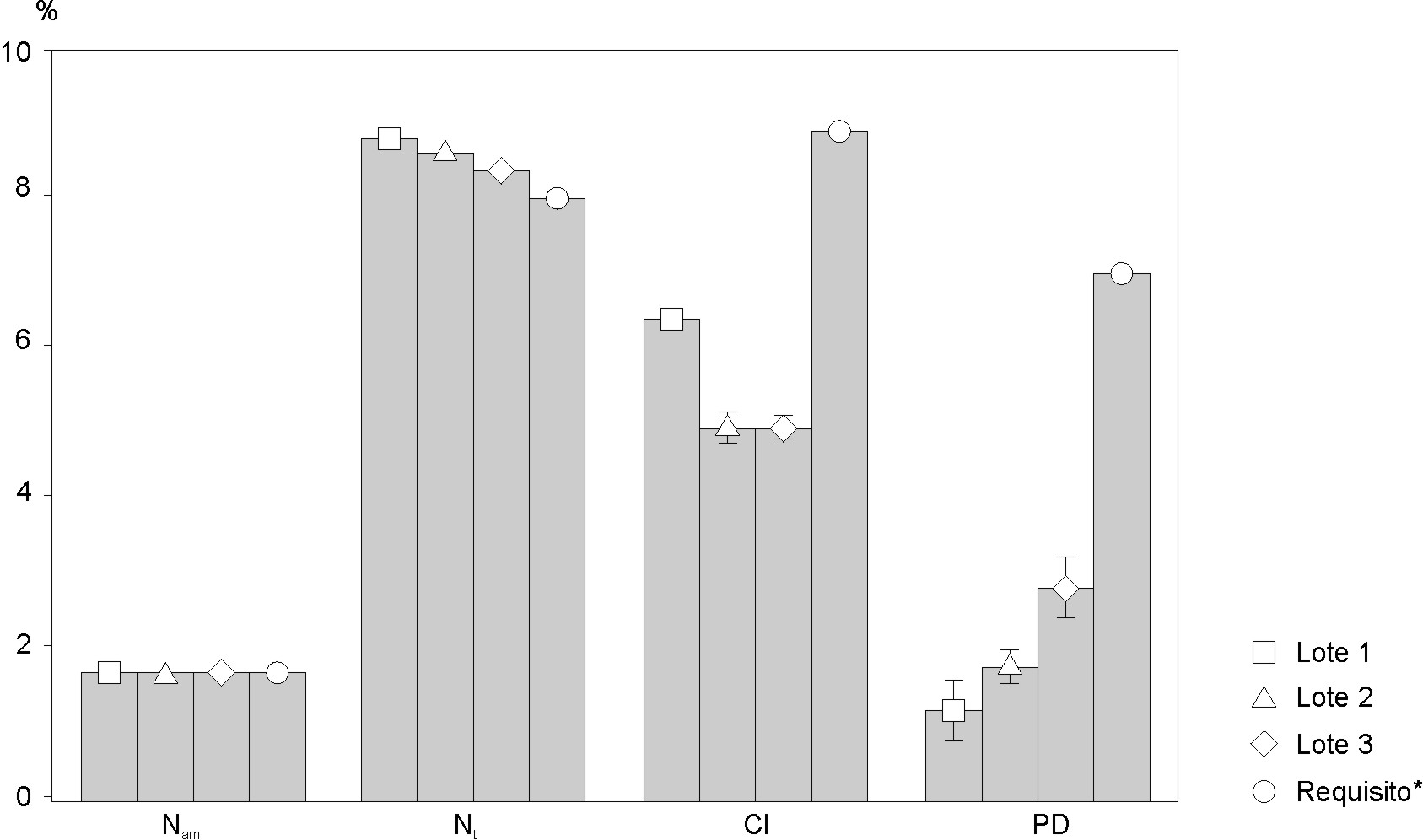
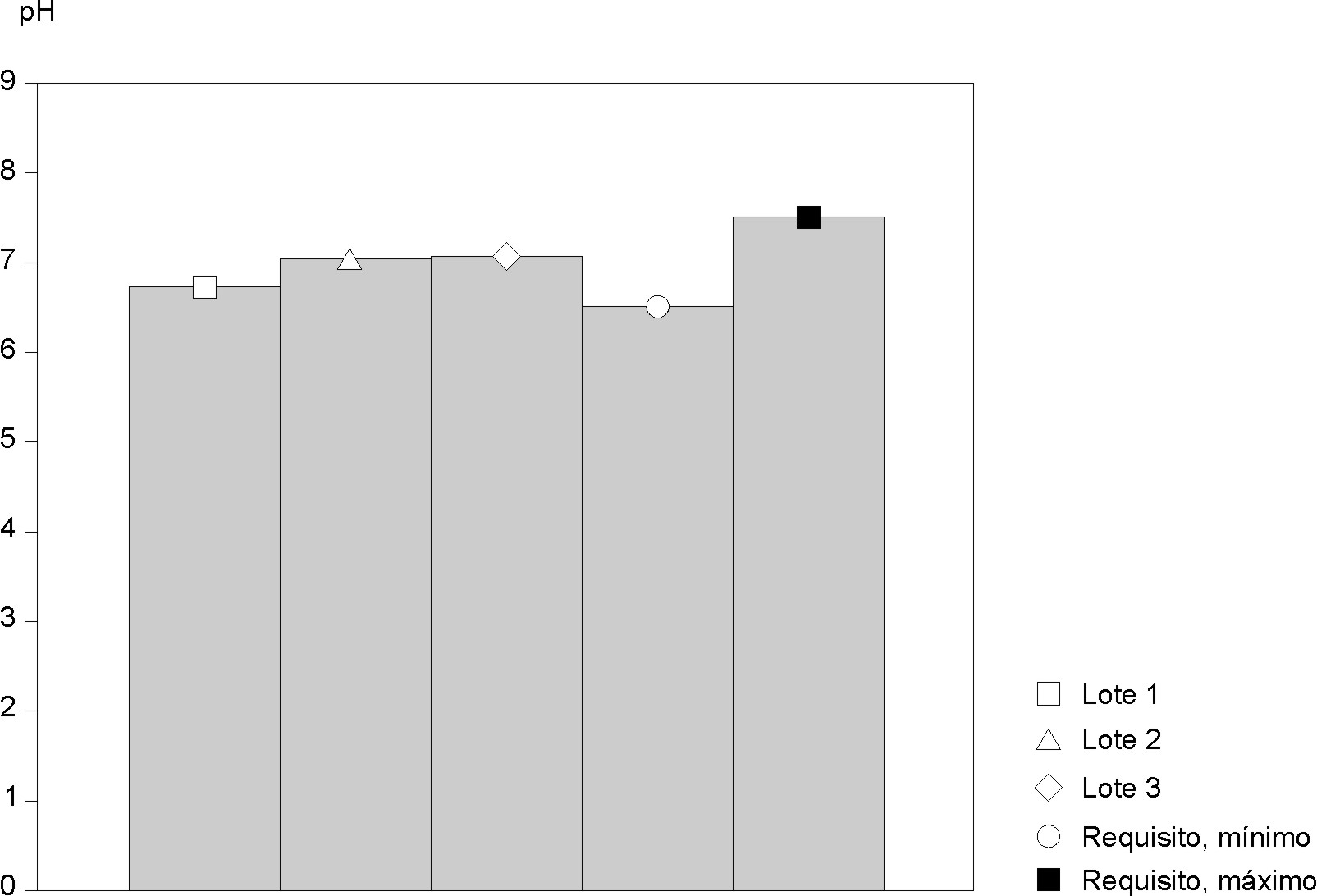
En las figuras 1 y 2 se muestran los resultados obtenidos en la evaluación físico-química de los 3 lotes de peptona de soya obtenidos a escala industrial en comparación con los requisitos de calidad establecidos desde la etapa de diseño del producto.
Valores medios; Whisker: Media ± DE para 95 % del nivel de confianza; Nam: contenido de nitrógeno amínico; Nt: contenido de nitrógeno total; Cl : contenido de cloruros, en forma de cloruro de sodio; PD: pérdida por desecación. *: requisito (valor mínimo) para el contenido de Nam y Nt; *: requisito (valor máximo) para el contenido de cloruros y pérdida por desecación
Fig. 1. Evaluación físico-química de peptona de soya experimental obtenida a escala industrial.
*: requisitos (valores mínimo y máximo) establecidos en la especificación del diseño
Fig. 2. Comportamiento de pH en los 3 lotes de peptona de soya experimental obtenida a escala industrial.
El contenido de nitrógeno amínico osciló entre 1,71 y 1,73 % (fig. 1).
Los valores de nitrógeno total obtenidos (fig.1) fluctuaron entre 8,34 y 8,85 %.
El contenido de cloruros, expresado como cloruro de sodio, osciló de 4,96 a 6,4 %, en los 3 lotes del producto estudiados (fig. 1). Se observó diferencia significativa para estos valores en los 3 lotes de peptona de soya estudiados en comparación con el requisito establecido ( 9 %).
En relación con otros índices estudiados del producto, se observó que la pérdida por desecación correspondió al intervalo de 1,2-2,8 % (fig. 1) y el pH se mantuvo entre los valores de 6,73 a 7,06 (fig. 2).
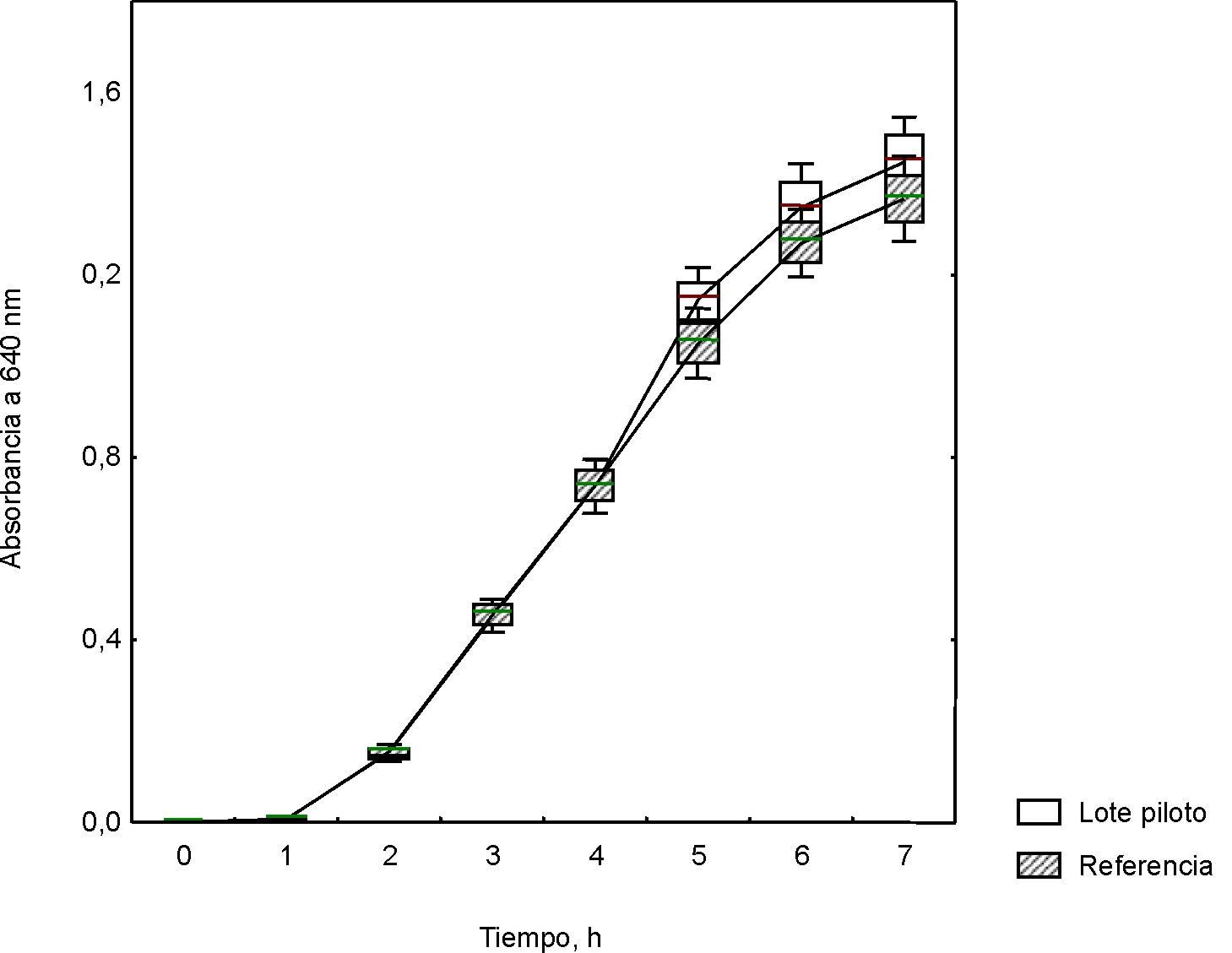
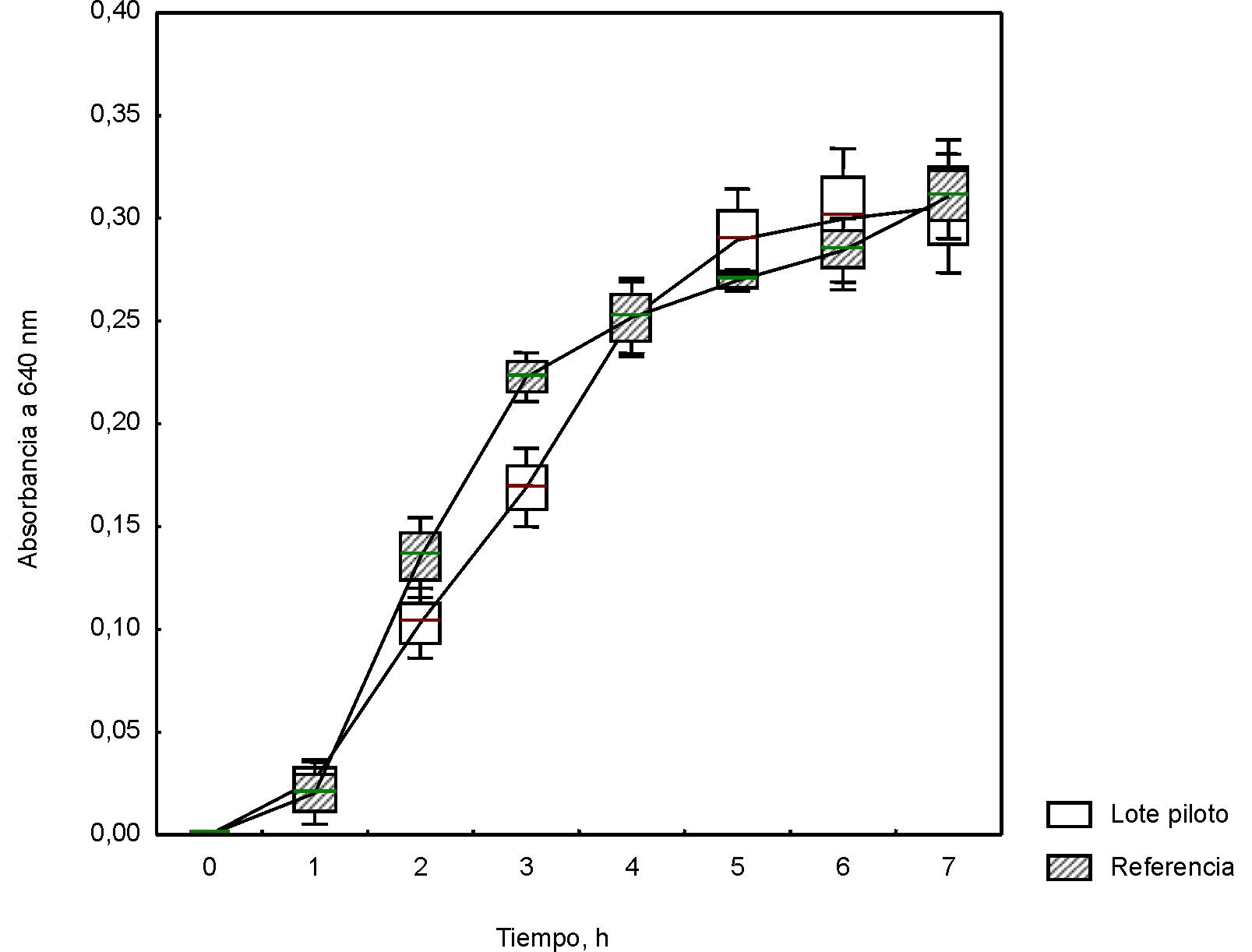
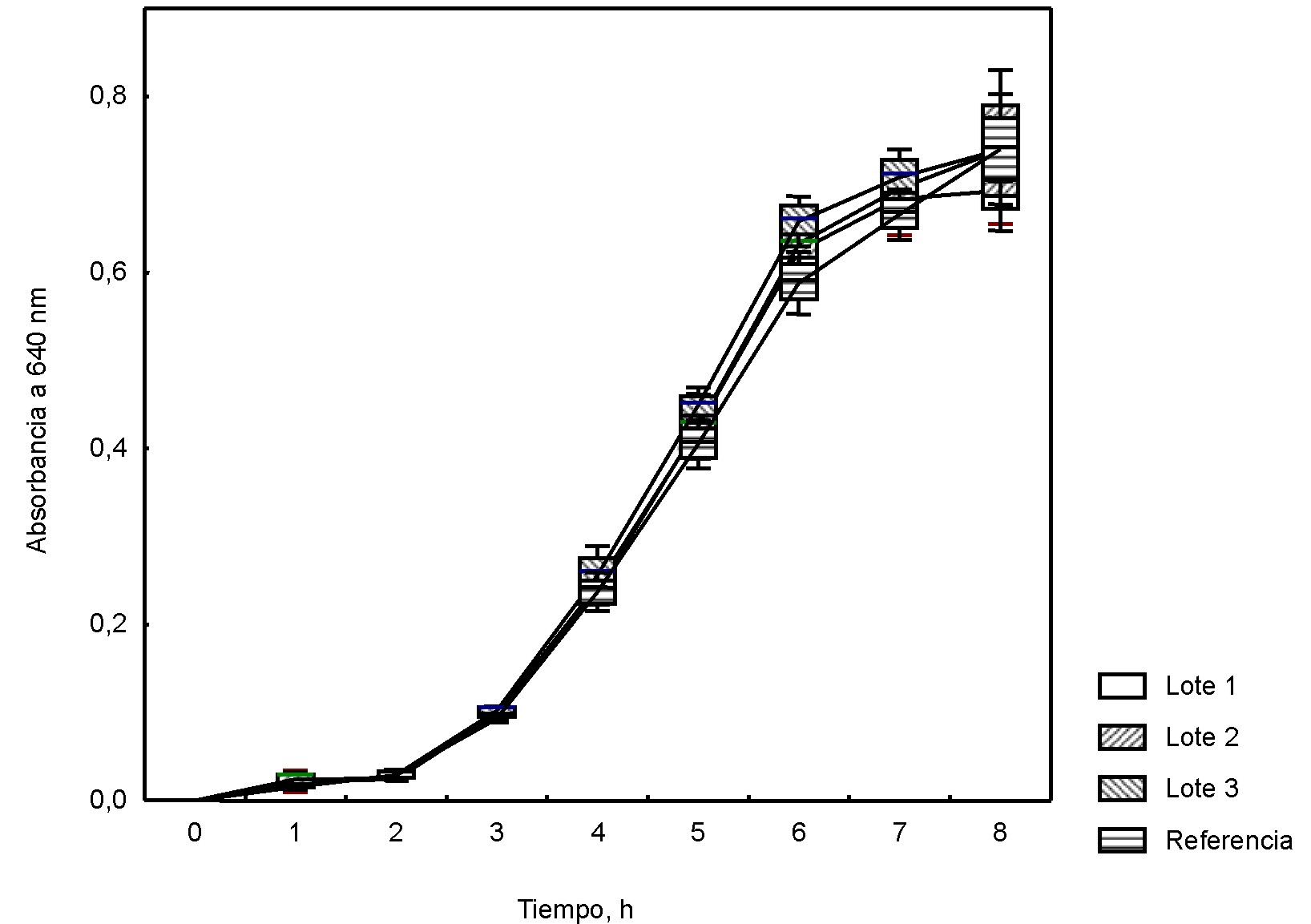
Los valores de la absorbancia a 640 nm en el tiempo para Staphylococcus aureus ATCC 25923 y Streptococcus pyogenes ATCC 19615 en el medio formulado con la mezcla de peptonas, incluida la peptona de soya BioCen (lote piloto) y peptona de soya Biotécnica Internacional (México) (Control), se muestran en las figuras 3 y 4. El análisis del crecimiento de ambos microorganismos expuso la ausencia de diferencias significativas entre el medio formulado con la base nutritiva experimental y la de referencia.
Valores medios; Whisker: Media ± DE para 95 % del nivel de confianza
Fig. 3. Curvas de crecimiento para Staphylococcus aureus ATCC 25923 en base mixta a escala piloto.
Valores medios; Whisker: Media ± DE para 95 % del nivel de confianza
Fig. 4. Curvas de crecimiento para Streptococcus pyogenes ATCC 19615 en base mixta a escala piloto.
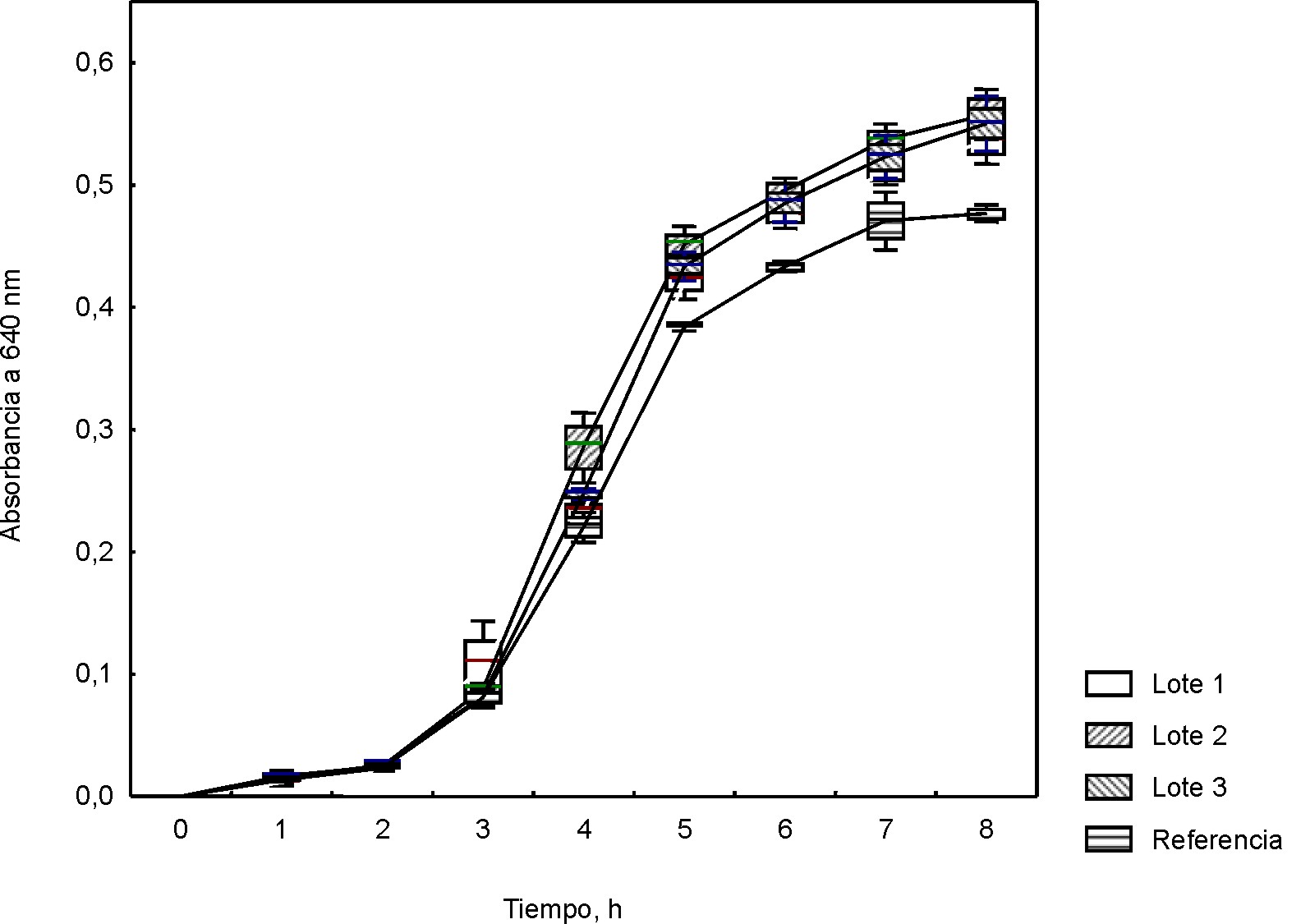
En las figuras 5 y 6 se presentan los resultados de la medición de la absorbancia de los cultivos de Staphylococcus aureus ATCC 25923 y Streptococcus pyogenes ATCC 19615, respectivamente, en la mezcla de bases nutritivas formulada con la peptona de soya obtenida a escala industrial (lotes 101, 102 y 103), utilizando como control la peptona de soya Biotécnica Internacional (México). En este experimento, no se detectó diferencia significativa en el crecimiento de ambos microorganismos cultivados en el medio formulado con lotes industriales de la peptona de soya experimental y el formulado con peptona de soya de referencia.
Valores medios; Whisker: Media ± DE para 95 % del nivel de confianza
Fig. 5. Curvas de crecimiento para Staphylococcus aureus ATCC 25923 en base mixta a escala industrial.
Valores medios; Whisker: Media ± DE para 95 % del nivel de confianza
Fig. 6. Curvas de crecimiento para Streptococcus pyogenes ATCC 19615 en base mixta a escala industrial.
En las tablas 1, 2 y 3 se pueden observar los resultados de la evaluación de la peptona de soya en los medios de cultivo: agar triptona soya, medio de propósito general para el cultivo de una gran variedad de microorganismos, empleado para los recuentos y las pruebas de límites microbianos, así como para el mantenimiento y la conservación de cultivos puros y el aislamiento de microorganismos de especímenes clínicos; caldo triptona soya, medio altamente nutritivo para el cultivo de una gran variedad de microorganismos exigentes y recomendado para los ensayos de esterilidad y para uso general de laboratorio y agar extracto de malta, medio para la detección, aislamiento y enumeración de levaduras y mohos.
Tabla 1. Evaluación de la peptona de soya en el agar triptona soya
| Microorganismo de ensayo | Crecimiento, UFC/mL* | |||
| Lote 101 | Lote 102 | Lote 103 | Producto de referencia | |
| Escherichia coli ATCC 25922 | 1,37 x 108 (1,03 x 108) | 3,00 x 108 (1,84 x 108) | 8,00 x 107 (1,40 x 107) | 9,25 x 107 (3,54x 106) |
| Staphylococcus aureus ATCC 25923 | 2,42 x 107 (2,47 x 106) a | 2,65 x 107 (5,66 x 106) a | 1,54 x 107 (5,66 x 106) ab | 1,18 x 107 (3,54 x 105) b |
| Streptococcus faecalis ATCC 19433 | 3,00 x 107 (9,90 x 106) | 2,83 x 107 (1,10 x 107) | 3,45 x 107 (9,90 x 106) | 2,15 x 107 (2,12 x 106) |
* Valores medios de 2 determinaciones. Cifras entre paréntesis indican el valor de la desviación estándar. Letras diferentes en la misma fila indican diferencias significativas entre los lotes industriales y medio control para p< 0,05. Filas sin letras indican la no existencia de diferencias significativas entre el lote industrial y medio control para p< 0,05. UFC: unidades formadoras de colonias.
Tabla 2. Evaluación de la peptona de soya en caldo triptona soya
| Microorganismo de ensayo | Crecimiento, UFC/mL | |
| Lotes industriales 101, 102 y 103 | Producto de referencia | |
| Escherichia coli ATCC 25922 | 10-6 | 10-6 |
| Staphylococcus aureus ATCC 25923 | 10-6 | 10-6 |
| Streptococcus faecalis ATCC 19433 | 10-5 | 10-5 |
Tabla 3. Evaluación de la peptona de soya en agar extracto de malta
| Microorganismo de ensayo | Crecimiento, UFC/mL* | |||
| Lote 101 | Lote 102 | Lote 103 | Producto de referencia | |
| Candida albicans ATCC 17111 | 3,83 x 106 (2,89 x 105) | 5,17 x 106 (1,76 x 106) | 3,67 x 106 (1,53 x 106) | 4,33 x 106 (1,89x 106) |
| Saccharomyces cerevisiae ATCC 9763 | 7,00 x 106 (1,32 x 106) | 8,00 x 106 (1,00 x 106) | 6,50 x 106 (8,66 x 105) | 8,00 x 106 (4,00 x 105) |
| Saccharomyces uvarum ATCC 9080 | 1,12 x 107 (2,89 x 105) | 1,35 x 107 (5,00 x 106) | 1,47 x 107 (2,25 x 106) | 1,37 x 107 (3,06 x 106) |
* Valores medios de 3 determinaciones. Cifras entre paréntesis indican el valor de la desviación estándar. Filas sin letras indican la no existencia de diferencias significativas entre los lotes industriales y medio control para p< 0,05. UFC: unidades formadoras de colonias.
En todos los medios se observó un crecimiento adecuado de las especies de microorganismos inoculados, tanto para los formulados con la base nutritiva experimental (lotes industriales 101, 102 y 103), como para aquellos que contenían la peptona de Biotécnica Internacional.
Discusión
Los valores de nitrógeno amínico obtenidos para los 3 lotes de la peptona de soya experimental evaluados, reflejan un adecuado grado de hidrólisis enzimática de las proteínas presentes en la harina de soya y coinciden con los reportados para los productos existentes en el mercado, pues estos se encuentran entre 1,5 y 5 % (BioMérieux. Bacteriología. France; 1984:15) (Manual of BBL Products and Laboratory Procedures. Becton Dickinson Microbiology Systems.
En relación con los valores de nitrógeno total obtenidos, se puede observar que estos se hallan en el rango recomendado por la USP 24 (The United States Pharmacopoeia XXIV. United States Pharmacopeial Convention, Rockville, Md., USA; 2000:2046) (igual o superior a 8,5 %) y se corresponden con la naturaleza proteica del sustrato, sometido a hidrólisis y purificación.
Tanto los valores de nitrógeno amínico, como de nitrógeno total, obtenidos para los 3 lotes de base nutritiva estudiados, superan los límites inferiores establecidos en Cuba para la peptona de soya (≥ 1,7 y 8 %, respectivamente), cumpliendo con la tendencia de la obtención de peptonas con el mayor valor de ambos indicadores.
Los hallazgos obtenidos en relación con el contenido de cloruros en la base experimental corresponden con lo estudiado por Barrow,1 quien reportó valores de este indicador entre 4 y 15 %, y se relacionan con el hecho de que durante el proceso de obtención de la base nutritiva no se emplean volúmenes significativos de HCl y NaOH que ocasionen una acumulación significativa de esta sal.
Por otra parte, los valores experimentales de cloruro de sodio obtenidos para los 3 lotes de peptona de soya estudiados corresponden a lo reportado por Biomerieux (BioMérieux. Bacteriología.
La existencia de diferencia significativa entre los cloruros de los lotes industriales ensayados y el requisito establecido en el país (≤ 9 %) resultó muy favorable, pues el cloruro de sodio en esas concentraciones no ejerce efecto inhibitorio sobre el crecimiento microbiano, lo que permite la utilización de la peptona de soya evaluada en el cultivo de diferentes especies de microorganismos.
Los valores de pérdida por desecación, significativamente inferiores al requisito establecido para este tipo de producto en Cuba (≤ 7 %), obtenidos para la peptona de soya, secada por aspersión a temperatura del aire cercana a 100 °C, se hallan por debajo del límite de 6 %, en general aceptado por los fabricantes de bases nutritivas (Organotechnie. Culture media constituentes. La Courneuve. France. Ed. 1; 1994).11 Para el clima tropical, el límite de este indicador se encuentra normalmente en valores iguales o inferiores a 8 %, según Mourey Valdés y otros,17 aunque muchos fabricantes (Organotechnie. Culture media constituentes. La Courneuve. France. Ed. 1; 1994)13 lo establecen como £ 5 % para la peptona de soya. Mayores niveles de humedad conllevan la pérdida de estabilidad y la disminución de la vida útil del producto. Se considera, por tanto, que los valores de pérdida por desecación obtenidos, impiden la aparición de interacciones químicas que deterioren el producto durante la conservación.
Los valores de pH que presentaron los diferentes lotes de peptona se enmarcan dentro del rango establecido para este tipo de productos y, a su vez, se corresponden con los valores de pH, a los cuales se realizan los pasos del proceso de purificación. El pH de las bases, además, resulta apropiado para garantizar la compatibilidad con otros componentes de los medios de cultivo.
La ausencia de diferencias significativas en el crecimiento, tanto para Staphylococcus aureus ATCC 25923, como para Streptococcus pyogenes ATCC 19615, entre la mezcla de bases nutritivas, que incluye la peptona de soya BioCen, y la mezcla con la peptona de Biotécnica, evidencia que el proceso de obtención garantizó un contenido adecuado de todos los nutrientes, especialmente los de origen proteico y los carbohidratos.
Se puede observar que la no existencia de diferencia significativa en el crecimiento de Staphylococcus aureus ATCC 25923 (p< 0,05) obtenido en las mezclas de peptonas preparadas con cada uno de los 3 lotes industriales del producto desarrollado y peptona de soya de Biotécnica Internacional (México), corroboran que el proceso de producción a escala industrial reproduce adecuadamente los resultados experimentales a menor escala y que los parámetros del proceso industrial fueron seleccionados de manera adecuada.
Los valores de absorbancia a 640 nm obtenidos en la evaluación del crecimiento de Streptococcus pyogenes ATCC 19615 evidencian que no existe diferencia significativa en el crecimiento (p< 0,05) de este microorganismo para los 3 lotes industriales de la peptona de soya, no así para la mezcla de peptonas con la peptona de referencia (Biotécnica Internacional, México), donde, a partir de la quinta hora se observa diferencia significativa en comparación con los lotes industriales BioCen. Estos hallazgos pueden estar atribuidos a que, al presentar la peptona de soya experimental menor grado de hidrólisis y, como consecuencia, mayor contenido de péptidos de un peso molecular superior, estos pueden ejercer un efecto protector sobre el cultivo de microorganismos exigentes, cuando se acumula una determinada cantidad de células en el medio. Este efecto protector puede deberse a una mayor osmolaridad del medio, según reporta Bridson.13
La no existencia de diferencia significativa (p< 0,05) entre los recuentos para E. coli ATCC 25922 y Streptococcus faecalis ATCC 19433 en el agar triptona soya experimental formulado con la peptona de soya obtenida en los 3 lotes industriales y el formulado con la base nutritiva tomada como control, pone de manifiesto, una vez más, el adecuado contenido de nutrientes en la base experimental. Los recuentos para Staphylococcus aureus ATCC 25923 resultaron estadísticamente similares para los 3 lotes experimentales de la base obtenida a escala industrial (p< 0,05) y de manera significativa superiores (p< 0,05) en los lotes experimentales 101 y 102 en comparación con el producto de referencia. Sin embargo, desde el punto de vista biológico, estas diferencias no deben ser consideradas como significativas por 2 razones fundamentales: la incertidumbre de la técnica de los recuentos de unidades formadoras de colonias y la variabilidad biológica en el comportamiento de los diferentes microorganismos.
Los resultados de la evaluación del crecimiento en el caldo triptona soya evidencian similitud en las características favorecedoras del crecimiento microbiano en el caldo formulado con la peptona de soya experimental y de Biotécnica Internacional (México), demostrando la alta sensibilidad para los microorganismos de ensayo, pues se logró promover el aumento de la biomasa a partir de inóculos altamente diluidos (10-5, 10-6).
Para todas las formulaciones (experimentales y control) no se observó diferencia significativa (p< 0,05) para los 3 microorganismos estudiados: Candida albicans ATCC 17111, Saccharomyces cerevisiae ATCC 9763 y Saccharomyces uvarum ATCC 9080.
En sentido general, se puede afirmar que los lotes industriales de peptona de soya garantizan un contenido adecuado de componentes nitrogenados y de otros factores de crecimiento para el cultivo de especies exigentes de bacterias y resultan apropiados para su empleo en calidad de base nutritiva en medios de cultivo de diferentes propósitos.
Agradecimientos
A A. K. Collado Coello y N. L. García Álvarez por la realización de algunas corridas experimentales con el lote piloto del producto.
Characterization of soy peptone for the culture of microorganisms
Summary
A soy peptone obtained with enzyme papain as a hydrolyzing agent was characterized. The physicochemical evaluation of the nutritive base attained at pilot and industrial scale showed the following characteristics: loss due to desiccation, 1.93 %; aminic nitrogen, 1.71 %; total nitrogen, 8.63 %; chlorides (as NaCl), 5.45 %; and pH, 6.94. For the functional evaluation of the pilot and industrial batches (3), developed soy peptone and another one taken as a reference from the Biotécnica Internacional firm (México), was incorporated to a mixture of bases. There were no significant differences (p <0.05) in the absorbance values at 640 nm obtained in the promotion of the growth between the developed product and that of reference for Staphylococcus aureus ATCC 25923. For Streptococcus pyogenes ATCC 19615, it was observed a mild superiority (significant difference for p < 0.05) starting from the 5th hour of incubation in favor of the industrial batches compared with the reference soy peptone. It was proved that the promotion of the growth in the soy triptone agar and broth media and in malt extract agar for the evaluated microorganisms was similar or higher (significant differences for p < 0.05) in those prepared with the experimental soy peptone, in comparison with the formulated with the reference base.
Key words: Soy peptone, culture media, absorbance increment, microbial count.
2. Nielsen PM, Eriksen S, Hansen OR, Kristensen SE, Hwass P, inventors; Novo Nordisk A/S, assignee. Method for production of a vegetable protein hydrolyzate with proteases. US patent 5,716,801. 1998 feb 10.
3. Ernster JH, inventor; Excelpro Inc, assignee. Hydrolysed soy protein and process for preparing soy protein. US patent 5,077,062. 1991 dec 31.