Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.58 n.2 Ciudad de la Habana Mayo-ago. 2006
Comunicación breve
Instituto de Medicina Tropical "Pedro Kourí"
Reconocimiento de células intactas de Cryptococcus neoformans por el AcM 4B3 antiglucuronoxilomanano
Dr. René Gato Armas,1 Dr. Gerardo Martínez Machín,2 Lic. Hermis Rodríguez Sánchez,3 Lic. Anselmo Otero González,4 Lic. Jorge Sarracent Pérez5 y Dra. María T. Illnait Zaragozí6
Resumen
Se estudió la capacidad del anticuerpo monoclonal 4B3, obtenido mediante inmunización de ratones BALB/c con el polisacárido capsular de Cryptococcus neoformans, para reconocer a dicha estructura como parte de la célula intacta de esta levadura. Con este propósito el anticuerpo 4B3 fue evaluado mediante ELISA celular e inmunofluorescencia indirecta empleando como antígeno una suspensión de células de la cepa 028 LMIPK de Cryptococcus neoformans. Se usó como control positivo suero del ratón empleado en la fusión para la obtención del anticuerpo monoclonal 4B3 y como control negativo un anticuerpo monoclonal anti-dengue. Ambos métodos demostraron que este anticuerpo monoclonal es capaz de reconocer al antígeno nativo, lo que permitirá su posterior evaluación con fines diagnósticos y terapéuticos.
Palabras clave: Cryptococcus neoformans, glucuronoxilomanano, ELISA celular, inmunofluorescencia, anticuerpo monoclonal.
Los anticuerpos monoclonales (AcM) se han convertido en el reactivo idóneo para el diagnóstico de gran número de enfermedades infecciosas, la purificación y caracterización de moléculas diversas, la detección sérica de hormonas, drogas y tóxicos, el tratamiento de infecciones y tumores malignos, así como la tipificación de antígenos en tejidos entre otras aplicaciones, revolucionándose el estudio de la inmunología, la biología celular y la biomedicina.1,2
El AcM 4B3 de clase IgG1 fue previamente obtenido mediante la inyección de ratones BALB/c con el polisacárido glucuronoxilomanao (GXM) de C. neoformans acoplado a eritrocitos de carnero.3
El GXM utilizado en la inmunización de los ratones había sido purificado por precipitación alcohólica a partir de un cultivo de la cepa 030 LMIPK.4 Se conoce que durante los procesos de purificación pueden ocurrir cambios conformacionales en la molécula; caso en el cual es posible que los anticuerpos elaborados contra el mismo, no reconozcan al antígeno nativo.5 Esto hizo necesario, antes de emprender otros estudios, determinar la capacidad del 4B3 para reconocer el antígeno en su forma natural, es decir, como componente de la cápsula del microorganismo.
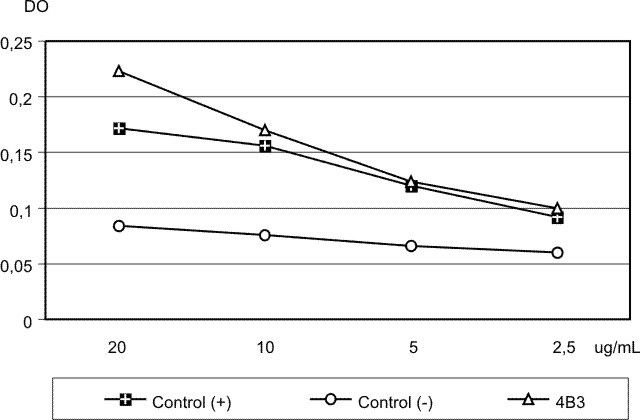
Para esto se diseñó un ELISA celular siguiendo la metodología recomendada por Ternynck y Avrameas.6 Se preparó una suspensión de 1 x 106 células/mL de C. neoformans de la cepa 028 LMIPK para fijar las placas de poliestireno de 96 pozos (Costar). Las muestras fueron constituidas por diluciones del 4B3 (1,25; 2,5; 5, 10 y 20 mg/mL), un control negativo (diluciones seriadas dobles del suero de un ratón sano desde 1/50 hasta 1/800) y un control positivo (suero del ratón utilizado para la fusión en la obtención del AcM a las mismas diluciones que el control negativo). Como valor de corte fue establecido el doble del valor de densidad óptica (DO) del suero control negativo en cada dilución.
Se consideraron positivas las concentraciones de 20, 10 y 5 mg/mL del 4B3 (fig. 1). No obstante puede apreciarse que los valores de DO en todos los casos resultaron bajos, lo cual pudo ser ocasionado por la poca sensibilidad de este tipo de ensayo, que tiene entre otras desventajas, valores de fondo elevados y la posibilidad de que las células no se fijen de forma uniforme en los diferentes pocillos.6
Fig. 1. Evaluación de la capacidad del AcM 4B3 para reconocer células de C. neoformans mediante ELISA celular.
Estos resultados fueron corroborados mediante inmunofluorescencia indirecta,7 empleando la misma suspensión antigénica utilizada en el ELISA celular. Se aplicaron diluciones seriadas dobles desde 1/50 hasta 1/400 de las muestras; un control positivo (suero del ratón utilizado para la fusión en la obtención del 4B3) y un control negativo (AcM anti-dengue). Se consideró positiva la observación de fluorescencia de color verde delimitando las levaduras (fig. 2). La fluorescencia homogénea sobre la cápsula de la levadura le confiere un aspecto anular, que coincide con los trabajos de Mukherjee y otros que describieron varios patrones de fluorescencia al utilizar diferentes clases de AcMs.8
Fig. 2. Determinación de la capacidad del AcM 4B3 para reconocer el antígeno polisacarídico como parte de la estructura íntegra de la cápsula de C. neoformans mediante inmunofluorescencia directa.
Los resultados de este trabajo permiten corroborar que el AcM 4B3 obtenido a partir del polisacárido capsular de C. neoformans es capaz de reconocer a este antígeno como parte de la célula intacta de esta levadura, lo cual da paso a su empleo en posteriores estudios para su posible utilización en sistemas de diagnóstico rápido o como agente terapéutico, o ambos.
Recognition of intact cells from Cryptococcus neoformans by the anti-glucuronoxylomannan 4B3 monoclonal antibody
Summary
The capacity of the 4B3 monoclonal antibody, previously obtained by immunization of BALB/c mice with the capsular polysaccharide of Cryptococcus neoformans was studied to recognize this structure as part of the intact cell of this yeast. With this aim, 4B3 was evaluated by cellular ELISA and indirect immunofluorescence, using as an antigen a cell suspension of the 028 LMIPK C. neoformans strain. Serum from the mouse used in the fusion for obtaining 4B3 monoclonal antibody was used as a positive control, whereas an anti-dengue monoclonal antibody was used as a negative control. Both methods demonstrated that the above mentioned monoclonal antibody is capable of recognizing the native antigen, which will allow its future evaluation for diagnostic and therapeutic purposes.
Key words: Cryptococcus neoformans, glucuronoxylomannan, cellular ELISA, immunofluorescence, monoclonal antibody.
Referencias bibliográficas
1. Gavilondo JV. Anticuerpos monoclonales. La Habana:Elfos Scientiae; 1995.
2. Stites DP, Terr AI, Parslow TG. Inmunología básica y clínica. 9a ed. México (DF): El Manual Moderno; 1999.