Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.59 n.1 Ciudad de la Habana ene.-abr. 2007
Artículos originales
Facultad de Medicina. UNAM, Hospital General de México
Diagnóstico de leptospirosis crónica, comparación entre la aglutinación microscópica y 3 técnicas diagnósticas confirmatorias
Dr Oscar Velasco-Castrejón,1 Dra. Beatriz Rivas Sánchez,2 Lic. Jacqueline Espinoza Hernández3 y Lic. Enrique Martínez Hernández4
Resumen
Se valoró que a pesar de ser la serología y particularmente la técnica de aglutinación microscópica, los métodos más recomendados para realizar el diagnóstico de leptospirosis, con frecuencia fracasa en el diagnóstico de casos individuales y brotes, en los cuales este termina realizándose postmortem, mediante impregnación argéntica e inmunohistoquímica, además de ser incapaz de diagnosticar leptospirosis crónica, porque en esta, los títulos de anticuerpos son muy bajos (≤1:80). Por ello y por la necesidad de un diagnóstico de laboratorio veraz y oportuno, se realizó un estudio comparativo de la videograbación en campo oscuro, apuntalada por la impregnación argéntica y la inmunohistoquímica en sangre y orina, contra la serología por la técnica de aglutinación microscópica, en 60 pacientes con leptospirosis crónica. La videograbación en campo oscuro, la impregnación argéntica y la inmunohistoquímica resultaron mucho más sensibles que la técnica de aglutinación microscópica, además de ser comparables entre sí, por lo que la videograbación es recomendable para realizar un diagnóstico rápido, temprano y económico, en particular si se asocia a la inmunohistoquímica o la impregnación argéntica. Asimismo, al cultivar estas muestras se obtuvieron 2 cepas de 82 % de primocultivos positivos, y se obtuvo una microfotografía electrónica en la sangre periférica de uno de los casos estudiados, lo que asegura el estudio y avala la existencia de la leptospirosis crónica.
Palabras clave: Leptospirosis, leptospirosis crónica, diagnóstico, campo oscuro, inmunohistoquímica, Fontana, Warthin Starry.
La leptospirosis es la zoonosis más importante en el mundo, tanto por las graves pérdidas económicas que registran los criadores de animales como por su creciente impacto en la salud pública mundial. Recientemente, Hartskeerl calculó que la leptospirosis tiene mayor importancia en la salud pública que el dengue y la hantavirosis, considerados 2 grandes problemas sanitarios globales.1
A pesar de ello, en la medicina humana, la leptospirosis continúa siendo una enfermedad muy subnotificada por causa de la ignorancia médica sobre su existencia, su magnitud y trascendencia. Aunque siempre se ha considerado a la leptospirosis humana una enfermedad aguda y esporádica, la leptospirosis crónica es ampliamente aceptada en medicina veterinaria y se afirma que produce pérdidas mucho mayores en los animales de granja que la aguda. En esta fase, los animales infectados presentan bajos títulos de anticuerpos, lo que la vuelve difícil de diagnosticar por los métodos serológicos convencionales.2,3
En el hombre, a pesar de que muchos autores reconocen esta fase cuando afirman que los pacientes recuperados de la fase aguda, suelen presentar con frecuencia secuelas de la enfermedad como cefalea, artralgias, mialgias, síndrome obsesivo-compulsivo, etc., y le llaman leptospirosis persistente,4 otros reconocen que se puede detectar al agente etiológico en orina hasta después de un año, que estos pacientes presentan reinfecciones endógenas después de meses de convalescencia y continúan sufriendo sus secuelas durante años;5 e incluso, algunos afirman abiertamente haber identificado varios episodios de la leptospirosis en el transcurso, pero no se atreven a calificarla como crónica. Todo esto constituye algunas formas de sugerir y al mismo tiempo eludir la aceptación de cronicidad de esta enfermedad. Por último, otros creen que hasta la fecha, esta fase simplemente no ha sido bien validada.1,6
En la experiencia de los autores de este trabajo, después de seguir la evolución de decenas de enfermos que padecieron la fase aguda, se observó que con frecuencia sufrían recaídas, semanas, meses o años más tarde (leptospirosis crónica), presentaban el mismo o diferente cuadro clínico (al inicial), por lo que a pesar de presentar títulos bajos de anticuerpos (≤1:100), la leptospira persistía en sangre y se excretaba en orina durante meses o años, e incluso en 80 % de los casos, se pueden obtener primocultivos positivos (que evolucionan durante meses y solo unos cuantos se convierten en cepas), además de responder al tratamiento específico y en su caso, en la autopsia se observan abundantes leptospiras en diversos órganos.7-9
En la literatura se encuentran frecuentes citas de fracasos en el diagnóstico por serología, tanto en casos aislados como en brotes epidémicos, donde con frecuencia el diagnóstico se ha tenido que realizar en la autopsia, por impregnación argéntica, inmunohistoquímica e incluso por cultivo.9-12 Por ello, la serología no es el método más adecuado para el diagnóstico temprano de la enfermedad, en particular cuando se hace por muestras pareadas, porque en la espera, el paciente grave fallece frecuentemente.8,13,14 Tampoco funciona para el diagnóstico de la fase crónica, por lo que es importante desarrollar métodos de detección de la bacteria o sus antígenos, o ambos, que sean sensibles, rápidos y específicos y permitan un diagnóstico confiable para dar al paciente una atención oportuna y adecuada.8,13,14
Métodos
Se estudiaron 60 pacientes, 33 mujeres y 27 hombres, de 2 a 70 años de edad, con datos epidemiológicos y clínicos sugestivos de padecer leptospirosis. Todos multitratados sin éxito en diferentes instituciones, por diversos diagnósticos. A cada paciente después de realizarle la historia clínica, se le diagnosticó clínicamente de leptospirosis crónica.
A cada uno se les tomó una muestra de sangre y de orina; la sangre se depositó en 2 tubos, uno sin anticoagulante para la obtención de suero y posterior titulación de anticuerpos por técnica de aglutinación microscópica (MAT), comenzando desde 1:20 y el segundo con EDTA, como anticoagulante, para realizar las otras técnicas.
Ambas muestras, orina y sangre, se observaron al microscopio de campo oscuro conectado a una cámara, un monitor de alta resolución y una videograbadora (VECOVISION)15 para la detección de leptospiras. La observación microscópica se realizó a 400x y con incremento de la potencia de la fuente de iluminación. Por otro lado, se realizaron extensiones de orina y sangre, se dejaron secar a temperatura ambiente, se fijaron con formaldehído durante 10 min. Al término de la fijación se enjuagaron con agua destilada, se secaron y se guardaron en refrigeración o a temperatura ambiente para la búsqueda de antígenos por inmunohistoquímica e impregnación argéntica (IA).
Inmunohistoquímica (IHQ)16: se utilizó un anticuerpo policlonal preparado en conejo con 10 serovariedades diferentes de Leptospira interrogans.17 Las preparaciones fueron incubadas durante 1 h a 37 ºC, se lavaron con una solución amortiguadora de fosfatos, se incubaron 1 h con un anti-Ig totales de conejo, conjugado a peroxidasa (SIGMA); la reacción se efectuó con H2O2 y 3,3 diaminobenzidina (SIGMA).
Para la impregnación argéntica se utilizaron las técnicas de Warthin-Starry y Fontana modificado.18
Resultados
Los pacientes presentaron síntomas diversos, entre los que destacaron astenia y adinamia (78 %), depresión 68 %, artralgias (63 %), fatiga (58 %) mialgias e hipersomnia (56 %), distensión abdominal y cefalea (50 %).
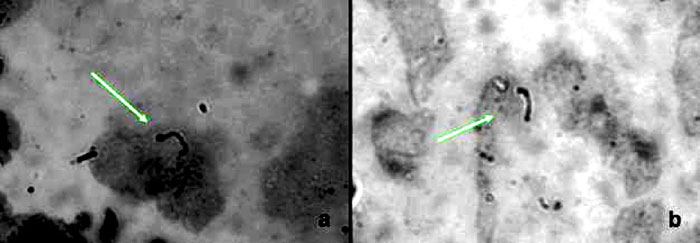
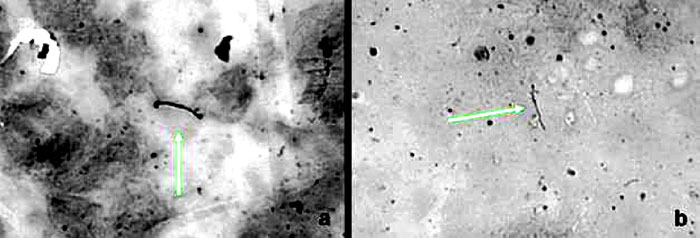
De las orinas, 87 %, y de las muestras sanguíneas, 82 %, fueron positivas a la observación y videograbación por microscopia de campo oscuro con amplificador de imágenes (VECOVISION). De las orinas 87 %, y 76 % de las sangres fueron positivos para inmunohistoquímica (fig. 1). En el caso de las impregnaciones argénticas, 64 % de las orinas y 44 % de las sangres fueron positivas por Warthin-Starry (fig. 2), y 74 % de las orinas y 80 % de las sangres lo fueron por Fontana modificado (fig. 3).
Fig. 1. Leptospiras en sangre (a) y orina (b) detectadas por inmunohistoquímica.
Fig. 2. Leptospiras en sangre (a) y orina (b), teñidas por Warthin-Starry.
Fig. 3. Leptospiras en sangre (a) y orina (b), teñidas por Fontana modificado.
Por otro lado, la MAT solo fue positiva en 20 % de los casos, a títulos ≥ 1:80 (fig. 4).
Fig. 4. Sensibilidad a la detección de leptospira y sus antígenos, comparada con la MAT.
Discusión
Es común que la serología falle en el diagnóstico de leptospirosis, con consecuencias graves o fatales, así se ha descrito en diversos reportes individuales o en brotes epidémicos, como el ocurrido en Nicaragua en 1995,11 en donde la serología fue incapaz de detectar leptospirosis al principio del estudio y fue hasta la autopsia, donde por impregnación argéntica e inmunohistoquímica, que se logró hacer el diagnóstico; igual ocurrió en una serie de 62 pacientes con leptospirosis que murieron en una zona metropolitana de la India, donde la serología solo fue capaz de diagnosticar 14 casos y en la autopsia a 30 de 54, les fue detectada leptospira en diversos tejidos mediante inmunohistoquímica.10
En el paciente crónico, que suele presentar un cuadro clínico muy proteiforme, el grupo de este estudio ha encontrado reiteradamente que la serología no constituye de ninguna manera el método más adecuado para realizar el diagnóstico, porque los títulos de anticuerpos que se obtienen en estos pacientes, casi siempre están por debajo del punto de corte que las normas oficiales internacionales consideran diagnósticos. Además, en esta fase, se ha observado, que las leptospiras siempre están presentes en sangre y orina y en cantidades importantes dentro de los tejidos, como se demostró en pacientes que fallecieron y habían sido diagnosticados previamente por nosotros; al ser estudiados en la autopsia mediante las técnicas antes descritas, se observó abundantes leptospiras en sus tejidos, incluida médula ósea, e inclusive en 1 de estos pacientes antes de morir se detectó leptospiras en sangre periférica y médula ósea mediante microscopia electrónica.8
En los casos graves de las fases aguda o crónica agudizada, es primordial que el paciente reciba el tratamiento específico en cuanto exista la sospecha clínica de la enfermedad, para que sea efectivo y el paciente no evolucione a la gravedad por falla multiorgánica o por otros síndromes, que puedan conducir al paciente a la muerte, o a que su recuperación sea más tardada.19
Para evitar el deterioro de estos pacientes e inclusive su muerte, se requiere la utilización de métodos diagnósticos sensibles, específicos y en su caso tempranos para la detección de leptospirosis aguda grave y crónica agudizada, y en el caso de enfermedad grave, debe darse tratamiento específico mientras se esperan los resultados.8,19
Tratando de solucionar el problema diagnóstico en pacientes crónicos, se compararon 3 métodos para la detección de leptospiras por observación directa con la serología por MAT. En la figura 1 se observa que estas técnicas de detección tienen una sensibilidad muy superior (87 %) comparadas con la MAT (20 %), por tanto, a pesar de que a la serología, especialmente a títulos altos, se le considere muy específica, es con frecuencia muy poco sensible tal como lo describen Chandrasekaram y Gomathi,13 al comparar la observación directa en microscopia de campo oscuro con la serología (ELISA-IgM) en pacientes leptospirosos. Se encontró que en el estudio de una muestra única, la observación por campo oscuro detectó 100 % de los casos, mientras que la serología lo hizo solo en 33 % durante la primera semana de la enfermedad y 2 semanas más tarde, la observación en campo oscuro lo hizo en 91 % contra 30 % de la serología.
En este caso, la microscopia y videograbación en campo oscuro detectaron el mayor porcentaje de muestras positivas de sangre (82 %) y orina (87 %), seguida por la inmunohistoquímica (76 y 87 %, respectivamente), que además de detectar antígenos específicos de Leptospira, permite observar su estructura, sin dejar dudas en la lectura. Por otro lado, las técnicas de impregnación argéntica fueron mucho más sensibles que la MAT, y el Fontana modificado fue la mejor de ambas, por detectar mayor número de muestras positivas (80 % en sangre y 74 % en orina), que se acerca en frecuencia a la videograbación en campo oscuro y a la inmunohistoquímica.
La superioridad del Fontana sobre el Warthin-Starry, aparentemente, se debe a que esta última es una técnica más compleja, que requiere 2 incubaciones en baño de María, por lo tanto, entre otras cosas, tiene una mayor probabilidad de desprendimiento de la muestra.
En general, la observación por estos métodos, es superior en orina, quizás porque está libre de células y existe menor confusión en su lectura.
Es importante mencionar que para la observación de leptospiras en campo oscuro se debe utilizar un microscopio con una fuente de luz potente2,15 y debe realizarse a 400 aumentos, porque la iluminación estándar es insuficiente para la observación adecuada, mientras que la observación a 200 aumentos no permite distinguir claramente a las leptospiras de algunos artefactos. Si a estas modificaciones, se agrega la videograbación, se obtendrán imágenes muy superiores a las logradas con la técnica de campo oscuro común, además de tener la posibilidad de repetir y analizar por el tiempo que se requiera, las imágenes observadas en los diferentes fluidos biológicos, para confirmar lo que se está observando.
Los resultados anteriores, sin duda, resaltan la importancia de las técnicas de observación directa de la bacteria, porque fueron mucho más sensibles y específicas que la MAT.
Es muy importante mencionar que estas muestras también fueron cultivadas en medios EMJH-ASB y que en 80 % de los casos se obtuvieron primoaislamientos positivos, muchos perdidos durante las resiembras, pero que en 2 de los casos descritos aquí, los primocultivos evolucionaron a cepas (aislados), después de más de 1 año de evolución; por lo que los cultivos no deben descartarse a las 16 semanas como se recomienda en diversos manuales y tratados de leptospirosis.6,17 Asimismo, es relevante informar que en la sangre de uno de estos casos, al ser estudiado mediante microscopia electrónica, se obtuvo la microfotografía de la bacteria (fig. 4), lo que constituyó junto a los resultados de la IA y la IHQ y el cultivo, pruebas irrefutables de la bondad de la observación microscópica y videograbación en campo oscuro para el diagnóstico de la leptospirosis.
Por último, los autores de este trabajo creen que el diagnóstico de la leptospirosis aguda o crónica debe realizarse en forma secuencial o in-constructo,20 como en el trabajo aquí presentado, sobre la base además de los datos clínicos y epidemiológicos del paciente, y en caso de urgencia y para obtener un diagnóstico temprano y expedito, la VECOVISION es una excelente alternativa, la cual puede ser apoyada por una de las técnicas confirmatorias.
Agradecimientos
A la Máster en Ciencias María Esther Sánchez, Central de Microscopia, ENCB-IPN, a la Técnica Alejandra Moran, Medicina-Tropical, por su colaboración en el procesamiento y obtención de microfotografías y a los compañeros Ricardo Vargas y Daniel Sánchez, Bioterio, Departamento de Medicina Experimental, Facultad de Medicina, UNAM, por su colaboración en la obtención del suero policlonal anti-leptospira de conejo.
Diagnosis of chronic leptospirosis, comparison between the microscopic agglutination and three confirmatory diagnostic techniques
Summary
In spite of the fact that the serology and, particularly, the microscopic agglutination technique are the most recommended methods to diagnose leptospirosis, they frequently fail in the diagnosis of individual cases and in outbreaks, where the diagnosis is frequently made post-mortem by argentic and immunohistochemical impregnation,. These techniques are also unable to diagnose chronic leptospirosis, since the antibody titres are very low (≤ 1:80) in it. Due to this fact, and to the need of a reliable and appropriate lab diagnosis, a comparative study of dark field videorecording, supported by argentic impregnation and immunohistochemistry in blood and urine was conducted against a serology by microscopic agglutination technique in 60 patients with chronic leptospirosis. Dark field videorecording, argentic impregnation, and immunohistochemistry proved to be be much more sensible than the microscopic agglutination technique, in addition to be comparable among themselves. We recommended videorecording to achieve a fast, early, and economical diagnosis, particularly, if we associate it with immunohistochemistry or argentic impregnation. Likewise, in the culture of these samples, 2 strains of 82 % of positive primoculture were obtained, and an electronic microphotography was possible to attain in the peripheral blood of one of the studied cases, which guarantees the study and confirms the existence of chronic leptospirosis.
Key words: Leptospirosis, chronic leptospirosis, diagnosis, dark field, immunohistochemistry,
Referencias bibliográficas
1. Hartskeerl Rudy A. International Leptospirosis Society: objectives and achievements. Rev Cubana Med Trop 2005;57(1):7-10.
2. OIE. Office International des Epizooties. Manual of standards for Diagnostic test and vaccines. Paris 2000.
3. Ellis WA. The diagnosis of leptospirosis in farm animals. In: The present state of leptospirosis diagnosis and control. Netherlands: Martinus Nijhoff, 5. Avdeeva MG. Outcome and tendency of late convalescence in icterohemorrhagic leptospirosis. Klin Med (Mosk) 2000;81(6):42-47. ISSN: 0023-2149. 6. Levett PN. Leptospirosis. Clin Microbiol Rev 2001:296-326. 7. Velasco-Castrejón O, Rivas-Sánchez B, Rivera-Reyes HH. Leptospirosis humana crónica. En: Diagnóstico y tratamiento en la práctica médica. Narro-Robles J, Rivero SO, López BJ. ed. México: Manual Moderno; 2006. 8. Velasco-Castrejón O, Rivas-Sánchez B, Gutiérrez E, Chávez L, Duarte P, Chavarría S, et al. Leptospira: ¿simulador o causante de leucemia?. Rev Cubana Med Trop 2005;57(1):17-24. 9. Velasco-Castrejón O, Rivas-Sánchez B. Tratamiento inmunoterapéutico en 50 pacientes con leptospirosis crónica refractaria a antibióticos. Rev Cubana Med Trop 2002; 54(1):74. 11. Trevejo RT, Rigau PJG, Ashford DA, McClure EM, Jarquin GC, Amador JJ, et al. Epidemic leptospirosis associated with pulmonary hemorrage-Nicaragua 1995. J Infect Dis 1998;178:1457-63. 13. Chandrasekaran S, Gomathi S. A standard screening test for the early and rapid diagnosis of leptospirosis. Indian J Medical Microbiol 2004;22 (1):23-7. 14. Saengjaruk P, Chaicumpa W, Watt G, Bunyaraksyotin G, Wuthiekanum V, Tapchaisri P, et al. Diagnosis of human leptospirosis by monoclonal antibody-based antigen detection in urine. J Clin Microbiol 2002;40(2):480-9. 15. Velasco-Castrejón O, Rivas-Sánchez B, Becker I, Velasco CA. VECOVISION, un nuevo método imagenológico para el diagnóstico definitivo de leptospirosis. Rev Cubana Med Trop 2002;54(1):67. 17. Bartholomew JW. Stains for microorganisms in smears. In. Clark G ed. Staining Procedures. 4th ed. EE. UU:Williams & Wilkins. p. 409-10; 1981. 19. Sacket D, Haynes B, Guyatt, Tugwell P. Epidemiología clínica. Ciencia básica para la medicina clínica. México:Ed. Panamericana; 1998. Recibido: 29 de noviembre de 2006. Aprobado: 12 de diciembre de 2006. 1 Doctor Investigador-Académico.
Dr. Oscar Velasco Castrejón. Laboratorio de Medicina Tropical. Segundo piso. Medicina Experimental, Facultad de Medicina, UNAM – Hospital General de México. Dr. Balmis 148. Colonia Doctores. México, D.F. CP 06726. Teléf.: (55) 5623-2678 y (55) 5623.2677. Fax: (55) 8596-4600. Correo electrónico: oscarvel1@yahoo.com y oscarvelasco@medicina-tropical.com
2 Maestra en Ciencias. Investigadora.
3 Licenciada en Química. Bacterióloga y Parasitóloga.
4 Médico Cirujano y Partero. Licenciado.