Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.60 n.3 Ciudad de la Habana sep.-dic. 2008
ARTÍCULO ORIGINAL
Aislamiento y propagación del virus de la hepatitis E en diferentes líneas celulares
Isolation and propagation of hepatitis E virus in several cell lines
María de la Caridad Montalvo VillalbaI; Ángel de Jesús Goyenechea HernándezII; Luis Morier DíazIII; Zoila GonzálezIV; Hermis Rodríguez SanchézV; Marité Bello CorredorVI; Aidonis Gutiérrez MorenoVII; Susel Sariego FrometaVIII; Dianeya Mendoza LlanesIX; Yamira Caballero LorenzoIX; Licel de los Ángeles Rodríguez LayX
I Especialista de I Grado de Inmunología. Máster en Virología. Investigadora Agregada. Instructora. Departamento de Virología. Instituto de Medicina Tropical "Pedro Kourí" (IPK). Ciudad de La Habana, Cuba.
II Especialista de II Grado de Microbiología. Investigador Titular. Profesor Titular Adjunto. Departamento de Virología. IPK. Ciudad de La Habana, Cuba.
III Licenciado en Microbiología. Investigador Auxiliar. Profesor Asistente. Departamento de Asistencia Científico Técnica (ACT). IPK. Ciudad de La Habana, Cuba.
IV Licenciada en Microbiología. ACT. IPK. Ciudad de La Habana, Cuba.
V Licenciado en Microbiología. ACT. Investigador Agregado. IPK. Ciudad de La Habana, Cuba.
VI Licenciada en Microbiología. Máster en Virología. Investigador Auxiliar. Departamento de Virología. IPK. Ciudad de La Habana, Cuba.
VII Técnico en Investigación y Servicios. Departamento de Virología. IPK. Ciudad de La Habana, Cuba.
VIII Licenciada en Microbiología. Aspirante a Investigador. Departamento de Virología. IPK. Ciudad de La Habana, Cuba.
IX Técnica en Investigación y Servicios. ACT. IPK. Ciudad de La Habana, Cuba.
X Médico Especialista de II Grado de Microbiología, Doctora en Ciencias Médicas. Investigador Titular. Profesor Auxiliar. Departamento de Virología, IPK. Ciudad de La Habana, Cuba.
RESUMEN
ANTECEDENTES: el virus de la hepatitis E es el agente causal de la hepatitis E. Las propiedades biológicas y moleculares de las cepas asiáticas del VHE ya han sido exploradas en cultivos celulares.
OBJETIVOS: aislar y propagar una cepa cubana del virus de la hepatitis E en diferentes líneas celulares.
MÉTODOS: la monocapa de las células A549 fue inoculada con una suspensión de heces obtenida de un paciente con diagnóstico serológico y molecular de hepatitis E. Estas células fueron observadas hasta el décimo pase. Mientras que, las líneas celulares MRC5, LLCMK2, HEP-2, FRhK4 y HeLa fueron utilizadas para propagar el virus de la hepatitis E, a partir del sobrenadante obtenido del tercer pase en A549. Estas células fueron seguidas hasta el tercer pase. El ARN y los antígenos de la cepa ECV/2349-03 fueron identificados por TR-RCP e inmunofluorescencia indirecta.
RESULTADOS: en las células A549 el ECP apareció desde el primer pase, a los 3 d de posinoculación. El genoma y los antígenos del virus fueron identificados en todos los pases seriados. En el resto de las líneas celulares estudiadas no se observó el ECP. En estas células el material genético del virus de la hepatitis E se detectó desde el primer pase y los antígenos a partir del segundo pase, excepto en las HeLa.
CONCLUSIONES: estos resultados confirman que las células A549 pueden ser utilizadas para aislar y propagar el virus de la hepatitis E, mientras que las células MRC5, LLCMK2, HEP-2 y FRhK4 son capaces de mantener el crecimiento viral.
Palabras clave: Virus de la hepatitis E, células A549, aislamiento.
ABSTRACT
BACKGROUND: hepatitis E virus (HEV) is the causative agent of hepatitis E. Biological and molecular properties of Asian HEV strains have been explored in cells cultures.
OBJECTIVES: the aim of this investigation was to isolate and propagate a Cuban HEV isolate in different cell lines.
METHODS: A549 cells monolayer was infected with faeces suspension from patient with sporadic hepatitis E and followed up until tenth passage. Lately, the supernatant harvested from third passage in A549 cells was inoculated in MRC5, HEP-2, LLCMK2, HeLa y FRhK4 for propagation study. These cells were observed up to third passage. RNA and viral antigen of ECV/2349-03 HEV strain were identified by RT-PCR and indirect immunofluorescence.
RESULTS: CPE appeared since first passage, at third day of post-inoculation in A549 cells. HEV antigens and genome were detected in all serial passages. CPE was not observed in the rest of cellular cultures. In the cells used for propagation the viral genome was observed from first passage, while the antigens were detected since second passage, except HeLa.
CONCLUSIONS: these results confirm that A549 can be used to isolate and propagate HEV. Meanwhile, the MRC5, HEP-2, LLCMK2 and FRhK4 were able to support viral growing.
Key words: HEV, A549 cells, propagation.
INTRODUCCIÓN
La hepatitis E está ampliamente distribuida en el nivel mundial; las grandes epidemias han sido reportadas en países en desarrollo de regiones tropicales y subtropicales, de Asia, África y América Latina (México). Epidemiológicamente, la hepatitis E puede presentarse en forma de brotes explosivos de hepatitis viral aguda o como casos esporádicos; esta última es la más común en países industrializados.1,2
El virus de la hepatitis E (VHE) es transmitido por vía fecal-oral, asociado al consumo de agua contaminada. Sin embargo, el riesgo de transmisión zoonótica, ha sido demostrado por varios autores.3-5
La hepatitis E tiene un período de incubación que oscila de 15 a 60 d, con una media de 32 d. Los síntomas provocados por la infección viral generalmente son ligeros, en ocasiones la infección es asintomática y nunca evoluciona a la cronicidad. En mujeres embarazadas que se infectan en el tercer trimestre de gestación, la letalidad es elevada y alcanza hasta 20 % en regiones endémicas.3,6
El VHE pertenece a la familia Hepeviridae, es el único miembro del género Herpevirus.7 El virus posee un genoma ARN de simple cadena, de sentido positivo; con una talla de 7,2 kb. Además, cuenta con 3 marcos abiertos de lectura (MAL1, MAL2, MAL3). Hasta el presente ha sido identificado un solo serotipo, pero posee una amplia variabilidad genética, por lo que se agrupa en 4 genotipos (1-4) y diferentes subtipos (a-j).8-10
En condiciones de laboratorio, la historia natural de la infección por el VHE ha sido reproducida en monos rhesus y macacos.2,11 La infección se ha detectado en estos animales por elevación de las aminotransferasas y la presencia del material genético del virus en suero y heces. Sin embargo, el cultivo celular es un sistema de replicación viral de fácil manipulación y reproducible. Así, varios grupos de investigadores han intentado obtener la adaptación del VHE en líneas celulares humanas (A549, 2BS, PLC/PRF/5, LLCMK2, KMB17, BEL7402 y HeLa) y de primates no humanos (Vero y FRhK4).8,12,13 El primer aislamiento se reportó en la línea FRhK4 co-cultivada con células de riñón de mono cynomolgus infectadas con una suspensión de heces de un paciente con hepatitis E.14 Además, otros autores detectaron que las líneas celulares 2BS, A549, PLC/PRF/5, LLCMK2 y Vero son sensibles al virus.8,14,15 No obstante, el efecto citopático (ECP) como marcador de replicación viral no aparece habitualmente en todos los sistemas celulares estudiados.
Del VHE muy poco se sabe de su interacción con células susceptibles. En esta investigación se describe el aislamiento y la propagación de la cepa cubana del VHE en A549, obtenida directamente de heces de un paciente infectado. Asimismo, se evaluó la capacidad de las líneas MRC5, LLCMK2, HEP-2, FRHK4 y HeLa de mantener el crecimiento viral. Este estudio es la base para establecer las características biológicas de los aislamientos autóctonos del VHE, lo que permitirá conocer la relación antigénica entre los diferentes aislamientos necesaria para la evaluación de futuros candidatos vacunales.
MÉTODOS
Preparación de la suspensión de heces
La muestra de heces fue colectada de un paciente cubano (ECV/2349-03) con diagnóstico clínico y serológico de hepatitis E; en los primeros 15 d después del inicio de los síntomas y la elevación de las aminotransferasas.16 El espécimen fue conservado a - 70 °C hasta su uso. La suspensión se preparó a 10 % con medio esencial mínimo (MEM) libre de suero fetal bovino (SFB) y suplementado con ampicillin (100 U/mL) y estreptomicina (100 µg/mL). Inmediatamente, fue homogenizada con vortex y luego clarificada por centrifugación a 2 000 g, durante 15 min a temperatura ambiente.
Cultivo celular
Para el aislamiento y la propagación del VHE se utilizaron las células A549 (línea celular de carcinoma de pulmón humano). Estas proliferaron en frascos plásticos de 25 cm2 a 37 ºC, hasta que la monocapa llegó a ser subconfluente. Para el crecimiento de las células se empleó medio esencial mínimo Dulbecco modificado, suplementado con SFB 10 %, ampicillin (100 UI/mL) y estreptomicina (100 µg/mL). Las células MRC5 (línea diploide de fibroblasto de pulmón humano); HEP-2 (línea de carcinoma epidermoide de laringe humano); LLCMK2 (células epiteliales de riñón de mono rhesus); FRhK4 (derivada de fibroblasto de riñón de mono rhesus) y la HeLa (células epiteliales humanas de carcinoma cervical) fueron empleadas para la propagación viral. Las líneas celulares antes referidas utilizaron MEM, excepto las células FRhK4 que crecieron con medio Dulbecco, suplementado con SFB 10 %, ampicillin y estreptomicina con las concentraciones antes referidas.
Aislamiento y propagación del virus
Para aislar el virus en A549, el medio de crecimiento se decantó y se inoculó la monocapa con 0,5 mL de la suspensión de heces, la que se mantuvo en contacto con las células durante 1 h a 37 ºC. Transcurrido el tiempo, se completó con medio de mantenimiento (MEM, 2 % SFB, antibiótico) y las células fueron observadas con el microscopio óptico de 9-11 d. Cuando el ECP llegó a ser de 3 cruces (75 % de la monocapa afectada) los frascos fueron congelados. Para los pases las células y el sobrenadante se sometieron a 3 ciclos de congelación y descongelación con el propósito de liberar el virus intracelular, luego se clarificó el sobrenadante y se inoculó en la nueva monocapa. La propagación del virus en las células MRC5, LLCMK2, HEP-2, FRhK4 y HeLa, se realizó en tubos de cultivo y se tomó 0,1 mL del sobrenadante del tercer pase en A549 donde el ECP comprometió a más de 90 % de las células. Este se mantuvo en contacto 1 h con la monocapa de cada línea celular. Luego, se procedió a completar hasta 1 mL de medio de mantenimiento en correspondencia con el sistema celular empleado. Las células fueron seguidas hasta los 11 d, con cambios de medio semanal. El ECP se cuantificó según la superficie de la monocapa que presentaba cambios morfológicos y fue dado por: 25 % (1 cruz); 50 % (2 cruces), 75 % (3 cruces) y 90 % (4 cruces).
Detección del ARN-VHE
Para la extracción se tomaron 0,2 mL de sobrenadante de cada línea celular, recogido a los 8 d de cultivo y la extracción se realizó mediante el método de TRIzol (Gibco, BRL), siguiendo las recomendaciones del fabricante. Se empleó 0,750 mL de TRIzol y después de añadirse la muestra, se homogenizó, para posteriormente adicionarle 0,2 mL de cloroformo. Esta mezcla se centrífugó a 13 000 g por 15 min a 4 ºC. La fase acuosa superior fue transferida y el ARN se precipitó en igual volumen de isopropanol a -70 ºC por 1 h. Cumplido el tiempo, se procedió a centrifugar en las condiciones antes descritas y luego de decantar el sobrenadante, el ARN se lavó con 0,8 mL de etanol 70 %. El precipitado de ARN fue secado y resuspendido en 0,02 mL de agua libre de ARNasa y ADNasa. Para desnaturalizar el ARN viral, este fue calentado a 70 °C por 10 min e inmediatamente colocado en hielo. La trascripción reversa (TR) se realizó con una mezcla que contenía Tris-HCl (10 mM, pH 8,3); KCL (50 mM); MgCl2 (3 mM); dithiothreitol (10 mM); trifosfato de dioxinucleótidos (0,5 mM cada uno); cebador antisentido (45 pmol); inhibidor de ARNasa (20 UD) (Promega, Madison, Wis); la enzima TR AMV (5UD, Promega) y 0,005 mL del ARN viral desnaturalizado; para un volumen total de 0,025 mL. La mezcla fue incubada 1 h a 42 °C y luego calentada durante 15 min a 70 °C, para inactivar la enzima.
La reacción en cadena de la polimerasa (RCP) simple fue preparada para un volumen final de 0,05 mL que contenía 0,005 mL de ADNc, en Tris-HCl (10 mM, pH 9,2); KCL (75 mM); MgCl2 (1,5 mM); trifosfato de dioxinucleótidos (0,2 mM cada uno); cebadores sentido y antisentido (50 pmol cada uno) y la enzima Taq ADN polimerasa (2,5 UD). La mezcla fue sometida a 35 ciclos de desnaturalización (95 °C x 30 s); hibridación (55 °C x 45 s) y extensión (72 °C x 60 s). El producto de la RCP de 197 pb fue separado por gel de agarosa 2 %, teñido con bromuro de etidium y visualizado con luz ultravioleta. Los cebadores empleados en la TR-RCP simple fueron referidos por Schlauder y otros e hibridan con el MAL2 desde la posición 6298_6494 según la cepa de Burma del VHE.9
· Secuencia de cebador antisentido: cttgttcrtgytggttrtcataatc.
· Secuencia de cebador sentido: gacagaattratttcgtcggctgg.
Inmunofluorescencia indirecta (IFI)
Esta técnica permitió detectar la expresión de antígenos virales en las líneas celulares empleadas. Después de 7 a 9 d en cultivo, las células fueron desprendidas de la superficie para ser fijadas en láminas portaobjetos. Luego de eliminar el medio, las células fueron sometidas a 2 lavados con solución tampón-fosfato (PBS). A continuación, se resuspendieron en el mismo tampón y se gotearon en las láminas para ser fijadas con acetona. Como fuente de anticuerpos para detectar la expresión de antígenos del virus se utilizó una mezcla de sueros de alto título de Ig totales anti-VHE, detectados por estuches diagnósticos comerciales de Genelabs Diagnostic. Seguidamente, las láminas se incubaron 30 min a 37 ºC en cámara húmeda y luego de 3 lavados con PBS, se añadió el conjugado anti-inmunoglobulina humana/isotiocinato de fluoresceína (SIGMA) diluido 1/40 en azul de Evans. La muestra se mantuvo en contacto con el conjugado 30 min a 37 ºC en cámara húmeda y al cabo de este tiempo se hicieron 3 lavados con PBS. A las láminas después de secadas se les añadió glicerina buferada sobre la cual se colocó el cubreobjeto. Las muestras fueron observadas en el microscopio de fluorescencia (Leíca). Los resultados fueron dados en positivos (% de células infectadas) y negativos, teniendo en cuenta el control de células no infectadas, a las que se aplicó igual procedimiento.16
RESULTADOS
En las células A549 infectadas con la suspensión de heces se comenzó a observar el ECP desde el primer pase, que resultó evidente a partir del tercer día de posinoculación. En la siembra primaria se observaron cambios citopáticos, pero estos se produjeron por la elevada toxicidad de la muestra. En los 2 primeros pases los cultivos fueron observados entre de 9 y 11 d. El ECP estuvo dado por aumento de la refringencia, redondeamiento y desprendimiento celular de la superficie de cultivo. El efecto progresó hasta llegar a la pérdida de la arquitectura normal de la monocapa y su destrucción (fig. 1). El tiempo de aparición del ECP disminuyó al aumentar el número de pases, por lo que las células tuvieron que ser congeladas tempranamente entre los 7 y 8 d de posinfección a partir del tercer pase. Esto se mantuvo hasta el décimo pase, cuando concluyó el seguimiento del cultivo de las A549. El resto de las líneas celulares infectadas con el sobrenadante obtenido del tercer pase en las A549, fueron observadas durante 3 pases seriados y no se constató ECP alguno.
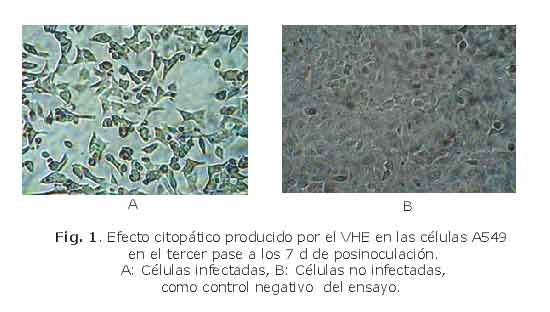
La expresión celular de los antígenos del VHE (tabla), se detectó desde el primer pase en las A549, y se mantuvo hasta la décima generación. En el resto de los sistemas celulares se constató a partir del segundo pase, excepto en la línea HeLa. El patrón de inmunofluorescencia fue granular, propio de los virus que tienen replicación citoplasmática.
En cuanto a la detección del material genético viral (fig. 2), su presencia se demostró en las A549 desde el primero hasta el décimo pase. En cambio, este marcador no tuvo un comportamiento uniforme en el resto de los sistemas estudiados.
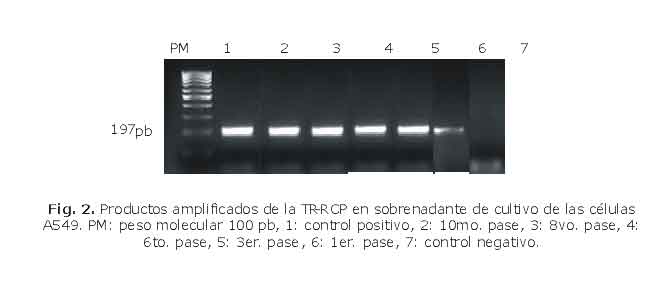
Así, en las MRC5 como en las HEP-2 el ARN del virus se detectó en todos los pases (tabla 1), en tanto en las LLCMK2 solo se constató en los 2 primeros pases. En las FRhK4 se obtuvo producto amplificado solo en el tercer pase, mientras que, en la línea HeLa, no se observó genoma del virus en ninguno de los sobrenadantes de los pases estudiados. Estos sistemas celulares fueron observados de 9 a 12 d.
DISCUSIÓN
Como es conocido, desde el siglo pasado los cultivos celulares se han utilizado para el aislamiento y la propagación de muchos virus. Asimismo, la detección de sus componentes en estos sistemas depende de la sensibilidad de los métodos empleados.
En las células A549, los resultados aquí presentados demuestran que el VHE fue infeccioso en todos los pases seriados. La intensidad del ECP se incrementó con cada pase, lo que sugiere una rápida adaptación de la cepa a este sistema celular y quizás una reducción de la fase exponencial de la replicación viral. Además, se confirmó la presencia del virus, porque en cada pase fue detectado el genoma y sus proteínas. El cultivo del VHE en esta línea celular directamente de heces fue reportado por primera vez por Huang y otros, quienes utilizaron muestras de brotes y casos esporádicos de hepatitis E en China.8,12
Las características del ECP provocado por la cepa cubana, fue similar a lo observado con los aislamientos asiáticos, donde además se refiere que aparece el ECP a las 48 h posinoculación. Este progresó hasta la destrucción completa de la monocapa y la presencia del virus se detectó por IFI, microscopia electrónica y TR-RCP.8,12-14
No hay antecedentes del uso de la línea de fibroblastos humanos MRC5 para propagar el VHE. Con este estudio se demostró que puede ser utilizada para el crecimiento viral, aunque su replicación no afecta la morfología, ni la monocapa celular. No obstante, la línea 2BS (células diploides de fibroblastos de pulmón fetal humano) ha demostrado ser útil para aislar y propagar el VHE, que produce un marcado ECP en esta línea celular.8,12,13,17
Si bien, en la línea LLCMK2 no se detectó ECP en los 3 pases seriados, sí se pudieron identificar los componentes del virus. En los 2 primeros pases se obtuvo el genoma viral y la expresión de antígenos fue máxima en el segundo pase para luego caer en el tercero. Huang y otros obtuvieron similares resultados en cuanto al ECP, no lo observaron después de realizar 3 pases seriados. Al mismo tiempo, detectaron que el título viral descendió en los pases sucesivos.18 Esta disminución en la detección de antígenos y de material genético viral pudiera estar determinada por la interacción entre la célula hospedera y el virus, donde se pueden producir alteraciones en el ciclo replicativo, lo que provoca una reducción progresiva de la progenia viral.
En la HEP-2, la expresión de las proteínas del virus aumentó del segundo al tercer pase y el genoma viral fue detectado en todos los pases realizados. La sensibilidad de este sistema al VHE no había sido explorada con anterioridad, por lo tanto se demuestra que puede ser utilizada para soportar el crecimiento del virus.
Las FRhK4 demostraron su capacidad para propagar el VHE, aunque la adaptación de la cepa a este sistema no ocurre de forma inmediata. Las FRhK4 fueron las primeras células utilizadas para aislar el VHE, cuando se cocultivaron con células de riñón de monos cynomolgus, infectados con el virus. En este experimento los componentes del virus fueron observados a partir del quinto pase (IFI y ARN).14
En tanto, se evidenció que la línea HeLa no fue permisiva para el VHE, pues en ninguno de los pases se detectaron componentes del virus. Según la literatura revisada, Le y otros siguieron estas células hasta el cuarto pase y obtuvieron resultados similares.13
En las líneas celulares empleadas para la propagación del VHE, el crecimiento viral fue detectado tempranamente en el primer pase por TR-RCP y no por IFI. Como se conoce, la sensibilidad de esta técnica es elevada con respecto a la IFI, que depende del reconocimiento de epítopes conformacionales del virus y de la concentración de los antígenos en las células tomadas del frasco de cultivo para ser fijadas. Mientras que, la TR-RCP puede identificar genoma del virus a bajas concentraciones y la empleada en esta investigación tuvo una sensibilidad <103 partículas virales (datos no publicados). No obstante, será necesario continuar el estudio de propagación para verificar si la expresión del VHE se mantiene más allá del tercer pase.
La posibilidad de cultivar el VHE en diferentes líneas celulares es un requisito para profundizar en los estudios de biología molecular y de replicación viral. Estos sistemas tienen una importancia extraordinaria, porque constituye una fuente de antígenos para diseñar estuches diagnósticos, realizar investigaciones de caracterización biológica de cepas cubanas del VHE y evaluar futuros candidatos vacunales.
AGRADECIMIENTOS
Agradecemos la colaboración de los doctores David Anderson, Teresa Howard y Ming Guan, quienes amablemente enviaron los estuches diagnósticos para la detección de inmunoglobulinas totales anti-HEV. Además, reconocemos la asistencia prestada por el doctor Tian Cheng Li, quien proporcionó el cADN-VHE, como control positivo de la RCP. Asimismo, la colaboración del doctor Shahid Jameel y el Máster en Biotecnología Vivek Chandra fue importante para culminar satisfactoriamente la investigación, porque asesoraron en la detección molecular del VHE.
REFERENCIAS BIBLIOGRÁFICAS
1. Balayan MS, Type E Hepatitis: State of the Art. Int J Infect Dis. 1997;2:113-120.
2. Purcell RH, Emerson SU. Hepatitis E virus. In: Knipe DM, Howley PM, Griffin DE, editors. Fields Virology. Philadelphia: Lippincott Williams and Wilkins; 2001. p. 3051-61.
3. Panda SK, Jameel S. Hepatitis E virus: from epidemiology and molecular biology. Vir Hep Rev. 1997;3:227-51.
4. Schlauder GG, Dawson GJ, Erker JC, Kwo PY, Knigge MF, Smalley DL, et al. The sequence and phylogenetic analysis of a novel hepatitis E virus isolated from a patient with acute hepatitis reported in the United States. J Gen Virol. 1998;79:447-56.
5. Meng XJ. Zoonotic and xenozoonotic risk of the hepatitis E virus. Infect Dis Rev. 2000;1:35-41.
6. Bradley DW. Enterically-transmitted non-A, non-B hepatitis. Br Med Bull. 1990;46:442-61.
7. Emerson SU, Anderson D, Arankalle A, Meng XJ, Purdy M, Schlauder GG, et al. Hepevirus. In: Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, editores. Virus Taxonomy VIIIth Report of the ICTV. London: Elseiver/Academic Press; 2004. p. 851-5.
8. Huang RT, Li DR, Wei J, Huang XR, Yuan XT, Tian X. Isolation and identification of hepatitis E virus in Xinjiang, China. J Gen Virol. 1992;73:143-8.
9. Schlauder GG, Desai SM, Zanetti AR, Tassopoulus NC, Mushawar IK. Novel hepatitis E virus (HEV) isolates from Europe: evidence for additional genotypes of HEV. J Med Virol. 1999;7:243-51.
10. Schlauder GG, Frider B, Sookoian S, Castaño GC, Mushahwar IK. Identification of 2 novel isolates of hepatitis E virus in Argentina. J Infect Dis. 2000;2:294-7.
11. Tsarev SA, Tsareva TS, Emerson SU, Yarbough PO, Legters LJ, Moskal T, et al. Infectivity titration of a prototype strain of hepatitis E virus in cynomolgus monkeys. J Med Virol. 1994;43:135-42.
12. Huang R, Li D, Wei S, Quinghong L, Yuang X, Geng L, et al. Cell Culture of Sporadic Hepatitis E Virus in China. Clin Diagn Lab Immunol. 1999;6:729-33.
13. Le GY, Wu J, Ma YB, Du RJ, Zhuang JY, Xie TH, et al. Propagation of hepatitis E virus in several cell lines including human embryo lung diploid cell KMB17. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2001;23(6):590-3.
14. Kazachkov YA, Balayan MS, Ivannikova TA, Panina LI, Orlova TM, Zamyatina NA, et al. Hepatitis E virus in cultivated cells. Arch Virol. 1992;127:399-402.
15. Meng J, Dubrei P, Pillot T. A new PCR-Based Seroneutralization assay in cell culture for diagnosis of hepatitis E. J Clin Microbiol. 1997;134:1373-77.
16. Diagnóstico de laboratorio. Dengue y Dengue hemorrágico los retos para su control. Ciudad Habana: Editorial Fun. Mundo Sano; 1999. p. 29-33.
17. Montalvo Villalba M, Aválos AT, Rodríguez Lay L, Goyenechea Hernández, A, Corre dor MB, Moreno AG, et al. Acute hepatitis E virus infection in a Cuban patient. Int J Infect Dis. 2005;9:286-7.
18. Huang R, Nakazono N, Ishii K, Li D, Kawamata O, Kawagushi R, et al. Hepatitis E virus (87A strain) propagated in A549 cells. J Med Virol. 1995;47:299-302.
Recibido: 11 de enero de 2008.
Aprobado: 15 de febrero de 2008.
Dra. María Caridad Montalvo Villalba. Instituto de Medicina Tropical "Pedro Kourí", Autopista Novia del Mediodía, Km 6 ½, AP 601, municipio La Lisa, Ciudad de La Habana. Correo electrónico: mcary@ipk.sld.cu














