Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão impressa ISSN 0375-0760versão On-line ISSN 1561-3054
Rev Cubana Med Trop v.61 n.3 Ciudad de la Habana set.-dez. 2009
ARTÍCULO ORIGINAL
Antigenicidad e inmunogenicidad de una cepa inactivada de Vibrio cholerae O1 El Tor Inaba
Antigenicity and immunogenicity of inactivated Vibrio cholerae 01 El Tor Inaba
Sonsire Fernández CastilloI; Gemma Año LópezII; Hilda García SánchezIII; Daily Serrano HernándezIV; Bárbara Cedré MarreroV; Tania Valmaseda PérezVI; Gustavo Falero DíazVII; Reinaldo Oliva HernándezVIII; Luis García ImiaIX; Arturo Talavera CoronelX
I Licenciada en Microbiología. Aspirante a Investigadora. Instituto Finlay. Ciudad de La Habana, Cuba.
II Máster en Microbiología. Investigadora Auxiliar. Instituto Finlay. Ciudad de La Habana, Cuba.
III Doctora en Ciencias de la Salud. Investigadora Titular. Instituto Finlay. Ciudad de La Habana, Cuba.
IV Técnica Media en Procesos Biológicos. Instituto Finlay. Ciudad de La Habana, Cuba.
V Máster en Microbiología. Investigadora Auxiliar. Instituto Finlay. Ciudad de La Habana, Cuba.
VI Máster en Bioquímica. Investigadora Agregada. Instituto Finlay. Ciudad de La Habana, Cuba.
VII Doctor en Ciencias Biológicas. Investigador Auxiliar. Instituto Finlay. Ciudad de La Habana, Cuba.
VIII Doctor en Medicina Veterinaria y Zootecnia. Instituto Finlay. Ciudad de La Habana, Cuba.
IX Doctor en Ciencias de la Salud. Investigador Titular. Instituto Finlay. Ciudad de La Habana, Cuba.
X Doctor en Ciencias. Investigador Titular. Instituto Finlay. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: el cólera continúa siendo problema de salud, principalmente en las zonas más pobres. La mayoría de los aislamientos que se realizan al nivel mundial pertenecen a Vibrio cholerae O1 biotipo El Tor serotipo Ogawa, aunque se han reportado brotes causados por el serotipo Inaba, por lo que se aconseja que una vacuna efectiva contra la enfermedad deberá contener células o antígenos de ambos serotipos.
OBJETIVO: describir las características de la cepa de V. cholerae O1 El Tor Inaba C6706 como posible cepa para la obtención de vacunas inactivadas contra el cólera.
MÉTODOS: se elaboró un lote de siembra de trabajo crioconservado a - 70 oC, se evaluó su identidad, pureza y viabilidad. La cepa fue cultivada en caldo triptona soya y su inactivación se realizó a 56 ºC durante 20 min. Se evaluó la capacidad antigénica del producto obtenido mediante western blot y ELISA de inhibición de lipopolisacárido. La inmunogenicidad en conejos, inoculados por vía intraduodenal, se determinó mediante la cinética de anticuerpos vibriocidas.
RESULTADOS: el lote de siembra de trabajo mantuvo su identidad, pureza y viabilidad durante 18 meses de estudio. Se observó la presencia de los antígenos lipopolisacárido, hemaglutinina sensible a manosa y proteína de membrana externa U, en las suspensiones de células inactivadas de V. cholerae O1, no así de las subunidades A y B de la toxina colérica (CTA y CTB, respectivamente) o pilli corregulado con la toxina (TCP). Por otra parte, se obtuvieron títulos vibriocidas en los sueros de conejos, similares a la respuesta inducida por la cepa viva atenuada 638 de V. cholerae O1, candidata a vacuna oral.
CONCLUSIONES: la cepa de V. cholerae O1 El Tor Inaba C6706 mostró características culturales, antigénicas e inmunogénicas que permiten considerarla como posible cepa para la obtención de vacunas inactivadas contra el cólera.
Palabras clave: Vibrio cholerae, inactivación, antigenicidad, inmunogenicidad, Inaba.
ABSTRACT
INTRODUCTION: cholera continues being a serius health problem, mainly in the poorest areas. Most of the isolations worldwide belong to Vibrio cholerae O1 biotype El Tor serotype Ogawa, although there have been reported outbreaks caused by serotype Inaba, that is why it is recommended that an effective vaccine against the illness should contain cells or antigens of both serotypes.
OBJECTIVE: to describe the characteristics of the strain C6706 of V. cholerae O1 El Tor Inaba as a likely strain for the obtaining of inactivated vaccines for cholera.
METHODS: a criopreserved working culture batch was made up at - 70 oC to evaluate identity, purity and viability. The strain was cultured in tryptone soy broth and was inactivated at 56º C for 20 minutes. Antigenicity of this preparation was tested by Western Blot and ELISA inhibition test. Immunogenicity in adult rabbits, inoculated intraduodenally, was determined by means of kinetics of vibriocidal antibodies.
RESULTS: the working culture batch kept their identity, purity and viability during 18 months of study. The results confirmed the presence of relevant antigens as lipopolysaccharide (LPS), mannose-sensitive hemagglutinin (MSHA) and outer membrane protein U (OmpU) in the suspension of inactivated V. cholerae O1 cells, but not cholera toxin subunits (CTA, CTB) or toxin-coregulated pili (TCP).On the other hand, vibriocidal titers were found in rabbit sera, which were similar to those previously reported for the live V. cholerae O1 strain 638, an attenuated oral vaccinal candidate
CONCLUSIONS: the V. cholerae O1 El Tor Inaba C6706 strain showed cultural, antigenic and immunogenic characteristics that allow us to consider it as a possible strain for the obtaining of inactivated vaccines for cholera.
Keywords: Vibrio cholerae, inactivation, antigenicity, immunogenicity, Inaba.
INTRODUCCIÓN
La mayoría de los aislamientos que se realizan al nivel mundial pertenecen a Vibrio cholerae O1 biotipo El Tor serotipo Ogawa. Sin embargo, se han reportado brotes causados por el serotipo Inaba en algunas regiones de países como la India, por lo que se aconseja que una vacuna efectiva contra la enfermedad deberá contener células o antígenos de ambos serotipos.1,2
Varios estudios han demostrado que las vacunas, orales, inactivadas contra el cólera (Dukoral y mOROVAC) son seguras y protectoras en poblaciones de riesgo en países subdesarrollados.3,4
También han sido reportadas la antigenicidad e inmunogenicidad de la cepa salvaje de V. cholerae C7258, biotipo El Tor, serotipo Ogawa,5 a partir de la cual fue lograda la formulación en tabletas que resultó ser antigénica e inmunogénica en animales de laboratorio.6
En el presente trabajo se reportan los resultados obtenidos en la elaboración de un lote de siembra de trabajo (LST), así como el cultivo y la inactivación de la cepa C6706, biotipo El Tor, serotipo Inaba y la posterior evaluación de su capacidad antigénica e inmunogénica en conejos adultos.
MÉTODOS
Cepa bacteriana: el estudio se realizó con la cepa C6706 de V. cholerae O1 (biotipo El Tor, serotipo Inaba), la cual fue aislada de un paciente en Perú.7 Se partió de conservaciones almacenadas a - 70 °C en caldo triptona soya (TSB) (BioCen, Cuba) con leche descremada 10 % (MERCK, Alemania) y glicerol 20 % (MERCK, Alemania).
Elaboración del LST: a partir de una ampolleta del lote de siembra de referencia, resuspendida en 1 mL de TSB, se inoculó un tubo con 15 mL del mismo medio. Este se incubó a 37 °C durante 24 h y subcultivó en un erlenmeyer con 100 mL del medio de cultivo referido, el cual fue incubado a 37 °C y 200 rpm por 4 h en zaranda orbital. El cultivo se mezcló con glicerol 20 % (v/v) y leche descremada 10 % (p/v). Se distribuyó en viales para crioconservación a - 70 °C.
Caracterización del LST: la identificación fisiológica y bioquímica del LST se realizó siguiendo la metodología recomendada en el manual de la Organización Mundial de la Salud (OMS).8 La determinación del serogrupo bacteriano se realizó mediante aglutinación en lámina utilizando antisueros comerciales (Murex Biotech Ltd.). Para el ensayo de pureza se realizó por observación microscópica del cultivo obtenido en agar triptona soya (TSA) mediante la tinción de Gram. Para la determinación de la viabilidad se realizó el recuento de unidades formadoras de colonias/mL (UFC/mL) mediante el método de diluciones seriadas y siembra en superficie en TSA, a los 0, 1, 3, 6, 12 y 18 meses después de la congelación.
Cinética de crecimiento: se realizaron 3 réplicas de cultivo en TSB incubados en zaranda orbital a 37 ºC, 200 rpm durante 7 h. Se realizó la medición de la densidad óptica (DO) del cultivo cada 1 h, en un espectrofotómetro Pharmacia LKB Ultrospec III, a una longitud de onda de 600 nm. Se determinaron las UFC/mL y se calculó la velocidad de crecimiento.
Obtención de biomasa en zaranda: a partir de una conservación del LST, se realizó un precultivo en tubos con TSB e incubación a 37 °C de 18 a 24 h. Posteriormente se realizó un cultivo en zaranda orbital en igual medio hasta el inicio de la fase exponencial, luego se subcultivó en iguales condiciones hasta el inicio de la fase estacionaria. La biomasa se cosechó por centrifugación a 17 700 g, a 4 °C, 30 min.5 El precipitado fue resuspendido en solución salina fosfatada (PBS: NaCl, KCl, Na2HPO4, K2HPO4 pH 7,4). La determinación de la concentración celular se realizó mediante conteo de las UFC/mL en placas de TSA.
Inactivación por calor: la biomasa proveniente de zaranda luego de 6 h de cultivo fue inactivada en un baño termostatado con agitación HAAKE SWB 20, a 56 °C durante 20 min. Se realizaron los controles de inactivación mediante la siembra en agar tiosulfato citrato sales biliares sacarosa (TCBS), así como en TSA.
Western blot: mediante esta técnica,9 se determinó la presencia de los antígenos pili corregulado con la toxina (TCP), hemaglutinina sensible a manosa (MSHA), subunidades A y B de la toxina colérica (CTA y CTB), proteína de membrana externa OmpU y lipopolisacárido (LPS) de V. cholerae O1 en la biomasa procedente del cultivo en zaranda antes y después de la inactivación. Los anticuerpos monoclonales (AcM) empleados se correspondieron con cada antígeno en estudio (tabla). Como control negativo se utilizó el AcM anti LPS O139. Se utilizó como patrón de peso molecular (PPM) una mezcla de phosphorilase b (94 kDa), BSA (67 kDa), OVA (43 kDa), anhydrasa carbónica (30 kDa), soybean trypsin inhibitor (20,1 kDa) y a-lactalbumina (14,4 kDa).
ELISA de inhibición para la detección de LPS Inaba: para el ELISA de inhibición se procedió como se describió antes.6 Se emplearon placas Maxisorp (Nunc, Dinamarca), las cuales fueron recubiertas con LPS Inaba purificado por el método fenol-agua.10 Las muestras del ensayo consistieron en una suspensión en PBS de células provenientes de cultivos de la cepa C6706 antes y después de la inactivación ajustados a una DO=1. Se utilizó el LPS Inaba como control positivo. Para este ensayo fue empleado el anticuerpo monoclonal anti-LPS Inaba 4D2G5 obtenido en el Laboratorio de Anticuerpos Monoclonales del Instituto Finlay.
Inmunogenicidad: se empleó el modelo de inoculación intraduodenal.11 Se emplearon 6 conejos adultos jóvenes híbridos F1 del cruce de las líneas Nueva Zelanda Blanco y Semigigante Blanco (NZB x SGB) con un peso vivo entre 1,8 y 2,3 kg, suministrados por el Centro para la Producción de Animales de Laboratorio (CENPALAB), con sus correspondientes certificados de calidad genética y sanitaria. A 3 de ellos se les inoculó en el espacio luminal del duodeno 5 mL de una suspensión bacteriana, que contenía 5 x 1010 células de la cepa C6706 inactivada y a los 3 conejos controles 5 mL de PBS. Se administraron, mediante el mismo procedimiento quirúrgico, 2 dosis con 14 d de intervalo y se tomaron muestras de sangre a los 0, 7, 14, 21, 28, 35 y 42 d posinoculación. Los sueros fueron almacenados a - 20 °C, hasta su posterior análisis. Este estudio preclínico cumplió con los principios de bioética de experimentación con animales de laboratorio.12
Vibriocida: los títulos de anticuerpos vibriocidas en los sueros colectados, fueron determinados según Cedré y otros en 1999.13 Se definió el título de anticuerpos vibriocidas como la mayor dilución de suero que inhibió 100 % del crecimiento bacteriano.
Análisis estadístico: para la determinación de los estadígrafos descriptivos de los valores de DO y UFC/mL se empleó Microsoft Excel y para la determinación del modelo matemático del cultivo, se aplicó el programa de Cinética de Fermentaciones de la Facultad de Biología de la Universidad de La Habana.14 Los valores obtenidos en el ELISA de inhibición de LPS fueron analizados mediante una prueba T de una muestra empleando el programa SPSS 7-0 con 95 % de confianza. Para los títulos obtenidos en el Vibriocida, se utilizó la transformación logarítmica en base 10 de los títulos. Se calcularon los promedios y desviaciones estándar usando Microsoft Excel.
Se verificó la distribución normal e igualdad de varianza. Para la comparación entre grupos se aplicó ANOVA y la prueba de rangos múltiples (LSD), con un nivel de significación de p< 0,05. Las pruebas se realizaron utilizando el paquete estadístico Statgraphics Plus para Windows 2.1.
RESULTADOS
Elaboración y caracterización del lote de siembra de trabajo: el LST obtenido de la cepa C6706 de Vibrio cholerae O1 resultó estable. Las características culturales observadas luego de la siembra en diferentes medios sólidos, así como la realización de pruebas bioquímicas y serológicas, confirmaron la presencia de V. cholerae O1 biotipo El Tor, serotipo Inaba. La observación microscópica del cultivo demostró la presencia de bacilos gramnegativos cortos, curvos o rectos, lo que coincide con la morfología típica de V. cholerae. La viabilidad de la cepa posterior a la congelación se mantuvo en el orden de 108 UFC/mL durante el período evaluado (Fig. 1).
Cinética de crecimiento: se obtuvieron comportamientos similares en las 3 réplicas del cultivo realizadas, con una velocidad de crecimiento (µ) promedio de 1,77 h-1, una desviación estándar (s) de 0,459 con ajuste al modelo logístico de crecimiento bacteriano, con un coeficiente de correlación (r2) de 0,993 y un intervalo de confianza de 95 %. En la figura 2 se puede observar que la fase exponencial se presentó desde la segunda hasta la quinta hora, la cual fue precedida por una fase de adaptación. A partir de la quinta hora se observó que el cultivo pasó a la fase estacionaria hasta la séptima hora.
Inactivación por calor: para la inactivación de la biomasa bacteriana, se detuvo el cultivo a la sexta hora, donde se obtuvo un valor promedio de 2,3 x 109 UFC/mL. El proceso de inactivación mediante el tratamiento con calor resultó eficiente, lo que se pudo comprobar por la ausencia de crecimiento en las placas de TSA y TCBS.
Western blot: en el western blot, las muestras procesadas antes o después de la inactivación de los cultivos, brindaron reacciones positivas frente a los AcM dirigidos contra el LPS, MSHA y OmpU; mientras que no se observó reacción ante los AcM anti TCP, CTA y CTB. No se observó reacción con el AcM anti LPS O139 (Fig. 3).
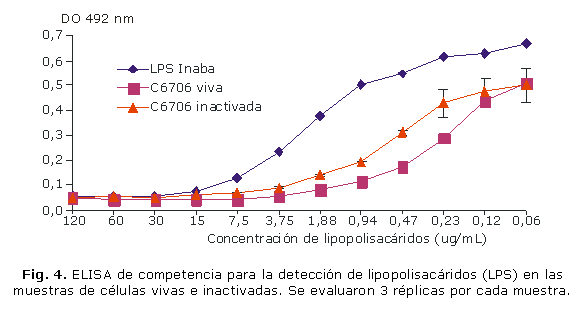
ELISA de inhibición de LPS: en la figura 4 se muestran los resultados del ELISA de inhibición, que permitieron afirmar la presencia de este antígeno en las células inactivadas, las cuales mostraron curvas similares entre las muestras antes y después de la inactivación de los cultivos y el patrón de LPS Inaba.
Inmunogenicidad: los valores del log10 del inverso de los títulos de anticuerpos vibriocidas inducidos en los conejos oscilaron entre 0,53 (± 0,42) y 2,7 (± 0,12) a los 7 y 21 d, respectivamente; mientras que a los 42 d el título fue de 2,4 (± 0,12) (Fig. 5). El valor máximo de anticuerpos se obtuvo a los 21 d. Hubo seroconversión en los conejos inoculados, mientras que en los controles no se detectaron niveles de anticuerpos vibriocidas.
DISCUSIÓN
La ventaja principal del sistema de lotes de siembra, es que en las bacterias cultivadas a partir del LST se reduce la probabilidad de ocurrencia de mutaciones y mantendrán las características del cultivo original. La crioconservación o conservación a bajas temperaturas permite detener los procesos metabólicos y el deterioro biológico durante largos períodos, a la vez que mantiene la estabilidad genética del material crioconservado. Diferentes autores han demostrado que la congelación a - 70 °C resulta adecuada para la preservación de V. cholerae, se mantiene la viabilidad constante durante períodos de 2 y 5 años.15,16
Con respecto a la cinética de crecimiento de esta cepa, su comportamiento fue similar al reportado para la cepa C7258 del biotipo El Tor, serotipo Ogawa.5
Con la utilización de la inactivación por calor se evitan los problemas que se generan cuando se realiza la inactivación con agentes químicos como fenol y formaldehído, porque la presencia de moléculas no disociadas de estos compuestos, facilita su penetración en la célula y provoca cambios sustanciales en las estructuras lipídicas de las membranas bacterianas, además, los residuos de estas sustancias que pudieran quedar en el preparado vacunal ocasionarían el aumento de su reactogenicidad.17
La ausencia de los antígenos TCP, CTA y CTB tanto antes como después de la inactivación pudiera deberse a que estos antígenos son pobremente expresados in vitro por cepas del biotipo El Tor, que requieren de un sistema y medio de cultivo (AKI) especial para lograr su expresión.18,19 Por otra parte, la ausencia de CTA tiene gran importancia porque esta subunidad de la toxina colérica se asocia a la mayoría de los síntomas provocados por el microorganismo, por lo que la OMS ha realizado indicaciones sobre la necesidad de determinar los residuos de esta subunidad en las vacunas orales inactivadas de V. cholerae.20
La presencia del LPS de V. cholerae, en cualquier formulación vacunal contra esta enfermedad es esencial, porque el polisacárido O del LPS constituye el principal antígeno protector, responsable de la mayoría de las respuestas antibacterianas que se inducen posterior a la infección.21
Vijayashree y otros observaron un decrecimiento en la adherencia de V. cholerae al intestino delgado de conejos que fueron inmunizados con sueros contra diferentes antígenos del microorganismo; los anticuerpos dirigidos contra el LPS resultan los más eficientes en la inhibición de la adherencia y promoción de la protección in vivo.22
Se ha visto también que otros componentes como las proteínas de membrana externa (OMP) son capaces de inducir determinado nivel de respuesta inmunológica. En particular, la OmpU es fuertemente reconocida por el suero de voluntarios convalecientes infectados con cepas virulentas de V. cholerae, lo cual indica que esta proteína es muy inmunogénica.23
Por otra parte, el papel de la MSHA ha sido muy controversial. Algunos autores afirman que este antígeno es un buen inmunógeno para desarrollar respuesta antibacteriana capaz de bloquear la colonización intestinal por V. cholerae.24 En contraposición, otros investigadores opinan que los anticuerpos anti MSHA no son suficientes para mediar una protección significativa ante un reto con cepas salvajes del biotipo El Tor.25 Independientemente del papel que desempeñe en la protección, la presencia de esta fimbria en las células inactivadas indica que el proceso de inactivación no afectó de forma apreciable la integridad de algunos antígenos superficiales.
En el presente trabajo se determinó la respuesta inmune mediante el título de anticuerpos vibriocidas en conejos inoculados de manera intraduodenal, este procedimiento ha mostrado asociación con los resultados en humanos para la mayoría de las cepas atenuadas cubanas que se han evaluado en ensayos clínicos11 y ha sido utilizado para evaluar la inmunogenicidad de la cepa C7258 inactivada.5,6
Aunque no se considera que los anticuerpos vibriocidas en el suero sean los mediadores reales de la inmunidad protectora, se cree que su presencia luego de la administración de una vacuna mucosal, se correlaciona con la presencia de anticuerpos IgA secretores intestinales asociados con la protección y la prevención de la adherencia.26
Los resultados descritos en este trabajo en cuanto a la estabilidad del LST de la cepa C6706 y la antigenicidad e inmunogenicidad de la biomasa obtenida, tanto antes como después de inactivar, resultan alentadores, porque son similares a los publicados para la cepa C7258 inactivada3 y a los de la cepa de V. cholerae 638 (atenuada) que mostró resultados satisfactorios en animales y en estudios con humanos.12,27
REFERENCIAS BIBLIOGRÁFICAS
1. Dutta B, Ghosh R, Sharma NC, Pazhani GP, Taneja N, Raychowdhuri A, et al. Spread of cholera with newer clones of Vibrio cholerae O1 El Tor, serotype Inaba, in India. J Clin Microbiol. 2006;44:3391-3.
2. Raychoudhuri A, Chatterjee S, Pazhani GP, Nandy RK, Bhattacharya MK, Bhattacharya SK, et al. Molecular characterization of recent Vibrio cholerae O1, El Tor, Inaba strains isolated from hospitalized patients in Kolkata, India. J Infect. 2007;55:431-8.
3. Hill DR, Ford L, Lalloo DG. Oral cholera vaccines: use in clinical practice. Lancet Infect Dis. 2006;6:361-73.
4. Anh DD, Canh DG, Lopez AL, Thiem VD, Long PT, Son NH, et al. Safety and immunogenicity of a reformulated Vietnamese bivalent killed, whole-cell, oral cholera vaccine in adults. Vaccine. 2007;25:1149-55.
5. Año G, García HM, Valmaseda T, Cedré B, Pino Y, Ancheta O, et al. Antigenicidad e inmunogenicidad de una cepa de Vibrio cholerae inactivada. Biotecn Aplic. 2003;20(1):9-13.
6. Talavera A, Año G, Pino Y, Castaño J, Uribarri E, Riverón L, et al. Formulation in tablets of a cholera whole cells inactivated vaccine candidate. Vaccine. 2006;24:3381-7.
7. Benítez JA, Silva AJ, Rodríguez BL, Fando R, Campos J, Robert A, et al. Genetic manipulation of Vibrio cholerae for vaccine development: construction of live attenuated El Tor candidate vaccine strains. Arch Med Res. 1996;27:275-83.
8. CDC/NCID.OPS. Métodos de laboratorio para el diagnóstico de Vibrio cholerae. Organización Panamericana de la Salud; 1994.
9. Towbin, H, Staehlin T, Gordon J. Electrophoretic transfer of proteins from polycrilamine gels to nitrocellulose sheets, procedure and some applications. Proc Natl Acad Sci USA. 1979;76:4350-4.
10. Westphal O, Jann K. Bacterial lipopolysaccharides: extraction with phenolwater and further applications of this procedure. Methods Carbohyd Chem. 1965;5:83-91.
11. García L, Oliva R, Cedré B, Valmaseda T, García H, Talavera A, et al. Intraduodenal inoculation of Adults Rabits for evaluating the immunogenicity of genetically attenuated Vibrio cholerae O1 strain. Lab An Sc. 1998;48:267-70.
12. Capó M, Borregón S, Gutiérrez MJ. Bioética animal: desarrollo de un concepto privado. Información Veterinaria. 1999;4.
13. Cedré B, García H, García L, Talavera A. Estandarización y evaluación del ensayo vibriocida modificado. Rev Cubana Med Trop. 1999;51:156-9.
14. Pérez J, Villaverde M, Costa F. Programa de Computación Cinética de Fermentaciones. Universidad de La Habana; 1992.
15. Delgado H, Moreira T, Luis L, García H, Martino K, Moreno A. Preservation of Vibrio cholerae by freeze-drying. Cryo-Letters. 1995;16:91-101.
16. Sack DA, Tacket CO, Cohen MB, Sack B, Losonsky GA, Shimko J, et al. Validation of a volunteer model of cholera with frozen bacteria as the challenge. Infect Immun. 1998;66(5):1968-72.
17. Davis DB, Dulbecco R, Eisen HN, Ginsberg HS. Growth and Death of Bacteria. In: Microbiology 4th ed. Lippincott-Raven Publishers; 1990. p. 51-63.
18. Iwanaga M, Yamamoto K. New medium for the production of cholera toxin by Vibrio cholerae 01 Biotype El Tor. J Clin Microbiol. 1985;22(3):405-8.
19. Jonson G, Holmgren J, Svennerholm AM. Analysis of expression of toxin-coregulated Pili in classical and El Tor Vibrio cholerae O1 in vitro and in vivo. Infect Immun. 1992;60(10):4278-84.
20. Guidelines for the production and control of inactivated oral cholera vaccines. WHO; 2004. Technical Report Series No. 924
21. Provenzano D, Kovac P, Wade WF. The ABCs (Antibody, B cells, and carbohydrate epitopes) of cholera immunity: considerations for an improved vaccine. Microbiol Immunol. 2006;50(12):899-927.
22. Vijayashree S, Kayak N, Panigrahi D, Sehgal S. Role of surface antigens of Vibrio cholerae O1 and non O1 serovars in intestinal adhesion. Indian J Pathol Microbiol. 2003;46:259-260.
23. Sperandio V, Giro JA, Silveira WD, Kaper JB. The OmpU outer membrane protein, a potential adherence factor of Vibrio cholerae. Infect Immun. 1995;63(11):4433-8.
24. Jacek O, Jonson G, Svennerholm AM, Holmgren J. Role of antibodies against biotype-specific Vibrio cholerae Pili in protection against experimental classical and El Tor cholera. Infect Immun. 1994;62:2901-7.
25. Attridge SR, Manning PA, Holmgren J, Jonson G. Relative significance of mannose sensitive hemagglutinin and toxin-nucleogulated pili in colonization of infant mice by Vibrio cholerae El Tor. Infect Immun. 1996;64:3369-73.
26. Dietrich G, Griot-Wenk M, Metcalfe IC, Lang AB, Viret JF. Experience with registered mucosal vaccines. Vaccine. 2003;21:678-83.
27. García L, Díaz M, García HM, Rodríguez BL, Fernández R, Año G, et al. The vaccine candidate Vibrio cholerae 638 is protective against cholera in healthy volunteers. Infect Immun. 2005;73(5):3018-24.
Recibido: 2 de enero de 2009.
Aprobado: 21 de abril de 2009.
Lic. Sonsire Fernández Castillo. Instituto Finlay. Centro de Investigación-Producción de Vacunas. Ave. 27 No. 19805, Lisa. CP 11600. AP 16017. Ciudad de La Habana, Cuba. Fax: (53-7) 208 6075; Teléf.: 271 6911. Correo electrónico: sfernandez@finlay.edu.cu














