Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.62 n.3 Ciudad de la Habana sep.-dic. 2010
ARTÍCULO ORIGINAL
Resistencia a insecticidas organofosforados en Aedes aegypti (Diptera: Culicidae) de Santiago de Cuba, 1997-2009
Resistance to organophosphorus insecticides found in Aedes aegypti (Diptera: Culicidae) from Santiago de Cuba, 1997-2009
María Magdalena RodríguezI; Juan A. BissetII; Yanelys RicardoIII; Omayda PérezIV; Domingo MontadaV; Daisy FigueredoVI; Ilario FuentesVII
I Doctora Ciencias Biológicas. Profesor Titular. Investigador Titular. Instituto de Medicina Tropical "Pedro Kourí". (IPK). Ciudad de La Habana, Cuba.
II Doctor en Ciencias de la Salud. Investigador Titular. IPK. Ciudad de La Habana, Cuba.
III Máster en Ciencias. Licenciada en Ciencias Biológicas. IPK. Ciudad de La Habana, Cuba.
IV Médico Veterinaria. IPK. Ciudad de La Habana, Cuba.
V Licenciado en Ciencias Biológicas. Investigador Auxiliar. IPK. Ciudad de La Habana, Cuba.
VI Especialista de I Grado en Higiene y Epidemiología. Santiago de Cuba, Cuba.
VII Licenciado en Educación Agrícola. IPK. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: la resistencia a insecticidas organofosforados en Santiago de Cuba fue diagnosticada en Aedes aegypti (Linnaeus, 1762) en 1997, y alguno de ellos se han continuado utilizando hasta la fecha, de ahí la necesidad de conocer cómo ha variado la resistencia desde entonces, hasta fechas más recientes, año 2009.
OBJETIVO: evaluar la resistencia a insecticidas organofosforados en larvas de Santiago de Cuba, colectadas en 2009 y su variación con respecto a 1997. Determinar la frecuencia en que aparece el mecanismo de resistencia, basado en la alta actividad de esterasas y su clasificación.
MÉTODOS: se evaluó la resistencia a los insecticidas organofosforados, malation, pirimifos metil, fenitrotion, fention, temefos y clorpirifos en larvas mediante la metodología recomendada por la Organización Mundial de la Salud. El mecanismo de esterasas se determinó a través de ensayos bioquímicos y electroforesis en gel de poliacrilamida.
RESULTADOS: las larvas de la cepa de Santiago de Cuba resultaron susceptibles a malation, pirimifos metil y fenitrotion y no hubo variación con los resultados obtenidos en una cepa de Santiago de Cuba de 1997, se observó moderada resistencia a fention y alta a temefos y clorpirifos. Al comparar estos resultados con los obtenidos en 1997, se observó un incremento de la resistencia a los tres insecticidas en el período 1997-2009. En la cepa de Santiago de Cuba de 2009 se demostró que las esterasas se encontraron con una alta actividad a una frecuencia de 0,7. Se observó la presencia de una esterasa tipo B amplificada, con un valor de movilidad relativa de 0,95 cm, la cual no se encontró en la cepa susceptible de referencia.
CONCLUSIONES: la resistencia a insecticidas y sus mecanismos es un fenómeno sumamente variable, aun en la misma especie sometida a distintas intensidades de aplicación de insecticidas, de ahí que su monitoreo constante de forma local y en el tiempo sea una necesidad para un programa de control de vectores.
Palabras clave: Aedes aegypti, organofosforados, esterasas.
ABSTRACT
INTRODUCTION: resistance to organophosphorus insecticides was diagnosed in Aedes aegypti (Linnaeus, 1762) from Santiago de Cuba in 1997 and some of them are still used up to date; hence the need of ascertaining how the insecticidal resistance has changed in recent times, particularly in 2009.
OBJECTIVE: to evaluate the resistance to organophosporus insecticides in larvae from Santiago de Cuba collected in 2009, and its variation in comparison with that observed in 1997; and to determine the frequency of occurrence of resistance mechanisms on the basis of high esterase activity and its classification.
METHODS: resistance to organophosphorus insecticides such as malathion, pirimiphos, methyl, phenitrotion, phention, temephos and clorpiriphos in larvae by using the WHO recommended methodology. The esterase mechanism was identified through biochemical assays and polyacrylamide gel electrophoresis.
RESULTS: larvae from the Santiago de Cuba strain were susceptible to malathion, pirimiphos, methyl and phenitrothion; there was no variation with the results achieved in a Santiago de Cuba strain in 1997, moderate resistance to phenthion and high resistance to temephos and chlorpiriphos were observed. When comparing these results with those of 1997, it was noted that resistance to the three insecticides increased in the 1997-2009 period. In the Santiago de Cuba strain 2009, it was shown that esterase activity was very high at a rate of 0,7. The presence of an amplified type B esterase with relative mobility of 0.95 cm was detected, which did not exist in the reference strain.
CONCLUSIONS: resistance to insecticides and its mechanisms are highly variable, even in the same species subjected to various intensities in the insecticidal use, therefore, it is necessary to constantly monitor both aspects at local level in the course of time, with a view to an effective vector control program.
Key words: Aedes aegypti, organophosphorus compounds, esterases.
INTRODUCCIÓN
El dengue es considerada la enfermedad viral más importante, que causa entre 50 y 100 millones de casos y miles de muertes anualmente.1 Hoy día el único método para prevenir la transmisión del virus que causa esta enfermedad es a través del control de su principal vector, el mosquito Aedes aegypti (L.).
En octubre de 1981, al finalizar la epidemia de dengue, en Cuba se implementó la campaña de erradicación de Ae. aegypti. Desde el comienzo de la campaña hasta la fecha, la política de uso de insecticidas ha sido la aplicación del organofosforado temefos como principal larvicida en formulación granulada (abate 1 ppm), fention en tratamientos perifocales y el organofosforado malation, que fue el principal adulticida utilizado hasta 1986, cuando cambió la estrategia de la campaña hacia la utilización de piretroides. Los insecticidas organofosforados más utilizados después de 1986 como adulticida en Cuba han sido pirimifos metil, utilizado en algunas áreas de provincia Habana en las décadas de los ochenta y noventa, fention que se utilizó en 1997, 2001 y 2006 en Santiago de Cuba y clorpirifos que se utilizó principalmente durante la epidemia ocurrida en Ciudad Habana (2001-2002) y en Santiago de Cuba en 2006. La mayoría de los programas de control de mosquitos en el mundo están utilizando actualmente piretroides como adulticida, debido a su rápido modo de acción y baja toxicidad a los mamíferos, en rociado espacial o a través de la impregnación de cortinas, mosquiteros y tapas de tanques.2 Sin embargo, la resistencia a organofosforados y piretroides en Ae. aegypti se ha diseminado en varios países,3 lo que representa un obstáculo para los programas de control de dengue.
En 1997 ocurrió un brote de dengue en el municipio de Santiago de Cuba, el cual se logró controlar exitosamente, pero a pesar del esfuerzo que se realiza en esta provincia para el control de Ae. aegypti, persisten infestaciones residuales del vector que ocasionan algunos brotes locales de dengue, como fue en 2006. Se evaluaron los niveles de resistencia a insecticidas organofosforados y se analizó la variación con respecto a 1997. Además, se investigó la asociación del mecanismo de esterasas con la resistencia a insecticidas organofosforados en la cepa colectada en 2009.
MÉTODOS
Cepas
Rockefeller: una cepa de referencia de Ae. aegypti susceptible a insecticidas, suministrada por el CDC, San Juan, Puerto Rico.
Santiago de Cuba 2009: una cepa de Ae. aegypti, colectada en el municipio Santiago de Cuba en una de las áreas de mayor infestación del vector en 2009.
Santiago de Cuba 1997: una cepa de Ae. aegypti, colectada del municipio de Santiago de Cuba, en una de las áreas de mayor infestación del vector en 1997.
Santem F14: una cepa de referencia de Ae. aegypti resistente a temefos, colectada en Santiago de Cuba en 1997 y mantenida bajo presión de selección con este insecticida por 14 generaciones.
Insecticidas
Organofosforados: malation (97 %; American Cyanamid Co.), pirimifos metil (97,8 %; Syngenta SA, Switzerland, fenitrotion (97 %; Sumitomo Chemical Company, Japan), fention (99,1 %; Mobay, Kansas City, KS), temefos (93,3 %; BASF, Alemania) y clorpirifos (Chemotécnica SA, Argentina).
Bioensayos en larvas
Las larvas de Ae. aegypti en tercer estadio tardío o cuarto estadio temprano, se evaluaron a través de los bioensayos de susceptibilidad de la Organización Mundial de la Salud (OMS),4 para determinar la concentración que causó 50 y 90 % de mortalidad de la población (CL50-CL90) con cada insecticida. Se preparó una solución madre al 1 % para cada insecticida en un volumen final de 100 mL con acetona, se aplicaron 5 concentraciones o más de cada uno (preparadas a partir de la solución madre) y se realizaron cinco réplicas por cada concentración, las cuales causaron mortalidades entre 2 y 98 %. Se utilizó un control por cada replica que consistió en 1 mL del solvente (acetona). La mortalidad se determinó 24 h después del tratamiento con los insecticidas y los resultados se analizaron mediante el programa Probit-logaritmo.5 Se calculó el FR50 y FR90 (factor de resistencia), comparando los valores de las cepas de campo de Santiago de Cuba con la cepa Rockefeller.
FR50= CL50 insecticida a evaluar/CL50 de la cepa Rockefeller
Ensayos bioquímicos: se determinó la actividad de esterasas en larvas de tercer estadio tardío o cuarto temprano, de acuerdo con el método estandarizado para Ae. aegypti.6 Se homogeneizó cada larva en 200 mmL de tampón fosfato 0,01 M, pH 7,5. En una placa de microtitulación de ELISA, a 20 mmL del homogenato se le añadió 200 mmL del sustrato (0,7-mM de b-naftil acetato). Se dejó transcurrir la reacción por 10 min y se añadieron 40 mmL de fast blue (previamente disuelto en 3 mL de agua destilada y 7 mL de duodecil sulfato de sodio 5 %). Se leyó la densidad óptica (DO) a 570 nm en lector de placas de ELISA, Versamax. La actividad enzimática se expresó como densidad óptica y se consideró como valor alto, en cada larva individual, cuando la media de la DO fue mayor que 1,2. Se calculó así el porcentaje (%) de larvas que mostró incrementada la actividad de esterasas en cada población.
Electroforesis en gel de poliacrilamida (10 %): en tubos Eppendorf (1,5 mL), se adicionaron 10 µL de muestra más 10 µL del indicador xilene cianol (0,02 % en sacarosa a 15 %). Se aplicaron 20 µL de esta mezcla en el gel y se realizó la corrida a 150 V, durante 45 min. Para la tinción de las bandas de esterasas, se sumergieron los geles en 50 mL de tampón fosfato (0,1 M) que contenían 4 mL de cada uno de los sustratos inespecíficos de las esterasas (a y b-naftilacetato). Después se añadieron 0,5 g del colorante fast garnet, disuelto previamente en buffer fosfato 0,01 M, pH 7,5. Para fijar la coloración de las bandas se sumergió el gel en una solución de ácido acético 10 %.
RESULTADOS
En la tabla 1 se muestran los valores de concentración que causaron 50 % (CL50) y 90 % (CL90) de mortalidad, con todos los insecticidas evaluados, en la cepa susceptible a insecticidas, utilizada como cepa de referencia.
Se compararon los valores obtenidos de CL50 en la cepa de Santiago de Cuba con la cepa Rockefeller para los insecticidas organofosforados, lo cual se expresó como factor de resistencia (FR50). Se pudo observar (tabla 2), que la cepa de estudio mostró susceptibilidad a malation, pirimifos metil y fenitrotion (FR50< 5x), con valores de 1,81x, 1x y 0,94x, respectivamente. Moderada resistencia se observó a fention (6,36x) (FR50 entre 5 y 10x), y alta resistencia (FR50 >10x) a temefos (26,94x) y clorpirifos (23,63x). Los altos valores de pendientes de la recta de regresión probit-log indicaron que esta cepa resultó ser homogénea con respecto a los valores obtenidos para la resistencia.
Al comparar lo valores de la resistencia a insecticidas organofosforados obtenidos en la cepa de estudio, colectada en el pasado año 2009, con los resultados obtenidos en una cepa del mismo lugar, pero colectada 13 años antes, en 1997, se pudo observar (Fig. 1) un incremento de la resistencia, expresada como FR50, para temefos, clorpirifos y fention. Para temefos se observó un incremento de 4,52 veces, desde un valor moderado de resistencia (FR50= 5,96x) en 1997 a alta resistencia (FR50= 26,94x) en 2009, para clorpirifos y fention no existió resistencia en 1997 con valores de FR50 de 0,11x y 0,25x, respectivamente. Para 2009 se incrementó 147,09 veces para clorpirifos hasta un valor alto de resistencia (FR50 =16,18x) y a moderada para fention (FR50= 6,36x) en el 2009, con un incremento de 25,94 veces.
A través de ensayos bioquímicos se pudo determinar que la actividad esterasas (DO 570 nm> 1,2) se encontró incrementada en 70 % de las larvas de la cepa de Santiago de Cuba 2009 y solo 30 % de las larvas colectadas en 1997, con respecto a la cepa Rockefeller (Fig. 2).
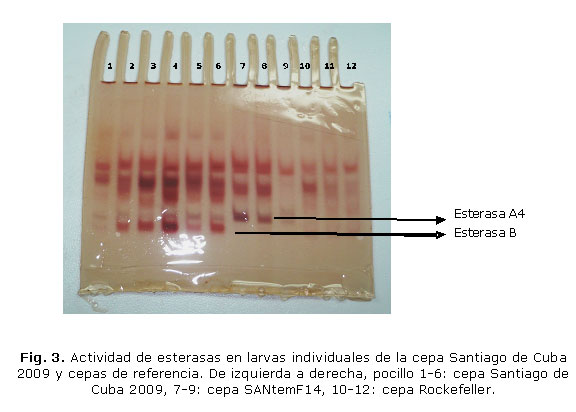
Los resultados, utilizando gel de poliacrilamida revelaron la presencia de una esterasa que se clasificó como tipo B, por su coloración rojiza que indica mayor afinidad por el sustrato b naftil acetato, esta última con una Rf (movilidad relativa) de 0,95 cm (Fig. 3.).
DISCUSIÓN
El incremento de la resistencia a los insecticidas organofosforados entre 1997 y 2009 está asociado con el uso de estos en Santiago de Cuba. Se obtuvo incremento a fention, temefos y clorpirifos, insecticidas que se han continuado utilizando de forma puntual, cuando ha sido necesario en esta provincia, sin embargo no hubo incremento a los insecticidas pirimifos metil, malation ni fenitrotion, los 2 últimos insecticidas no han sido utilizados por salud pública en Cuba en los últimos 24 años, pirimifos metil sí se utilizó en la década de los ochenta y noventa, alternado con cipermetrina en algunas localidades de provincia Habana. Los insecticidas organofosforados han sido utilizados por la campaña nacional para el control de Ae. aegypti desde 1981, entre ellos el temefos en tratamiento focal, fention en tratamiento adulticida perifocal y malation en tratamiento adulticida intradomiciliario y extradomiciliario. Con el uso de malation se logró erradicar el mosquito Ae. aegypti entre 1981 y 1986, pero se incrementaron las densidades de otras especis de mosquitos, que ocuparon los sitios de cría de Ae. aegypti y ocurrió un reemplazo interespecífico.7 Por el efecto adverso que causaba a la comunidad el uso de malation, así como la resistencia detectada en Cx. quinquefasciatus a este insecticida,7 este se sustituyó en 1986 por piretroides.
En Santiago de Cuba, con la ocurrencia del brote de dengue en 1997, se utilizaron los organofosforados temefos y fention y el piretroide cipermetrina; en el período 2001-2002 Santiago de Cuba no tuvo epidemia, no obstante se aplicó un intensivo con temefos y fention y el piretroide lambdacialotrina, en 2006 se aplicó de nuevo temefos, fention, clorpirifos y cipermetrina. Como se puede observar, los resultados obtenidos con respecto a la resistencia a insecticidas organofoforados en la cepa de Santiago de Cuba 2009, así como su incremento con respecto a 1997, se relaciona bien con los insecticidas que se han utilizado en los últimos 13 años en Santiago de Cuba, temefos, clorpirifos y fention.
Hay países como la India, que a pesar del uso intensivo de insecticidas, tanto Ae. aegypti como Aedes albopictus mostraron completa susceptibilidad a los organofosforados más utilizados por el Programa de Control de enfermedades trasmitidas por vectores, como fueron el temefos, fention, malation y fenitrotion.8,9 Se ha demostrado una tendencia al incremento de la resistencia a temefos en países como Brasil10 y en Tailandia,11 que indica la necesidad de aplicarse otros métodos de control alternativos, para poder preservar la efectividad de este larvicida. Sin embargo, otros trabajos han demostrado que Ae. aegypti es aún susceptible a fenitrotion en Brasil.12 Existen trabajos que demuestran que Aedes aegypti muestra aún susceptibilidad a malation, como ha sido en la India9 y en Tailandia.13
Por medio de ensayos bioquímicos se demostró que la actividad de esterasas estuvo incrementada en 70 % de la población de Santiago de Cuba 2009 con respecto a la cepa susceptible de referencia y mediante electroforesis en gel de poliacrilamida se observó una banda de esterasa tipo B engrosada, clasificada de esta manera por su afinidad por el b naftil acetato y con un valor de movilidad relativa de 0,95 cm, que no se observó así en la cepa Rockefeller. Durante el brote de dengue ocurrido en el municipio Santiago de Cuba en 1997, se identificó una banda de esterasa, clasificada como esterasa A4,14 incrementada con respecto a la cepa susceptible Rockefeller, la cual se ha encontrado no solo en Santiago de Cuba, sino también en Ciudad de La Habana durante la epidemia 2001-2002, 15,16 y en otros países de América Latina.3 La esterasa tipo B, detectada en este trabajo en Santiago de Cuba, al parecer se ha seleccionado en la cepa de campo estudiada, con el tiempo, en la medida en que se ha ido ejerciendo presión de selección con organofosforados, especialmente temefos; porque este mismo fenómeno no se ha observado en la cepa de referencia resistente a temefos, la cual hoy día, después de más de 14 generaciones de selección con este organofosforado no tiene la presencia de esta esterasa tipo B incrementada, solo presenta la esterasa A4 que apareció incrementada a las 6 primeras generaciones de selección en la cepa de Santiago de Cuba, colectada en Santiago de Cuba en 1997.17 Este mecanismo de resistencia ha sido asociado con la resistencia a temefos en Ae. aegypti de Venezuela,18 Tailandia,19 Brasil,20 Malasia,21 Cuba14-17 y otros países de América latina.3
Los resultados de este trabajo demostraron cómo la resistencia a insecticidas y sus mecanismos es un fenómeno sumamente variable, en el tiempo y en el espacio y aun en la misma especie de mosquito, sometida a distintas intensidades de aplicación de insecticidas; de ahí que su monitoreo constante de forma local y en el tiempo sea una necesidad para un programa de control de vectores.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud. Report of the Scientific Working Group on Dengue. Document WHO/TDR/SWG/08. Geneva: WHO; 2006.
2. Kroeger A, Lenhart A, Ochoa M, Villegas E, Levy M, Alexandrer N, et al. Effective control of dengue vectors with curtains and water container covers treated with insecticide in Mexico and Venezuela: cluster randomized trials. BMJ. 2006;332:1247-52.
3. Rodríguez MM, Bisset JA, Fernández D. Levels of insecticide resistance and resistance mechanisms in Aedes aegypti (Diptera: Culicidae) from some Latin-American countries. J Am Mosq Control Assoc. 2007;24(3):420-9.
4. Organización Mundial de la Salud. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. WHO/VBC/81.80. 1981b. Geneva: WHO; 1981. p. 6.
5. Raymond M. Present d' un programme d' analyse log-probit pour microordinateur Cahiers Orstrom. Sér Ent Med Parasitol. 1985;23:117-21.
6. Rodríguez MM, Bisset JA, Molina DF, Lauzan L, Soca A. Detection of resistance mechanisms in Aedes aegypti from Cuba and Venezuela. J Med Entomol. 2001;38:623-8.
7. Bisset JA, Navarro A, Marquetti MC, Mendizabal ME, González BM. La abundancia larval de mosquito urbano durante la campaña de erradicación de Aedes aegypti y del dengue en Cuba. Rev Cubana Med Trop. 1985;37:161-8.
8. Mukhopadhyay AK, Patnaik SK, Satya Babu P. Susceptibility status of some culicine mosquitoes to insecticides in Rajahmundry town of Andhra Pradesh, India. J Vect Borne Dis. 2006;43:39-41.
9. Tikar SN, Mendki MJ, Chandel K, Parashar BD, Prakash. Susceptibility of immature stages of Aedes (S) aegypti: vector of dengue and chikungunya to insecticides from India. Parasitol Res. 2008;102(5):907-113.
10. Lima EP, De Oliveira Filho AM, de Oliveira Lima JW, Ramos Júnior AN, de Góes Cavalcanti LP, Pontes RJ. Aedes aegypti resistance to temephos of Ceará State. Rev Soc Bras Med Trop. 2006;39:259-63.
11. Jirakanjanakit N, Saentharatip S, Rongnoparut P, Duchon S, Bellec C, Yoksan S. Trend of temephos resistance in Aedes (Stegomya) mosquitoes in Tailand during 2003-2005. Environ Entomol. 2007;36:506-11.
12. Sunaiyana S, Pungasem P, Kasin S. Detection of insecticide resistance status in Culex quinquefasciatus and Aedes aegypti to major groups of insecticides. Trop Biomed. 2006;23:97-101.
13. Ponlawat A, Scott JG, Harrington LC. Insecticide susceptibility of Aedes aegypti and Aedes albopictus across Thailand. J Med Entomol. 2005;42:821-5.
14. Rodríguez MM, Bisset JA, Mila L, Calvo E, Díaz C, Soca LA. Niveles de Resistencia a insecticidas y sus mecanismos en una cepa de Aedes aegypti de Santiago de Cuba. Rev Cubana Med Trop. 1999;51:93-8.
15. Rodríguez MM, Bisset JA, Fernández D, Pérez O. Resistencia a insecticidas en larvas y adultos de Aedes aegypti: prevalencia de la esterasa A4 asociada con la resistencia a temefos. Rev Cubana Med Trop. 2004;56(1):54-60.
16. Bisset JA, Rodríguez MM, Fernández D, Pérez O. Estado de la resistencia a insecticidas y mecanismos de resistencia en larvas del Municipio Playa, colectadas durante la etapa intensiva contra el Aedes aegypti en Ciudad de La Habana, 2001-2002. Rev Cubana Med Trop. 2004;56:61-6.
17. Rodriguez MM, Bisset JA, Soca A. Cross-resistance to pyrethroid and organophosphorus insecticides induced by selection with temephos in Aedes aegypti (Diptera: Culicidae) from Cuba. J Med Entomol. 2002;39(6):882-8.
18. Mazarri MB, Georghiou GP. Characterization of resistance to orgaphosphate, carbamate and pyrethroid insecticides in field populations of Aedes aegypti from Venezuela. J Am Mosq Control Assoc. 1995;11:315-22.
19. Saelim V, Brogdon WG, Rojanapremsuk J, Suvannadaba S, Pandii W, Jones JW, et al. Bottle and biochemical assays on temephos resistance in Aedes aegypti in Thailand. Southeast Asian J Trop Med Public Health. 2005;36:417-25.
20. Montella IR, Martins AJ, Viana-Medeiros PF, Lima JB, Braga IA, Valle D. Insecticide resistance mechanism of Brazilian Aedes aegypti populations from 2001 to 2004. Am J Trop Med Hyg. 2007;77(3):467-77.
21. Dhang Ch, Ahmad NW, Lim LH, Benjamin S, Sofian-Azirun M. Biochemical Detection of Temephos Resistance in Aedes (Stegomyia) aegypti (Linnaeus) from Dengue-endemic areas of Selangor State, Malaysia. Parasitol. 2008;3:6-20.
Recibido: 11 de enero de 2010.
Aprobado: 26 de mayo de 2010.
Prof. Juan A. Bisset. Instituto de Medicina Tropical "Pedro Kourí". Departamento Control de Vectores. Autopista Novia del Mediodía Km 6 ½. Lisa. AP 601Ciudad de La Habana, Cuba. Correo electrónico: bisset@ipk.sld.cu