Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.63 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULO DE REVISIÓN
Una actualización acerca de histoplasmosis
Histoplasmosis updating
Dr. C. Carlos M. Fernández Andreu, Dra. María T. Illnait Zaragozí, Dr. Gerardo Martínez Machín, MSc. Mayda R. Perurena Lancha, Lic. Ernesto Monroy Vaca
Laboratorio de Micología, Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
La histoplasmosis infección causada por el hongo Histoplasma capsulatum ha sido reportada en todos los continentes y se considera endémica en el continente americano, incluida Cuba. El hongo se desarrolla en el suelo con excretas de aves y murciélagos, donde es capaz de producir abundantes microconidios, que al ser inhalados por el hombre son capaces de causar la infección. El cuadro clínico puede variar, desde infecciones asintomáticas hasta cuadros diseminados graves que involucran a uno o varios órganos y sistemas y que afectan sobre todo a pacientes con sida, neoplasias hematológicas, con trasplantes u otras inmunodeficiencias. Los principales grupos de riesgo incluyen además, aquellos individuos que por razones ocupacionales se expongan los aerosoles contaminados con el hongo. El diagnóstico de laboratorio se basa en la observación de este en fluidos y tejidos orgánicos, en el cultivo de esos materiales y en la detección de anticuerpos y antígenos específicos. Los métodos moleculares, en especial mediante la reacción en cadena de la polimerasa, aunque no han sido suficientemente evaluados, pudieran representar un importante avance en el diagnóstico temprano de esta micosis. Para el tratamiento de las formas agudas moderadas, localizadas y respiratoria crónica se recomienda el itraconazol, mientras que para las formas graves y diseminadas la droga de elección es la anfotericina B, con preferencia en alguna de sus formulaciones lipídicas. La histoplasmosis representa hoy una de las micosis sistémicas más importante en las Américas, con una amplia distribución en todas las regiones de Cuba.
Palabras clave: histoplasmosis, Histoplasma capsulatum, micosis, Cuba.
ABSTRACT
Histoplasmosis, an infection caused by the fungus Histoplasma capsulatum, has been reported all over the world and is considered endemic in the American continent, including Cuba. This fungus grows on the soils contaminated with bird and bat excreta, where it produces a great number of microconidia that could cause the infection when they are inhaled. The clinical spectrum varies from asymptomatic infections to serious disseminated diseases involving one or many organ systems and affects mainly AIDS patients, patients with hematological neoplasias, transplant recipients or other immunosuppressed patients. The main risk groups include those individuals whose working activities make them be exposed to aerosols contaminated with H. capsulatum. Lab diagnosis is based on the microscopic observation, isolation and identification of the fungus in fluid or tissue samples of patients, and on specific antigen and antibodies detection. The molecular methods based on polymerase chain reaction have not been sufficiently defined, and they could be an important advance in the early diagnosis of this mycosis. Itraconazole is recommended for treatment of moderate, localized and chronic infection whereas amphotericin B is the drug of choice for disseminated and serious manifestations, particularly in its lipidic formulations. At present, histoplasmosis is considered one of the most important systemic mycoses in the Americas, and it is widely spread over all regions of Cuba.
Key words: histoplasmosis, Histoplasma capsulatum, mycosis, Cuba.
INTRODUCCIÓN
Aunque se ha sugerido la existencia de la histoplasmosis desde la antigüedad, sobre la base de descripciones de su patogenia, se puede afirmar de manera más objetiva, que la historia de esta micosis comienza en 1906 con los importantes hallazgos realizados por Darling a partir de la necropsia de un hombre de 27 años, que trabajaba en las obras de construcción del canal de Panamá; describió al microorganismo observado como «un parásito de forma ovoide a redonda, rodeado de un halo que no se colorea, con un grosor de aproximadamente 1/6 del diámetro del parásito». Debido al parecido con Leishmania, pensó que se trataba de un protozoo y que el halo era una cápsula, por lo que lo denominó Histoplasma capsulatum.1 Ni era un protozoo, ni había en realidad tal cápsula, pero el nombre ha perdurado hasta hoy.
Los primeros casos descritos hicieron pensar que se trataba de una enfermedad parasitaria rara, mortal y propia de países tropicales; varias décadas más tarde se pudo precisar que en realidad la histoplasmosis era una infección frecuente en algunas regiones geográficas, tanto de clima tropical como templado, que la mayoría de las veces cursaba de forma benigna o asintomática y su agente causal no era un protozoo encapsulado, sino un hongo dimórfico.2
En la actualidad esta micosis ha adquirido una mayor relevancia desde el punto de vista social por varias razones: a) está considerada una enfermedad endémica en amplias áreas del continente americano;2,3 b) se reconoce como una infección oportunista marcadora de sida, por lo que su importancia clínica y epidemiológica se ha ido extendiendo en la medida en que ha avanzado esa pandemia viral;4-7 c) se ha relacionado con diferentes actividades laborales por lo que también está registrada en muchos países como una enfermedad ocupacional;8-10 d) el número de casos se ha incrementado en todos los continentes, incluida Europa, donde en los últimos años la enfermedad ha estado muy relacionada con el turismo y las migraciones11-13 y e) la histoplasmosis ha sido reportada en una gran cantidad de especies de animales en todos los continentes.14-16
El objetivo de la presente revisión es facilitar una actualización sobre los principales aspectos relacionados con su agente etiológico, epidemiología y manifestaciones clínicas más frecuentes, así como los métodos de más utilizados para su diagnóstico de laboratorio.
AGENTE ETIOLÓGICO
De las 3 variedades que integran la especie, solo H. capsulatum var. capsulatum ha sido encontrado en el continente americano, y es por ello que en muchas ocasiones se suele denominar como histoplasmosis americana a la infección causada por esta variedad, aunque en la actualidad se prefiere denominarla simplemente histoplasmosis.17 Las otras variedades son: H. capsulatum var. duboisii, agente etiológico de la llamada histoplasmosis africana e H. capsulatum var. farciminosum, causante de la linfangitis epizoótica de los equinos.
Su estado teleomorfo fue descrito por primera vez en 1972, como un ascomiceto filamentoso, denominado Emmonsiella capsulata.18 Más tarde se reubicó en el género Ajellomyces, el cual agrupa 3 especies: A. dermatitidis, A. crescens y A. capsulatus, cuyos estados anamorfos o mitospóricos pertenecen a 3 géneros distintos: Blastomyces dermatitidis, Emmonsia crescens e Histoplasma capsulatum, respectivamente.19 Desde el punto de vista taxonómico se ubica en el reino Eumycota, división Ascomycota, clase Euascomycetes, orden Onygenales y familia Onygenaceae.20 Es un hongo heterotálico, cuyos tipos de apareamiento compatibles (+) y (-) pueden encontrarse en el suelo en la misma frecuencia, aunque 90 % de los aislamientos clínicos corresponden al tipo (-). En los cultivos se pueden observar cleistotecios de 100 a 150 µm de diámetro, con hifas peridiales laxas y ascas globulosas con 8 ascosporas elípticas, de 1,5 µm de diámetro y una pared celular lisa.21
Histoplasma capsulatum var. capsulatum es un hongo térmicamente dimórfico al que se le suele denominar por razones de brevedad, H. capsulatum. A temperaturas inferiores a 35 °C crece como un hongo filamentoso, que forman 2 tipos de colonias: el tipo A (albino o blanco) y el tipo B (brown o pardo). Las primeras se caracterizan por desarrollar un micelio blanco, algodonoso, con abundantes hifas aéreas anchas; produce macroconidios y microconidios. Las colonias del tipo B presentan un micelio escaso, aplanado, de color canela a pardo oscuro con hifas pigmentadas estrechas; por lo general entre los 10 y 14 d, la colonia se cubre de numerosos macroconidios tuberculados, con proyecciones espiculadas en la superficie y muy pocas hifas; los microconidios son escasos y se difunde un pigmento marrón oscuro en el medio de cultivo. Al microscopio los microconidios se presentan sésiles (o en hifas cortas no diferenciadas), lisos, esféricos, piriformes o en forma de clava, sin septos, de pared fina, que pueden medir 1-4 x 2-6 µm. Los macroconidios se observan en conidióforos cortos, son en general esféricos (8-14 µm de diámetro), de paredes gruesas, sin septos, de aspecto tuberculado, bien apreciables al microscopio óptico.20,22 A menudo los primo-aislamientos son del tipo B, en particular cuando se aíslan del suelo; al envejecer pueden llegar a cubrirse de un micelio blanco y transformarse en el tipo A, de manera irreversible.21
En los tejidos del hospedero y en medios de cultivo enriquecidos, a 37 °C, se observan células levaduriformes esféricas u ovaladas, de 2-3 x 3-4 µm, de paredes finas que se reproducen por gemación polar con una base estrecha. In vitro se desarrollan colonias cremosas de color grisáceo a beige.21
La pared celular de H. capsulatum está formada principalmente por a-1,3 glucano, b-1,3 glucano y quitina. En comparación con otros hongos patógenos dimórficos, el contenido de quitina es superior en este hongo. Sin embargo, existen diferencias en la composición de glucanos en las 2 fases: a-1,3 glucano es el componente principal de la fase levaduriforme, mientras que en la micelial es superior el contenido de b-1,3 glucano.23 La presencia de altos niveles de a-1,3 glucano se ha asociado con la virulencia de la cepa.21 Otro componente importante, aunque se encuentra en menor cantidad, es un galactomanano situado en la capa más externa de la pared celular, el cual se considera el principal polisacárido antigénico de H. capsulatum; otros galactomananos son responsables de las reacciones cruzadas en las pruebas serológicas con Blastomyces dermatitidis y Paracoccidioides brasiliensis.23
En el medio ambiente H. capsulatum se encuentra en suelos con alto contenido de nitrógeno y fosfatos, asociados por lo general a la acumulación de excretas de aves y de murciélagos. Puede crecer en rangos de pH entre 5 y 10 y requiere oxígeno para sobrevivir y desarrollar su fase filamentosa.21,22 Estos suelos se localizan con preferencia en regiones tropicales y subtropicales con una temperatura media anual de 22 a 29 ºC, una humedad relativa de 60-80 % y un promedio de precipitación anual de aproximadamente 1 000 mm; aunque también el hongo se ha encontrado en áreas geográficas con condiciones climáticas muy diversas.21,22,24,25 Las cuevas, con condiciones más o menos estables de temperatura y humedad, sin la incidencia directa de las radiaciones solares y con acumulación de excretas de murciélagos (y de aves en algunas ocasiones), representan un nicho ecológico muy satisfactorio para el desarrollo de H. capsulatum.
Su contenido de guanina-citosina está entre 45,4 y 49,8 %, tanto en la fase filamentosa como en la levaduriforme.26 Los estudios encaminados a la caracterización, tanto fenotípica como genotípica, de diferentes aislamientos de H. capsulatum han evidenciado una gran variabilidad genética en esta especie; entre estos métodos se pueden mencionar la caracterización de isoenzimas, electroforesis en gel de campo pulsado, el polimorfismo de la longitud de los fragmentos de restricción (RFLP, siglas en inglés), el polimorfismo del ADN amplificado al azar (RAPD, siglas en inglés) y la secuenciación de ADN.27,28
Sin embargo, en trabajos más recientes, que combinan datos de las secuencias de genes que codifican para 4 proteínas independientes, Kasuga y otros encontraron novedosas e interesantes relaciones filogenéticas al estudiar 137 aislamientos pertenecientes a las 3 variedades de H. capsulatum, procedentes de 6 regiones geográficas diferentes. Así, se pudieron identificar 8 clades, que representan genéticamente grupos aislados que pueden ser reconocidos como especies filogenéticas: i) América del Norte clase I, ii) América del Norte clase II, iii) América Latina grupo A, iv) América Latina grupo B, v) Australia, vi) Holanda (en realidad eran aislados procedentes de Indonesia), vii) Eurasia, y viii) África. H. capsulatum var. capsulatum fue encontrado en los 8 clades; el clade africano incluyó a todos los aislamientos de H. capsulatum var. duboisii, así como individuos de las otras 2 variedades, mientras que todos los individuos de la var. farciminosum quedaron distribuidos en 3 especies filogenéticas. Estos resultados sugieren la necesidad de realizar nuevas reconsideraciones en relación con la validez taxonómica de las 3 variedades reconocidas de esta especie.29 Algunos autores han planteado que esta gran diversidad fenotípica y genotípica apoya la idea de que H. capsulatum es en realidad una especie críptica o un "complejo de especies" y que cada clade sería una especie integrada por cepas con diferencias biológicas.26-28
PATOGENIA
La infección por H. capsulatum es el resultado de la inhalación de microconidios y fragmentos cortos de hifas, los cuales, una vez en el interior del hospedero, pasan a la fase levaduriforme que es la responsable de la patogenia de este hongo. Los microconidios, por su pequeño tamaño e hidrofobicidad son fácilmente dispersados por vía aérea y pueden alcanzar el aparato respiratorio del hospedero humano o animal, por lo que esta característica se convierte en un importante atributo de patogenicidad de la especie. De ahí que el morfotipo filamentoso se considere la forma infectante, mientras que la fase levaduriforme se considere el morfotipo patogénico.30,31 La cuantía crítica del inóculo no ha podido ser precisada y depende en gran medida del estado inmunitario del hospedero.2,31
Aunque todavía se desconocen muchos de los mecanismos relacionados con la patogenia de este hongo, sus principales determinantes de patogenicidad y sus efectos potenciales se muestran en la tabla 1.30-32 Además, se ha señalado, al igual que en otros hongos patógenos, la producción de pigmentos tipo melanina como factor de virulencia en H. capsulatum.33
Tabla 1. Principales determinantes de patogenicidad conocidos de H. capsulatum
y sus efectos demostrados o potenciales, según Woods (2003)
| Determinante de patogenicidad | Efectos potenciales |
| Formación de microconidios | Diseminación a través de aerosoles |
| Dimorfismo térmico | Transformación del morfotipo infectante (filamentoso) |
| Supervivencia en el | Parasitismo intracelular de macrófagos |
| Parasitismo intracelular | Enfermedad pulmonar y diseminada |
| Habilidad de causar | Potencialidad de reactivación de la enfermedad |
| Modulación del pH en | Protección contra las enzimas degradativas |
| Producción de catalasas | Protección contra oxígeno reactivo |
| Producción de sideróforos | Adquisición de hierro en microambiente |
| Producción de proteínas | Adquisición de calcio en microambiente |
| Gen URA5 | Biosíntesis de pirimidina y ácidos nucleicos |
| Fenotipo rugoso | Incremento de la virulencia en algunas cepas |
Una vez que H. capsulatum ha alcanzado el interior del hospedero, la capacidad de adaptarse a sus condiciones se convierte en su principal atributo patogénico. El proceso de transformación a levadura tiene lugar en el sitio inicial de la infección en los pulmones. La temperatura es un factor determinante en esta transición, aunque también se han identificado otros factores como la presencia de cisteína y monofosfato de adenosina cíclico (AMPc). Ya en el interior del organismo, el hongo es fagocitado por los macrófagos y es capaz de sobrevivir en el medio intracelular gracias a diversos mecanismos que le permiten, en primer lugar, modular el pH y resistir el efecto de los radicales tóxicos de oxígeno y el efecto degradativo de diferentes enzimas.30-32
H. capsulatum es un parásito intracelular facultativo; aunque puede encontrarse en el medio extracelular, se ubica preferentemente dentro de los fagocitos mononucleares (macrófagos y monocitos). El mecanismo principal de entrada al macrófago es por fagocitosis mediada por opsoninas (inmunoglobulinas y componentes del complemento); también puede alcanzar el interior de los neutrófilos, lo que es importante en la infección temprana. Se ha podido comprobar que este hongo puede internalizarse en otros fagocitos no profesionales, como las células epiteliales, las cuales actuarían como reservorios alternativos para infecciones persistentes.30-32
De manera general, la inmunidad protectora en la histoplasmosis es compleja y se basa en la interacción coordinada entre ciertos componentes celulares (máxime macrófagos, aunque también las células natural killer (NK) y los leucocitos polimorfonucleares) y la liberación de citoquinas (fundamentalmente IFN-g, TNF-a e IL-12).34,35 El principal mecanismo inmune responsable de la protección se considera que es la respuesta mediada por células, mientras que la respuesta humoral en apariencia no tiene un efecto directo en la inmunidad.35
La resolución de la infección está condicionada por el desarrollo de una respuesta de linfocitos T específicos en alrededor de 2 semanas y que desempeña un papel fundamental en los mecanismos de defensa contra este agente. Los linfocitos T auxiliares activan los macrófagos, aumentando sus capacidades fungicidas y estimulando la formación de granulomas. Por otra parte, las células NK son capaces de eliminar el hongo extracelularmente y la presencia de anticuerpos anti-H. capsulatum incrementa la capacidad fungicida de estas células.21,34
En pacientes con alteraciones de la respuesta inmune celular, la infección por H. capsulatum no suele ser controlada y hay tendencia a la diseminación progresiva. La infección se extiende a varios órganos, que incluye principalmente médula ósea, hígado, bazo y glándulas suprarrenales.2,21,36
MANIFESTACIONES CLÍNICAS
La mayoría de las infecciones por H. capsulatum evolucionan de forma asintomática (90-95 %) y se detectan por la respuesta intradérmica a la prueba de histoplasmina y, en algunos casos, por la presencia de focos pulmonares de calcificación en la imagen radiológica.2,21 Sin embargo, entre 5 y 10 % de los infectados presentan síntomas muy variables que dependen en gran medida del número de conidios inhalados y del estado inmunitario del hospedero. Las manifestaciones clínicas más frecuentes son la histoplasmosis pulmonar aguda, la forma pulmonar crónica y la histoplasmosis progresiva diseminada. Independientemente de esta clasificación general, existen otras formas menos frecuentes como la histoplasmosis cutánea primaria, el histoplasmoma, además de otras que se pueden considerar atípicas o poco frecuentes.37-39
Histoplasmosis pulmonar aguda
En su forma benigna es indistinguible de un resfriado común. Los síntomas más frecuentes son inespecíficos: fiebre, malestar general, cefalea, mialgia, anorexia, tos no productiva y dolor torácico. El comienzo es súbito; hay engrosamiento hiliar y del mediastino. Se puede presentar eritema nudoso y multiforme. La radiografía de tórax consigue mostrar la presencia de infiltrado local con linfadenopatía hiliar o mediastínica que más tarde puede calcificarse. Los síntomas logran desaparecer espontáneamente antes de las 3 semanas. Cuando la exposición ha sido muy intensa, es posible que se presente como una neumonía severa donde todos los signos anteriores se agudizan. En estos últimos pacientes se hace necesaria la terapia antimicótica.40 Esta es la forma de presentación de la mayoría de los casos asociados con brotes epidémicos en Cuba.6,10,22
Histoplasmosis pulmonar crónica
Se desarrolla en el adulto, varón, entre la tercera y cuarta década de la vida, residente en áreas endémicas. Constituyen factores predisponentes el hábito de fumar y los defectos anatómicos preexistentes. Estos pacientes pueden responder de manera favorable al tratamiento con anfotericina B; sin embargo, si la enfermedad pulmonar de base continúa su avance, el tratamiento antimicótico resulta ineficiente. Los síntomas iniciales son: fiebre, tos productiva, posible hemoptisis, disnea y de modo eventual otros signos de enfermedad respiratoria crónica (pérdida de peso, inanición, disnea, cianosis). Las lesiones cavernosas de los campos pulmonares superiores son generalmente bilaterales.40
Como complicaciones de estas formas pulmonares también se han descrito, con menos frecuencia, el granuloma mediastínico, la fibrosis mediastínica y la pericarditis.41,42
Histoplasmosis progresiva diseminada
Se presenta casi exclusivamente en individuos con factores de riesgo que comprometen la inmunidad mediada por células, como son la infección por el virus de la inmunodeficiencia humana, los tratamientos con corticosteroides y otros agentes inmunosupresores, los trastornos hematológicos (leucemias, linfomas) y los trasplantes de órganos; la infancia, cuando aún está inmaduro el sistema inmunológico, también se considera un factor de riesgo. En general se presenta como una infección pulmonar aguda de rápida diseminación a varios órganos y sistemas, con una elevada frecuencia de lesiones cutáneas y mucocutáneas, que llegan a causar la muerte en la mayoría de los casos debido a fallo respiratorio, hemorragia digestiva, coagulación intravascular diseminada o sepsis bacteriana sobreañadida. Los signos pulmonares son ligeros y se pueden presentar infiltrados miliares difusos, infiltrados lobulares y adenopatía hiliar. En estos pacientes la gravedad de la enfermedad es proporcional a la deficiencia de la inmunidad mediada por células. El cuadro clínico incluye fiebre, anorexia, pérdida de peso, hepatomegalia, esplenomegalia y linfadenopatía generalizada. En algunos casos se afecta un solo órgano o sistema, lo que puede dar lugar a endocarditis, meningitis o enfermedad de Addison. Una de las formas más característica consiste en la ulceración de la lengua, el paladar, la epiglotis, la laringe y la mucosa genital. Puede ser de origen exógeno o por una reactivación endógena a partir de alguna antigua infección latente. La respuesta al tratamiento es pobre.2,4,7,21,43
El tratamiento de la histoplasmosis depende de la severidad del cuadro clínico. Las formas benignas, por lo general no requieren tratamiento antimicótico, sino medidas sintomáticas. Para las formas moderadas el tratamiento recomendado es el itraconazol, mientras que para las formas graves la droga de elección es la anfotericina B.2,21,40 En los últimos años las presentaciones lipídicas de la anfotericina B han ido ganando en aceptación, debido a su menor toxicidad en comparación con la forma convencional (desoxicolato). El fluconazol está reconocido como un medicamento de segunda línea, aunque puede ser de mucha utilidad para la histoplasmosis del sistema nervioso central, mientras que el ketoconazol cada día es menos empleado debido a su toxicidad y menor efectividad en comparación con los últimos azoles. Tanto el voriconazol como el posaconazol se consideran también de segunda línea, porque aún no existe suficiente información sobre su utilidad clínica en esta micosis. Por otra parte, las equinocandinas no se recomiendan para el tratamiento de la histoplasmosis.2 Para más precisiones sobre el tratamiento de la histoplasmosis se recomienda consultar la guía publicada por Wheat y otros.44
EPIDEMIOLOGÍA
La región de mayor endemicidad en el mundo se localiza en el centro-este de los EE. UU., donde se calcula que de 80 a 90 % de la población ha sido infectada con H. capsulatum.2 Otras zonas endémicas importantes se localizan en Suramérica (con la excepción de Chile), Centroamérica y las Antillas.3,45-47 También se ha descrito la enfermedad en Asia, África, Australia y Oceanía.48-50 Aunque en Europa los informes de casos autóctonos son escasos,11 en los últimos años son cada vez más frecuentes los reportes de histoplasmosis en viajeros procedentes de América y África.12,13,46,51
Algunas de las manifestaciones clínicas de esta enfermedad se presentan con mayor frecuencia a determinadas edades. Por ejemplo, la forma pulmonar aguda suele presentarse en adultos jóvenes, mientras que las formas diseminadas progresivas tienen mayor incidencia en niños, en ancianos y en pacientes inmunocomprometidos.40,45,52 Durante la niñez, los 2 sexos son igualmente susceptibles, pero a partir de la pubertad se presenta más en el varón que en la mujer, en una proporción de 4:1.45 Durante mucho tiempo se ha señalado como causa de este hecho la mayor exposición del hombre a posibles fuentes de infección, fundamentalmente por razones ocupacionales; sin embargo, también se ha comprobado el efecto inhibitorio de los estrógenos sobre el crecimiento de H. capsulatum.53
La enfermedad no se trasmite de hombre a hombre ni de animal al hombre. Los casos de transmisión por vía percutánea han sido muy escasos; también han sido documentados la transmisión sexual y la vía gastrointestinal.21,24,54 De manera excepcional, se ha reportado la transmisión, a partir del donante, en transplantes de riñón.55,56
H. capsulatum se distribuye de manera no homogénea en el suelo, en los llamados microfocos, lo que hace más difícil su eliminación y control. La mayoría de los brotes de histoplasmosis han ocurrido por la realización de actividades humanas generadoras de aerosoles a partir de estos microfocos, sin las adecuadas medidas de protección, en lugares donde se acumulan excretas de aves o murciélagos; estos aerosoles pueden contener las partículas infectantes del hongo (conidios y fragmentos de hifas), las cuales son fácilmente diseminadas por el viento, por lo que el riesgo también existe para las personas situadas a varios metros de la fuente de infección.9,10,57-61 Entre los principales grupos de riesgo ocupacional, relacionados con distintas profesiones o hobbies, se pueden citar: trabajadores agrícolas y forestales, granjeros, criadores de aves, jardineros, trabajadores de la construcción o reparación de edificaciones, trabajadores relacionados con la instalación y el mantenimiento de sistemas de ventilación, mineros, militares, arqueólogos, espeleólogos, recolectores de guano, microbiólogos, biólogos, turistas, entre otros.9 También han sido descritas las infecciones por H. capsulatum adquiridas en el laboratorio62 y en investigaciones de campo.8 En Cuba, según la Resolución Conjunta No. 2 de 1996 de los ministerios de Salud Pública y de Trabajo y Seguridad Social, la histoplasmosis está considerada una enfermedad profesional y como tal, de declaración obligatoria.
En el caso de las cuevas, que son las principales fuentes de infección de histoplasmosis en Cuba,22 se ha recomendado como principal medida preventiva su clausura o la colocación de avisos consignando el riesgo que representa la entrada a esta.57 Siempre que sea posible, en dependencia de la actividad que se realice, se debe evitar la formación de aerosoles rociando agua o alguna sustancia humectante y reducir al mínimo la exposición a un medio contaminado (no solo las cuevas, sino cualquier otro sitio frecuentado por murciélagos y aves);63 el uso de mascarillas protectoras también constituye una medida muy recomendada, aunque no todos los modelos existentes evitan completamente la infección.9,22
La mayor epidemia conocida de histoplasmosis tuvo lugar en Indianápolis, EE. UU., en la cual se estima que alrededor de 100 000 personas resultaron infectadas, 400 enfermaron y 75 presentaron la forma diseminada de la enfermedad. Esta epidemia se presentó en diversos puntos de la ciudad y es un ejemplo típico de la llamada "histoplasmosis urbana", no asociada con cuevas sino con espacios abiertos.64
Las medidas divulgativas pueden llegar a ser una importante herramienta en el conocimiento y la prevención de la enfermedad, las cuales deben ir encaminadas a mantener actualizado al personal médico en los aspectos más relevantes de esta micosis, no solo en su diagnóstico y tratamiento, sino también en su prevención y control. Los grupos de riesgo también deben ser informados de sus peligros y limitaciones.57,60 Para la eliminación de focos puntuales bien identificados, se ha recomendado la descontaminación química con formalina al 3%, con la debida autorización de las autoridades de medio ambiente; también se ha recomendado hipoclorito de sodio, aunque éste tiende a disminuir su actividad más rápidamente.9,10
En Cuba, los estudios sobre la histoplasmosis comenzaron en 1951, cuando se informaron, separadamente, los 2 primeros casos, cuyo diagnóstico de certeza se realizó mediante el cultivo e identificación de H. capsulatum a partir de diferentes muestras clínicas.65,66
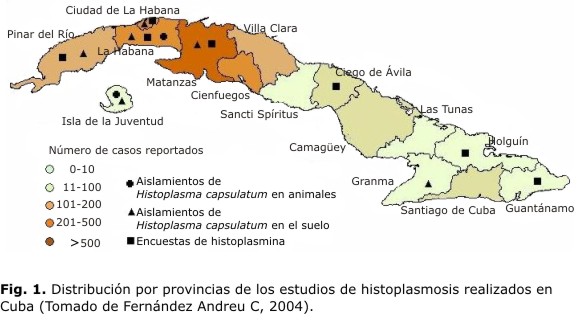
Los 3 primeros brotes epidémicos de histoplasmosis en Cuba, de los cuales se tienen referencias, ocurrieron en las provincias occidentales.67 El primero de ellos afectó a más de 300 personas y se considera uno de los mayores registrados en el mundo hasta ese momento. Otros brotes reportados en la literatura médica han tenido lugar en las provincias de La Habana, Matanzas, Pinar del Río, Ciego de Ávila y el municipio Isla de la Juventud.68,69 Los estudios de algunos de estos brotes han incluido la determinación de la fuente de infección, aunque no en todos los casos ha sido posible aislar al agente causal.10,69-73 También han ocurrido brotes en el resto de las provincias, pero la información que se tiene sobre ellos es incompleta (Fig. 1).
Los primeros casos cubanos de infección por H. capsulatum asociada a la infección por el VIH se informaron en 1990.74 Desde entonces, la histoplasmosis diseminada se considera una de las micosis más importantes por su relativa frecuencia y gravedad en los pacientes cubanos con sida.5,75 Su forma de presentación se ha asociado con elevada frecuencia a las lesiones cutáneas,76,77 lo que pudiera estar en correspondencia con las variaciones genéticas y el mayor dermotropismo de las cepas latinoamericanas en comparación con las aisladas en los EE. UU.78
H. capsulatum se ha aislado de numerosas especies de mamíferos, tanto domésticos como de la fauna silvestre, entre las que se encuentran quirópteros, marsupiales, insectívoros, primates, roedores, carnívoros, etc.15,79,80 Entre los animales domésticos, los perros, los gatos y los caballos son los más afectados.16,80,81 Las aves, sin embargo, no se infectan debido a su elevada temperatura corporal.79
No ocurre trasmisión del animal al hombre, por lo que no puede considerarse una verdadera zoonosis sino una sapronosis, porque el hongo se adquiere a partir de su vida saprofítica en la naturaleza;82 existen reportes de infecciones en animales y en el hombre por exposición simultánea a las partículas infectantes en una fuente común en lugares relacionados con actividades consideradas de riesgo83 y se ha podido demostrar, mediante métodos moleculares, que las cepas que afectan al hombre son idénticas a las que se aíslan en animales en una región determinad.59
La presentación clínica de la histoplasmosis en los animales, de manera general, se corresponde con las principales manifestaciones en el hombre.15 No obstante, existen algunas formas de presentación solo descrita en algunas especies animales, como el aborto micótico por H. capsulatum en los equinos.84
Entre las especies animales son, sin dudas, los murciélagos los más relacionados con la histoplasmosis y ellos desempeñan un papel decisivo en el mantenimiento de su agente causal en el medio ambiente, porque a través de sus excretas proporcionan al suelo los nutrientes necesarios para su desarrollo.22,85 Los análisis de los patrones de ADN han demostrado la estrecha relación entre las cepas de H. capsulatum aisladas de murciélagos y las de origen humano.59,86
No existen vacunas preventivas ni terapéuticas para el control de la histoplasmosis, aunque se han hecho algunos intentos de obtener un inmunógeno que pueda brindar una adecuada protección. Uno de los primeros trabajos en este sentido fue realizado por Feit y Tewari, quienes demostraron el efecto protector de una fracción ribosomal de la fase levaduriforme del hongo en un modelo murino.35,87 Más reciente se ha podido aislar una proteína de la familia de las hsp 60 (heat shock proteins o proteínas de choque térmico) obtenida de un extracto de pared y membrana celulares de la misma fase, que ha demostrado poseer capacidad protectora en animales de experimentación.34,88 Esta proteína también se ha obtenido por vía recombinante, y se ha logrado inducir una respuesta inmune protectora en ratones retados por vía intranasal con un inóculo letal de la fase levaduriforme del hongo.89 Otras 2 proteínas recombinantes han sido evaluadas con el mismo objetivo: una de ellas, el antígeno H, miembro de la familia de las â-glucosidasa y usado ampliamente en inmunodiagnóstico, mostró efecto protector en un modelo de reto intranasal, no así cuando el reto fue intravenoso;90 la segunda proteína es una hsp 70, que ha mostrado poseer capacidad de inducir una respuesta inmune celular pero con limitado efecto protector.34 Estos estudios, aunque preliminares, pudieran servir de base para la producción y evaluación de futuros candidatos vacunales contra la infección por H. capsulatum.34,35
DIAGNÓSTICO DE LABORATORIO
El diagnóstico de laboratorio de la histoplasmosis se basa en técnicas de cultivo, microscopia y la detección de antígenos y anticuerpos.2,91 Los productos patológicos suelen ser muy diversos, en dependencia de la forma clínica que se presente; los más frecuentes son esputo y otras secreciones respiratorias, sangre, médula ósea, exudados y raspados de lesiones cutáneas o mucocutáneas, orina, líquido cefalorraquídeo (LCR) y muestras de biopsias de distintos órganos. En la tabla 2 se muestra comparativamente la sensibilidad de estos métodos en las principales formas de presentación de la enfermedad.
Tabla 2. Sensibilidad de los métodos diagnósticos empleados en el diagnóstico
de las principales manifestaciones clínicas de la histoplasmosis
| Método diagnóstico | Manifestaciones clínicas | Ventajas | Desventajas | ||
| Sensibilidad (%) | |||||
| Diseminada | Pulmonar crónica | Autolimitada* | |||
| Microscopia | 43 | 17-40 | 9 | Rápido | Baja sensibilidad |
| Cultivo | 85 | 85 | 15 | Gold standard | 2-4 semanas de incubación |
| Diagnóstico definitivo | Baja sensibilidad en la forma autolimitada | ||||
| Pruebas serológicas | 71 | 100 | 98 | Rápido | Falsos positivos y falsos negativos |
| Sensible en las formas crónicas y autolimitadas | |||||
| Detección de antígeno | 92 | 15-21 | 39 | Rápido | Pobre sensibilidad en la crónica y en la autolimitada |
| Sensible en la forma diseminada | Costos elevados | ||||
| Útil para monitoraer la terapia | |||||
| Diagnóstico molecular | 69-10 | NE | NE | Alta especificidad | Costos elevados |
| Rápido | |||||
* Las manifestaciones autolimitadas incluyen la histoplasmosis pulmonar aguda,
las manifestaciones reumatólogicas y la pericarditis. NE: no evaluado
(adaptado de Wheat, 2006; y Guimarães y otros, 2006).
Examen microscópico directo
El examen directo de estas muestras, sin coloración previa, resulta de muy poco valor diagnóstico debido al pequeño tamaño de las levaduras en los tejidos. Sin embargo, los frotis coloreados con Giemsa o Wright permiten la observación, en el interior de los macrófagos, de levaduras pequeñas (1-2 µm de diámetro), redondas a ovoides, con el núcleo teñido de violeta oscuro y el citoplasma en azul tenue, casi incoloro, simulando una cápsula, las cuales corresponden a H. capsulatum.45 Los raspados de piel y exudados pueden ser examinados en preparaciones con KOH 10 % con tinta Parker o blanco de calcofluor.91
La histopatología es en especial útil y constituye una de las vías más importantes para alertar al laboratorio de la presencia del patógeno. En cortes histológicos de muestras de tejidos, la pared de la levadura se tiñe muy débilmente con hematoxilina-eosina (Fig. 2). Con tinciones más específicas, como las del ácido peryódico de Schiff, Gram y metenamina de plata de Grocott-Gomori la intensidad de la coloración es mayor y permiten observar además, la respuesta hística del hospedero: en individuos inmunodeprimidos, esta respuesta es pobre y se observan abundantes levaduras en el interior de macrófagos, mientras que en los inmunocompetentes el hongo evoca una reacción granulomatosa, con predominio de células epitelioides y gigantes, en cuyo interior se observan las levaduras de H. capsulatum.2,91 La sensibilidad de este método es muy baja en las formas autolimitadas y en la histoplasmosis pulmonar aguda; su valor se incrementa en las formas pulmonares crónicas y diseminadas. Es en particular de mucha utilidad para establecer un diagnóstico rápido de histoplasmosis diseminada a partir de muestras de biopsias de médula ósea.91 Una modificación rápida de la coloración de Grocott ha sido recomendada para su empleo en laboratorios de micología debido a su elevada sensibilidad y fácil interpretación en muestras de secreciones respiratorias, raspados de lesiones cutáneas y punciones ganglionares.92
La observación en cualquier tipo de muestra clínica, de levaduras intracelulares con las características mencionadas es muy sugestiva de histoplasmosis; sin embargo, debe tenerse en cuenta que algunas células pequeñas de Cryptococcus neoformans pobremente encapsuladas, así como también las células de Candida glabrata, Penicillium marneffei, Pneumocystis jirovecii, Toxoplasma gondii y Leishmania donovani pueden crecer de modo intracelular y ser confundidas con H. capsulatum; dando lugar a un diagnóstico incorrecto.2,91
Cultivo e identificación
El aislamiento en medios de cultivo de H. capsulatum a partir de muestras clínicas se considera el método gold standard y es el que da el diagnóstico definitivo de histoplasmosis.2,52 La identificación se basa en sus caracteristicas culturales y microscópicas, así como en la demostración de su dimorfismo in vitro, la prueba de exoantígenos y la utilización de sondas de ADN.20
El material patológico debe sembrarse paralelamente en agar Sabouraud glucosado y en agar Sabouraud glucosado con cloranfenicol y cicloheximida e incubar a 28-30 °C, y en medios de cultivo enriquecidos como son agar sangre con glucosa y cisteína o agar infusión de cerebro y corazón con cisteína e incubar a 37 °C para lograr la fase levaduriforme. El tiempo de incubación debe ser de 2 a 4 semanas, aunque la mayoría de los autores recomiendan de 6 a 12 semanas;47,91 no obstante, Hove y Woods encontraron que 90 % de los aislamientos de H. capsulatum se obtuvieron antes de los 21 d y señalan que en áreas endémicas la incubación por 4 semanas es innecesaria y, en consecuencia, proponen el establecimiento de protocolos de incubación en dependencia del tipo de muestra clínica.93 Otros autores han logrado acortar el tiempo de incubación con el empleo del agar papa dextrosa con cloranfenicol para el aislamiento primario.94
A temperaturas inferiores a 35 °C, H. capsulatum crece formando colonias de color blanco a beige, algodonosas, de crecimiento lento, las cuales pueden producir 2 tipos de conidios: microconidios lisos, esféricos, piriformes o en forma de clava, sin septos, de pared fina, que pueden medir 1-4 x 2-6 µm y macroconidios en conidióforos cortos, esféricos (8-14 µm de diámetro), de paredes gruesas, sin septos, de aspecto tuberculado o con proyecciones cilíndricas, fácilmente apreciables al microscopio óptico (Fig. 3).20 La observación de los macronidios tuberculados permite solo un diagnóstico presuntivo de histoplasmosis, porque especies de los géneros Sepedonium y Chrysosporium pueden formar estructuras similares.2,21,24,45
En medios de cultivo enriquecidos, a 37 °C, se observan células levaduriformes esféricas u ovaladas, de 2-3 x 3-4 µm, de paredes finas que se reproducen por gemación polar con una base estrecha, las cuales dan lugar a colonias cremosas de color grisáceo a beige.21,45
La conversión a fase levaduriforme se considera un paso confirmatorio en la identificación de H. capsulatum. Este es un proceso gradual y para lograrlo se deben realizar varios pases sucesivos de un fragmento de la colonia filamentosa a medios enriquecidos (agar infusión de cerebro y corazón con sangre de carnero o sin esta, agar sangre con glucosa y cisteína, agar yema de huevo) e incubar a 37 °C.47,95 No siempre es posible obtener esta conversión, porque no solo depende de la temperatura y los nutrientes del medio, sino también de las características individuales de las cepas; los cultivos envejecidos, mantenidos por mucho tiempo en su forma filamentosa, por lo general no se transforman fácilmente a levaduras.
La prueba de exoantígenos se emplea para la identificación de cultivos de H. capsulatum mediante la detección de antígenos solubles específicos, elaborados por el hongo en los primeros estadios de su crecimiento.96,97 El extracto concentrado, conteniendo los exoantígenos de la cepa a identificar se enfrenta en una prueba de inmunodifusión a un suero control de histoplasmosis; la detección de las bandas de precipitación específicas permite la identificación de H. capsulatum. Se considera una prueba confirmatoria, de elevada especificidad, que es capaz de identificar las formas típicas, las atípicas y las asporógenas de la especie; debido a su relativa laboriosidad y al requerimiento de sueros controles, es recomendada solo para laboratorios de referencia.22,64
Una alternativa más reciente es el empleo de una sonda quimioluminiscente de ADN, disponible comercialmente (Accu-Probe; GenProbe, Inc., San Diego, California, EE. UU.), muy específica y sensible, que permite la identificación rápida de cultivos de H. capsulatum.98 Aunque ha sido diseñada para la identificación de cepas, se ha sugerido su posible utilización en el diagnóstico a partir de muestras de tejidos en las cuales el número de microorganismos sea lo suficiente elevado.99 En los últimos años esta prueba ha reemplazado a las anteriores como prueba confirmatoria.2 Un reporte reciente de un caso falso positivo mediante esta prueba, confirma una vez más la importancia de valorar en conjunto los resultados de las pruebas moleculares con las características fenotípicas de los aislamientos.100
Los sistemas de lisis y centrifugación para el procesamiento de las muestras de sangre en el aislamiento de H. capsulatum han mostrado mayor sensibilidad que los sistemas convencionales de hemocultivo, en especial en pacientes inmucomprometidos.101,102 También los sistemas automatizados tipo BACTEC se consideran altamente eficientes, aunque de costos muy elevados .91
La mayor positividad de los cultivos se presenta en los casos de infección diseminada, histoplasmosis pulmonar cavitaria crónica y en la enfermedad pulmonar aguda después de masivas exposiciones al agente. En las demás formas clínicas de histoplasmosis, incluida la pulmonar benigna a moderada, la forma de granuloma mediastínico y la meningitis, los cultivos generalmente son negativos.2,47,64,91
En el laboratorio, tanto las muestras de pacientes como los cultivos de H. capsulatum deben manipularse con precauciones extremas y deben cumplirse las medidas generales de bioseguridad y las correspondientes al trabajo con microorganismos patógenos, teniendo en cuenta que, aunque la Lista oficial de agentes biológicos que afectan al hombre, los animales y las plantas de la Resolución 38/2006 del Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba ubica a H. capsulatum en el nivel de riesgo 2, la mayoría de los países y organismos internacionales lo consideran de riesgo 3.8,9,20
Detección de anticuerpos
Las pruebas que detectan anticuerpos han sido de gran valor en el diagnóstico de la histoplasmosis, no solo por su relativa rapidez en comparación con los métodos de cultivo e identificación, sino también porque, en muchas ocasiones, son la primera y a veces la única evidencia de infección;64,103 las más empledas han sido la inmunodifusión doble, la fijación del complemento y la técnica de ELISA indirecta.22
Según Wheat estas pruebas son positivas en aproximadamente 71 % de las formas diseminadas de histoplasmosis, en 100 % de las pulmonares crónicas y en 98 % de las pulmonares agudas y autolimitadas (tabla 2). Sin embargo, en individuos inmunocomprometidos la positividad es mucho menor.64
La inmunodifusión doble se considera una prueba sencilla, económica y muy específica, debido a la aparición de las bandas de precipitación H y M entre las 4 y 6 semanas después de la exposición, aunque su sensibilidad es baja. La presencia de una banda M indica una infección activa o pasada, o la aplicación reciente de una prueba intradérmica de histoplasmina; mientras que la banda H aparece después de la banda M e indica infección activa.21 Los anticuerpos anti-M pueden persistir durante años en el suero del paciente, mientras que los anti-H tienden a desaparecer mucho más rápido. La prueba de fijación del complemento es más sensible y menos específica que la inmunodifusión, pero requiere de gran experiencia y habilidad por parte del personal del laboratorio. Un título de 1:32 se considera positivo, mientras que los títulos de 1:8 y 1:16 son débilmente positivos y en algunos casos indican una infección anterior, en especial en individuos de áreas endémicas. Si se pretende alcanzar una mayor sensibilidad se recomienda realizar de manera simultánea ambas pruebas.91
Los ensayos inmunoenzimáticos también han sido empleados en el diagnóstico de histoplasmosis, aunque de manera limitada, y han mostrado buena sensibilidad aunque menor especificidad que las pruebas de inmunoprecipitación.22,91
En todos los casos la interpretación de las pruebas serológicas debe realizarse integrando sus resultados con los datos clínico-epidemiológicos y micológicos.2,64
Prueba intradérmica de histoplasmina
Se considera una herramienta epidemiológica de gran valor para determinar áreas endémicas, porque permite conocer el grado de exposición de diferentes grupos de riesgo, relacionados fundamentalmente con la actividad ocupacional: mineros, agricultores, recolectores de guano, criadores de aves, espeleólogos, etc. Su valor diagnóstico queda limitado a los casos siguientes: en lactantes, cuando tiene lugar un viraje de negativa a positiva, y cuando se detecta en personas que no han habitado antes en áreas endémicas y no presentan reacciones positivas con otros antígenos fúngicos. En este último caso se pueden citar varios ejemplos recientes de turistas que han visitado zonas endémicas de América Latina.46,51,63,104 En áreas endémicas su valor diagnóstico es muy escaso.105
Detección de antígeno
Las pruebas que detectan antígenos se consideran mucho más eficientes para el diagnóstico de histoplasmosis. H. capsulatum es capaz de liberar un antígeno polisacarídico, el cual puede ser detectado en el suero, líquido pleural, lavado bronquioalveolar, LCR y orina. Este constituye un método inmunoenzimático rápido para el diagnóstico de la histoplasmosis diseminada, con una buena sensibilidad y especificidad (sensibilidad en orina: 92 %; en suero: 82 %). Se detecta con menos frecuencia en pacientes con la forma pulmonar aguda y otras formas autolimitadas (39-41 %), y en la pulmonar crónica (21 %) (tabla 2).64,106 En muestras de LCR también se ha detectado el antígeno en 42 a 67 % de los pacientes que desarrollaron la forma meníngea y en 70 % de los lavados bronquiales de pacientes con sida que padecían una histoplasmosis pulmonar.64 Este método ha sido particularmente útil en pacientes con sida.4 Sin embargo, estas pruebas de detección de antígeno no sustituyen a las pruebas convencionales (detección de anticuerpos, examen directo y cultivo), sino que las complementan al mejorar la sensibilidad general del diagnóstico y aumentar su rapidez, sobre todo en aquellos pacientes con las formas graves de la enfermedad. Este método, aunque es específico para el antígeno polisacarídico de H. capsulatum, ha mostrado reactividad cruzada en muestras de orina de pacientes con otras micosis sistémicas.2
Las concentraciones de antígeno disminuyen en respuesta al tratamiento. En los pacientes con sida tratados con anfotericina B los niveles caen durante las primeras semanas de terapia y se estabilizan a niveles bajos durante el tratamiento de mantenimiento. En pacientes sin sida la eliminación del antígeno ocurre más rápido y completamente.2,107 La principal desventaja de este método, además de su elevado costo, es que solo se encuentra disponible en centros de referencia de los EE. UU.64,105,108
Otros autores han ensayado diferentes métodos que también detectan antígeno de H. capsulatum en muestras clínicas, aunque no han sido comercializados. Mediante el empleo de anticuerpos monoclonales que reconocen la proteína de 70 kDa, Gómez y otros lograron diseñar un sistema inmunoenzimático capaz de detectar antígeno en muestras de suero y orina, aunque encontraron hasta 20 % de reacciones cruzadas en sueros de pacientes con aspergilosis, paracoccidioidomicosis y tuberculosis.109 Otro método de detección de antígenos ha sido evaluado por Scheel y otros, quienes encontraron 81 % de sensibilidad mediante un ELISA de captura en muestras de orina de individuos seropositivos al VIH con histoplasmosis confirmada por cultivo, empleando anticuerpos policlonales; según sus autores este método pudiera ser una alternativa atractiva para laboratorios de pocos recursos en países endémicos.110
Diagnóstico por métodos moleculares
Debido a las dificultades que se presentan con el diagnóstico convencional de la histoplasmosis, en particular por la demora y la baja sensibilidad, en especial en algunas formas clínicas, en la actualidad se centran grandes esperanzas en las posibilidades que pudieran brindar los métodos moleculares, particularmente la técnica de la reacción en cadena de la polimerasa (PCR, sigla en inglés).64
Uno de los primeros estudios en este sentido fue reportado por Bialek y otros, quienes diseñaron un nested PCR que fue capaz de detectar ADN de H. capsulatum con elevada sensibilidad en muestras de tejidos y sangre de ratones experimentalmente infectados; sin embargo, también detectó ácido nucleico de B. dermatitidis y P. brasiliensis.111 Otros autores han reportado igual la detección de ADN de H. capsulatum en muestras clínicas humanas mediante PCR, dirigidos sobre todo a la región 18S del ADN ribosomal, con buena sensibilidad y especificidad, pero ninguna de estas metodologías están comercializadas ni se dispone de protocolos estandarizados.112,113 Se han diseñado otros PCR dirigidos a los genes que codifican para los antígenos H y M de manera separada, por 2 grupos de investigadores, también con buenos resultados al ser aplicados en muestras de casos conocidos de histoplasmosis.114,115
Una variante de PCR en tiempo real (PCR-TR) fue diseñada por Martagón-Villamil y otros dirigida a la región ITS-1 del ADN ribosomal y permitió identificar H. capsulatum entre una variedad de otras especies fúngicas y después aplicarlo con éxito en muestras clínicas humanas.116 Buitrago y otros, con el empleo de la misma técnica obtuvieron una sensibilidad de 78,6 % y una especificidad de 100 % al evaluarla en enfermos con histoplasmosis demostrada, lo cual confirma las posibilidades de esta técnica como herramienta que pudiera extenderse, debido a sus ventajas de automatización y cuantificación de los resultados, a laboratorios con capacidades diagnósticas.105
Mediante un nested PCR dirigido a los genes de la proteína de 100 kDa específica de H. capsulatum, Maubon y otros encontraron 100 % de sensibilidad al evaluar 40 muestras clínicas de 27 pacientes y compararlas con los cultivos positivos de este hongo.117 Muñoz y otros con una PCR para estos mismos genes y evaluando un mayor número de muestras encontraron buenos resultados de sensibilidad y especificidad, lo que indica que esta técnica puede llegar a ser una promisoria herramienta para la detección temprana de H. capsulatum en diferentes tipos de muestras clínicas.118
Por otra parte, pudiera ser de gran utilidad disponer de métodos moleculares específicos y sensibles para la detección de H. capsulatum en muestras ambientales. En la actualidad, esto se realiza mediante la inoculación intraperitoneal de la muestra en ratones para el posterior retrocultivo, lo que resulta un método laborioso, costoso, poco sensible y muy demorado. Aunque se ha reportado una PCR que detectó H. capsulatum en muestras de suelo simuladas,119 este debe ser evaluado en muestras ambientales naturalmente contaminadas con este patógeno.
Hasta el presente son pocos los trabajos publicados, solo un pequeño número de pacientes ha sido diagnosticado con el empleo de técnicas moleculares y no hay métodos estandarizados ni sistemas de PCR disponibles comercialmente para el diagnóstico de la histoplasmosis, por lo que algunos autores han planteado que todavía no está muy definido el papel futuro de estos métodos en el diagnóstico de histoplasmosis.40,64
CONCLUSIONES
La histoplasmosis continuará siendo una micosis de gran interés médico y social en los próximos años, particularmente vinculada al incremento de la población de individuos inmunocomprometidos. Los métodos de diagnóstico, tanto convencionales como moleculares, aún presentan limitaciones, por lo que deben ser optimizados y asequibles a la mayoría de los laboratorios después de una correcta validación en diferentes grupos poblacionales y en todas las manifestaciones clínicas de la enfermedad.
Las medidas divulgativas pueden desempeñar un papel importante en la prevención de la enfermedad, particulamente en los grupos de riesgo más susceptibles. Por otra parte, urge encontrar métodos de detección de H. capsulatum en el medio ambiente, lo que incidiría de manera directa en la aplicación de medidas de control en las posibles fuentes de infección.
La histoplasmosis, por las características de su agente causal y su hábitat, plantea un problema difícil de resolver, que deberá enfrentarse de manera integral por las diferentes instituciones que de una forma u otra pueden estar implicadas en su diagnóstico, prevención y control. El presente trabajo brinda una información actualizada con vistas a facilitar una mejor comprensión de los aspectos incluidos y constituye además una alerta sobre esta importante micosis.
REFERENCIAS BIBLIOGRÁFICAS
1. Darling ST. A protozoön general infection producing pseudotubercles in the lungs and focal necrosis in the liver, spleen and lymph nodes. J Amer Med Ass. 1906;46:1283-5.
2. Kauffman CA. Histoplasmosis: a clinical and laboratory update. Clin Microbiol Rev. 2007;20:115-32.
3. Colombo AL, Tobón A, Restrepo A, Queiroz-Tellez F, Nucci M. Epidemiology of systemic fungal infections in Latin America. Med Mycol. 2011. Early online 1-14. doi: 10.3109/13693786.2011.577821
4. Wheat LJ, Connolly-Springfield PA, Baker RL, Curfman MF, Eads ME, Israel KS, et al. Disseminated histoplasmosis in the acquired immunodeficiency syndrome: clinical findings, diagnosis and treatment, and review of the literature. Medicine (Baltimore) 1990;69:361-74.
5. Fernández Andreu CM, Corral Varona C, Martínez Machín G, Rodríguez Barreras ME, Ruiz Pérez A. Histoplasmosis diseminada progresiva en pacientes con sida. Rev Cubana Med Trop. 1996;48:163-6.
6. Fernández Andreu CM. Epidemiología de la histoplasmosis en Cuba. Rev VITAE Acad Biomed Dig. 2001;9. Disponible en: http://www.caibco.ucv.ve/vitae/VitaeNueve/Articulos/Micologia/Histoplasmosis/ArchivosHTML/Introducion.htm
7. Mora DJ, Barbosa dos Santos CT, Silva Vergara ML. Disseminated histoplasmosis in acquired immunodeficiency síndrome patients in Uberaba, MG, Brazil. Mycoses. 2007;51:136-40.
8. Fernández Llanes R, Fernández Andreu CM, Fuentes González O. Riesgo biológico asociado con trabajos de campo: informe de dos casos de histoplasmosis. Rev Cubana Med Trop. 1987;39:61-7.
9. Lenhart SW, Schafer MP, Singal M, Hajjeh RA. Histoplasmosis: Protecting workers at risk. DHHS (NIOSH) Publication No. 2005-109; 2004.
10. Fernández Andreu CM, Martínez Machín G, Illnait Zaragozí MT, Perurena Lancha MR, González L. Brotes de histoplasmosis ocupacional en la provincia La Habana. Rev Cubana Med Trop. 2010;62:68-72.
11. Ashbee HR, Evans EGV, Viviani MA, Dupont B, Chryssanthou E, Surmont I, et al. Histoplasmosis in Europe: report on an epidemiological survey from the European Confederation of Medical Mycology Working Group. Med Mycol. 2008;46:57-65.
12. Sánchez-Alemán MA. Histoplasmosis, la micosis del viajero. Enf Inf Microbiol. 2009;29:111-6.
13. Buitrago MJ, Bernal-Martínez L, Castelli MV, Rodríguez-Tudela JL, Cuenca-Estrella M. Histoplasmosis and paracoccidioidomycosis in a non-endemic área: a review of cases and diagnosis. J Travel Med. 2011;8:26-33.
14. Reyes-Montes MR, Rodríguez-Arellanes G, Pérez-Torres A, Rosas-Rosas AG, Parás-García A, Juan-Sallés C, et al. Identification of the source of histoplasmosis infection in two captive maras (Dolichotis patagonum) from the same colony by using molecular and immunologic assays. Rev Arg Microbiol. 2009;41:102-4.
15. Fernández Andreu CM, Martínez Machín G, Illnait Zaragozí MT, Perurena Lancha MR. Histoplasmosis animal: Una actualización. CubaZoo Rev Parque Zoo Nac. 2009;20:45-54.
16. Mavropoulou A, Grandi G, Calvi L, Passeri B, Volta A, Kramer LH, et al. Disseminated histoplasmosis in a cat in Europe. J Small Anim Prac. 2010;51:176-80.
17. Odds FC, Arai T, DiSalvo AF, Evans EGV, Hay RJ, Randhawa HS et al. Nomenclature of fungal diseases: a report and recommendations from a Sub-Committee of the International Society for Human and Animal Mycology. J Med Vet Mycol 1992;30:1-10.
18. Kwon Chung KJ. Sexual stage of Histoplasma capsulatum. Scienc. 1972;475:325.
19. Peterson SW, Sigler L. Molecular genetic variation in Emmonsia crescens and Emmonsia parva, etiologic agents of adiaspiromycosis, and their phylogenetic relationship to Blastomyces dermatitidis (Ajellomyces dermatitidis) and other systemic fungal pathogens. J Clin Microbiol. 1998;36:2918-25.
20. De Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. Baarn/Reus: Centraalbureau voor Schimmelcultures/Universitat Rovira i Virgili; 2009.
21. Rippon JW. Micología Médica. Hongos y actinomicetos patógenos. México DF: Ed. Interamericana McGraw; 1990. p. 411-56.
22. Fernández Andreu CM. Histoplasmosis en Cuba: Contribución a su diagnóstico, prevención y control [Tesis presentada en opción al grado científico de Doctor en Ciencias de la Salud]. Instituto de Medicina Tropical ¨Pedro Kourí¨, Ciudad de La Habana; 2004.
23. Hearn VM. Structure and function of the fungal cell wall. En: Jacobs PH, Nall L, editors. Fungal Diseases. Biology, immunology, and diagnosis. New York: Marcel Dekker, Inc.; 1997. p. 27-60.
24. Domer JE, Moser SA. Histoplasmosis. A review. Rev Med Vet Mycol. 1980;15:159-82.
25. Taylor ML, Reyes Montes MR, Martínez Rivera MA, Rodríguez Arellanes G, Duarte Escalante E, Flores Estrada JJ. Histoplasmosis en México Aportaciones inmunológicas y moleculares sobre su epidemiología. Ciencia y Desarrollo. 1997;136:59-63.
26. Romero-Martínez R, Canteros C, Taylor ML. Variabilidad cromosómica intraespecífica en hongos patógenos de humanos, especialmente en Histoplasma capsulatum. Rev Iberoam Micol. 2004;21:168-76.
27. Taylor JW, Geisser DM, Burt A, Koufopanou V. The evolutionary biology and population genetics underlying fungal strain typing. Clin Microbiol Rev. 1999;12:126-46.
28. Reyes-Montes MR, Taylor ML, Curiel-Quesada E, Mesa-Arango AC. Estado actual de la tipificación del hongo patógeno Histoplasma capsulatum var. capsulatum: una revisión de los hallazgos. Rev Iberoam Micol. 2000;17:121-6.
29. Kasuga T, White TJ, Koenig G, McEwen J, Restrepo A, Castaneda E, et al. Phylogeography of the fungal pathogen Histoplasma capsulatum. Mol Ecol. 2003;12:3383-401.
30. Woods JP. Knocking on the right door and making a comfortable home: Histoplasma capsulatum intracellular pathogenesis. Curr Opin Microbiol. 2003;6:327-31.
31. López CE. Dimorfismo y patogenia de Histoplasma capsulatum. Rev Arg Microbiol. 2006;38:235-42.
32. Retallack DM, Woods JP. Molecular epidemiology, pathogenesis, and genetics of the dimorphic fungus Histoplasma capsulatum. Microb Infect. 1999;1:817-25.
33. Nosanchuk JD, Gómez BL, Youngchim S, Diez S, Aisen P, Zancopé-Oliveira RM, et al. Histoplasma capsulatum synthesizes melanin-like pigments in vitro and during mammalian infection. Infect Immun. 2002;70:5124-31.
34. Deepe GS, Wüthrich M, Klein BS. Progress in vaccination for histoplasmosis and blastomicosis: coping with cellular immunity. Med Mycol. 2005;43:381-9.
35. Segal E, Elad D. Fungal vaccines and immunotherapy. J Méd Mycol. 2006;16:134-51.
36. Vail GM, Mocherlas S, Wheat LJ, Goldberg J, Camp A, Brizendine E, et al. Cellular immune response in HIV-infected patients with histoplasmosis. J Acquir Immun Defic Syndr. 2002;29:49-53.
37. Thompson GR, LaValle CE, Everett ED. Unusual manifestations of histoplasmosis. Diagn Microbiol Infect Dis. 2004;50:33-41.
38. Pasqualotto AC, Oliveira FM, Severo LC. Histoplasma capsulatum recovery from the urine and a short review of genitourinary histoplasmosis. Mycopathologia. 2009;167:315-23.
39. Alves MD, Pinheiro L, Manica D, Fogliatto LM, Fraga C, Goldani LZ. Histoplasma capsulatum sinusitis: case report and review. Mycopathologia. 2011;171:57-9.
40. Kauffman CA. Histoplasmosis. Clin Chest Med. 2009;30:217-25.
41. Wheat LJ, Stein L, Corya BC, Wass JL, Norton JA, Grider KRN, et al. Pericarditis as a manifestation of histoplasmosis during two large urban outbreaks. Medicine (Baltimore). 1983;62:110-9.
42. Loyd JE, Tillman BF, Atkinson JB, Des Prez RM. Mediastinal fibrosis complicating histoplasmosis. Medicine (Baltimore). 1988;67:295-310.
43. Kauffman CA. Diagnosis of histoplasmosis in immunosuppresses patients. Curr Opin Infect Dis. 2008;21:421-5.
44. Wheat LJ, Freifeld AG, Kleiman MB, Bladdley JN, McKinsey DS, Loyd JE, et al. Clinical practice guidelines for the management of patients with histoplasmosis: 2007 update by the Infectious Diseases Society of America. Clin Infect Dis. 2007;45:807-25.
45. Bonifaz A. Micología Médica Básica. 2ª ed. México DF: Méndez Editores, S.A. de C.V.; 2000. p. 257-73.
46. Salomon J, Flament Saillour M, De Truchis P, Bougnoux ME, Dromer F, Dupont B, et al. An outbreak of acute pulmonary histoplasmosis in members of a trekking trip in Martinique, French West Indies. J Travel Med. 2003;10:87-93.
47. Ferreira MS, Borges AS. Histoplasmosis. Rev Soc Bras Med Trop. 2009;42:192-8.
48. Ajello L, Kuttin ES, Beemer AM, Kaplan W, Padhye A. Occurrence of Histoplasma capsulatum Darling, 1906 in Israel, with a review of the current status of histoplasmosis in the Middle East. Am J Trop Med Hyg. 1977;26:140-7.
49. O´Sullivan MVN, Whitby M, Chahoud C, Miller SM. Histoplasmosis in Australia: a report of a case with a review of the literature. Aust Dental J. 2004;49:94-7.
50. Chakrabarti A, Slavin MA. Endemic fungal infections in the Asia-Pacific región. Med Mycol. 2011;49:337-44.
51. Erkens K, Lademann M, Tintelnot M, Kaben U, Reisinger EC. Histoplasmosis group disease in bat researchers returning from Cuba. Dtsch Med Wochenschr. 2002;127:21-5.
52. Kurowski R, Ostapchuk M. Overview of histoplasmosis. Am Fam Physician. 2002;66:2247-52.
53. Negroni R. Inmunología de las micosis. En: Margni RA, editor. Inmunología e Inmunoquímica. La Habana: Ed. Científico-Técnica; 1982. p. 340-62.
54. Lamps LW, Molina CP, West AB, Haggitt RC, Scott MA. The pathologic spectrum of gastrointestinal and hepatic histoplasmosis. Am J Clin Pathol. 2000;113:64-72.
55. Wong SY, Allen DM. Transmission of disseminated histoplasmosis via cadaveric renal transplantation: case report. Clin Infect Dis. 1992;14:232-4.
56. Limaye AP, Connolly PA, Sagar M, Fritsche TR, Cookson BT, Wheat LJ, et al. Transmission of Histoplasma capsulatum by organ transplantation. N Engl J Med. 2000;343:1163-6.
57. Lyon GM, Bravo AV, Espino A, Lindsley MD, Gutiérrez RE, Rodríguez I, et al. Histoplasmosis associated with exploring a bat-inhabited cave in Costa Rica, 1998-1999. Am J Trop Med Hyg 2004;70:438-42.
58. Huhn GD, Austin C, Carr M, Heyer D, Boudreau P, Gilbert G, et al. Two outbreaks of occupational acquired histoplasmosis: more than workers at risk. Environ Health Perspect. 2005;113:585-9.
59. Taylor ML, Chávez-Tapia CB, Rojas-Martínez A, Reyes-Montes ML, Bobadilla del Valle M, Zúñiga G. Geographical distribution of genetic polymorphism of the pathogen Histoplasma capsulatum isolated from infected bats, captured in a central zone of Mexico. FEMS Immnunol Med Microbiol. 2005;45:451-8.
60. Jülg B, Elias J, Zahn A, Köppen S, Becker-Gaab C, Bogner JR. Bat-associated histoplasmosis can be transmitted at entrances of bat caves and not only inside the caves. J Travel Med. 2008;15:133-6.
61. Muñoz B, Martinez MA, Palma G, Ramirez A, Frias MG, Reyes MR, et al. Molecular characterization of Histoplasma capsulatum isolated in treasures hunters. BMC Infec Dis. 2010;10:264. doi:10.1186/1471-2334-10-264
62. Yravedra J, Robledo AG, Renedo G, Aguirre M. Histoplasmosis. Un caso autóctono por inhalación de esporas en el laboratorio. Rev Esp Microbiol Clin. 1989;4:310-3.
63. Negroni R, Duré R, Ortiz Nareto A, Arechavala AI, Maiolo EI, Santiso GM, et al. Brote de histoplasmosis en la Escuela de Cadetes de la Base Aérea de Morón, Provincia de Buenos Aires, República Argentina. Rev Arg Microbiol. 2010;42:254-60.
64. Wheat LJ. Improvements in diagnosis of histoplasmosis. Expert Opin Biol Ther. 2006;6:1207-21.
65. Sanguily J, Fernández Ferrer O, León Blanco F. Histoplasmosis en Cuba. Reporte de un caso con breve revisión de la literatura. Arch Soc Est Clin Hab. 1951;44:1-44.
66. Barquet Chediak A, Chediak M, Magriñat G. Histoplasmosis: resumen de la enfermedad. Presentación de un caso diagnosticado por punción ganglionar. Rev Kuba. 1951;7:143-53.
67. Nocedo Pous B, Prince Baró A, Ferrerons Acevedo F. Contribución al estudio de la epidemiología de la histoplasmosis en Cuba. Rev Cubana Med. 1965;4:143-78.
68. Fernández Andreu CM, Martínez Machín G. Histoplasmosis en Cuba. Rev Iberoam Micol. 1994;11:52-3.
69. Fernández Andreu CM, Martínez Machín G. Histoplasma capsulatum var. capsulatum e histoplasmosis en Cuba. Rev Cubana Hig Epidemiol. 1996;34:34-42.
70. Font D'Escoubet E, Macola Olano S, Chang Puga M. Aislamiento de Histoplasma capsulatum del medio en Cuba. Rev Cubana Med Trop. 1975;27:115-27.
71. Armas Pérez L, Font D´Escoubet E, González Ochoa E, Macola Olano S. Histoplasmosis pulmonar: estudio clínico-epidemiológico de un brote en estudiantes. Rev Cubana Med. 1978;17:541-51.
72. Fernández Andreu CM, López Abraham AM. Confirmación diagnóstica mediante el cultivo del agente causal en dos casos de histoplasmosis ocupacional. Rev Cubana Med Trop. 1986;38:32-7.
73. Fernández Andreu CM, Martínez Machín G. Fuentes de infección de histoplasmosis en la Isla de la Juventud. Rev Inst Med Trop S Paulo.1992;34:441-6.
74. Capó de Paz V, Rodríguez ME, Borrajero Martínez IP, Martínez Rodríguez R. Reporte del primer caso de histoplasmosis cutánea en un paciente cubano de SIDA. Actas Dermosifilogr. 1990;81:429-31.
75. Arteaga Hernández E, Capó de Paz V, Pérez Fernández-Terán ML. Micosis oportunistas invasivas en el SIDA. Un estudio de 211 autopsias. Rev Iberoam Micol. 1998;15:33-5.
76. Rodríguez Barreras ME, Capó de Paz V, Fernández Andreu CM, Martínez Machín G, Ricardo Fonseca ME, Díaz M. Histoplasmosis cutánea diseminada como forma de presentación del SIDA. Actas Dermosifilogr. 1992;83:332-4.
77. Pérez Molina AD, Gala González A, Rodríguez Barreras ME, Capó de Paz V, Collazo Caballero S, Fernández Andreu C. Histoplasmosis con manifestaciones cutáneas en pacientes VIH/sida. Rev Cubana Med Trop. 2007;59(2):119-26.
78. Karimi K, Wheat J, Connolly P, Cloud G, Hajjeh R, Wheat E, et al. Differences in histoplasmosis in patients with acquired immunodeficiency syndrome in the United States and Brazil. J Infect Dis. 2002;186:1655-60.
79. Otcenášek M, Dvoøak J, Rosický B. Some epidemiological aspects of histoplasmosis on the light of Pavlovsky's theory. Folia Parasitol (Praha). 1967;14:193-206.
80. Menges RW. Clinical manifestations of animal histoplasmosis. Chapter 20. En: Ajello L, Chick EW, Furcollow ML, editors. Histoplasmosis. Proc Second Nat Conf., Springfield: CC Thomas Publisher; 1971. p. 162-169.
81. Forjaz MHH, Fischmann O. Histoplasmosis animal in Brazil: isolation of Histoplasma capsulatum from a dog in the Northern coast of São Paulo. Mycoses. 2010;28:191-4.
82. Hubálek Z. Emerging human infectious diseases: anthroponoses, zoonoses, and sapronoses. Emer Infect Dis. 2003;9:403-4.
83. Davies SF, Colbert RL. Concurrent human and canine histoplasmosis from cutting decayed wood. Ann Intern Med. 1990;113:252-3.
84. Saunders JR, Matthiesen RJ, Kaplan W. Abortion due to histoplasmosis in a mare. J Am Vet Med Assoc. 1983;183:1097-9.
85. Galvão Dias MA, Zancopé Oliveira RM, Giudice MC, Montenegro Netto H, Jordão LR, Grigorio IM, et al. Isolation of Histoplasma capsulatum from bats in the urban area of Sao Paulo State, Brazil. Epidemiol Infect. 2010. doi: 10.1017/S095026881000289X.
86. Canteros CE, Iachini RH, Rivas MC, Vaccaro O, Madariaga J, Galarza R, et al. Primer aislamiento de Histoplasma capsulatum de murciélago urbano Eumops bonariensis. Rev Arg Microbiol. 2005;37:46-56.
87. Feit C, Tewari RP. Immunogenicity of ribosomal preparations from yeast cells of Histoplasma capsulatum. Infect Immun. 1974;10:1091-7.
88. Gomez FJ, Gomez AM, Deepe GS. Protective efficacy of a 62-kilodalton antigen, HIS-62, from the cell wall and cell membrane of Histoplasma capsulatum yeast cells. Infect Immun. 1991;59:4459-64.
89. Gomez FJ, Allendoerfer R, Deepe GS. Vaccination with recombinant heat shock protein 60 from Histoplasma capsulatum protects mice against pulmonary histoplasmosis. Infect Immun. 1995;63:2587-95.
90. Deepe GS, Gibbons R. Protective efficacy of H antigen from Histoplasma capsulatum in a murine model of pulmonary histoplasmosis. Infec Immun. 2001;69:3128-34.
91. Guimarães AJ, Nosanchuk JD, Zancopé-Oliveira RM. Diagnosis of histoplasmosis. Braz J Microbiol. 2006;37:1-13.
92. Bava AJ, Zuiani MF. Comparación de las coloraciones de Giemsa y Grocott en el diagnóstico de la histoplasmosis. Acta Bioquim Clin Latinoam. 2007;41:395-8.
93. Hove MGM, Woods GL. Duration of fungal culture incubation in an area endemic for Histoplasma capsulatum. Diagn Microbiol Infect Dis. 1997;28:41-3.
94. Burtelow MA, Merker JD, Baron EJ. Growth of Histoplasma capsulatum isolates is better on potato dextrose agar with chloramphenicol than on brain heart infusion agar. J Mycol Méd. 2009;19:197-9.
95. Fressatti R, Dias-Siqueira VL, Svidzinski TIE, Herrero F, Kemmelmeier C. A medium for inducing conversion of Histoplasma capsulatum var. capsulatum into its yeast-like form. Mem Inst Oswaldo Cruz. 1992;87:53-8.
96. Kaufman L, Standard PG. Specific and rapid identification of medically important fungi by exoantigen detection. Ann Rev Microbiol. 1987;41:209-25.
97. Fernández Andreu CM, Vilarrubia Montes de Oca OL, Martínez Machín G, Oramas Rodríguez B. Utilización de exoantígenos para la identificación de Histoplasma capsulatum. Rev Cubana Med Trop. 1990;42:272-8.
98. Stockman L, Clark KA, Hunt JM, Roberts GD. Evaluation of commercially available acridinium ester-labeled chemiluminescent DNA probes for culture identification of Blastomyces dermatitidis, Coccidioides immitis, Cryptococcus neoformans, and Histoplasma capsulatum. J Clin Microbiol. 1993;31:845-50.
99. Chemally RF, Tomford JW, Hall GS, Sholtis M, Chua JD, Procop GW. Rapid diagnosis of Histoplasma capsulatum endocarditis using the AccuProbe on an excised valve. J Clin Microbiol. 2001;39:2640-1.
100. Brandt ME, Gaunt D, Iqbal N, McClinton S, Hambleton S, Sigler L. False-positive Histoplasma capsulatum Gen-Probe chemiluminescent test result caused by a Chrysosporium species. J Clin Microbiol. 2005;43:1456-8.
101. Santiago AR, Hernández B, Rodríguez M, Romero H. Comparación del método de hemocultivo convencional con el de lisis/centrifugación modificado para el diagnóstico de fungemias. Rev Iberoam Micol. 2004;21:198-201.
102. Oliveira FM, Fernandes SS, Severo CB, Guazzelli LS, Severo LC. Histoplasma capsulatum fungemia in patients with acquired immunodeficiency syndrome: detection by lysis-centrifugation blood-culturing technique. Rev Inst Med Trop S Paulo. 2007;49:135-8.
103. Freitas RS, Carvalho-Vivi JO, Zamboni IM, Assis CM, Costa-Martins JE, Vicentini-Moreira AP. The importance of serological assays in diagnosing acute pulmonary histoplasmosis. J Venom Anim Toxins Incl Trop Dis. 2009;15:278-88.
104. Torres-Rodríguez JM, Ribas Forcadell E, Gascón J, López-Jodra O, Espasa M. Utilidad diagnóstica de la prueba intradérmica con histoplasmina, en áreas no endémicas de histoplasmosis. Rev Iberoam Micol 2000;17:97-101.
105. Buitrago MJ, Gómez-López A, Monzón A, Rodríguez-Tudela JL, Cuenca-Estrella M. Evaluación de una técnica de PCR cuantitativa para el diagnóstico clínico de la histoplasmosis importada. Enferm Infecc Microbiol Clin. 2007;25:16-22.
106. Swartzentruber S, Rhodes L, Kurkjian K, Zahn M, Brandt ME, Connolly P, et al. Diagnosis of acute pulmonary histoplasmosis by antigen detection. Clin Infect Dis. 2009;49:1878-82.
107. Hage CA, Kirsch EJ, Stump TE, Kauffman CA, Goldman M, Connolly P, et al. Histoplasma antigen clearance during treatment of histoplasmosis in parients with AIDS determined by quantitative antigen enzyme immunoassay. Clin Vaccine Immunol. 2011;18:661-6.
108. Wheat LJ, Garringer T, Brizendine E, Connolly P. Diagnosis of histoplasmosis by antigen detection based upon experience at the histoplasmosis reference laboratory. Diag Microbiol Infect Dis. 2002;43:29-37.
109. Gómez BL, Figueroa JI, Hamilton AJ, Diez S, Rojas M, Tobón A, et al. Detection of the 70-kilodalton Histoplasma capsulatum antigen in serum of histoplasmosis patients: correlation between antigenemia and therapy during follow-up. J Clin Microbiol. 1999;37:675-80.
110. Scheel CM, Samayoa B, Herrera A, Lindsley MD, Benjamin L, Reed Y, et al. Development and evaluation of an enzyme immunosorbent assay to detect Histoplasma capsulatum antigenuria in immunocompromissed patients. Clin Vaccine Immunol. 2009;16:852-8.
111. Bialek R, Fischer J, Feucht A, Najvar IK, Dietz K, Knobloch J, et al. Diagnosis and monitoring of murine histoplasmosis by a nested PCR assay. J Clin Microbiol. 2001;39:1506-9.
112. Bialek R, Feucht A, Aepinus C, Just-Nubling G, Robertsosn VJ, Knobloch J, et al. Evaluation of two nested PCR assays for detection of Histoplasma capsulatum DNA in human tissue. J Clin Microbiol. 2002;40:1644-7.
113. Rickerts V, Bialek R, Tintelnot K, Jacobi V, Just-Nubling G. Rapid PCR-based diagnosis of disseminated histoplasmosis in an AIDS patient. Eur J Clin Microbiol Infect Dis. 2002;21:821-3.
114. Bracca A, Tosello ME, Girardini JE, Amigot SL, Gómez C, Serra E. Molecular detection of Histoplasma capsulatum var. capsulatum in human clinical samples. J Clin Microbiol. 2003;41:1753-5.
115. Guedes HL, Guimaraes AJ, Muniz M de, Pizzini CV, Hamilton AJ, Peralta JM, et al. PCR assay for identification of Histoplasma capsulatum based on the nucleotide sequence of the M antigen. J Clin Microbiol. 2003;41:535-9.
116. Martagon-Villamil J, Shrestha N, Sholtis M, Isada CM, Hall GS, Bryne T, et al. Identification of Histoplasma capsulatum from culture extracts by real-time PCR. J Clin Microbiol. 2003;41:1295-8.
117. Maubon D, Simon S, Aznar C. Histoplamosis diagnosis using a polymerase chain reaction method. Application on human samples in French Guiana, South America. Diagn Microbiol Infect Dis. 2007;58:441-4.
118. Muñoz C, Gómez BL, Tobón A, Arango K, Restrepo A, Correa MM, et al. Validation and clinical application of a molecular method for identification of Histoplasma capsulatum in human specimens in Colombia, South America. Clin Vaccine Immunol. 2010;17:62-7.
119. Reid TM, Schafer MP. Direct detection of Histoplasma capsulatum in soil suspension by two- stage PCR. Mol Cell Probes. 1999;13:269-73.
Recibido: 18 de junio de 2011.
Aprobado: 10 de julio de 2011.
Carlos M. Fernández Andreu. Instituto de Medicina tropical "Pedro Kourí". Autopista Novia del Mediodía km 6½. Lisa, La Habana, Cuba. Correo electrónico: cfandreu@ipk.sld.cu