Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.63 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULO ORIGINAL
Vigilancia activa de eventos adversos a la vacuna Pandemrix para prevenir la influenza AH1N1 en Cuba
Active surveillance of adverse effects of Pandemrix vaccine to prevent influenza A(H1N1) in Cuba
MSc. Belkys María Galindo Santana,I MSc. Otto Reinaldo Peláez Sánchez,II Dr. Miguel Angel Galindo Sardiña,II Lic. Milagros Leon Villafuerte,II Téc. Damarys Concepción Díaz,I Dr. C. Luis Estruch Rancaño,II MSc. Raydel Martínez Sánchez,I Dr. Manuel Santín PeñaII
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Ministerio de Salud Pública. La Habana, Cuba.
RESUMEN
Introducción: en abril de 2009, en México y Norteamérica, un nuevo virus fue identificado como causa de enfermedad respiratoria, el cual se expandió rápidamente a otros países. El 11 de junio de 2009 la Organización Mundial de la Salud notificó casos en 74 países y territorios, en 2 de sus regiones. Esta transmisión elevada y sostenida de este virus en el mundo, propició que se estableciera la fase 6 o de pandemia, lo cual indicó que la situación implicaba diseminación y no mayor gravedad.
Objetivos: reportar los eventos conocidos o nuevos tras la aplicación de la vacuna A (H1N1) Pandemrix, identificar los eventos más frecuentes en las embarazadas e investigar de inmediato los eventos severos asociados.
Métodos: se diseñó un estudio descriptivo prospectivo para caracterizar los eventos adversos a la vacuna Pandemrix, reportados en todo el país desde el Primero de abril hasta el 30 de junio de 2010. Se vacunaron 1 123 526 personas y se cubrió 100 % de las embarazadas.
Resultados: de la vigilancia activa desarrollada en el país se reportaron 5 763 síntomas y signos en 3 401 personas (615 reportes en embarazadas). La tasa general de reportes fue de 302,7 x 100 000 dosis aplicadas. Los eventos adversos: fiebre, cefalea, dolor, inflamación y enrojecimiento en el sitio de inyección, decaimiento, artralgia, manifestaciones alérgicas, vómitos y náuseas como síntomas más frecuentes. Estos 10 síntomas y signos representan 79,1 % del total de eventos reportados. Se vacunó un total de 80 317 embarazadas, de las cuales 615 reportaron eventos adversos, lo que representa 0,8 % del total de gestantes vacunadas. En los niños la fiebre fue el síntoma que más notificaciones produjo (193), seguido de reacciones locales en el sitio de inyección (23), vómitos (20) artralgias (17), cefalea (11), decaimiento (10) y convulsiones relacionadas con fiebre (6). Se investigaron 8 eventos como severos.
Conclusiones: con la aplicación de la vacuna estaban relacionados 3 eventos, otros 3 no relacionados con la aplicación de la vacuna y en 2 se decidió que eran no concluyentes (2 abortos espontáneos). No se reportaron fallecidos. Se demostró la capacidad del sistema de salud cubano para la aplicación de la vacuna con una vigilancia activa en un corto período de tiempo. En los datos derivados de la vigilancia de eventos supuestamente atribuidos a la vacunación o inmunización, no se reportó ningún evento inusual, por lo que no se sugieren problemas de seguridad relacionados con la vacuna Pandemrix.
Palabras clave: influenza A(H1N1), pandemia, vigilancia activa, vacuna Pandemrix, eventos adversos.
ABSTRACT
Introduction: in April 2009, a new virus was identified in Mexico and North America as the cause of a respiratory disease. The virus quickly spread over other countries. On June 11, 2009 the World Health Organization (WHO) reported cases in 74 countries and territories located in 2 of its regions. The high sustained transmission of this virus worldwide led to establish the phase 6 or the pandemic phase, indicating that the situation had to do with spreading rather than increased severity.
Objectives: to report on already known or new events after the administration of vaccine A(H1N1) called Pandemrix, to identify the most frequent events occurred in pregnant women and to research into the associated severe events.
Methods: a prospective descriptive study was designed to characterize the adverse effects of Pandemrix reported across the country from April 1st to June 30th, 2010. A total of 1,123,526 people were vaccinated in which 100 % of pregnant women were included.
Results: active surveillance nationwide reported 5 763 signs and symptoms detected in 3 401 people (615 reports from pregnant women). The overall rate of reports was 302.7 x 100 000 doses administered. Adverse events such as fever, headache, pain, swelling and redness at the injection site, malaise, arthralgia, allergic reactions, nausea and vomiting were reported as common symptoms. These 10 symptoms and signs accounted for 79.1 % of all the reported events. A total number of 80 317 pregnant women were vaccinated of whom 615 reported adverse effects, accounting for 0.8 % of the vaccinated pregnant women. Fever was the most notified symptom in children (193) followed by local reactions at the injection site (23), vomiting (20), arthralgia (17), headache (11), malaise (10) and high fever-related seizures (6). Eight events were analyzed as severe.
Conclusions: the administration of the vaccine was related to 3 events, unrelated to other 3 events and 2 were classified as inconclusive (3 miscarriages). No deaths were reported. The capacity of the Cuban Health System for the administration of this vaccine with active surveillance in a short period of time was proved. Data from monitoring of events that were supposedly attributable to vaccination or immunization did not notify any unusual event. Therefore, no safety problem is associated to the Pandemrix vaccine.
Key words: influenza A(H1N1), pandemic, active surveillance, Pandemrix vaccine, adverse events.
INTRODUCCIÓN
En abril de 2009, en México y Norteamérica, un nuevo virus fue identificado como causa de enfermedad respiratoria. Este virus se expandió rápidamente a otros países. El 11 de junio de 2009 la Organización Mundial de la Salud (OMS) notificó casos en 74 países y territorios en 2 de sus regiones. Esta transmisión elevada y sostenida de este virus en el mundo, propició que se estableciera la fase 6 o de pandemia, lo cual indicó que la situación implicaba diseminación y no mayor gravedad.1,2 La Organización Mundial de la Salud la calificó como una "emergencia de salud pública de importancia internacional".3 Este nuevo virus se consideró pandémico, porque no existía inmunidad previa y además por su capacidad de afectar el tracto respiratorio inferior, se señalan como diferencias con los virus estacionales. Los niños y adultos jóvenes, personas de cualquier edad con enfermedad crónica pulmonar y cardiaca, aquellas con desórdenes metabólicos, con enfermedad renal crónica, hepatitis crónica, ciertas condiciones neurológicas, mayores de 65 años y obesos presentaron el mayor riesgo de infección.4,5 Las embarazadas constituyeron un grupo importante, con un espectro de enfermedad que puede ser leve, hasta progresar rápido hacia las formas graves y fatales (neumonía y deshidratación). Algunos estudios demostraron que en las embarazadas infectadas las posibilidades de requerir hospitalización en unidades de cuidados intensivos resultaron 10 veces mayores que en el resto de las personas infectadas, y entre 7 y 10 % de los casos hospitalizados fueron mujeres en el segundo o tercer trimestre del embarazo.1,6-8
Dada la magnitud y rapidez de la pandemia, el desarrollo de vacunas contra la influenza pandémica constituyó una alta prioridad y un reto para su producción. La vacuna específica contra el nuevo virus pandémico fue una de las herramientas que permitió la mitigación de la pandemia.9
Diferentes tipos de vacunas están disponibles a nivel mundial, incluidas vacunas inactivadas con adyuvantes y sin estos, y vacunas atenuadas, las que han demostrado ser seguras, que pueden ser administradas según las recomendaciones del grupo de expertos sobre inmunizaciones que asesora a la OMS.10
El balance riesgo-beneficio de las vacunas pandémicas utilizadas para la pandemia de gripe A (H1N1) actual es favorable.11 Como parte del plan de preparación para la influenza pandémica, la OMS reunió a grupos de reguladores de todo el mundo, se establecieron lineamientos especiales para la regulación de estos nuevos productos, por su necesidad de uso inmediato. Los documentos WHO biosafety risk assessment and guidelines for the production and quality control of human influenza pandemic vaccines, WHO TRS No. 941, 2007. p. 265-290 y Regulatory Preparedness for Human Pandemic Influenza Vaccines WHO/BS/07.2007, presentan una serie de herramientas útiles para la regulación y el control de estos productos.
La calidad de las vacunas, en especial de esta nueva vacuna contra el virus de la influenza pandémica A (H1N1), está garantizada y se sustenta en la precalificación que la OMS hace a los laboratorios proveedores, y en el control de calidad que realizan las autoridades nacionales de regulación en cada país para el registro y la liberación de los lotes de vacuna para su uso masivo.2 Además, la autoridad nacional cubana reguladora de medicamentos (CECMED) tiene establecido la regulación 17/2008, en la cual se describe la metodología de investigación, interrelación y responsabilidades de esta entidad con vistas a la detección temprana y la respuesta apropiada a estos eventos que pueden presentarse después de la vacunación, y trabaja en estrecha colaboración con el sistema de vigilancia de eventos supuestamente atribuibles a la vacunación (ESAVI) del Programa Nacional de Inmunización (PNI). Esta es una de las funciones básicas establecidas por la OMS con la finalidad de recopilar y evaluar información sobre la calidad, efectividad y seguridad de los medicamentos y(o) vacunas durante su comercialización.12
En el contexto de la Cooperación Técnica de la Organización Panamericana de la Salud/Organización Mundial de la Salud (OPS/OMS) para la introducción de la vacuna pandémica, se desarrolló el Taller para la implementación de la vigilancia de los eventos supuestamente atribuidos a la vacunación e inmunizaciones (ESAVIs) de la vacuna H1N1, la prevención y el manejo de crisis¨ en La Habana, Cuba, del 26 al 28 de enero de 2010, que contó con la participación de 52 funcionarios de salud de 16 países de la Región, quienes representaron a la autoridad regulatoria y al programa de inmunizaciones de cada país; cuyo fundamento se basó en fortalecer e intensificar las acciones de vigilancia de estos eventos atribuidos a la vacuna antipandémica H1N1, para evitar cualquier incidente que reste credibilidad a las acciones de vacunación.
Los eventos supuestamente atribuidos a vacunación o inmunización (ESAVI), terminología utilizada en la región de las Américas,13,14 se conceptualizan como un cuadro clínico que tiene lugar después de la administración de la vacuna, que podría estar relacionado con esta y que causa gran preocupación en la población.14,15 Esta definición se encuentra bien establecida por la Organización Panamericana de la Salud para los países miembros, que tienen sistemas de vigilancia de eventos adversos a la vacunación, lo cual permite estandarizar esta definición en los países.12,15,16 Los eventos severos se definen como aquellos que causan peligro para la vida, hospitalización, discapacidad, o pueden causar la muerte.
El siguiente artículo tiene como objetivos: reportar los eventos conocidos o nuevos tras la aplicación de la vacuna A (H1N1) Pandemrix, identificar los eventos más frecuentes después de la administración de esta vacuna fundamentalmente en las embarazadas e investigar de inmediato los eventos severos asociados temporalmente a la administración de la vacuna.
MÉTODOS
Cuba ya contaba con un Plan Nacional para el enfrentamiento de la Influenza pandémica A (H5N1) desde octubre de 2005, que fue actualizado para el enfrentamiento de la influenza pandémica A (H1N1) 2009 y puesto en vigor el 19 de mayo de 2009. Diseñó su estrategia de vacunación antipandémica sobre la base de la vacuna que fue donada por la OMS. Además se consultaron las recomendaciones realizadas por esta organización para esa vacuna. Teniendo en cuenta la experiencia acumulada por Cuba en las más de 4 décadas de implementado el Programa Nacional de Inmunización con la realización de varias campañas de vacunación, estos constituyeron aspectos muy importantes para lograr esa estrategia. Se diseñó un estudio descriptivo prospectivo para caracterizar los eventos adversos a la vacuna Pandemrix, reportados en todo el país desde el Primero de abril hasta 30 de junio de 2010. La OMS donó una cifra de dosis para inmunizar aproximadamente el 10 % de la población en riesgo, o sea 1 124 000 personas.13 En Cuba se aplicó la vacuna Pandemrix, producida por la Glaxo Smith Kline, de virus fraccionados, inactivada y adyuvada. Estas vacunas adyuvadas permiten un uso más amplio y eficaz de la vacunación y su perfil de seguridad puede considerarse similar a las vacunas estacionales.17
Se describen los grupos de riesgo a vacunar en el cuadro siguiente:18
| Grupos | Universo |
| Embarazadas y puérperas (todas la embarazadas registradas en el momento de comenzar la campaña, independientemente de su edad gestacional y las paridas hasta 42 d después de la fecha de parto) | 76 700 |
| Trabajadores de salud (todos los trabajadores de la salud vinculados con la línea de atención de personas con síntomas respiratorios en la atención primaria y secundaria, incluye la atención ambulatoria, a hospitalizados, al que está grave, personal de toma de muestra y laboratorios) | 179 200 |
| Instituciones de salud (todos los trabajadores y pacientes de los hospitales psiquiátricos, hogares de ancianos y centros psicopedagógicos u hogares de impedidos) | 38 400 |
| Instituciones escolares (todos los trabajadores relacionados con la atención directa a escolares y todos los matriculados en la enseñanza especial y los círculos infantiles mayores de 6 meses de edad) | 212 700 |
| Trabajadores de sectores esenciales (frontera, puertos, aeropuertos, la aeronáutica civil, turismo de salud, de la atención a discapacitados no institucionalizados, las instituciones armadas y deportistas de alto rendimiento) | 105 540 |
| Personas mayores de 6 meses con factores de riesgo por enfermedad crónica o inmunodepresión (menores de 18 años con malformaciones cardiovasculares, enfermedades oncológicas, hematológicas y enfermedad fibroquística, todos los discapacitados físico-motores y mixtos, pacientes con transplantes, diabéticos insulinodependientes, personas viviendo con VIH, pacientes con insuficiencia renal crónica y todos los asmáticos grado III y los grados II menores de 18 años) | 508 000 |
| Dosis no asignadas | 3 460 |
| Total a vacunar | 1 124 000 |
Fuente: Direcciones Provinciales de Salud y OACE implicados.
La vacunación comenzó a nivel nacional el Primero de abril de 2010. Esta se realizó en la modalidad "campaña" (en 2 etapas), con 1 mes de duración a partir de su inicio, con una semana adicional para recuperar dosis y equiparar la información definitiva. Se desarrolló desde los "vacunatorios" de las 498 áreas de salud del país. Se aplicó en una primera etapa a las embarazadas y otros grupos de riesgo incluidos los niños entre 6 meses y 9 años que recibieron la mitad de la dosis del adulto (0,25 mL). En una segunda etapa se reactivaron a estos niños mencionados antes.
Plan de capacitación: se dirigió inicialmente a los directores provinciales de salud, a los jefes de programa de vacunación provincial y municipal, a los médicos de familia, a las enfermeras de áreas relacionadas de manera directa o indirectamente con la introducción de la vacuna; se realizó en cascada con el objetivo de elevar los conocimientos y brindar información a la población y a los trabajadores del sector salud sobre la vacuna contra la gripe pandémica A (H1N1), que se aplicó en Cuba, y sobre sus beneficios y características.
Se elaboró un plan con diseño de estrategias de promoción basadas en información clara y eficaz, con el objetivo de fortalecer la confianza de la comunidad y garantizar la misma calidad a todos los niveles.
Médico de familia: fue el responsable de la ejecución del sistema de vigilancia de los eventos adversos consecutivos a la vacuna. Tanto en el consultorio como en el vacunatorio cumplió con las funciones de enfoque educativo, explicó los beneficios derivados de la vacunación, así como los posibles riesgos. A su vez orientó a los receptores de vacunas o a los familiares del vacunado que serían objeto de vigilancia durante los 3 primeros días de la vacunación, a la primera semana después, y luego a los 30 y 42 d de aplicada. Se exigió del cumplimiento de las normas técnicas de vacunación y se observó durante 1 h después de ser vacunados. Fue el encargado de reflejar en la encuesta epidemiológica de eventos adversos a la vacunación modelo 84-30-2 (utilizada en todo el país desde la creación del sistema de vigilancia de eventos adversos a la vacunación en 1999)19,20 el(los) síntoma(s) que el paciente refería. Esta encuesta transitó desde el médico de familia, área de salud, municipio, hasta llegar a los jefes de programa de vacunación provincial que son los encargados del llenado de la base de datos en Microsoft Office Excel 2003 y después enviar al Instituto de Medicina Tropical "Pedro Kourí" (IPK); donde se agrupan en una base de datos general, en la cual se realiza la revisión y comprobación, para hacer el procesamiento, análisis e interpretación de los resultados.
Recolección y análisis de datos: la fuente primaria de obtención de la información se recogió a través del modelo de encuesta epidemiológica, recibido de todas las provincias del país.
Los informes se introdujeron en una base de datos creada en Excel, para facilitar los cálculos correspondientes. Para el análisis se emplearon frecuencias absolutas, frecuencias relativas (porcentajes) y tasas (generales y específicas). La tasa de eventos adversos se calculó por 100 000 dosis aplicadas (DA) y por años. Los datos se organizaron en tablas y figuras para su análisis.
En el caso de reportarse un evento severo la notificación era inmediata y se comenzaba a realizar la investigación lo más rápido posible
Las investigaciones pueden dar como resultado en dependencia de la causa, los resultados siguientes:
1. Está relacionado con la vacunación:
— Inducidos por la vacuna: está estrechamente relacionado a los componentes de esta, a los cuales puede ser alérgica la persona que se vacuna. Estas reacciones relacionadas con las propiedades intrínsecas de las vacunas, se clasificarán por su gravedad, relación causal y según los componentes de la vacuna que las produce
— Errores operativos del programa de vacunación (error programático), entre estos se encuentran: vacunas aplicadas en sitios incorrectos, vía de administración inadecuada, uso de agujas y jeringuillas no esterilizadas, manipulación incorrecta de agujas, vacunas reconstituidas con diluentes no apropiados, incremento de la dosis de vacunas, vacunas y diluentes contaminados, sustitución de vacunas por otros productos, incorrecta conservación de la vacuna, entre las más importantes.
2. No está relacionado con la vacunación:
Coincidentales: cuando se comprueba que el incidente médico pudo haber ocurrido aun si el individuo no fuese vacunado.
3. No es concluyente:
De causa desconocida: cuando el incidente médico no está inducido por la vacuna, ni por errores programáticos, ni es coincidental.12,21
RESULTADOS
En la campaña fueron vacunadas 1 123 526 personas. Como resultado de la vigilancia activa de eventos adversos a la vacunación desarrollada en el país se reportaron 5 763 síntomas y signos, en 3 401 personas (615 reportes en embarazadas).
La tasa general de reportes resultó de 302,7 x 100 000 dosis aplicadas.
En Cuba se aplican otras vacunas como la Pentavalente (DPT, Hib, HB) , la AM_BC y DPT en el esquema de vacunación infantil. Si se realiza una comparación con las tasas de eventos supuestamente atribuidos a la vacunación e inmunización como se observa en la tabla 1, la tasa de notificaciones de eventos asociados a la vacuna contra la influenza A (H1N1), no muestra un comportamiento que difiera de manera significativa respecto a otras vacunas contempladas en el Programa Nacional de Inmunización (PNI).
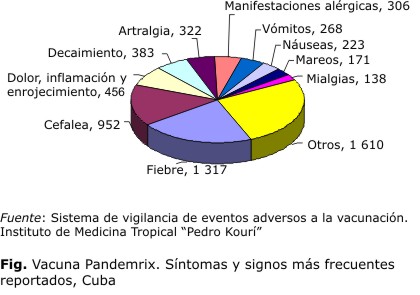
Los eventos adversos reportadas fueron: la fiebre, cefalea, dolor, inflamación y enrojecimiento en el sitio de inyección, decaimiento, artralgia, manifestaciones alérgicas, vómitos y náuseas, como síntomas más frecuentes. Estos 10 síntomas y signos representan 79,1 % del total de eventos reportados (Fig.).
Se vacunó en el país un total de 80 317 embarazadas (más de lo que estaba planificado para ese grupo de riesgo), de las cuales 615 reportaron eventos adversos, lo que representa 0,8 % del total de gestantes vacunadas. Los eventos adversos más frecuentes reportados en este grupo de riesgo se describen en la tabla 2.
En las gestantes la fiebre, cefalea, vómitos, dolor, enrojecimiento en el sitio de inyección fueron los eventos que más se reportaron. En los 2 casos de abortos espontáneos, existían antecedentes de abortos a repetición.
En los niños (hasta 9 años de edad), la fiebre fue el síntoma que más notificaciones produjo (193), seguido de reacciones locales en el sitio de inyección (23), vómitos (20) artralgias (17), cefalea (11), decaimiento (10) y convulsiones relacionadas con fiebre (6). En relación con la fiebre está referido en la ficha técnica de esta vacuna que la fiebre se eleva tras la segunda dosis, que coincide con el presente trabajo. La agencia europea de medicamentos en su informe plantea estos síntomas como los más comunes, solo difiere en que los vómitos ocupan el segundo lugar en su lista de notificaciones.
Se comunicaron 8 eventos severos. De los resultados de la investigación, se concluye que 3 eventos estaban relacionados con la aplicación de la vacuna, 3 no relacionados con su aplicación y en 2 se decidió que eran no concluyentes, que son los 2 abortos espontáneos.
No se reportaron fallecidos con la aplicación de esta vacuna en el país.
DISCUSIÓN
La vacunación antipandémica contra el A (H1N1) fue aplicada a personas con factores de riesgo predisponentes, a diferencia de otras vacunas que van dirigidas a una población predominantemente sana, además se trata de un proceso de vigilancia activa, intensificada, en la cual la frecuencia de notificaciones se incrementa.
La vigilancia de los eventos supuestamente atribuidos a la vacunación e inmunización fue importante debido a la limitada información de la nueva vacuna. La solidez del sistema de salud pública cubano, su capacidad técnica para poder realizar esta vigilancia, la disponibilidad de los recursos humanos (médicos y enfermeras de familia) y un sistema de vigilancia de eventos adversos que ya cuenta con 10 años de implementado en el país, contribuyeron a desarrollar la vigilancia activa a esta vacuna con todo el rigor que se necesitaba.
Los eventos adversos notificados son similares a los descritos en la ficha técnica de esta vacuna, y catalogados como los más frecuentes.17 La agencia europea de medicamentos expone los principales eventos reportados con esta vacuna, solo que lo refleja por sistemas, y de forma general coincide con los principales síntomas y signos. La autoridad nacional de medicamentos y productos en salud de Portugal informa que la fiebre, cefalea, dolor, inflamación y enrojecimiento en el sitio de inyección, decaimiento, artralgia, manifestaciones alérgicas, son los síntomas con mayor notificación.22,23
La Organización Panamericana de la Salud (OPS) solicitó colaboración de todos los países de la región en la vigilancia de los ESAVIs, con especial atención en las mujeres embarazadas que fueran vacunadas y realizar un intercambio de resultados preliminares de vigilancia de la seguridad de estas vacunas antipandémicas. Hasta el 3 de septiembre de 2010, 31 países de la región de las Américas habían vacunado 199 293 352 personas con la influenza pandémica, especialmente entre los grupos de riesgo. Solo 20 países reportaron eventos adversos, para un total de 7 692.24 La agencia europea de medicamentos ha recibido casos de abortos, muerte intrauterina, parto prematuro o hipoquinesia fetal con vacuna Pandemrix y Focetria. La agencia portuguesa de medicamentos notifica 3 abortos poco después de ser vacunadas con este inmunobiológico. Estas 2 agencias consideran que no hay actualmente pruebas de que estos eventos hayan sido causados por las correspondientes vacunas.22,23
Según lo reportado internacionalmente con la aplicación de esta vacuna en embarazadas, el Irish Medicines Board de Irlanda en su reporte del Primero de abril de 2010 reporta 17 eventos adversos; el dolor e inflamación en el sitio de inyección y la fiebre son los que más se notificaron, similar a nuestros resultados y además reportan 1 caso de aborto espontáneo en una mujer con historia de abortos a repetición.
Ellos concluyeron que no existían evidencias que sugirieran que la vacunación estaba directamente relacionada con el evento.25
En relación con los eventos adversos en los niños, la fiebre fue el síntoma con mayor frecuencia de reportes; otros síntomas como reacciones locales en el sitio de inyección, vómitos, artralgias, cefalea, decaimiento y convulsiones febriles también resultaron descritos. La agencia europea de medicamentos en su informe refleja estos síntomas como los mas comunes, solo difiere en que los vómitos ocupan el segundo lugar en su lista de notificaciones. Sin embargo, el sistema de vigilancia cubano comunica 3 casos de epistaxis, que no fueron notificados previamente.22
Como resultado de la investigación de los eventos adversos severos, se concluye que: 3 eventos estaban relacionados con la aplicación de la vacuna, 3 no relacionados con su aplicación y en 2 se decidió que eran no concluyentes, que son los 2 abortos espontáneos. No existen reportes de que los abortos hayan sido causados por las correspondientes vacunas.22,23
Los datos derivados de la vigilancia de eventos supuestamente atribuidos a la vacunación o inmunización no reportaron ningún evento inusual.
Se concluye que:
— La capacidad y organización del Sistema de Salud cubano se demostró para la aplicación de esta vacuna con una vigilancia activa en un corto período de tiempo.
— Los datos derivados de la vigilancia de ESAVIs no reportaron ningún evento inusual, por lo que no se sugieren problemas de seguridad relacionados con la vacuna Pandemrix.
— El universo total de las embarazadas del país fue vacunado, teniendo en cuenta que es el grupo de mayor riesgo, sin encontrar señales de alerta.
— Los eventos severos asociados temporalmente a la aplicación de esta vacuna se reportaron e investigaron.
— La vacuna Pandemrix contra el virus de la influenza AH1N1 tiene un perfil de inocuidad similar al de las vacunas contra la gripe estacional.
— La colaboración entre la autoridad nacional regulatoria de medicamentos (CECMED) y el programa nacional de inmunización (PNI) resultó evidente.
AGRADECIMIENTOS
Por la intervención de los médicos y enfermeras de las 498 áreas de salud que participaron en el proceso de la vacunación y la vigilancia, a los jefes de programas de vacunación provinciales y municipales, a directivos y funcionarios del grupo de enfrentamiento nacional, a la autoridad nacional regulatoria de medicamentos cubana (CECMED), que mostró incondicionalidad en todo momento. Sin su apoyo, este trabajo no hubiese sido una realidad objetiva.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Clinical management of human infection with pandemic (H1N1) 2009: revised guidance. Available at guidance: http://www.who.int/csr/disease/swineflu/guidance/surveillance/WHOcasedefinitionswineflu20090429
2. OPS/ OMS. Vacunación segura. Vigilancia de los Eventos Supuestamente Atribuidos a la Vacunación o Inmunización de la Vacuna Contra la Influenza Pandémica A (H1N1) 2009 y Prevención de Crisis; 2010. p. 5-12.
3. Pandemic (H1N1) 2009. World Health Organization Global alert and reponse [cited 17 Oct 2010]. Disponible en: http://www.who.int/csr/disease/swineflu/en/index.html
4. OPS/OMS. Inmunización Integral de la Familia. Área de Salud Familiar y comunitaria Plan Regional para la Vacunación en Caso de Pandemia de Influenza; 2009. p. 4-6.
5. Vacunas pandémicas. Ministerio de Sanidad y política social. Gobierno de España. Consideraciones y recomendaciones de su utilización en el contexto actual.30 octubre de 2009.
6. Jamieson DJ, Honein MA, Rasmussen SA, et al. H1N1 2009 influenza virus infection during pregnancy in the USA. Lancet 2009;374:451-8.
7. Tamma PD, Ault KA, del Rio C, Steinhoff MC. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol. 2009:547-51
8. Neal A. Halsey, Saad B. Omer. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol. 2009:547-52
9. OPS/OMS. Lineamientos técnicos para la vacunación contra el virus de la Influenza Pandémica. 2009:11-13
10. Ledesma MR. Enfermedad viral y embarazo ¿Qué hacer en caso de influenza AH1N1? Rev Mexicana Anestesiol. 2010;l33(3):40-44.
11. Lakemedelsverket. Medical Product Agency. Summary of Adverse Drug Reaction reports in Sweden with Pandemrix received through January 8 [cited 18 Ene 2010]. Available in: http://www.lakemedelsverket.se/english/Allnews/NYHETER-2010/Summary-of-Adverse-Drug-Reaction-reports-in-Sweden-with-Pandemrix-received-through-January-8/
12. República de Cuba. Ministerio de Salud Pública. Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED). Regulación no. 17 2008. Directrices para la investigación de los eventos adversos supuestamente atribuibles a la vacunación o inmunización (ESAVI).
13. Pickering LK, Baker CJ, Freed L, Grogg S, Poland GA, Rodewal LE, et al. Infectious Diseases Society of America. Immunization programs for infants, children, adolescents, and adults: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2009;49(6):817-40.
14. Organización Panamericana de la Salud. Organización Mundial de la salud. Vacunación segura. Módulos de capacitación. Modulo IV. Aspectos técnicos y clínicos de los eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI); 2007. p. 2.
15. Olivera L, Castillo C, Donovano C, Peña J, Andrés J. Vacunación segura. Avances recientes en inmunización, 2da edición. Publicación Científica No. 619. 2007;69-86.
16. Severino A, Battistini T, Pérez A, Patricia L, Fedelli S, Moreno J, et al. Estudio de un efecto adverso supuestamente atribuible a la vacunación e inmunización en el marco de una campaña de vacunación: experiencia en Catamarca. Rev Hosp Niños de Buenos Aires. 2005;47( 214):264-9.
17. Pandemrix. Ficha técnica de las características del producto. Agencia Europea de Medicamentos (EMEA) [citado 20 Mar 2010]. Disponible en: http://www.emea.europa.eu/
18. MINSAP. Despliegue de la vacuna contra la influenza A (H1N1) pandémica. Plan de vacunación en Cuba; 2010.
19. Ministerio de Salud Pública. Programa de sistema de vigilancia de eventos adversos consecutivos a la vacunación. Ciudad de La Habana; 1999.
20. Galindo BM, Galindo MA, Pérez A. Sistema de vigilancia de eventos adversos consecutivos a la vacunación en la República de Cuba. Rev Cubana Med Trop. 1999;51(3):194-200.
21. Organización Panamericana de la Salud. Organización Mundial de la Salud. Vacunación segura ¿Cómo enfrentar los eventos supuestamente atribuidos a la vacunación e inmunización? Washington DC: OPS; 2002. p. 9-12.
22. Pandemrix. Vacuna para la pandemia gripal (H1N1) (virión escindido, inactivado, con adyuvante) A/California/7/2009. Ref.doc: EMEA/681670/2009. Disponible en: http://www.ema.europa.eu
23. Farmacovigilancia de las vacunas de la gripe A (H1N1) [citado 11 Feb 2010]. Disponible en: http//www.infarmed.pt
24. OPS/OMS. Report on the Progress of Pandemic Influenza (H1N1) Vaccination in the Region of the Americas; 2010. p. 2-4.
25. Irish Medicines Board. Available in: http://www.imb.ie/EN/Safety—Quality/Advisory-Warning—Recall-Notices/Human-Medicines/Update-on-the-National-Monitoring-Experience-with-Pandemic-H1N1-Vaccines.aspx
Recibido: 2 de junio de 2011.
Aprobado: 10 de julio de 2011.
Belkys Maria Galindo Santana. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía. Km 6 ½. Lisa, La Habana, Cuba. Correo electrónico: bgalindo@ipk.sld.cu