Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.63 no.3 Ciudad de la Habana sep.-dic. 2011
ARTÍCULO ORIGINAL
Alteración de la carga eritrocitaria utilizando el método de azul Alcian en extractos de Ascaris lumbricoides
Change of erythrocyte charge with the use of Alcian blue method in Ascaris lumbricoides extracts
Bioq. Patricia Ponce de León, Aux. Santiago Di Vita, Lic. Liliana Racca, Dra. Claudia Biondi, Dra. Juana Valverde
Universidad Nacional de Rosario, Argentina.
RESUMEN
Introducción: el estudio de las interacciones hospedador-parásito es un nuevo desafío para comprender aspectos del metabolismo parasitario, los mecanismos de invasión, escape inmunológico y daño. Ascaris lumbricoides puede provocar anemia y trombosis. Previamente se demostró que este parásito altera la carga superficial eritrocitaria, lo cual indica que puede captar ácido siálico del glóbulo rojo.
Objetivo: estudiar el efecto producido por extractos del parásito adulto sobre la carga eritrocitaria, utilizando el método de azul Alcian y comparar su sensibilidad con el método de Polibrene.
Métodos: se trabajó con 55 extractos parasitarios [EA] y con suspensiones de eritrocitos grupo O. Se realizó el tratamiento de los glóbulos incubando el sedimento con igual volumen de [EA] a 37 ºC durante 1 h. El Control (eritrocitos sin contacto con [EA]) fue incubado con tampón fosfato pH 7,4. Se aplicó el método de azul Alcian y se determinó la carga aniónica eritrocitaria porcentual (CAE%) en el Control y en los glóbulos tratados. Se definió el coeficiente experimental de carga aniónica eritrocitaria (Cexp CAE), como el cociente entre CAE% final e inicial.
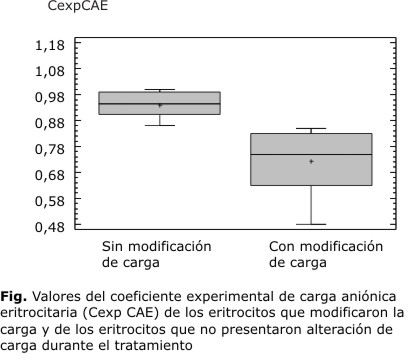
Resultados: se observó que 27 de los 55 [EA] (49,1 %) modificaron la carga de los glóbulos rojos, el Cexp CAE para estos eritrocitos resultó 0,75 ± 0,1144 y para los que no mostraron variación de carga de 0,94 ± 0,04450. El análisis estadístico concluyó que los métodos de Polibrene y de azul Alcian tienen sensibilidades comparables (p> 0,20).
Conclusiones: Ascaris lumbricoides es capaz de captar ácido siálico del eritrocito, lo que contribuiría a explicar la trombosis atribuida al parásito, pero también sugeriría que el nematodo lo podría utilizar en sus rutas metabólicas o en sus estrategias de evasión inmunológica.
Palabras clave: Ascaris lumbricoides, ácido siálico, método azul Alcian.
ABSTRACT
Introduction: the study of the host-parasite interactions is a new challenge to understanding some aspects of the parasitic metabolism and the mechanisms of invasion, immunological evasion and damage. Ascaris lumbricoides may cause anemia and thrombosis. It was previously shown that Ascaris lumbricoides modified the superficial charge of erythrocytes, which means that the parasite can capture sialic acid from the red blood cell.
Objective: to study the effect of adult parasite extracts on the erythrocyte charge using the Alcian Blue method and to compare its sensitivity with the Polybrene method.
Methods: fifty five adult parasite extracts and Group O erythrocyte suspensions were used. The erythrocytes were treated by incubating the sediment with an equal volume of parasite extracts for one hour at 37 ºC. The control group (erythrocytes without any contact with the parasite extracts) was incubated with pH 7.4phosphate buffer solution. Alcian Blue method was applied and the percentage erythrocyte anionic charge was determined in the control group and in the treated red cells. The experimental coefficient of erythrocyte anionic charge was defined as the quotient between the initial and the final percentage erythrocyte anionic charge.
Results: it was shown that 27 out of 55 parasite extracts (49.1 %) modified the charge of the red blood cells, being their experimental coefficient of the erythrocyte anionic charge 0.75 ± 0.1144 whereas the same coefficient amounted to 0,94 ± 0.0445 for those which did not show any charge variation. The statistical analysis concluded that the Polybrene and Alcian Blue Methods had comparable sensitivities (p>0.20).
Conclusions: A. lumbricoides is able to capture sialic acid from the erythrocyte, which would not only explain the thrombosis attributed to the parasite, but also suggest that the nematode could use this acid either in its metabolic routes or for its strategies of immunological evasion.
Keywords: Ascaris lumbricoides, sialic acid, Alcian Blue method.
INTRODUCCIÓN
El desarrollo de las infecciones parasitarias y la gravedad que pueden adquirir en cada individuo, es el resultado de la relación que se establece entre el sistema inmunitario del hospedador y las estrategias de evasión que utiliza el parásito. El estudio de las interacciones entre ambos, se ha convertido en un nuevo desafío para comprender no solo aspectos del metabolismo parasitario, sino también los mecanismos de invasión, escape inmunológico y daño.1,2 En este contexto, la glicobiología ha aportado una nueva visión, al demostrar la importancia y la participación de los glicoconjugados del hospedador y del parásito.3
El ácido siálico, responsable de la carga del glóbulo rojo, además de su importancia hemorreológica y hemodinámica,4 se encuentra presente en glucoproteínas y glucolípidos involucrados en funciones biológicas como son los procesos de reconocimiento celular, la vida media de células y las proteínas plasmáticas, la modulación del sistema inmune y apoptosis. También es ligando de moléculas de adhesión, como por ejemplo, selectinas o sialoadhesinas, mediando adhesión celular o transducción de señales.3
La ascariosis constituye un problema de salud pública en países no desarrollados. La infección alcanza mayor prevalencia en niños y compromete a los 2 sexos por igual. Este parásito posee una gran resistencia metabólica y capacidad de reproducción, lo que explica la alta frecuencia de casos humanos.5 El ejemplar adulto puede producir anemia, también son frecuentes la pérdida de peso, el síndrome diarreico y el malestar general. El estado de desnutrición, especialmente en los niños, retrasa el desarrollo. Cuando hay un gran número de gusanos adultos se pueden producir oclusiones y suboclusiones del intestino. Otras posibles complicaciones son las migraciones ectópicas del parásito, en su forma larvaria o adulta, hacia otros órganos, las cuales pueden producir trombosis.5-7
En experiencias preliminares, aplicando el método de partición en sistemas bifásicos acuosos (Dx/PEG)8 y el método de Polibrene,9 se demostró que Ascaris lumbricoides puede alterar la carga superficial eritrocitaria. Este hecho indica que tiene la capacidad de captar ácido siálico del glóbulo rojo. La remoción de los residuos de ácido siálico eritrocitario podría estar relacionada a los trombos y a la anemia, comunicados en la ascariosis. El objetivo fue estudiar el efecto producido por extractos del parásito adulto sobre la carga aniónica del glóbulo rojo aplicando el método espectrofotométrico de azul Alcian y comparar su eficacia con el método de Polibrene, previamente utilizado, para detectar alteraciones de la carga eritrocitaria.
MÉTODOS
Muestras
Extractos de A. lumbricoides ([EA]): se trabajó con 55 extractos parasitarios obtenidos a partir de la remoción de la cutícula de ejemplares adultos y ruptura mecánica refrigerada.10
Procedimientos
Método espectrofotométrico de azul Alcian11
Es una técnica espectrofotométrica que permite estudiar de manera indirecta la carga y el contenido de ácido siálico superficial del glóbulo rojo. Se fundamenta en la unión del colorante catiónico azul Alcian con el ácido siálico.
La absorbancia del blanco de azul Alcian corresponde a 100 %. La absorbancia medida en el sobrenadante del tubo en el que se coloca la muestra de eritrocitos, corresponde al colorante que no se ha unido a los glóbulos. La medición de absorbancia del azul Alcian que permanece libre, es referida a la del blanco para calcular el porcentaje que representa. Por diferencia con el 100 %, se determina el porcentaje de colorante unido al ácido siálico de la muestra, que se denomina CAE % (carga aniónica eritrocitaria porcentual). Debido a que el colorante se disuelve en alcohol y produce hemolisis globular, se debe preparar un blanco de hemolisis cuyo valor de absorbancia se resta al de la muestra con eritrocitos.
Se utilizaron glóbulos rojos humanos frescos grupo O obtenidos de muestras con anticoagulante, lavados 3 veces en tampón fosfato pH 7,4 (PBS). El método se aplicó simultáneamente en eritrocitos no tratados (Control) y en los mismos eritrocitos tratados con el [EA]. El tratamiento consistió en incubar 50 µl del sedimento globular con igual volumen de [EA], durante 1 h en baño termostatizado a 37 ºC. Los eritrocitos Control, fueron incubados de la misma manera con igual volumen de PBS.
Al término de la incubación, los glóbulos Tratados y Control se lavaron 3 veces en PBS y se prepararon los tubos de medición:
Tubo blanco (B): 2 mL de azul Alcian.
Tubo blanco de hemolisis (BH): 2 mL de alcohol etílico + 10 µL de sedimento globular.
Tubo de muestra eritrocitos control/eritrocitos tratados (GRC/ GRT): 2 mL de azul Alcian + 10 µL de sedimento globular.
Todos los tubos se incubaron en baño a 37 ºC durante 30 min, se centrifugaron a 1 500 rpm durante 10 min y se efectuó la medición de absorbancia del sobrenadante, por duplicado, en espectrofotómetro a 650 nm.
Se calcularon los valores de CAE %.
Reactivos
-Solución de azul Alcian: en el momento de uso disolver 6,25 mG de colorante en 25 mL de alcohol etílico (99,5 %). Colocar en baño a 37 ºC durante 30 min y luego centrifugar (5 min a 1 500-2 000 rpm).
-Alcohol etílico 99,5 %.
Cálculo CAE %
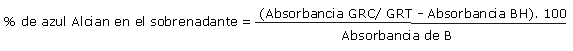

Se definió el Coeficiente experimental de Carga Aniónica Eritrocitaria (Cexp CAE), como el cociente entre CAE % final y CAE % inicial

Análisis estadístico
Se calculó con las 2 mediciones de CAE% de cada uno de los eritrocitos Tratados y del correspondiente Control, el valor de la media y de la desviación estándar. Luego se relacionaron para establecer si los valores incluidos en el rango de dispersión de CAE% de los Tratados también estaban en el rango de dispersión de CAE% del Control respectivo.12 Con estos datos se determinó cuál era el valor mínimo de Cexp CAE, el cual indicaba que se había producido alteración de carga eritrocitaria con el tratamiento.
Se calcularon las medidas estadísticas descriptivas12 para los valores del Cexp CAE, en los cuales se consideró que se había modificado la carga eritrocitaria con el tratamiento y en los que no se determinó alteración de esta.
En experiencias previas se empleó el método de Polibrene9 para evaluar disminuciones de carga eritrocitaria debidas al tratamiento, con 49 de los 55 extractos parasitarios utilizados en este trabajo. Se aplicó la prueba de Mc Nemar,12 a los fines de comparar la sensibilidad de ese método con el de azul Alcian para la detección de alteraciones de carga aniónica por acción de los extractos.
RESULTADOS
Teniendo en cuenta para las mediciones de CAE% de cada uno de los eritrocitos Tratados, el valor de la media y la desviación estándar en relación con el valor obtenido en el correspondiente Control, se consideró que cuando Cexp CAE era menor o igual que 0,85, los eritrocitos alteraron su carga aniónica durante el tratamiento con el [EA], lo que representó una variación entre el CAE% inicial y final mayor que 3 %. Los resultados mostraron que 27 de los 55 [EA] (49,1 %) modificaron la carga de los glóbulos rojos. No se detectó cambio significativo en el tratamiento con los 28 extractos restantes.
La media y la desviación estándar de los Cexp CAE correspondientes a los glóbulos en los que se consideró que la carga había disminuido por contacto con el [EA], fue 0,7230 ± 0,1144, mientras que en los eritrocitos en los que no se modificó resultó 0,9407 ± 0,0445. En la tabla 1 y la figura se muestran las estadísticas resumen de los valores del Cexp CAE de los eritrocitos que disminuyeron su carga y de los que no la alteraron con el tratamiento.
Los métodos de azul Alcian y Polibrene, aplicados para evaluar el efecto de los extractos sobre los eritrocitos, mostraron coincidencia en el tratamiento con 30 de los 49 [EA]; se detectó menor carga globular después del contacto con 15 y cambio no significativo de carga con los otros 15 [EA].
En 12 tratamientos se detectó disminución de carga solo por el método de azul de Alcian y en 7 tratamientos únicamente por el de Polibrene.
La prueba de Mc Nemar (tabla 2) concluyó que la proporción de detección de alteraciones de carga eritrocitaria debidas al tratamiento, no difirió significativamente con ambos métodos (p> 0,20).
DISCUSIÓN
Los ácidos siálicos pertenecen a una familia de azúcares que se localizan en las posiciones terminales de una gran variedad de glucoconjugados. Naturalmente muestran una inmensa diversidad de estructuras que reflejan su participación en importantes procesos biológicos de crecimiento y desarrollo, tanto normal como patológico.13 Se conoce hoy día la existencia de más de 50 estructuras de ácidos siálicos, hecho que no sucede con ningún otro monosacárido, los cuales están distribuidos en vertebrados, algunos invertebrados, bacterias y virus, aunque no se han encontrado en vegetales.14
Los trabajos del profesor Roland Schauer han puesto de manifiesto que los ácidos siálicos presentan varias e importantes funciones biológicas, de las cuales inclusive, algunas son diametralmente opuestas. Entre ellas se destacan, la influencia sobre la estructura de macromoléculas y sobre la especificidad de antígenos, el papel de protección frente a ataques enzimáticos, la capacidad de poseer sitios de reconocimiento y el efecto anti-reconocimiento (enmascaramiento), por lo que la participación de los ácidos siálicos en la composición de los glicoconjugados determina, al menos de modo parcial, sus funciones.14
Por otro lado, las células más abundantes en la sangre son los eritrocitos, cuya función primordial es el transporte de oxígeno y dióxido de carbono, pero también, tanto por sus propiedades mecánicas como por su abundancia, son los principales determinantes del comportamiento reológico de la sangre.15 La tendencia de los eritrocitos a asociarse cara con cara, formando las denominadas «pilas de monedas», fenómeno que también se denomina agregación, depende del balance entre los factores que favorecen y los que dificultan su aparición. Entre los inhibidores de la agregación debe mencionarse en primer lugar, la repulsión electrostática entre los glóbulos, que es causada por la carga negativa distribuida sobre la membrana del eritrocito.15 La carga superficial eritrocitaria está determinada por el ácido siálico, lo que lo convierte en un elemento fundamental del comportamiento hemorreológico y hemodinámico.
El único método directo de cuantificación de ácido siálico en el eritrocito, es su medición en la membrana. Debido a que la implementación de esta técnica no es accesible a todos los laboratorios, surgieron varios métodos que permiten estudiar de manera indirecta la carga y el contenido de ácido siálico superficial del glóbulo rojo. Uno de ellos, que ha sido empleado con buenos resultados para estimar la carga aniónica del eritrocito, es el que utiliza el colorante catiónico azul Alcian.16,17
Los resultados permitieron demostrar que 49,1 % de los 55 [EA] alteraron la carga del glóbulo durante el tratamiento; la media y la desviación estándar del Cexp CAE para estos eritrocitos resultó 0,75 ± 0,1144, mientras que la de los que no mostraron variación de carga fue 0,94 ± 0,0445.
En experiencias previas aplicando el método de Polibrene9 y el mismo tratamiento de los glóbulos, se comunicó que 19 de 51 [EA] (37,25 %) provocaron una marcada diferencia de agregación con respecto a la observada en los eritrocitos Control. La prueba de Mc Nemar concluyó que ambos métodos tienen sensibilidades comparables.
Si bien la captación de ácido siálico por este helminto explicaría en parte la formación de trombos en ascariosis, también permitiría especular que el parásito podría secuestrarlo a partir de otros glucoconjugados que posean residuos sialisados, tal como fue comunicado para Trypanosoma cruzi.18 El ácido siálico inhibe la vía alternativa del complemento.18-20 Los tripanosomas lo obtienen del hospedador, porque les confiere resistencia al ataque por proteínas del complemento y por anticuerpos citolíticos.21
Debido a las variadas funciones del ácido siálico, posiblemente A. lumbricoides lo utilice también como una manera de evadir la respuesta inmune o bien en alguna etapa de su metabolismo, como ha sido descrito en Entamoeba histolytica y Entamoeba invadens.22
Estos resultados permiten explicar que A. lumbricoides es capaz de captar ácido siálico del eritrocito, lo que puede contribuir a la trombosis atribuida al parásito, pero también sugeriría que el nematodo lo utiliza en sus rutas metabólicas o en sus estrategias de evasión inmunológica.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosales-Borjas D, Ortiz-Ortiz L. Infecciones parasitarias: Mecanismos de evasión de la respuesta inmune. RMEP ULA. 2008;2(2):89-98.
2. Alonso Gutierrez Hernandez Y, Hernandez Bautista VM, Huerta Lopez JG. Respuesta inmune a virus y parásitos. Alerg Inmunol Pediatr. 2006;15:94-6.
3. Previato L, Todeschini AR, Previato JO. Enfermedad de Chagas. Macromoléculas: Carbohidratos, lípidos y glucoproteínas. Disponible en: http://www.fiocruz.br/chagas_esp/cgi/cgilua.exe/sys/start.htm?sid=79
4. Foresto PG, D'Arrigo M, Filipini F, Gallo R, Rasia R, Valverde JR. Estudio de parámetros hemorreológicos en hipertensión esencial. Rev Fed Arg Cardiol. 2002;31:69-73.
5. Sccot M. Ascaris lumbricoides: Una revisión de su epidemiología y su relación con otras infecciones. Ann Nestlé. 2008;66:7-22.
6. Atías A. Parasitología Médica. Santiago: Mediterráneo; 1998.
7. Beaver CH, Cupp EW, Jung RC. Parasitología Clínica. 3ª ed. México: Masson Editores; 2003.
8. Ponce de León P, Lebensohn N, Foresto P, Valverde J. Ascaris lumbricoides: alteration of the erythrocyte superficial charge using the Partition Method in aqueous two-phase system. Rev Inst Med Trop Sao Paulo. 2009;51:219-21.
9. Ponce de León P, Biondi C, Valverde J. Efecto producido por Ascaris lumbricoides sobre la carga superficial eritrocitaria utilizando el Método de Polibrene. Acta Bioq Clin Latinoam. 2010;44(4):689-96.
10. Ponce de León P, Valverde J, Zdero M. Preliminary studies on antigenic mimicry of Ascaris lumbricoides. Rev Inst Med Trop São Paulo. 2000;42:295-6.
11. Oguzhan D, Dilek Y, Ayliz V, Hasan C, Nihal A, Goncagül H, et al. Effects of ACE Inhibition and Angiotensin II receptor blockade on glomerular basement membrane protein excretion and charge selectivity in Type 2 diabetic patients. J Renin Angiotensin Aldosterone Syst. 2006;7:98-103.
12. Wackerly D, Mendenhall W, Scheaffer R. Estadística matemática con aplicaciones. México: Thomson Learning; 2003.
13. Lehmann F, Tiralongo E, Tiralongo J. Sialic acid-specific lectins: occurrence, specificity and function. Cell Mol Life Sci. 2006;63:1331-54.
14. Cabezas Fernández del Campo JA. Influencia de la sialilación y de la "pegilación" de la molécula de ciertos medicamentos en su actividad. An R Acad Nac Farm. 2008;74:409-32. Disponible en: http://www.anales.ranf.com/ojs/2008/03/text/06.html
15. Saraví F. ETAS- Hemodinámica 2007, Capítulo 11: Reología de la Sangre. Disponible en: http://fcm.uncu.edu.ar/medicina/area/fisica/11Reologia2007.pdf
16. Lebensohn N, Re A, Filippini F, Carrera L, D'Ottavio A, Valverde J, et al. Impacto hemorreológico de la carga aniónica eritrocitaria en vasculopatías. Medicina. 2007;67(Supl. 3):94.
17. Lebensohn N, Re A, Carrera L, Barberena L, D´Arrigo M, Foresto P. Acido siálico sérico, carga aniónica y agregación eritrocitaria en pacientes diabéticos e hipertensos. Medicina. 2009;69:331-4.
18. Buscaglia C. Trans-sialidasa de Tripanosoma cruzi: un blanco potencial para el tratamiento de la enfermedad de Chagas. Rev Hosp Mat Inf Ramón Sardá. 2002;21:24-7.
19. Murray PR, Rosenthal K, Pfaller MA. Microbiología Médica, 5º ed. Madrid: Gea Consultoría Editorial; 2006.
20. Chabalgoity J, Pereira M, Rial A. Inmunidad contra los agentes infecciosos. Disponible en: http://www.higiene.edu.uy/cefa/2008/Inmunidadcontralosagentesinfecciosos.pdf
21. Souto Padron T. The surface charge of trypanosomatids. An Acad Bras Ciênc. 2002;74:649-75.
22. Chayen A, Avron B, Nuchamowitz Y, Mirelman D. Appearance of sialoglycoproteins in encysting cells of Entamoeba histolytica. Infect Immun. 1988;56:673-81.
Recibido: 21 de septiembre de 2010.
Aprobado: 15 de marzo de 2011.
Patricia Ponce de León. Área Parasitología, Facultad de Ciencias Bioquímicas y Farmacéuticas, Universidad Nacional de Rosario, Argentina. Suipacha 531- 2000. Rosario, Argentina. Teléfs.: 0341-4804592/ 93/ 98, interno 219. Correo electrónico: tefu1958@hotmail.com