Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão impressa ISSN 0375-0760
Rev Cubana Med Trop vol.65 no.2 Ciudad de la Habana abr.-jun. 2013
CARTA AL EDITOR
Ensayo de infección artificial de garrapatas cubanas con Borrelia burgdorferi sensu stricto
Artificial infection assay of Cuban ticks with Borrelia burgdorferi sensu stricto
Lic. Angel Alberto Noda Ramos,I Dr. C. Islay Rodríguez González,I Lic. Omar Fuentes González,I Téc. Yanet Quintana TorrenteII
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Centro Nacional de Parasitología del Instituto de Medicina Veterinaria. Artemisa, Cuba.
La Habana, 19 de agosto de 2012
Estimado Doctor:
Como es conocido, Borrelia spp. constituye un grupo importante de patógenos bacterianos transmitidos por garrapatas, a excepción de Borrelia recurrentis que es transmitida por piojos del cuerpo. Estos microorganismos son los causantes de borreliosis o enfermedad de Lyme y fiebre recurrente.1
El complejo B. burgdorferi sensu lato es causante de la enfermedad de Lyme, y el principal vector descrito lo constituyen las garrapatas duras del género Ixodes.2 Recientemente se ha reportado en México y Brasil la presencia de ADN de B. burgdorferi sensu stricto,3,4 una de las 19 genomaespecies del complejo, en garrapatas Amblyomma cajennense, pero se desconoce si esta especie es capaz de transmitir las borrelias a un nuevo hospedero. En Cuba, a partir de evidencias serológicas específicas de la infección por este agente y teniendo en cuenta las especies de ixódidos que prevalecen, así como sus características ecológicas y antropofílicas, las garrapatas A. cajennense y Rhipicephalus sanguineus se consideran vectores potenciales de las borrelias.5
Sobre la base de los hallazgos e hipótesis anteriormente mencionados se hace necesario iniciar investigaciones para comprobar si otras especies diferentes de Ixodes spp. son capaces de transmitir las borrelias. Ello requiere contar con un método sencillo y eficaz que permita la infección artificial de ixódidos. Se han reportado disímiles estrategias con estos fines, entre las que se incluyen el empleo de cámaras de alimentación con membranas naturales o artificiales, la infusión por enema, la inoculación hemocélica y la alimentación por capilares. Esta última es la que más se ha utilizado para la infección de garrapatas del género Ixodes con B. burgdorferi.6-9
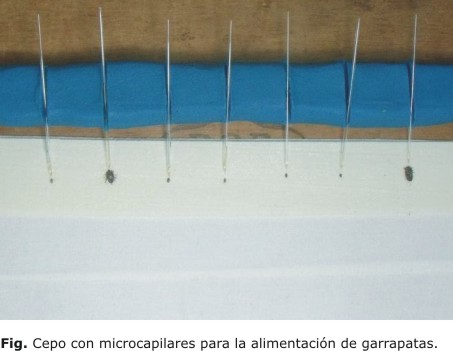
Con el propósito de disponer en el Instituto de Medicina Tropical "Pedro Kourí" (IPK) de un método de infección artificial de ixódidos con borrelias, se realizó un ensayo con 7 garrapatas R. microplus (cepa Cayo Coco), cultivadas en el Centro Nacional de Parasitología del Instituto de Medicina Veterinaria (CNP-IMV) de Cuba, por ser esta la única especie cultivable en el país actualmente. Se alimentaron a través de microcapilares con un subcultivo de B. burgdorferi sensu stricto (B31) de 15 días de incubación que contó con una elevada pureza y viabilidad. Para ello, se construyó un cepo (Fig.) que consistió en un soporte de madera, en el que se colocó una barra de plastilina con ranuras para fijar los microcapilares (cargados previamente con el subcultivo de borrelias) y paralelamente una cinta adhesiva para inmovilizar las garrapatas con la cara ventral hacia arriba.
Los microcapilares se colocaron en el hipostoma de las garrapatas con ayuda de un estereoscopio (ZEISS STEMI 2000-C, Alemania). Posteriormente se colocó el cepo en una cámara húmeda bajo la incidencia directa de un bombillo incandescente durante toda la noche. Al día siguiente las garrapatas se recuperaron y se mantuvieron a 4o C hasta su uso.
Para demostrar que las garrapatas se habían alimentado del subcultivo, y por consiguiente la presencia de las borrelias en su interior, se realizó la extracción de ácidos nucleicos a partir de estas garrapatas infectadas por el método de hidróxido de amonio y calor, según protocolo modificado por Humair y otros.10
La eficacia de la extracción de ácidos nucleicos, así como la ausencia de inhibidores en los extractos se evaluó por reacción en cadena de la polimerasa (PCR: polymerase chain reaction), a través de la amplificación de un fragmento de 320 pb del gen que codifica para la subunidad 16S del ARN mitocondrial de las garrapatas, reportado por Halos y otros.11 Ello permitió comprobar la presencia de ADN y ausencia de inhibidores en los extractos de 6 garrapatas. A estos últimos se les aplicó una PCR para amplificar un fragmento de 394 pb del gen que codifica para la subunidad 16S del ARN ribosomal de Borrelia spp., estandarizado por este grupo de trabajo (resultados en fase de publicación), lo que permitió demostrar la presencia de ADN de Borrelia en 5 de los 6 extractos evaluables (83,3 %), lo cual confirma que la alimentación artificial fue posible al menos en 5 garrapatas.
Los resultados negativos pudieron estar dados por la presencia de inhibidores de la enzima utilizada para la reacción de amplificación en la primera PCR, porque no se realizó un procedimiento de purificación de ADN; o por razones de sensibilidad analítica en la segunda PCR o la no alimentación de la garrapata en cuestión.
Aun cuando los resultados de esta investigación son preliminares y se utilizó un número pequeño de ixódidos, estos corroboran la validez del método de infección utilizado y son comparables con los reportados por otros autores. Por ejemplo, Gern y otros observaron una prevalencia de infección de 66,6 % de las garrapatas utilizadas en el ensayo, al utilizar la alimentación con microcapilares siguiendo un procedimiento similar al descrito antes.6 Por su parte, Broadwater y otros obtuvieron valores de prevalencia de infección de 30 a 70 %, al emplear otra variante de este procedimiento.12
Existen parámetros que no han sido exhaustivamente descritos para la metodología referida en este estudio como la duración de la alimentación capilar, el volumen de fluido ingerido y la densidad de bacterias en la solución de alimentación que pueden afectar la viabilidad de las garrapatas para adquirir y transmitir la infección;10 elementos a tomar en consideración en futuras investigaciones en las que el objetivo fundamental sea la evaluación de la transmisión de la infección.
Tomando en consideración el amplio uso de la infección artificial de garrapatas con capilares y los resultados de esta investigación preliminar, se propone continuar con la utilización de esta técnica para la infección experimental de ixódidos cubanos con B. burgdorferi sensu lato, y evaluar la capacidad de transmisión de estos, fundamentalmente A. cajennense y R. sanguineus.
REFERENCIAS BIBLIOGRÁFICAS
1. Oshaghi MA, Rafinejad J, Choubdar N, Piazak N, Vatandoost H, Telmadarraiy Z, et al. Discrimination of Relapsing Fever Borrelia persica and Borrelia microtti by diagnostic species-specific primers and polymerase chain reactionrestriction fragment length polymorphism. Vect Born Zoon Dis. 2011;11:3.
2. Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin N Am. 2008;22:217-34.
3. Gordillo-Pérez G, Vargas M, Solórzano-Santos F, Rivera A, Polaco OJ, Alvarado L, et al. Demonstration of Borrelia burgdorferi sensu stricto infection in ticks from the northeast of Mexico. Clin Microbiol Infect. 2009;15:496-8.
4. Oliveira A, Fonseca AH, Da Costa CM, Mantovani E, Yoshinari NH. Growth, cysts and kinetics of Borrelia garinii (Spirochaetales: Spirochaetaceae) in different culture media. Mem Inst Oswaldo Cruz. 2010;105:717-9.
5. Rodríguez I, Fernández C, Sánchez L, Martínez B, Siegris HH, Lienhard R. Serological evidences suggest Borrelia burgdorferi sensu lato infection in Cuba. Braz J Infect Dis. 2012;16:405-6.
6. Gern L, Toutoungi LN, Hu CM, Aeschlimann A. Ixodes (Pholeoixodes) hexagonus, an eficient vector of Borrelia burgdorferi in the laboratory. Med Vet Entomol. 1991;5:431-5.
7. Burkot TR, Happ CM, Dolan MC, Maupin GO. Infection of Ixodes scapularis (Acari: Ixodidae) with Borrelia burgdorferi using a new artificial feeding technique. J Med Entomol. 2001;38:167-71.
8. Johns R, Ohnishi J, Broadwater A, Sonenshine DE, De Silva AM, Hynes WL. Contrasts in tick innate immune responses to Borrelia burgdorferi challenge: immunotolerance in Ixodes scapularis versus immunocompetence in Dermacentor variabilis (Acari: Ixodidae). J Med Entomol. 2001;38:99-107.
9. Turell MJ, Pollack RJ, Spielman A. Enema infusion technique inappropriate for evaluating viral competence of ticks. J Med Entomol. 1997;34:298-300.
10. Humair PF, Douet V, Moran-Cadenas F, Schouls L, Van de Pol I, Gern L. Molecular identification of blood meal source in Ixodes ricinus ticks using 12S rDNA as a genetic marker. J Med Entomol. 2007;44:869-80.
11. Halos L, Taoufik J, Vial L, Maillard R, Suau A, Le Menach A, et al. Determination of an efficient and reliable method for DNA extraction from ticks. Vet Res. 2004;35:709-13.
12. Broadwater AH, Sonenshine DE, Hynes WL, Ceraul S, de Silva AM. Glass Capillary tube feeding: A method for infecting nymphal Ixodes scapularis (Acari: Ixodidae) with the Lyme disease spirochete Borrelia burgdorferi. J Med Entomol. 2002;39:285-92.
Recibido: 6 de agosto de 2012.
Aprobado: 24 de enero de 2013.
Islay Rodríguez González. Instituto de Medicina Tropical "Pedro Kourí". Novia del Mediodía, km 6 ½. La Lisa. La Habana, Cuba. Correo electrónico: islay@ipk.sld.cu