Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO ORIGINAL
Evaluación de temefos y pyriproxifeno en Aedes aegypti (Diptera: Culicidae) de Guayaquil, Ecuador
Evaluation of temephos and pyriproxifen against Aedes aegypti (Diptera: Culicidae) from Guayaquil, Ecuador
MSc. María del Carmen Terán Zavala,I Dra. C. María Magdalena Rodríguez Coto,II MSc Yanelys Ricardo Leyva,II Dr. C. Juan A. Bisset. LazcanoII
I Instituto Nacional de Higiene y Medicina Tropical "LIP". Guayaquil, Ecuador.
II Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: el Ministerio de Salud Pública de la ciudad de Guayaquil, Ecuador, ha utilizado, hasta la fecha, temefos (abate) como principal medida química para el control larval de Aedes aegypti, principal vector del dengue en este país.
Objetivos: determinar la resistencia a temefos y sus mecanismos bioquímicos en dos cepas Aedes aegypti de Ecuador, así como determinar la eficacia del regulador de crecimiento, pyriproxifeno, como posible alternativa para su control.
Métodos: en larvas de Aedes aegypti provenientes de dos localidades (Pascuales y Guayacanes), de la ciudad de Guayaquil, Ecuador, se evaluó la resistencia al insecticida oganofosforado temefos y la eficacia del pyriproxifeno mediante metodologías recomendadas por la Organización Mundial de la Salud. Los mecanismos de resistencia metabólicos se determinaron a través de ensayos bioquímicos y electroforesis en gel de poliacrilamida.
Resultados: las larvas de la cepa Pascuales resultaron con moderado nivel de resistencia a temefos y Guayacanes resultó susceptible. A través de ensayos bioquímicos y electroforesis se demostró que el mecanismo de resistencia de acción metabólica, basado en una incrementada actividad de la esterasa-A4, resultó ser responsable de la resistencia detectada a temefos. Las dosis de pyriproxifeno que causaron 50 % de inhibición de la emergencia (IE50) y 95 % (IE95), resultaron muy similares entre las cepas de Ecuador y la cepa de referencia susceptible a insecticidas, Rockefeller.
Conclusiones: se demostró que el mecanismo de esterasas, responsable de la resistencia a temefos, está presente en Aedes aegypti de Guayaquil, Ecuador, de ahí la necesidad de monitorear este fenómeno en diferentes regiones del país. El regulador de crecimiento pyriproxifeno resultó muy eficaz, y esto lo convierte en una alternativa a evaluar para el control de poblaciones de Aedes aegypti en Ecuador.
Palabras clave: Aedes aegypti, Ecuador, pyriproxifeno, resistencia, temefos.
ABSTRACT
Introduction: the Ministry of Public Health in the city of Guayaquil, Ecuador, has so far used temephos (abate) as the main chemical measure for larval control of Aedes aegypti, the fundamental dengue vector in the country.
Objectives: determine temephos resistance and its biochemical mechanisms in two strains of Aedes aegypti in Ecuador, and determine the efficacy of the growth regulator pyriproxyfen as a possible control alternative.
Methods: resistance to organophosphorus insecticide temephos and the efficacy of pyriproxyfen were evaluated in Aedes aegypti larvae from two areas (Pascuales and Guayacanes) in the city of Guayaquil, Ecuador, by means of methodologies recommended by the World Health Organization. Metabolic resistance mechanisms were determined by biochemical assays and polyacrylamide gel electrophoresis.
Results: larvae from the Pascuales strain showed moderate resistance to temephos, whereas those from the Guayacanes strain were found to be susceptible. Biochemical assays and electrophoresis revealed that the resistance mechanism of metabolic action, based on increased esterase-A4 activity, was responsible for the temephos resistance observed. The doses of pyriproxyfen causing 50 % emergence inhibition (EI50) and 95 % (EI95) were very similar between strains from Ecuador and the reference insecticide susceptible strain Rockefeller.
Conclusions: it was found that the esterase mechanism, responsible for temephos resistance, is present in Aedes aegypti from Guayaquil, Ecuador. Hence the need to monitor this phenomenon in different regions of the country. The growth regulator pyriproxyfen proved to be very effective, which turns it into an alternative to evaluate for the control of Aedes aegypti populations in Ecuador.
Key words: Aedes aegypti, Ecuador, pyriproxyfen, resistance, temephos.
INTRODUCCIÓN
Existen 4 serotipos del virus dengue (DEN-1, DEN-2, DEN-3, y DEN-4) y causa entre 50 y 100 millones de casos de dengue y miles de muertes cada año.1 En Ecuador, en 1988, se produjo el primer brote epidémico de dengue clásico serotipo 1 en la ciudad de Guayaquil, con un estimado de 600 000 casos (http://www.msp.gob.ec), a partir de entonces, todas las provincias del litoral, de la amazonia y valles subtropicales de la Sierra, han sido afectados por brotes epidémicos de diversa magnitud, con circulación de los 4 serotipos del virus.2
El Ministerio de Salud Pública de Ecuador a través del Servicio Nacional de Control de Enfermedades Transmitidas por Vectores Artrópodos (SNEM); ha hecho uso del larvicida temefos (abate), en su formulación granular, como medida para el control del dengue; aplicándolo en recipientes de agua para consumo humano y otros criaderos domésticos que requieren cuidados especiales por su proximidad a las personas, teniendo como objetivo eliminar el estado larvario del mosquito y, por consiguiente, evitar que se complete su ciclo evolutivo. El uso prolongado del insecticida organofosforado (OF) temefos ha propiciado la aparición de poblaciones resistentes en todo el mundo.3-El incremento en la actividad de las enzimas esterasas se ha asociado con la resistencia a temefos en cepas de Aedes aegypti de El Salvador,8 Cuba,9-12Perú,13 y otros países de América Latina.3,14,15
Como consecuencia del desarrollo de resistencia a temefos en el mundo, se hace necesario evaluar otras alternativas para su uso en los programas de control de Ae. aegypti. El pyriproxifeno, es un análogo de la hormona juvenil que inhibe la producción de huevos y la metamorfosis, su poder de acción es principalmente contra los insectos chupadores y tiene poco efecto en los himenópteros; también es eficaz contra las larvas de mosquitos y aunque puede ser tóxico para los organismos acuáticos, la dosis diferencial entre la mayoría de estos y las pupas de los mosquitos es tan grande que lo convierte en una buena elección para el control de mosquitos en ambientes sensibles.16 La Organización Mundial de la Salud ha recomendado utilizar el pyriproxifeno para the control of some mosquito species (WHO 2001). el control de algunas especies de mosquitos y aprobó su uso en aguas de consumo humano, lo cual lo convierte en una alternativa para el control de Ae. aegypti.17
Guayas es la provincia de Ecuador con más casos de dengue reportados a escala nacional, según la Dirección de Salud de la Provincia. La ciudad de Guayaquil, pertenece a esa provincia y ha presentado altos índices de Ae. aegypti en estos años, es altamente urbanizado, de ahí que las principales actividades de control estén encaminadas a disminuir los índices de infestación por el mosquito vector trasmisor de dengue, a un nivel que no represente riesgo de transmisión de la enfermedad.
El presente trabajo tiene como objetivo determinar la resistencia a temefos y sus mecanismos bioquímicos en dos cepas Ae. aegypti de Ecuador, así como determinar la eficacia del regulador de crecimiento, pyriproxifeno, como posible alternativa para el control de este vector.
MÉTODOS
Cepas de Aedes aegypti utilizadas en el trabajo
- Rockefeller: cepa de laboratorio de referencia, susceptible a insecticidas, suministrada por el centro para el control de enfermedades (CDC) de San Juan, Puerto Rico.
- SANtemF13: cepa de referencia resistente a temefos, generada en el laboratorio por un proceso de selección a partir de una cepa de Santiago de Cuba.
- Guayacanes y Pascuales: cepas colectadas en Ecuador, Provincia del Guayas, en dos localidades de la ciudad de Guayaquil del mismo nombre en los años 2010 y 2011, respectivamente. Las larvas fueron colectadas en esas localidades, se obtuvo la F1 en el insectario del Instituto Nacional de Higiene y Medicina Tropical de Guayaquil y se trabajó con la F2 obtenida en el insectario del Instituto de Medicina Tropical "Pedro Kourí" de Cuba.
Cría y mantenimiento de las cepas de Aedes aegypti en el laboratorio
Para la cría de las larvas se utilizaron cubetas plásticas con 2,5 l de agua y 0,7 g de harina de pescado como alimento. Al pasar al estadio de pupa se colocaron en vasos de precipitados dentro de una doble jaula (30x30x30cm) hasta que emergieron los adultos, que fueron alimentados con solución azucarada en el caso de los machos y para las hembras se colocaron curieles enjaulados; condiciones estas necesarias para el mantenimiento de la colonia y las posteriores puestas de huevos. En el vaso de precipitado que se colocó dentro de la jaula se dispuso, en su borde interior, una tira de papel de 4 a 5 cm de ancho para la recogida de los huevos. Una vez puestos estos, las tiras de papel se retiraron y se guardaron debidamente rotuladas. Se utilizaron ratones OF-1 heterocigóticos para el desarrollo de la hematofagia, en su uso se han tenido en cuenta las regulaciones de los principios éticos nacionales e internacionales para la experimentación animal.18
Insecticidas utilizados
- Temefos grado técnico: 90 % de pureza, suministrado por American Cyanamid Co., Princeton, New Jersey.
- Pyriproxifeno: 97 % de pureza, suministrado por Jiangsu Flag Chemical Industry Co, LTD.
Bioensayos utilizando temefos grado técnico
Se evaluó, a través de los bioensayos de susceptibilidad.19 Se aplicaron 5 concentraciones del insecticida o más, a partir de una solución 1 % con acetona como diluyente y se realizaron diluciones de 1:10. Se aplicaron concentraciones que causaran entre 2 y 98 % de mortalidad en cada cepa. Se realizaron 5 réplicas y 1 control por cada concentración. Se evaluó un total de 1 000 larvas por cepa. Todas las soluciones de insecticidas se ajustaron a un volumen final de 1 ml con acetona, concentración que no causó mortalidad en los controles. La mortalidad se determinó 24 h después de aplicado el insecticida y los resultados se analizaron mediante el programa Probit-logaritmo de Raymond.20
Con la CL50 se calculó el factor de resistencia (FR50), comparando el valor de la cepa problema o de campo con el de la cepa Rockefeller.
![]()
Diagnóstico de la resistencia: Si FR50 < 5 Susceptible; FR50 5 10 Resistencia moderada y FR50 > 10 Resistente.
Para corregir la mortalidad en los controles en los bioensayos con larvas se utilizó la fórmula de Abbot (1925):
Donde X= porcentaje de sobrevivientes en los controles, Y= porcentaje de sobrevivientes en los recipientes tratados.
Ensayos bioquímicos
Preparación de las muestras
Se utilizaron larvas de cuarto estadio temprano. Las muestras se colocaron individualmente en placas de microtitulación y fueron maceradas en 50 µL de tampón Na2PO4 0,01 mol/L, pH 7,5 (tampón fosfato), con el empleo de un homogenizador de placas, sobre una bolsa de hielo. Se completó a un volumen de 300 µL de tampón Na2PO4. Se evaluó un total de 254 larvas de la cepa Rockefeller, 193 larvas de la cepa Pascuales y 83 larvas de la cepa Guayacanes.
Esterasas inespecíficas
Se dispensaron 20 µL del homogenizado de cada larva por pocillo y se adicionaron 200 µL del sustrato a-naftil acetato 70 mM (diluido 1:100 en tampón fosfato), 10 min después de transcurrida la reacción, se añadieron 40 µL de fast blue. La densidad óptica se leyó a 570 nm en un lector de ELISA (VERSAmax Microplate Reader). 21
Cálculo de la frecuencia de individuos resistentes
Para calcular la frecuencia de individuos resistentes en una población, basados en el mecanismo de esterasas se utilizó la ecuación de Hardy-Weinberg, asumiendo que la población estaba en equilibrio genético. Se determinó el valor medio de actividad específica (nmol de â naftol/mg de proteína) y la desviación estándar (DE) en la cepa Rockefeller. El valor medio de actividad específica de esterasas + 3 DE para la cepa Rockefeller, fue considerado el valor de corte para el diagnóstico de alta actividad de estas enzimas o resistentes a temefos (RR o RS) en las cepas evaluadas.
Electroforesis en gel de poliacrilamida
Para realizar la electroforesis se determinó la actividad específica de las esterasas en cada larva una vez maceradas en 50 µL de tampón fosfato (0,1M) pH= 7,2. Se seleccionaron las muestras con mayor actividad. Posteriormente, en una placa se adicionaron 20 µL de muestra más 20 µL del indicador xilene cianol. Se aplicaron 20 µL de esta mezcla en el gel y se realizó la corrida a 150 V, durante 45 min.
Para la tinción de las bandas de esterasas se sumergieron los geles en 50 mL de tampón fosfato (0,1 M) que contenía 4 mL de cada uno de los sustratos inespecíficos de las esterasas, a-naftil acetato (70 mM) y ß-naftil acetato (70 mM). Posteriormente, se adicionó el colorante fast garnet GBC (30 mg en una mezcla de H2O destilada y SDS [5 %] hasta observar la aparición de las bandas. Los geles se lavaron con agua destilada y para la detención de las bandas se sumergieron en una solución de fijación (metanol [250 mL], ácido acético [75 mL] y agua [675 mL]).
Bioensayos utilizando pyriproxifeno
Para evaluar el regulador de crecimiento pyriproxifeno se utilizaron los bioensayos recomendados por la OMS,22 en este caso se utilizaron larvas en tercer estadio. Se colocaron 25 larvas de cada cepa a evaluar por cada recipiente con 200 mL de agua declorinada. Se realizaron 3 réplicas por concentración e igual número de controles a los cuales se les añadió 1 mL de acetona, que fue el solvente utilizado. Debido al tiempo de duración del experimento se le proporcionó a cada frasco una pequeña cantidad de alimento (harina de pescado 10 mg/Ll) en intervalos de 2 días, hasta que se realizó el conteo final. Todos los recipientes se cubrieron con gasa para evitar el escape de los adultos al medio. El conteo de la mortalidad o supervivencia se registró diariamente hasta la emergencia completa de los adultos en el control. Los recipientes fueron mantenidos a una temperatura entre 25 y 28 ºC, con un fotoperíodo de 12L:12D.
Al final del período de observación, el resultado se expresó como porcentaje de inhibición de la emergencia (IE%), basado en el número de larvas que no se desarrollaron con éxito en adultos viables. En este porcentaje entran las larvas y pupas moribundas o muertas, así como lo adultos que no estaban completamente separados de la exuvia pupal.
El porcentaje de inhibición de la emergencia (IE%) se calculó sobre la base del número de larvas expuestas, utilizando la fórmula siguiente:
Donde T = porcentaje de sobrevivientes o adultos emergidos en los recipientes tratados.
C = porcentaje de sobrevivientes o adultos emergidos en los controles.
Análisis estadístico
Los valores medios de actividad específica para cada cepa se compararon utilizando el análisis de varianza (ANOVA) de una sola vía. Las diferencias fueron consideradas significativas para p< 0,05. La prueba de Tukey se llevó a cabo para determinar los valores medios que diferían uno del otro. Todos estos análisis se realizaron una vez determinado que la naturaleza de cada variable seguía una distribución normal. Estas pruebas estadísticas se realizaron utilizando el programa Statistic 6,0 (STATSOFT INC., Tulsa, OK, U.S.A.).
RESULTADOS
Bioensayos de susceptibilidad o resistencia con el temefos grado técnico
Se determinó el valor de factor de resistencia (FR50), a partir de la concentración de temefos que causó el 50 % de mortalidad (CL50), en las cepas de estudio (tabla 1). En Guayacanes se mostró susceptibilidad a temefos con un FR50<5x (4,2), mientras que la resistencia en Pascuales resultó ser moderada, FR50 entre 5x y 10x (9,2). La cepa de referencia resistente a temefos (SANtemF13) mostró un FR50 de 51,2x, esta cepa se mantiene bajo presión de selección en el laboratorio, utilizando la CL90 para temefos.
Ensayos bioquímicos
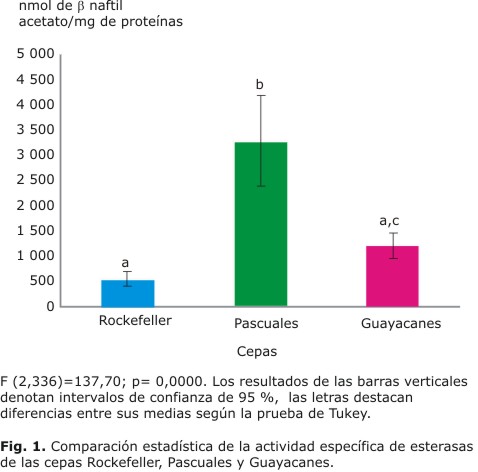
Como se muestra en la tabla 2, la frecuencia en que apareció incrementada la actividad de esterasas en la cepa Pascuales fue de 89 % y en Guayacanes de 56 %. La actividad de esterasas en las larvas de la cepa Pascuales difirió significativamente (p= 0,00001) de la obtenida en la cepa Rockefeller, sin embargo la cepa Guayacanes no difirió de Rockefeller (Fig. 1).
Electroforesis en gel de poliacrilamida
En el zimograma para esterasas, se observó en la cepa Pascuales la presencia de una banda, fuertemente teñida, conocida como esterasa A4 y que se observó también en la cepa SANtemF13. La banda de Est-A4 se observó con muy baja actividad en la cepa susceptible Rockefeller y en Guayacanes (Fig. 2).
Eficacia del pyriproxifeno
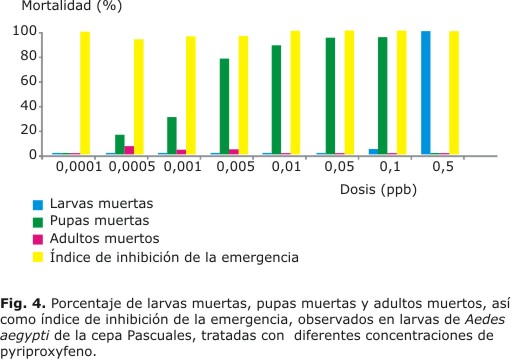
Se evaluó el pyriproxifeno en la cepa Rockefeller y las cepas de campo Pascuales y Guayacanes, de la ciudad de Guayaquil. Se pudo observar que para la cepa Guayacanes el pyriproxifeno mostró mayor actividad larvicida y pupicida en el rango de concentración de 0,01 a 0,05 ppb (Fig. 3). Para Pascuales la mayor actividad larvicida resultó entre 0,1 y 0,5 ppb y pupicida en el rango entre 0,0005 y 0,1 ppb (Fig. 4). La actividad adulticida fue mínima en ambas cepas.
En la tabla 3 se muestran los valores de inhibición de la emergencia de adultos de estas cepas para el regulador de crecimiento pyriproxifeno, en todas se obtuvieron valores de IE50 e IE95 menores a los recomendados por la OMS para el género Aedes. La IE50 de las cepas de campo y de referencia susceptible resultó a concentraciones de 0,001 ppb; 0,007 ppb; 0,001 ppb para Rockefeller, Pascuales y Guayacanes, respectivamente.
DISCUSIÓN
El insecticida temefos (ABATE) es muy utilizado en Guayaquil, Ecuador, para el control larval de Ae. aegypti. El nivel de susceptibilidad a temefos en larvas de Ae. aegypti de dos localidades de la ciudad de Guayaquil, se manifestó en una de ellas con valores bajos de FR50, como es el caso de la cepa Guayacanes. De igual manera hay otros países, como la India, donde se ha demostrado que tanto Ae. aegypti como Aedes albopictus resultaron susceptibles a los organofosforados más utilizados en los programas de control, entre estos a temefos.23La OMS define la resistencia como un fenómeno que aparece en intervalos sumamente variables, en especies diferentes y aun en la misma especie sometida a distintas intensidades de aplicación de insecticidas.24
La actividad de esterasas desempeñó un papel importante en la resistencia moderada a temefos, que se manifestó en la cepa Pascuales. Estas enzimas constituyen uno de los mecanismos de resistencia, de acción metabólica, que más se ha asociado con la resistencia a temefos en Ae. aegypti de América Latina, como en El Salvador,8Cuba,9-12, Perú,13 Brasil,5 Panamá,14 Costa Rica,15 y otros países.16
A través de electroforesis en gel de poliacrilamida, se observó en la cepa Pascuales, la presencia de una banda de esterasas, fuertemente teñida, ya clasificada como esterasa A4.25Las esterasas encontradas deben ser consideradas como posibles mecanismos capaces de degradar o secuestrar compuestos organofosforados, cuya importancia en el desarrollo de resistencia debe ser cuidadosamente evaluada en Ae. aegypti de Ecuador. Estos resultados concuerdan con investigaciones realizadas en dos cepas de Ae. aegypti colectadas en los estados de Coro y Maracay, Venezuela; en las que se observaron niveles moderados de resistencia a temefos, lo cual se asoció con la presencia de una banda electroforética correspondiente a una esterasa con movilidad relativa de 0,61 en 91 % de los mosquitos analizados.26 En otros estudios se demostró que en 98 % de las poblaciones de Ae. aegypti estudiadas de Cuba y Venezuela predominó la esterasa A4 con una movilidad relativa de 0,779, la cual generó resistencia a organofosforados.21
El regulador de crecimiento pyriproxifeno resultó ser muy eficaz a dosis bajas, tanto en la cepa Pascuales como Guayacanes, mostrando mayor eficacia como larvicida y pupicida, que adulticida. Hay trabajos que han demostrado que los análogos de la hormona juvenil, son más eficaces en la etapa inicial de la metamorfosis y la embriogénesis en los insectos, tales como las larvas de últimos estadios, pupas y huevos recién depositados.27-28
En el presente estudio el pyriproxifeno inhibió 95 % la emergencia (IE95) en Rockefeller a 0,01 ppb, Pascuales y Guayacanes a 0,02 ppb, las cuales resultaron dentro de este rango de IE95, recomendadas por la OMS (0,052 ppb y 2,6 ppb) para Ae. aegypti.23 En estudios realizados en tres cepas de Ae. aegypti de Cuba,29 se demostró que el pyriproxifeno fue eficaz, a las mismas dosis, independiente de su grado de resistencia a temefos, con valores de IE50 dentro del rango establecido para el género Aedes. El pyriproxifeno ha sido evaluado, a nivel de laboratorio y con buenos resultados en otros países como en Argentina30 y Perú.31
Se demostró que el mecanismo de esterasas, responsable de la resistencia a temefos, está presente en Ae. aegypti de Ecuador, de ahí la necesidad de monitorear este fenómeno en diferentes regiones de este país. El regulador de crecimiento pyriproxifeno resultó muy eficaz, lo cual lo convierte en una alternativa a evaluar para el control de poblaciones de Ae. aegypti en Guayaquil, Ecuador.
AGRADECIMIENTOS
Al Instituto de Medicina Tropical "Pedro Kourí" de La Habana, Cuba, y al Instituto Nacional de Higiene y Medicina Tropical «LIP», Guayaquil-Ecuador; por el apoyo brindado para este trabajo de investigación. REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Dengue Guidelines for Diagnosis, Treatment, Prevention and Control. Document WHO/HTM/ NTD/DEN/2009.1. Geneva: World Health Organization; 2009.
2. Real J, Álava A, Mosquera C, Russell K, Watts D. Seroprevalencia de dengue en la ciudad de Guayaquil y Durán, Ecuador. Revista Científica del Colegio de Médicos del Guayas. Abril del 2000. [citada Abr 10 2012]. Disponible en: http://www.medicosecuador.com/revistacmg/vol2num2-2002
3. Rodríguez MM, Bisset JA, Fernández D. Levels of insecticide resistance and resistance mechanisms in Aedes aegypti from some Latin American countries. J Am Mosq Control Assoc. 2007;23:420-9.
4. Flores AE, Grajales JS, Salas IF, Garcia GP, Becerra MHL, Lozano S, Brogdon WG, Black IV WC, Beaty B. Mechanisms of insecticide resistance in field populations of Aedes aegypti (L.) from Quintana Roo, Southern México. J Am Mosq Control Assoc. 2006;22:672-7.
5. Braga IA, Valle D. Aedes aegypti: history of control in Brazil. Epidemiol Serv Saúde. 2007;16:113-18.
6. Jirakanjanakit N, Saentharatip S, Rongnoparut P, Duchon S, Bellec C, Yoksan S. Trend of temephos resistance in Aedes (Stegomyia) mosquitoes in Thailand during 2003-2005. Environm Entomol. 2007;36:506-11.
7. Tikar SN, Kumar A, Prasad GB, Prakash S. Temephos-induced resistance in Aedes aegypti and its cross-resistance studies to certain insecticides from India. Parasitol Res. 2009;105,57-63.
8. Bisset JA, Rodríguez MM, San Martín JL, Romero JE, Montoya R. Evaluación de la resistencia a insecticidas de una cepa de Aedes aegypti de El Salvador. Rev Pan Salud Pub. 2009;26:229-34.
9. Bisset JA, Rodríguez MM, Fernández D, Pérez O. Estado de la resistencia a insecticidas y mecanismos de resistencia en larvas del municipio Playa, colectadas durante la etapa intensiva contra el Ae. aegypti en Ciudad de La Habana, 2001-2002. Rev Cubana Med Trop. 2004;56:61-6.
10. Bisset JA, Rodríguez MM, Ricardo Y, Ranson H, Perez O. Temephos resistance and esterase activity in Aedes aegypti (Diptera: Culicidae) from Havana city increased dramatically between 2006 and 2008. Med Vet Entomol. 2011;25:233-9.
11. Rodríguez MM, Bisset JA, Ruiz M, Soca A. Cross-resistance to pyrethroid and organophosphorus insecticides induced by selection with temephos in Aedes aegypti (Diptera: Culicidae) from Cuba. J Med Entomol. 2002;39(6):882-8.
12. Rodríguez MM, Bisset JA, Fernández D, Pérez O. Resistencia a insecticidas en larvas y adultos de Aedes aegypti: prevalencia de la esterasa A4 asociada con la resistencia a temefos. Rev Cubana Med Trop. 2004;56:54-60.
13. Bisset JA, Rodríguez MM, Fernández D. Resistencia a insecticidas y mecanismos de resistencia en Aedes aegypti (Diptera: Culicidae) de dos provincias del Perú. Rev Cubana Med Trop. 2007;58:210-6.
14. Bisset JA, Rodríguez MM, Cáceres L. Niveles de Resistencia a insecticidas y sus mecanismos en 2 cepas de Aedes aegypti de Panamá. Rev Cubana Med Trop. 2003;55(3):191-5.
15. Bisset JA, Marín R, Rodríguez MM, Severson DW, Ricardo Y, French L, Díaz M, Pérez O. Insecticide Resistance in Two Aedes aegypti (Diptera: Culicidae) Strains from Costa Rica. J Med Entomol. 2013~50(2):352-61.
16. Ayesa P, Harrington L, and Scott J. Evaluation of novel insecticides for control of dengue vector Aedes aegypti (Diptera: Culicidae). J Med Entomol. 2006;43:55-60.
17. Organización Mundial de la Salud. Review of the insect growth regulator pyriproxyfen GR. In Report of the 4th WHOPES Working Group Meeting, 2000 December 4-5, Geneva, Switzerland: World Health Organization; 2001; p. 50-67.
18. Pérez O, Bisset JA, Leyva M, Rodríguez J, Fuentes O, García I, et al. Manual de Indicaciones Técnicas para Insectarios. La Habana: MINSAP; 2004. p. 16-53.
19. Organización Mundial de la Salud. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. WHO/VBC/81.80. Geneva, Switzerland: World Health Organization; 1981.
20. Raymond M. Present d'un programme d'analyse log-probit pour microordinateur. Cahiers ORSTOM, Serie Entomol Med Parasitol. 1985;23:117-21.
21. Rodríguez MM, Bisset JA, Molina DF, Lauzan L, Soca A. Detection of insecticide resistance in Aedes aegypti from Cuba and Venezuela. J Med Entomol. 2001;38:623-8.
22. Organización Mundial de la Salud. Review of the insect growth regulator pyriproxyfen GR. In Report of the 4th WHOPES Working Group Meeting, 2000 December 4-5, Geneva, Switzerland: WHO; 2001. p. 50-67.
23. Sharma SN, Saxena VK, LaI S. Study on susceptibility status in aquatic and adult stages of Aedes aegypti and Aedes albopictus against insecticides at international airports of South India. J Commun Dis. 2004;36:177-81.
24. Organización Mundial de la Salud. Resistance of vectors of disease to pesticides. Fifth report of the WHO Expert Committee in Vector Biology and Control. WHO. 1980;655:1-82.
25. Rodríguez MM, Bisset JA, Mila L, Calvo E, Díaz C, Soca LA. Niveles de resistencia a insecticidas y sus mecanismos en una cepa de Aedes aegypti de Santiago de Cuba. Rev Cubana Med Trop. 1999;51:93-8.
26. Mazarri MB. Insecticide resistance in two field populations of Aedes aegypti (L.) from Venezuela [master degree´thesis]. California: University of Riverside; 1994.
27. Liu T, Chen TY. Effects of a juvenile hormone analog pyriproxyfen, on the apterous form of Lipaphis erysimi (Homoptera: Aphididae). Entomol Experimentalis Applicata. 2001;98:295-301.
28. Liu TX and Chen T-Y. Susceptibility of immature stages of Chrysoperla rufilabris (Neuroptera: Chrysopidae) to pyriproxyfen, a juvenile hormone analog. J Applied Entomol. 2002;126:125-9.
29. Ricardo Y, Rodríguez MM, Bisset JA, Pérez O, Sánchez L. Eficacia del pyriproxifeno para el control de Aedes (S) aegypti (Diptera: Culicidae) en cepas con diferentes niveles de resistencia a temefos. Rev Cubana Med Trop. 2010;62:224-9.
30. Seccacini E, Lucia A, Harburguer L, Zerba E, Licastro S, Masuh H. Effectiveness of pyriproxyfen and diflubenzuron formulations as larvicides against Aedes aegypti. J Am Mosq Control Assoc. 2008;24(3):398-403.
31. Sihuincha M, Zamora E, Orellana W, Stancil J, López V, Vidal C, et al. Potencial use of pyriproxyfen for control of Aedes aegypti (Diptera: Culicidae) in Iquitos, Peru. J Med Entomol. 2005;42(4):620-30.
Recibido: 21 de febrero de 2013.
Aprobado: 25 de septiembre de 2013.
Juan A. Bisset. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía Km 6 1/2 entre Autopista Nacional y Carretera Central. La Habana, Cuba. Correo electrónico: bisset@ipk.sld.cu