Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana sep.-dic. 2014
ARTÍCULO ORIGINAL
Normalización de un método inmunoquímico para detectar Papilomavirus humano tipo 16 en lesiones cérvico-uterinas
Standardization of immunochemical method for detection of type 16 human papilomavirus in cervix uterine lesions
Griselda Torres López,I Yudira Soto Brito,I Virginia Capó de Paz,I Ledy Xiomara López Fuentes, I Ana Isabel de la Torre Jiménez,II Adibel Goicolea Maiza,III Daniel Limonta Velázquez,I Anny Pérez Rodríguez,II Anamays Govín Chávez,I Luis Morier Díaz,I Yamira Caballero Lorenzo, I Hermis Rodríguez Sánchez,I Rosa Irene Álvarez Goyanes,IV Adanays Calvo Pérez,IV Xiomara Escobar Pérez,IV Celia María Limia León,I Vivian Kourí CardelláI
I Departamento de Anatomía Patológica, Departamento de Virología, Laboratorio de Enfermedades de Transmisión Sexual, Departamento de Virología, Laboratorio de Producción, Departamento de Aseguramiento Científico-Técnico, Laboratorio de Cultivo de Células. Instituto de Medicina Tropical "Pedro Kourí". (IPK). La Habana, Cuba.
II Departamento de Patología de Cuello, Departamento de Anatomía Patológica. Hospital Ginecobstétrico "Ramón González Coro". La Habana, Cuba.
III Departamento de Patología de Cuello. Hospital Ginecobstétrico "Eusebio Hernández". La Habana, Cuba.
IV Departamento de Biología Celular y Banco de Muestras Biológicas. Instituto Nacional de Oncología y Radiobiología. La Habana, Cuba.
RESUMEN
Introducción: la infección por Papilomavirus Humano (PVH) es la condición necesaria para la aparición y desarrollo del cáncer cérvico-uterino. Los genotipos de alto riesgo oncogénico son los causantes de este tipo de neoplasia y dentro de ellos el más frecuente es el PVH 16, que se encuentra aproximadamente en el 60 % de los casos. Los métodos de diagnóstico comerciales resultan costosos para países con escasos recursos económicos, lo que sugiere la búsqueda de alternativas empleando protocolos sencillos y baratos.
Objetivos: normalizar un método inmunoquímico para la detección del antígeno L1 de PVH tipo 16 en muestras cérvico-uterinas de pacientes con lesiones intraepiteliales escamosas y determinar la coincidencia entre el método normalizado y la Reacción en Cadena de la Polimerasa en Tiempo Real (RCP-TR), como técnica de referencia, para estimar la utilidad de dicho método en el diagnóstico de la infección por este genotipo viral.
Métodos: se compararon tres procedimientos de inmunotinción (Indirecto de inmunoperoxidasa en dos pasos, Estreptavidina-Biotina y Amplificación por polímero) respecto a sensibilidad analítica, tinción inespecífica de fondo y tiempo de terminación, para la detección de la proteína L1 de PVH 16 en líneas celulares derivadas de carcinomas cervicales humanos y en muestras cérvico-uterinas utilizadas como controles. El protocolo normalizado se aplicó a muestras cérvico-uterinas de mujeres entre 30 y 59 años, 82 con lesiones intraepiteliales cervicales y 10 sin antecedentes de alteraciones citológicas, a las que además se les determinó PVH 16 mediante RCP-TR.
Resultados: el procedimiento de Estreptavidina-Biotina resultó el más sensible y específico. La coincidencia entre el método inmunoquímico y la RCP-TR fue de un 98,6 %, la sensibilidad fue de un 98,57 % y la especificidad de un 91,67 %, con valores predictivos negativo y positivo por encima del 90 %.
Conclusiones: se demostró la validez del método inmunoquímico como prueba confirmatoria de la infección por PVH 16. Dicho método probó ser sensible, sencillo y no requiere de una compleja infraestructura para detectar PVH 16 en muestras cervicales. Además, esta técnica permite obtener información rápidamente y evita el uso de métodos invasivos.
Palabras clave: PVH, Proteína L1, lesiones intraepiteliales cervicales, Inmunohistoquímica, Reacción en Cadena de la Polimerasa en Tiempo Real.
ABSTRACT
Introduction: Human Papillomavirus (HPV) infection is the necessary condition for the occurernce and development of cervical cancer. The high oncogenic risk genotypes are the responsible for this type of neoplasia and the most frequent is HPV 16 that affects roughly 60 % of cases. Commercial kits for HPV detection are expensive for resource-poor countries, which suggests the search for alternative throguh non-expensive simple protocoles.
Objectives: to standardize an immunochemical method for the detection of HPV 16 L1 antigen in cervical samples of patients with squamous intraepithelial lesions and to determine the diagnostic coincidence between the immunochemical method and the real-time polymerase chain reaction to estimate the usefulness of this method for the detection of cervical infection with this viral genotype.
Methods: three immunostaining methods (Two-Step Indirect Immunoperoxidase, Labelled Streptavidin-Biotin and Enhanced Polymer) were compared in terms of analytical sensitivity, nonspecific background staining and time of completion, for the detection of protein L1 of HPV-16 in a cell line derived from human cervical carcinoma and clinical samples from uterine cervix. The optimized protocol was applied to 82 cervical samples from women aged 30-59 years with squamous intraepithelial lesions and to 10 samples of sexually active women without previous signals of positive cytology. The presence of type 16 HPV was also detected with the aid of RT-PCR.
Results: the Streptavidin-Biotin system was the most sensitive and specific. The diagnostic agreement between the immunochemical method and the real-time polymerase chain reaction reached 98.6 %, sensitivity was 98.57 % and specificity was 91.67 %, with positive and negative predictive values above 90 %.
Conclusions: the validity of the immunochemical method as a confirmatory test for infection by HPV-16 has been demonstrated. The normalized immunochemical method proved to be a sensitive, simple, relatively fast method to detect HPV from clinical samples of cervical cells. Furthermore, this method provides information quickly, avoiding the use of invasive methods in patients.
Key words: HPV, L1 protein, cervival intraepithelial lesions, immunohistochemistry, real-time polymerase chain reaction.
INTRODUCCIÓN
Los Papilomavirus Humanos (PVH) constituyen una causa necesaria en el desarrollo del cáncer cérvico-uterino.1 Estos virus infectan células epiteliales de la capa basal, ya sea en piel o mucosas. Los genotipos con alto potencial oncogénico están asociados a más del 99,7 % de las neoplasias cervicales invasivas, siendo el PVH 16 el genotipo con mayor incidencia a escala mundial.2 Las lesiones del epitelio cervical pueden ser detectadas por citología, análisis histológico o por observación colposcópica. Estos métodos de diagnóstico son importantes en la evolución clínica de las pacientes. Por otra parte, los métodos moleculares de detección viral que permiten identificar los genotipos de PVH de alto riesgo (PVH-AR) en las lesiones cervicales, ofrecen la capacidad de establecer una asociación entre genotipos virales específicos, las lesiones en la mucosa cervical y su pronóstico.3 Sin embargo, la posibilidad de extender estas técnicas a la pesquisa poblacional en Cuba, es limitada por su costo.4
A pesar de que el programa para el diagnóstico precoz del cáncer de cuello uterino ha resultado en una reducción sustancial de la incidencia de este tipo de cáncer en Cuba, dicha patología continúa siendo una importante causa de muerte en mujeres en edad reproductiva.5 Por lo tanto se hace necesario emplear otros métodos de diagnóstico confirmatorio, más sensibles que la citología, que detecten proteínas o ADN de PVH, que además resulten factibles de aplicar a estudios poblacionales desde el punto de vista económico y que aporten nuevos datos con respecto a la situación de la infección por PVH en mujeres cubanas.
El objetivo del presente trabajo fue normalizar un método inmunoquímico para la detección del antígeno L1 de Papilomavirus Humano (PVH) tipo 16 en muestras cérvico-uterinas de pacientes con lesiones intraepiteliales escamosas así como determinar la coincidencia entre el método normalizado y la RCP-TR, como técnica de referencia, para estimar la utilidad de dicho método en el diagnóstico de la infección por este genotipo viral.
MÉTODOS
Método inmunoquímico para la detección in situ del antígeno L1 de PVH 16
Para la normalización del método inmunoquímico se evaluaron tres procedimientos de inmunotinción descritos previamente en la literatura: Método Indirecto de Inmunoperoxidasa en dos pasos, Estreptavidina-Biotina (LSAB, del inglés, labelled streptavidin-biotin) y Amplificación por Polímero (ANACROM DIAGNÓSTICOS, MAD-041880QK-U, España).6 Dicho método se aplicó a los controles empleados: las líneas celulares derivadas de carcinoma cervical humano y las muestras clínicas definidas previamente como positivas o negativas a PVH 16 por RCP-TR.7 Los tres procedimientos de inmunotinción se compararon en cuanto a sensibilidad analítica (medida como intensidad de la inmunotinción), tinción inespecífica de fondo y tiempo consumido en la realización de la técnica. Al mismo tiempo se optimizaron dos pasos internos del método inmunoquímico: el desenmascaramiento antigénico (enzimático o térmico) y la dilución óptima de trabajo del anticuerpo primario anti-L1 de PVH 16.
Líneas celulares y muestras clínicas
Líneas celulares
Se empleó la línea de carcinoma cervical humano (American Type Culture Collection, ATCC) transformada por PVH, SiHa con 1-2 copias del genoma de PVH 16 (ATCC, HTB 35, Rockville, Md) (7). Como control negativo se utilizaron células de fibroblastos humanos (ATCC, CCL 171).
Controles
Como controles para la infección por PVH se utilizaron muestras de células cérvico-uterinas frescas y fragmentos de tejido de igual localización, fijados en formol y embebidos en parafina (FFEP) procesados en el Departamento de Anatomía Patológica del Instituto de Medicina Tropical “Pedro Kourí”. Dichos controles fueron definidos como positivos o negativos al agente viral según metodologías publicadas con anterioridad.7,8
Muestras clínicas
Se analizaron muestras de células endo- y exo-cervicales obtenidas mediante raspados realizados a 82 pacientes con citología positiva. De estas pacientes se obtuvieron, además, muestras de cuello uterino FFEP obtenidas por conización, para su estudio histopatológico. Dichas muestras se diagnosticaron como lesiones intraepiteliales cervicales de alto y bajo grado (HSIL, del Inglés High-grade squamous intraepithelial lesions y LSIL, del Inglés Low-grade squamous intraepithelial lesions), según el sistema Bethesda.9 Se incluyeron células del epitelio endo- y exo-cervical provenientes de diez mujeres con citología negativa. Los diagnósticos citológicos e histológicos fueron realizados en el Departamento de Anatomía Patológica de los hospitales “Ramón González Coro” y “Eusebio Hernández”. El diagnóstico para PVH en todas las muestras clínicas se realizó por RCP-TR mediante protocolos publicados previamente.7,10
Procesamiento de las muestras para las técnicas inmunoquímicas
Los raspados celulares se procesaron según protocolos publicados previamente.11 A partir de las muestras de tejido cérvico-uterino embebido en parafina se efectuaron cortes histológicos de 4 µm de espesor, que se colocaron sobre láminas silanizadas. Los cortes histológicos se desparafinaron y rehidrataron según protocolos estándares.6,11,12
Procedimiento de inmunotinción
Los cortes de tejidos y extendidos celulares empleados como controles, se sometieron a dos métodos de desenmascaramiento antigénico. Uno de ellos consistió en la digestión proteolítica con una solución de tripsina al 0,05 % y cloruro de calcio al 0,1 % pH 7.8, por 20 minutos a 37 oC. El otro método empleado fue la recuperación antigénica por calor en baño térmico (Fisher Scientific Polystat 24, Bélgica) 30 minutos a 95 oC en tampón citrato 10 mM pH 6.0. Las láminas se trataron posteriormente con una solución de peróxido de hidrógeno al 0,5 % y metanol absoluto durante 15 minutos para inhibir la actividad de la peroxidasa endógena. Los sitios de uniones inespecíficas del anticuerpo se bloqueron con una solución de albúmina sérica bovina (BSA), al 5 % en TBS-T durante 30 minutos. Como anticuerpo (Ac) primario se utilizó el anticuerpo monoclonal (AcM) anti-L1 PVH 16 (Chemicon International INC, CBL402, EUA). La dilución apropiada se determinó mediante el análisis de las diluciones: 1:50, 1:100, 1:200, 1:500 y 1:1000. Las muestras se incubaron 16 horas, a 4 oC en presencia del Ac primario.
Se emplearon tres métodos de inmunotinción en los que se varía el Ac secundario utilizado. El Método Indirecto de Inmunoperoxidasa en dos pasos, en el que se utilizó como Ac secundario inmunoglobulina de conejo anti-ratón conjugada con peroxidasa de rábano picante (HRP) (Dako Cytomation, P0260, Dinamarca). En el método LSAB se utilizó como Ac secundario inmunoglobulina de cabra anti-ratón biotinilada (Dako Cytomation, Dinamarca) y el complejo estreptavidina-HRP (Dako Cytomation, Dinamarca). En el Método de Amplificación por Polímero la inmunotinción se realizó utilizando los reactivos del estuche comercial MASVISION UNIVERSAL POLIVALENTE (ANACROM DIAGNÓSTICOS, MAD-041880QK-U, España) según las instrucciones estrictas del fabricante.
Se utilizaron controles internos del procedimiento de inmunotinción para determinar la calidad de la fijación e inclusión de los tejidos en parafina, así como la funcionalidad de los reactivos empleados, según protocolos publicados previamente.13 La presencia del antígeno viral L1 de PVH 16 se determinó previamente en los controles mediante el método inmunoquímico optimizado. Se utilizó la RCP-TR como técnica de referencia para medir la eficiencia del método normalizado.
Interpretación de las pruebas inmunoquímicas
Para la lectura inmunoquímica se siguió un protocolo a doble ciegas y se realizó una clasificación de acuerdo a la inmunoreactividad nuclear, citoplasmática y/o en la membrana celular. Las muestras fueron diagnosticadas según la siguiente estratificación: 0 Nula o negativa, + Débil o dudosa, ++ Moderada, +++ Intensa, de acuerdo a la intensidad y al área abarcada por el depósito del precipitado color marrón que ocurre donde se encuentra el antígeno detectado. Se consideró positiva una señal igual o mayor de dos cruces.14 La tinción inespecífica de fondo se evaluó siguiendo los mismos parámetros.
Análisis estadístico
Los indicadores estadísticos básicos para evaluar el desempeño de la técnica inmunoquímica se calcularon mediante el empleo del paquete estadístico EPIDAT 3.1 para el Análisis Epidemiológico de Datos Tabulados. Así se calcularon los valores de sensibilidad, especificidad, índice de validez de la prueba diagnóstica y los valores predictivos positivo y negativo.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Revisión de Ética Médica del Instituto de Medicina Tropical “Pedro Kourí” y de los hospitales ginecobstétricos. En todos los casos se obtuvo el consentimiento informado de las pacientes para formar parte de la investigación, comunicándoles que este estudio se realizaría teniendo en cuenta los principios éticos de la Declaración de Helsinki sobre la investigación clínica en humanos.
RESULTADOS
Métodos inmunoquímicos en los controles
De las dos formas de desenmascaramiento antigénico probadas, sólo el tratamiento con calor en baño térmico permitió el reconocimiento eficiente de los epítopes de la proteína mayoritaria de la cápside viral L1 de PVH 16, sin alteraciones en su conformación activa. La dilución óptima de trabajo del Ac primario empleado fue 1:100.
Se encontraron diferencias en cuanto a la sensibilidad analítica, tinción inespecífica de fondo y tiempo consumido en la realización de las técnicas (tabla 1). El procedimiento LSAB fue el más eficiente en la detección del antígeno L1 de PVH 16 para su aplicación en muestras clínicas. El mismo resultó altamente sensible, no mostró tinción inespecífica de fondo y los resultados fueron similares a los obtenidos por el sistema comercial de Amplificación por Polímero. Este último método mostró una baja tinción de fondo y el mayor ahorro de tiempo pues, debido al empleo de reactivos listos para su uso y la reducción de períodos de incubación, se obtuvieron resultados satisfactorios en solo 4 horas. El método Indirecto de Inmunoperoxidasa no resultó satisfactorio para este tipo de ensayo.
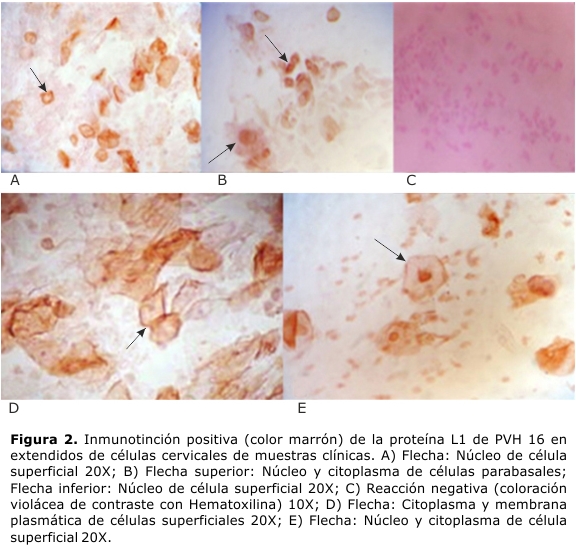
Las señales de inmunodetección del antígeno viral obtenidas en las líneas celulares, mostraron diferencias notables entre los controles positivos y el control negativo. El método LSAB funcionó de manera más eficiente en dichos controles (figura 1). La línea celular SiHa mostró inmunotinción nuclear y citoplasmática de color marrón que indicó la presencia del antígeno viral L1. En los tres métodos analizados los resultados observados en los controles clínicos de extendidos celulares y tejidos fueron similares a los que se obtuvieron en la línea celular.
Aplicación del sistema LSAB en las muestras clínicas
El método inmunoquímico empleado para la detección del antígeno L1 de PVH 16 en muestras clínicas fue el sistema LSAB. Se empleó el desenmascaramiento antigénico por calor en baño térmico a 95 oC durante 30 min y una dilución de trabajo, del AcM primario, de 1:100 a 4 oC durante 30 minutos.
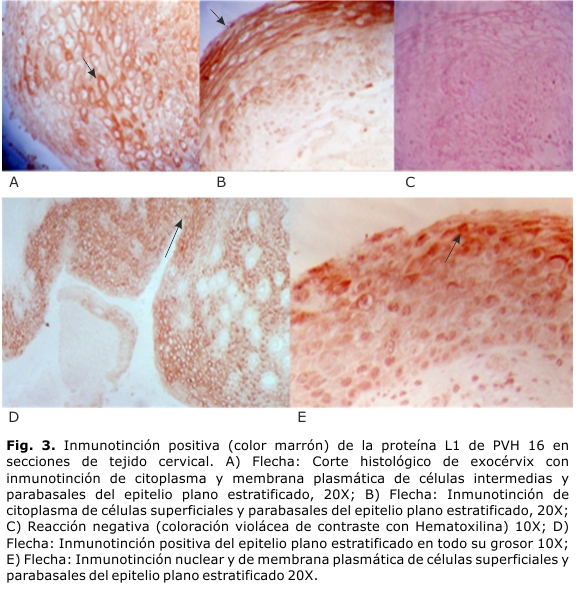
La positividad en la expresión de la proteína viral en los 82 casos de pacientes con citologías y biopsias de lesiones intraepiteliales cervicales, se detectó en extendidos celulares y cortes de tejidos. La observación de pigmentos de color marrón localizados en el núcleo, en el citoplasma y en la membrana plasmática indicó la presencia de este antígeno viral. El análisis inmunoquímico de las diez muestras previamente definidas como negativas por citología y RCP-TR, no mostró reconocimiento de los antígenos virales en ninguno de los casos.
En el 85,3 % de los extendidos celulares de las pacientes con lesión intraepitelial cervical, se identificó la presencia de la proteína L1 de PVH 16. Este antígeno se localizó en el núcleo y en el citoplasma de las células cervicales parabasales y superficiales (figura 2). En los tejidos de estas pacientes, dicho antígeno se localizó en el citoplasma de las células cervicales intermedias, parabasales y superficiales, y en el núcleo de las células superficiales del epitelio plano estratificado del cuello uterino (figura 3).
Al analizar la positividad a PVH en los cortes de tejido, los resultados coincidieron con los hallazgos obtenidos en los extendidos celulares. No hubo diferencias en el reconocimiento antigénico entre la inmunocitoquímica y la inmunohistoquímica. Con el empleo del método inmunoquímico se obtuvo una mayor detección para este tipo viral (85,3 %) que por RCP-TR (84,1 %), con una elevada coincidencia diagnóstica (98, 6 %) entre estas pruebas pues no se encontraron diferencias significativas entre dichos valores. Los resultados del análisis estadístico muestran buenos valores de sensibilidad y especificidad para la técnica inmunoquímica al ser comparada con la técnica de referencia (tabla 2).
DISCUSIÓN
En la búsqueda de sistemas alternativos que complementen el diagnóstico de laboratorio de la infección por PVH se han explorado métodos inmunoquímicos para la detección de antígenos virales.15 En este sentido, la normalización de la técnica inmunoquímica en muestras clínicas constituye un paso fundamental.
El método de desenmascaramiento antigénico a utilizar depende de pasos previos que pueden ser críticos en la estructura y en la antigenicidad de las proteínas virales. El tipo de fijador empleado, su concentración, el pH y el tiempo de exposición, son factores que causan la pérdida de la inmunoreactividad para muchos antígenos, debido a los cambios que éstos introducen en la conformación e integridad de las proteínas componentes del tejido. En la optimización de los pasos de la técnica inmunoquímica, el desenmascaramiento enzimático con tripsina16,17 no resultó válido para la recuperación del antígeno viral en los controles utilizados en esta investigación. La digestión proteolítica de las muestras pudo conllevar a la destrucción de epítopes involucrados en la reacción.6 Por este motivo, en el presente trabajo, se empleó la exposición al calor (temperatura cercana al punto de ebullición del agua) para la restauración de la inmunoreactividad tanto en los extendidos celulares como en los cortes de tejido FFEP. Aunque no se conocen exactamente los mecanismos de acción de los procesos de desenmascaramiento antigénico, el uso del calor ha resultado de gran importancia en revertir los daños causados por la fijación en formol y la inclusión en parafina.6
Al emplear el método convencional de inmunoperoxidasa en las técnicas inmunoquímicas, algunos autores han encontrado una baja sensibilidad para en la detección de antígenos virales, tanto para las muestras clínicas como para los controles de líneas celulares.18 Al comparar los tres procedimientos de inmunotinción analizados en este estudio, se encontró que la amplificación en la sensibilidad, inherente a la tecnología LSAB (basada en la alta afinidad de la estreptavidina por la biotina) y la de Polímero (un promedio de 70 moléculas de enzima y 10 moléculas de Ac secundario adjuntas a la columna de polímero) hacen a estos métodos más convenientes que el procedimiento convencional para la detección de proteínas virales en muestras clínicas.
En este estudio se corroboró la presencia de PVH 16 en lesiones intraepiteliales cervicales mediante el método inmunoquímico. La detección de proteínas virales expresadas en diversas muestras clínicas con lesiones premalignas y malignas asociadas a la infección por PVH, se emplea como un indicador de infección viral productiva y a su vez como una herramienta confirmatoria del diagnóstico citohistopatológico.19 La identificación específica de antígenos de PVH 16 en el epitelio cervical permite el estudio descriptivo más objetivo de los cambios morfológicos encontrados en el epitelio infectado. Existen numerosos estudios que refieren la baja sensibilidad de las técnicas inmunoquímicas cuando se utilizan para el diagnóstico de la infección viral, comparadas con las técnicas que detectan ADN de PVH.20,21 Sin embargo, el sistema LSAB tiene un potencial uso práctico para el diagnóstico de PVH por ser un método simple, rápido, barato y eficiente que en nuestro estudio, mostró una sensibilidad adecuada para la detección viral en lesiones cervicales. Por estas razones se puede considerar como un método apropiado para la confirmación del diagnóstico histopatológico.
Los valores de positividad a PVH 16 obtenidos en el presente trabajo mediante el método inmunoquímico fueron de 85,3 %. Otros estudios que emplean las técnicas inmunoquímicas para la detección de proteínas de PVH, reportan valores fluctuantes de positividad para el antígeno viral L1,22,23 algunos autores describen esta proteína en menos del 50 % de los casos15 y otros24 plantean entre un 55 y un 65 % de positividad para este antígeno. Son pocos los estudios que muestran una positividad del 60 al 80 %, o más en la detección de PVH por inmunoquímica.25,26 En ninguno de los trabajos publicados se esclarece el porqué de esta divergencia en los valores de positividad, sin embargo pudiera deberse a la variabilidad inter-observador y a lo subjetiva que resulta la interpretación de estas técnicas. No obstante, las técnicas inmunoquímicas actualmente se emplean para evaluar la expresión de proteínas de PVH de alto riesgo, como biomarcador en la caracterización y progresión de lesiones cervicales.15
El método LSAB, normalizado mostró una coincidencia en el 98,6 % de los casos para la detección de PVH 16, al ser comparado con el protocolo de referencia. Con el empleo del método inmunoquímico se obtuvo una mayor detección para este tipo viral (85,3 %) que por RCP-TR (84,1 %), sin embargo no existen diferencias significativas entre ambas proporciones. Los valores de sensibilidad, especificidad, validez, valor predictivo negativo y positivo son buenos para la técnica inmunoquímica.
La detección de PVH proporciona una prueba de alta sensibilidad y una medida objetiva de la presencia del virus causante del cáncer cervical o lesión precursora de riesgo.27 El valor principal de la prueba de detección de PVH en un programa de pesquisa es prevenir lesiones intraepiteliales cervicales de alto grado en mujeres cuyas alteraciones podrían haber pasado inadvertidas con la búsqueda citológica solamente. El uso de la prueba inmunocitoquímica para la detección de PVH en conjunto con la citología puede reducir sustancialmente el número de mujeres cuyas lesiones permanecen no detectadas a pesar de que se sometan al análisis citológico regularmente. De acuerdo a los resultados de este estudio, se puede contar en el laboratorio con una metodología sensible, sencilla, rápida, relativamente barata y sin la necesidad de una compleja infraestructura para detectar PVH de alto riesgo oncogénico en muestras clínicas de cuello uterino. Sin embargo, son necesarios otros estudios donde se analice un mayor número de muestras para validar el método inmunoquímico en el diagnóstico de la infección por PVH 16 en mujeres cubanas.
REFERENCIAS BIBLIOGRÁFICAS
2. De Vuyst H, Clifford GM, Nascimento MC, Madeleine MM, Franceschi S. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis. Int J Cancer. 2009;124(7):1626-36. Epub 2008/12/31.
3. Coste J, Cochand-Priollet B, de Cremoux P, Le Gales C, Cartier I, Molinie V, et al. Cross sectional study of conventional cervical smear, monolayer cytology, and human papillomavirus DNA testing for cervical cancer screening. BMJ. 2003;326(7392):733. Epub 2003/04/05.
4. Murillo R, Almonte M, Pereira A, Ferrer E, Gamboa OA, Jeronimo J, et al. Cervical cancer screening programs in Latin America and the Caribbean. Vaccine. 2008;26 Suppl 11:L37-48. Epub 2008/11/26.
6. Boenisch T. Staining Methods. In: Boenisch T, editor. Immunochemical Staining Methods H A N D B O O K 3rd ed. California, USA: DakoCytomation - Carpinteria, CA, USA; 2001. p. 26-31.
7. Soto Y, Kourí V, Martínez PA, Correa C, Torres G, Goicolea A, et al. Standardization of a real-time based polimerase chain reaction system for the quantification of human papillomavirus of high oncogenic risk. Vaccimonitor. 2012; 21(1):30-7.
8. Soto Y, Mune M, Morales E, Goicolea A, Mora J, Sanchez L, et al. Human Papillomavirus infections in Cuban women with cervical intraepithelial neoplasia. Sex Transm Dis. 2007;34(12):974-6.
Recibido: 28 de mayo de 2014.
Aprobado: 4 de agosto de 2014.
MSc. Yudira Soto Brito. Instituto de Medicina Tropical Pedro Kourí. Departamento de Virología. Laboratorio de Enfermedades de Transmisión Sexual. Carretera Novia del Mediodía Km 6 ½ PO Box 601. Marianao 13. Tel: (537) 2553551, Fax: (537) 202-0633, (537) 204-6051.
Correo electrónico: yudira@ipk.sld.cu; yudira@infomed.sld.cu