My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
On-line version ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana Sept.-Dec. 2014
PRESENTACIÓN DE CASO
Miocarditis aguda y meningoencefalitis por Trypanosoma cruzi en un paciente seropositivo al VIH
Acute miocarditis and meningoencephalitis caused by Trypanosoma cruzi in an HIV-seropositive patient
Dra. Dora del Valle Pugliese Uliarte, Dr. Luis Angel Trombetta Durante, Dr. Daniel Moreno Rivas, Dra. Viviana Galache Villegas, Dra. Karin Semorile Maestre, Dr. Amadeo Javier Bava de Soto
Hospital "Francisco Javier Muñiz". Ciudad Autónoma de Buenos Aires, Argentina.
RESUMEN
La enfermedad de Chagas, endémica en Argentina, transcurre en dos fases: aguda y crónica. En los pacientes seropositivos al VIH, el Trypanosoma cruzi afecta a aquellos con inmunodeficiencia severa, se localiza principalmente en el sistema nervioso central y menos frecuentemente en el miocardio. La distinción entre miocarditis aguda y reactivación de la infección crónica, no es sencilla. El bajo recuento de linfocitos T CD4+ es un factor predictivo positivo de reactivación. En los enfermos con inmunodeficiencia avanzada, los resultados negativos de las pruebas serológicas no excluyen el diagnóstico de enfermedad de Chagas, que se confirma por la aplicación de métodos directos en sangre o líquido cefalorraquídeo. Se presenta el caso de un paciente infectado por el VIH, adquirido por transmisión vertical, con inmunodeficiencia severa, miocarditis aguda y compromiso del SNC. La parasitemia y parasitorraquia positivas para T. cruzi, establecieron la asociación de estos síntomas con la enfermedad de Chagas.
Palabras clave: Chagas, tripanosomiasis, SIDA, reactivación, miocarditis, meningoencefalitis.
ABSTRACT
Chagas disease, endemic in Argentina, goes through two stages: acute and chronic. In VIH seropositive patients, Trypanosomacruzi affects those with severe immunodeficiency; it is mainly located in the central nervous system and less frequently in the myocardium. Distinction between acute myocarditis and chronic infection reactivation is not simple. Low T CD4+ lymphocyte count is a positive predictive factor of reactivation. In patients with advanced immunodeficiency, negative results of serological tests do not exclude diagnosis of Chagas disease which may bre confirmed through the application of direct methods in blood and cerebrospinal fluid. The case of a VIH infected patient who got the disease through vertical transmission with severe immunodeficiency, acute myocarditis and central nervous system damage. Positive parasitemia and parasitorrachya for T. cruzi established the association between these symptoms and Chagas disease.
Key words: Chagas, tripanosomiasis, AIDS, reactivation, myocarditis, meningoencephalitis.
INTRODUCCIÓN
La enfermedad de Chagas, cuyo agente etiológico es Trypanosoma cruzi, es endémica en Argentina. La infección transcurre en dos fases: aguda y crónica.
La primera incluye la enfermedad de transmisión vectorial, congénita y en huéspedes inmunocomprometidos, en quienes la parasitosis puede resultar de la reactivación de una infección crónica o adquirida por diferentes vías. Esta fase también incluye los casos de adquisición post transfusional, por transplante de órganos y células hematopoyéticas, y los accidentes de trabajo del personal de salud, ocurridos en el laboratorio, durante procedimientos quirúrgicos y de hemodiálisis. Se caracteriza por una elevada parasitemia, que puede ser detectada por métodos directos.
La fase crónica sigue a la aguda y comienza cuando la parasitemia se torna indetectable. Clínicamente cursa con o sin patología demostrada, y la infección se diagnostica por métodos serológicos y moleculares.
En pacientes seropositivos al virus de la inmunodeficiencia humana (VIH), T. cruzi afecta a aquellos con inmunodeficiencia severa, se localiza principalmente en el sistema nervioso central y menos frecuentemente en el miocardio.
La miocarditis por T. cruzi, es infrecuente como manifestación única en pacientes seropositivos al VIH. La distinción entre miocarditis aguda y reactivación de la infección crónica, no es sencilla. El bajo recuento de linfocitos T CD4+ es un factor predictivo positivo de reactivación.
En estos enfermos los resultados negativos de las pruebas serológicas no excluyen el diagnóstico de enfermedad de Chagas, cuyo diagnóstico se confirma por la aplicación de métodos directos en sangre o líquido cefalorraquídeo.
Se presenta el caso de un paciente infectado por el VIH, adquirido por transmisión vertical, con inmunodeficiencia severa, miocarditis aguda y compromiso del SNC. La parasitemia y parasitorraquia positivas para T. cruzi, establecieron la asociación de estos síntomas con la enfermedad de Chagas. La serología específica, fue sólo transitoriamente positiva por la técnica de inmunofluorescencia indirecta, presentando en lo sucesivo, resultados reiteradamente negativos.
Caso clínico
El paciente, varón de 23 años, seropositivo al VIH, adquirido por transmisión vertical, ingresó el 12/06/2010, con cefalea de una semana de evolución. Presentó en la tomografía computarizada (TC) de cerebro (sin contraste) una imagen hipodensa en el lóbulo frontal derecho y otra paraventricular izquierda. Se inició tratamiento empírico para toxoplasmosis.
Tenía antecedentes de diarrea por Isospora belli y serología negativa para sífilis, toxoplasmosis, enfermedad de Chagas y virus hepatotropos primarios.
Abandonó el tratamiento antirretroviral (TARV) 2 años antes, luego de cumplir múltiples esquemas con falta de adherencia.
No es usuario de drogas iv y habita una vivienda de material de construcción con sanitarios completos. Viajó a la zona endémica a los 18 años de edad.
La ecografía abdominal revela hepatoesplenomegalia, el riñón izquierdo con aumento de la ecogenicidad medular, adenopatías retroperitoneales isoecoicas y leve derrame pericárdico. El fondo de ojo fue normal y el recuento de linfocitos T CD4+ de 198 células/mm3. Radiografía de tórax normal.
Presentó convulsiones, deterioro sensorial, cefalea y parestesias en el miembro superior derecho, que llevaron a realizar una punción lumbar, de la cual se obtuvo líquido cefalorraquídeo (LCR) cristal de roca, con 47 g/dl de glucosa, 0,5 g/dl de proteínas y 4 células/mm3. El estudio parasitológico reveló elementos móviles (flagelados) micromorfológicamente compatibles con tripomastigotes de T. cruzi.
La serología para la enfermedad de Chagas fue negativa con las técnicas de aglutinación de partículas (AP), hemaglutinación indirecta (HAI) y enzimoinmunoensayo (ELISA). La inmunofluorescencia indirecta (IFI) fue positiva con un título de 1/64 (valor de corte 1/32), y luego fue negativa en 3 determinaciones sucesivas posteriores, realizadas en el mismo laboratorio.
La aplicación de la técnica de Strout dio resultado positivo.
Se inició tratamiento con Beznidazol (vo), que al 5 to. día fue suspendido por la aparición de un severo rash cutáneo pruriginoso y fue reemplazado por Nifurtimox (vo), a la vez que se suspendió el tratamiento para la toxoplasmosis.
Al 5º día presentó fiebre y taquicardia sinusal con descompensación hemodinámica transitoria. El ecocardiograma demostró un leve aumento del tamaño del ventrículo izquierdo, con función sistólica conservada, y leves hipertrofia concéntrica y derrame pericárdico, configurando un patrón restrictivo.
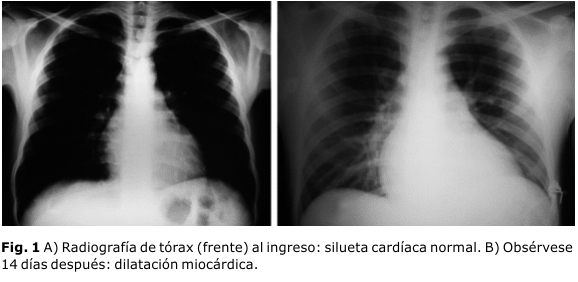
A los 14 días presentó síntomas de insuficiencia cardíaca y la radiografía de tórax reveló dilatación miocárdica aguda con un patrón de redistribución de flujo pulmonar (figuras 1A y B). En el electrocardiograma se observó bloqueo A-V de 1er grado y en un nuevo ecocardiograma, la disminución de la función sistólica y dilatación miocárdica aguda con signos de insuficiencia.
Recibió tratamiento con enalapril, espironolactona, furosemida y corticoides como antiinflamatorios del miocardio, con los cuales presentó mejoría.
A los 26 días de internación, inició tratamiento con vancomicina por una infección por Staphylococcus aureus meticilino-resistente, vinculada a un catéter. Se reinició TARV con Zidovudina, Lamivudina, Saquinavir y Ritonavir.
En el ECG remitió el bloqueo A-V. El paciente presentó nauseas, vómitos, dolor abdominal, aumento de la urea y el potasio sanguíneos. Se suspendió la vancomicina, el TARV y los diuréticos y se continuó con daptomicina. A los 55 días de internación fue dado de alta, continuando tratamiento con Nifurtimox.
DISCUSIÓN
La localización más frecuente de la enfermedad de Chagas en los pacientes con SIDA es el SNC; ocasiona meningoencefalitis difusa o masa cerebral ocupante y es indistinguible clínicamente, o a través de las neuroimágenes, de otras infecciones oportunistas y de neoplasias del SNC, habituales en estos pacientes.1,2
En la experiencia en el Hospital "Muñiz", la enfermedad de Chagas constituye la tercera causa de lesiones focales en pacientes con SIDA.1
Trypanosoma cruzi produce generalmente una encefalitis multifocal con lesiones únicas o múltiples, afecta la sustancia blanca y ocasionalmente se extiende dentro de la corteza cerebral, provocando necrosis hemorrágica, angeítis obliterante, infiltrado perivascular de las células gliales, los macrófagos y las células endoteliales con amastigotes en su interior.2,3
En la TC se observan áreas hipodensas, edema perilesional y efecto de masa ocupante sobre la línea media. La confirmación diagnóstica requiere de la biopsia intracraneal o la observación de tripomastigotes en el LCR.
El miocardio constituye un blanco secundario de la enfermedad de Chagas en los pacientes con SIDA, y la miocarditis aguda se ubica en el segundo lugar en la reactivación de la parasitosis.2
En el historial clínico del paciente, los exámenes serológicos previos para la enfermedad de Chagas fueron negativos.
T. cruzi intensifica y prolonga la activación inmune, contribuyendo a un estado de inflamación crónica que entre otros cambios, determina el descenso de los linfocitos T CD4+ y CD8+, e incrementa la apoptosis en una interacción que podría acelerar la progresión de la enfermedad por el VIH.4
El abandono del TARV y el deterioro de la inmunidad celular, pueden haber estimulado la reactivación de una infección no reconocida, ya que los exámenes serológicos previos eran negativos.
La miocarditis chagásica como única manifestación clínica en los pacientes infectados por el VIH es poco común, y al contrario de la meningoencefalitis, el compromiso cardíaco puede ser subestimado. El examen anatomopatológico de las necropsias, ha permitido reconocer que la miocarditis está presente en el 30-40 % de los pacientes.4,5
En pacientes con miocarditis es difícil realizar el diagnóstico diferencial entre la reactivación de la enfermedad de Chagas y la descompensación de la cardiopatía chagásica crónica, ya que las manifestaciones clínicas son similares.5,6
El bajo recuento de linfocitos T CD4+, sugiere una reactivación de la infección chagásica, más que una infección aguda en un paciente con pruebas serológicas para la enfermedad de Chagas que no alcanzaron los criterios de diagnóstico, el cual requiere dos determinaciones diferentes positivas.
El diagnóstico durante la fase aguda de la enfermedad se basa en la demostración del parásito por métodos directos (gota fresca, Strout o micrométodo). La seroconversión positiva entre dos análisis con 30 a 90 días de intervalo puede también servir como diagnóstico confirmatorio de fase aguda si no puede realizarse la parasitemia, aunque posee menor valor en el diagnóstico de pacientes con tratamientos o enfermedades que generen inmunosupresión o inmunodepresión. Durante la fase crónica, la parasitemia se vuelve indetectable por los métodos directos y es menester emplear la determinación de anticuerpos específicos y las técnicas moleculares.
Los anticuerpos IgG comienzan a manifestarse antes de los 30 días de ocurrida la infección, mientras que las IgM se generan más tempranamente, no siempre se detectan y su ausencia no excluye la infección.2,7
Auger y col3 propusieron la drogadicción iv como una nueva hipótesis de transmisión urbana de la enfermedad de Chagas. Observaron en 2 de 3 pacientes seropositivos al VIH chagásicos, usuarios de drogas iv, serología negativa para Chagas, mientras que 5 pacientes chagásicos (de trasmisión vectorial) que contrajeron VIH, presentaban serología positiva.
Varios estudios reafirman que la serología y la epidemiología no siempre son relevantes. Sostienen que la inmunosupresión puede impedir la generación de IgM en la infección aguda, o que la inmunodepresión extrema tornaría negativas las pruebas serológicas previamente positivas (IgG). Concluyen que la investigación de la parasitemia y parasitorraquia resultan indispensables para el diagnóstico en los pacientes con SIDA.3,8,9
Una revisión que abarcó el período 1980-2010, encontró que la meningoencefalitis es la forma clínica más severa, con 100 % de mortalidad, de no mediar el tratamiento precoz para la enfermedad de Chagas.9
El mismo estudio destacó que en la reactivación de esta última, el 74 % de los casos afectó al SNC y el 17 % se localizó en el miocardio. En los casos reactivados, el promedio del recuento de linfocitos T CD4+ fue de 98 células/mm3.9
El diagnóstico se realizó mediante serología, y sus resultados fueron interpretados de acuerdo a las recomendaciones Internacionales, empleando mayormente las técnicas de ELISA, HAI e IFI (9). En el 5,4 % de los casos, la serología fue negativa, y se atribuyó la responsabilidad de ello a los trastornos inmunológicos involucrados en la patogénesis de la infección por el VIH.
El diagnóstico de reactivación de la enfermedad de Chagas debe considerarse en pacientes seropositivos al VIH con enfermedad aguda, con manifestaciones clínicas de descompensación de la fase crónica, o ante la presencia de imágenes de lesiones cerebrales pseudotumorales y parasitemia.9
El diagnóstico diferencial de la localización en el SNC se realiza con otras infecciones oportunistas frecuentes en los pacientes con SIDA, como la toxoplasmosis, el linfoma primario de cerebro, la leucoencefalopatía multifocal progresiva, la tuberculosis y la criptococosis.5
En el tratamiento antiparasitario se emplea el Benznidazol (5 a 7 mg/k/día en 2 o 3 tomas diarias) durante 60 a 90 días o en Nifurtimox (8 a 10 mg(k/día en 3 tomas diarias) durante igual lapso.5
Se recomienda el uso de profilaxis secundaria trisemanal con Benznidazol para aquellos pacientes que hayan remitido el cuadro clínico, tornado negativa la parasitemia, se encuentren bajo TARV y mientras los recuentos de linfocitos T CD4+ persistan con valores por debajo de 200 células/mm³.2,5
En nuestro país, la enfermedad de Chagas es endémica. En pacientes seropositivos al VIH con manifestaciones clínicas de meningoencefalitis difusa, masa cerebral ocupante o miocarditis, el diagnóstico de la parasitosis se realiza mediante métodos directos. Los resultados negativos de las determinaciones serológicas para la enfermedad de Chagas, pueden resultar insuficientes para excluir el diagnóstico de la misma.
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Corti M, Trione N, Corbera K, Vivas C. Enfermedad de Chagas: otra causa de masa cerebral ocupante en pacientes con síndrome de inmunodeficiencia adquirida. Enferm Infecc Microbiol Clin. 2000;18(4):194-5.
2. Corti M. AIDS and Chagas’ Disease. Review. AIDS Patient Care STDS. 2000;14(11):581-8.
3. Auger S, Storino R, De Rosa M, Caravello O, Gonzalez M, Botaro E, et al. Chagas y SIDA, la importancia del dignóstico precoz. Rev. Argent. Cardiol. [online]. 2005;73(6):439-445 [citado 2013-01-19]. Disponible en: <http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S1850-37482005000600008&lng=es&nrm=iso>. ISSN 1850-3748.
4. Vaidian AK, Weiss LM, Tanowitz HB. Chagas' disease and AIDS. Kinetoplastid Biol Dis. 2004;3(1):2.
5. Novaes Ramos Júnior A, Tatto E, Rocha A, Sartori A, Correia D, Dias Gontijo E, et al. Recomendações para diagnostico, tratamento, e acompanhamento da co-infecção Trypanosoma cruzi-vírus da imunodeficiência humana. Ministério da Saúde. Rev Soc Bras Med Trop. 2006;39(4):392-415.
6. Almeida EA, Silva EL, Guariento ME, Souza ML, Aoki FH, Pedro R de J. Evolução fatal da co-infecção doença de Chagas/Aids: dificuldades diagnósticas entre reagudização da miocardite e a miocardiopatia chagásica crônica. Rev Soc Bras Méd Trop. 2009;42(2):199-202.
7. Guías para la atención al paciente infectado con Trypanosoma cruzi (Enfermedad de Chagas). Buenos Aires: Ministerio de Salud de la Nación, 2012. [Internet] [citado 20 de julio de 2014]. Disponible en: http://www.msal.gov.ar/chagas/images/stories/Equipos/Guia_Nacional_Chagas_version_27092012.pdf
8. Sartori AM, Lopes MH, Caramelli B, Duarte MI, Pinto PL, Neto V, et al. Simultaneous occurrence of acute myocarditis and reactivated Chagas disease in a patient with AIDS. Clin Infect Dis. 1995;21:1297-1299.
9. De Almeida E, Novaes Ramos A, Correia D, Shikanai-Yasuda M. Co-infection Trypanosoma cruzi/HIV: systematic review (1980 - 2010). Rev Soc Bras Med Trop. 2011;44(6):762-770.
Recibido: 22 de enero de 2014.
Aprobado: 4 de agosto de 2014.
Luis Angel Trombetta. Avenida Rivadavia 3494 – Piso 3º (CP 1203). Ciudad Autónoma de Buenos Aires, Argentina.
Correo electrónico: lusumar@fibertel.com.ar