My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.68 no.1 Ciudad de la Habana Apr. 2016
Rev Cubana Med Trop 2016;68(1)
ARTÍCULO ORIGINAL
Resistencia a insecticidas y sus mecanismos bioquímicos en Aedes aegypti del municipio Boyeros en los años 2010 y 2012
Insecticide resistance and its biochemical mechanisms in Aedes aegypti mosquitoes from the municipality of Boyeros in the years 2010 and 2012
Juan Andrés Bisset Lazcano, María Magdalena Rodríguez Coto, Daymi Hurtado Nuñez, Hilda Hernández Alvarez, Vivian Valdéz Miró, Ilario Fuentes López
Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: el programa de control de Aedes aegypti (L.) (Diptera: Culicidae) en Cuba utiliza fundamentalmente temefos (ABATE) como larvicida y piretroides como adulticidas, y se ha utilizado, esporádicamente, el organofosforado (OF) clorpirifos. El monitoreo de la resistencia a estos insecticidas es esencial para lograr un control efectivo de esta especie.
Objetivo: determinar la resistencia a temefos en larvas y sus mecanismos, y evaluar el nivel de resistencia a los insecticidas más utilizados como adulticidasen cinco áreas de salud del municipio Boyeros, La Habana, colectadas indistintamente en los años 2010-2012.
Métodos: se evaluó la resistencia a temefos y la eficacia del mismo, en su formulación comercial (ABATEX G1), en larvas, a través de los bioensayos recomendados por la Organización Mundial de la Salud. Los mecanismos de resistencia se realizaron a través de ensayos bioquímicos. La resistencia en el estado adulto se determinó a través del método de las botellas impregnadas.
Resultados: la resistencia a temefos en larvas disminuyó del año 2010 al 2012. El producto comercial de temefos mostró 100 % de mortalidad entre 5 y 12 días. Se demostró que las esterasas y monooxigenasas desempeñaron un papel importante en la resistencia a temefos en larvas. En el estado adulto, se observó resistencia a piretroides y a clorpirifos en algunas cepas.
Conclusiones: estos resultados corroboran la necesidad de establecer estrategias de control integrado para preservar la vida útil de los insecticidas disponibles para el control de Ae. aegypti en el municipio Boyeros.
Palabras clave: Aedes aegypti; resistencia a insecticidas; mecanismos de resistencia; temefos.
ABSTRACT
Introduction: the program for control of Aedes aegypti (L.) (Diptera: Culicidae) in Cuba is mainly based on the use of temephos (Abate) as larvicide and pyrethroids as adulticides. Organophosphate (OP) insecticide Chlorpyrifos has also been used on occasion. Monitoring resistance to these insecticides is essential to achieve effective control of the species.
Objective: determine temephos resistance in larvae and its mechanisms, and evaluate the level of resistance to the insecticides most commonly used as adulticides in five health areas from the municipality of Boyeros, Havana, surveyed in the years 2010 and 2012.
Methods: an evaluation was conducted of resistance to and effectiveness of temephos in its commercial formulation (Abatex G1) in larvae, using tests recommended by the World Health Organization. Resistance mechanisms were assessed with biochemical assays. The impregnated bottle bioassay was used to determine resistance in the adult stage.
Results: larval resistance to temephos decreased from 2010 to 2012. The commercial product temephos showed 100% mortality between 5 and 12 days. Esterases and monooxygenases were found to play an important role in larval resistance to temephos. Some strains showed resistance to pyrethroids and Chlorpyrifos in the adult stage.
Conclusions: these results corroborate the need to set up integrated control strategies to preserve the useful life of the insecticides available to control Aedes aegypti in the municipality of Boyeros.
Key words: Aedes aegypti; insecticide resistance; resistance mechanisms; temephos.
INTRODUCCIÓN
El dengue es considerada la enfermedad viral más importante, que afecta entre 50 y 100 millones de casos y miles de muertes anualmente.1 En la actualidad, el único método para prevenir la transmisión del virus que causa esta enfermedad es el control de su principal vector, el mosquito Aedes aegypti (L.) (Diptera: Culicidae).
Desde 1981, el objetivo de la campaña anti-Ae. aegypti en Cuba está basada en el control permanente de este vector. La misma propone la destrucción de los sitios de cría del mosquito mediante un intenso uso de larvicidas y adulticidas, así como campañas educacionales que previenen el aumento de nuevos sitios de cría. A pesar de que se ha logrado la disminución del vector en muchas áreas, las poblaciones de Ae. aegypti continúan incrementándose en otras, principalmente en las provincias La Habana y Santiago de Cuba, lo cual constituye un peligro potencial para la ocurrencia de brotes o epidemias de dengue.
El municipio Boyeros, uno de los 15 municipios de La Habana, cuenta con 188 712 habitantes con una densidad poblacional de 1406,2 habitantes por km² y ha sido uno de los implicados con la presencia de altos índices de Ae. aegypti, de ahí que las principales actividades de control en este municipio estén encaminadas hacia la reducción y el tratamiento de los criaderos del vector. Las acciones se han basado fundamentalmente en el uso de temefos granulado 1 % como larvicida y tratamiento espacial adulticida con los piretroides cipermetrina o lambdacialotrina y esporadicamente. El organofosforado clorpirifos. El uso continuado de insecticidas conlleva a que este vector desarrolle resistencia a diferentes tóxicos. Estudios realizados han demostrado que algunas enzimas son las responsables de este fenómeno de,2-5 de ahí la importancia de evaluar la resistencia de los insecticidas químicos tanto en larvas como en adultos, así como los mecanismos de resistencia responsables. En el presente trabajo se realizó una evaluación de los niveles de resistencia a insecticidas en larvas y adultos de Ae aegypti del municipio Boyeros. Los resultados de este trabajo aportan información que contribuye a mejorar las estrategias de uso de insecticidas para el control de Ae. aegypti en el municipio Boyeros.
MÉTODOS
Cepas de Ae. Aegypti
ROCKEFELLER: cepa de laboratorio de referencia, susceptible a insecticidas, suministrada por el Centro para el Control de Enfermedades (CDC) de San Juan, Puerto Rico.
SAN-F6: cepa de referencia resistente a temefos, colectada en 1997 en Santiago de Cuba. Las larvas fueron sometidas a presión de selección con este organofosforado por seis generaciones de selección6 y se mantiene en el laboratorio bajo presión de selección, utilizando la concentración letal 90 (CL90) para temefos.
Ubicación del área de estudio
El Municipio Boyeros está ubicado al norte de la provincia La Habana. El municipio está dividido en siete áreas de salud: Salvador Allende, Cabdevila, Wajay, Boyeros, Calabazar, Mulgoba y Santiago de las Vegas (Fig. 1). El trabajo se realizó en Ae. aegypti, provenientes de 5 áreas de salud.
Armada, Cabdevila 2010, Boyeros 2010, Mulgoba 2010, Santiago de las Vegas 2010, Cabdevila 2012, Mulgoba 2012, Calabazar 2012: cepas criadas en el insectario del IPK, a partir de larvas de colectas en los año 2010 y 2012 en el municipio Boyeros, cuyo nombre fue asignado de acuerdo al área de salud y año de colecta.
Cría y mantenimiento de las cepas de Ae. aegypti en el laboratorio
El mantenimiento de las cepas de Ae. aegypti se realizó en el insectario del Departamento de Control de Vectores del IPK, siguiendo la metodología del Manual de Indicaciones Técnicas del Insectario. La temperatura durante el período de estudio se mantuvo a 25 °C ± 2 y una humedad relativa de 75 ± 2. Se utilizaron ratones OF-1 heterocigótico para el desarrollo de la hematofagia, para su uso se han tenido en cuenta las regulaciones de los principios éticos nacionales e internacionales para la experimentación animal.7
Bioensayos utilizando temefos grado técnico
Insecticida: Temefos grado técnico: 90 % de pureza, suministrado por American Cyanamid Co., Princeton, New Jersey.
Métodos: Se evaluó, a través de los bioensayos,8 la susceptibilidad y/o resistencia al insecticida organofosforado temefos en larvas tercer estadio tardío o cuarto temprano de Ae. aegypti, de todas las cepas colectadas, así como de la cepa de referencia susceptible, para determinar las concentraciones que causaron 50 y 90 % de mortalidad (CL50 y CL90) frente a este insecticida. Se aplicaron cinco o más concentraciones del insecticida con acetona como diluente y se evaluaron cinco réplicas y un control por cada concentración, las que causaron una letalidad entre 2 y 98 %. Todas las soluciones de insecticidas se ajustaron a un volumen final de 1 mL con acetona, concentración que no causó mortalidad en los controles. La mortalidad se determinó 24 h después de aplicado el insecticida. Los resultados se analizaron mediante la prueba probit implementada en el programa estadístico SPSS versión 11,5,9 el cual permite contrastar gráficamente la mortalidad observada contra el logaritmo de las dosis de insecticida empleadas. Se determinó la dosis que causó 50 y 90 % de mortalidad (CL50 y CL90) y se calculó el factor de resistencia (FR50 y FR 50) según la ecuación FR= CL50 cepa en estudio ∕ CL50 cepa de ROCKEFELLER. Para el diagnóstico de la resistencia se utilizó el siguiente criterio10: FR50 < 5 Susceptible, FR50 entre 5 y 10 Resistencia moderada y FR50> 10 Resistente.
Bioensayos utilizando temefos comercial
Insecticida: temefos granulado: ABATEX G1, suministrado por Centro de Protección de Higiene de las Radiaciones (CPHR), Cuba.
Métodos: Los bioensayos en larvas se realizaron utilizando ABATEX G1. Se añadió 1 g de esta formulación en recipientes de 10 L de agua y se dejó por 24 h antes de añadir las larvas. Se adicionaron 50 larvas de tercer estadio o cuarto temprano por recipiente (un control y cuatro réplicas) y se leyó la mortalidad a las 24 h. El agua fue eliminada totalmente cada 24 h, previo a la adición de las 50 nuevas larvas. De aquí que, el temefos que quedó, fue el que quedó pegado en el recipiente, este se añadió el primer día del experimento. El procedimiento se repitió diariamente y fue replicado dos veces por cada cepa en diferentes días para un total de 8 recipientes y dos controles por cepa.
Ensayos bioquímicos
Preparación de las muestras: Larvas de cuarto estadio temprano fueron maceradas individualmente en placas de microtitulación en 50 µL de tampón Na2PO4 0,01 mol/L, pH 7,5 (tampón fosfato), con el empleo de un homogenizador de placas, sobre una bolsa de hielo. Se completó a un volumen de 300 µL de tampón Na2PO4.
La actividad de esterasas: Se determinó siguiendo la metodología descrita por Peiris y Hemingway11 con algunas modificaciones realizadas para su detección en Ae. aegypti.12 Se adicionaron 20 µL del homogenato de larvas individuales a cada pocillo de la placa de microtitulación. Posteriormente, se añadió 200 μL del sustrato β-naftil acetato (0,7-mm) a cada pocillo. Se dejó transcurrir la reacción por 10 min a temperatura ambiente, antes de añadir 40 μL de Fast-blue B salt (0,3 % en 3,5 % lauryl sulfato de sodio) para detener la reacción. La absorbancia se leyó a 570 nm en un lector de placas VersaMax™ (Molecular Devices Corporation, Sunnyvale, CA, U.S.A.). La actividad de esterasas se expresó como µmol β-naftol acetato/min/mg proteína.
La actividad monooxigenasa: se determinó siguiendo la metodología descrita por Brogdon y otros, en 1997.13 Brevemente, 20 mg de 3, 3, 5, 5 tetrametilbenzidina dihidrocloride (TMBZ) se diluyó en 25 mL de metanol y posteriormente, se mezcló con 75 mL de acetato de sodio 0,25 M (pH 5,0). Se añadió 200 µL de la solución de TMBZ a cada pocillo de la placa de microtitulación, seguido de 25 µL de peróxido de hidrógeno al 3 %. La placa se incubó durante 5 min y se leyó a 620 nm. La actividad de la enzima monooxigenasa se expresó como nmol TMBZ/min.
Bioensayos en adultos utilizando el método de las botellas impregnadas
Los bioensayos para evaluar el nivel de resistencia a insecticidas en el estado adulto se realizaron con el uso de la metodología, previamente descrita por Brogdon y McAllister, 1998,14 estandarizadas por el Centro para el Control de Enfermedades (CDC, 2010).15 En cada experimento se utilizaron 4 réplicas de cada concentración diagnostica del insecticida para un tiempo de 30 min (tabla 1) y un control. El control consistió en utilizar una botella impregnada con acetona. En cada botella se colocaron entre 16 y 20 mosquitos de 1 a 3 días de nacidos. La mortalidad se leyó durante una hora cada 5 min. Los resultados se analizaron siguiendo el criterio de susceptibilidad descrito por Mazzarri y Georghiou, 1995.10
Análisis de los datos
La actividad enzimática de esterasas para cada cepa fue comparada, y se utilizó la prueba de Kruskal Wallis. Todos los ensayos estadísticos fueron con el programa STATISTIC 6,0 (STATSOFT INC., Tulsa, OK, U.S.A.).
RESULTADOS
Bioensayo de temefos en larvas
Todas las cepas colectadas de las cinco áreas del municipio Boyeros, La Habana resultaron resistentes a temefos [factor de resistencia (FR50 > 10×)], excepto en Cabdevila-2012 que mostró moderada resistencia [factor de resistencia (FR50 entre 5 y 10×)]. Los valores de resistencia resultaron mayores en el año 2012, en un rango desde 23,33× en Mulgoba-2012 hasta 80,33× en Capdevilla-2012 y en el 2010 resultó de 11,66× en Mulgoba- 2010 y 15× en Calabazar-2010. La resistencia resultó más homogénea en las cepas colectadas en el 2012 que en el 2010, lo que se evidenció por los valores más elevados de la pendiente de las líneas de regresión (% de mortalidad vs concentración del insecticida) (tabla 2).
Efectividad del temefos en su formulación comercial (ABATEX G1)
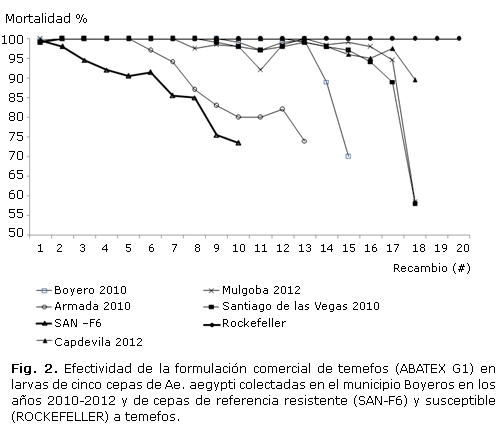
Se determinó la efectividad de la formulación comercial de temefos para varias cepas de Ae. aegypti del municipio Boyeros en los años 2010 y 2012 (Fig. 1). La única aplicación de temefos que produjo 100 % de mortalidad en un periodo de 20 días fue en la cepa susceptible de referencia pero en las cepas de Ae. aegypti de larvas colectadas en el año 2010 fluctuó entre 5 y 9 días y en el 2012 entre 7 y 12 días. De forma general la efectividad (100 % de mortalidad) resultó entre 5 y 12 días con recambio diario de agua.
Actividad de esterasas
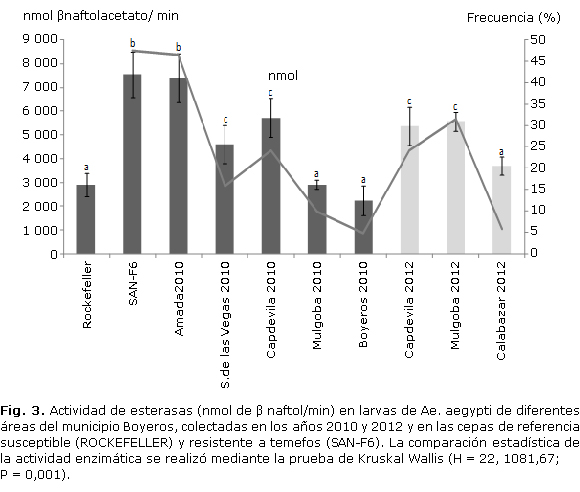
Existió diferencias significativas (P< 0,05, P= 0.001) entre el nivel de actividad de esterasas de las cepas de Boyeros en los dos años de colecta y la cepa susceptible de referencia, excepto las cepas de Mulgoba-2010, Boyeros-2010 y Calabazar-2012 (Fig. 2). La actividad de esterasas en la cepa de campo, que mostró mayor resistencia a temefos (Armada 2010), difirió significativamente de ambas cepas de referencia, susceptible (Rockefeller) y resistente (SAN-F6), y de las otras cepas de campo colectadas en ambos periodos. Sin embargo, en el resto de las cepas de campo el comportamiento en la actividad de las enzimas esterasas observadas en los dos años de colecta resultó similar. En las cepas de campo la actividad enzimática resultó significativamente inferior a la observada en la cepa SAN-F6, excepto la cepa Armada 2010.
Actividad de monooxigenasas
Todas las cepas de campo mostraron alta actividad de monooxigenasa, lo cual se evidenció por las diferencias significativas (P< 0,05, P= 0,001) observadas con la cepa Rockefeller, excepto las cepas Mulgoba-2010 y Boyeros-2010, que no mostraron diferencia con la susceptible (Fig. 3). La cepa de Armada 2010, que mostró la más alta resistencia a temefos y que mostró mayor actividad de esterasa, también se observó, que resultó la cepa de campo con mayor actividad monooxigenasa. Sin embargo, en el resto de las cepas de campo la actividad enzimática en los dos años de colecta resultó similar. Para todas las cepas la actividad de esta enzima resultó significativamente inferior a la cepa de referencia SAN-F6 (Fig. 4).
Bioensayos de adultos
Se evaluó la resistencia en mosquitos adultos para los piretroides cipermetrina, lambdacialotrina, deltametrina y para el organofosforado clorpirifos (tabla 3). Se observó alta resistencia (% mortalidad < 80 %) en la mayoría de las cepas evaluadas, tanto a los piretroides como al clorpirifos y muy pocas mostraron susceptibilidad (% mortalidad > 98 %) o en verificación (% mortalidad entre 80 y 98 %). El 42,86 % de las cepas mostró susceptibilidad a cipermetrina (Capdevila-2010, Capdevila-2012 y Calabazar-2012), seguido de 28,57 % para clorpirifos (Santiago de las Vegas-2010 y Calabazar-2012 y para deltametrina y lambdacialotrina el 14,28 % (Calabazar-2012).
DISCUSIÓN
Desde la creación de la campaña para erradicar el Ae. aegypti en Cuba en 1981, el control larvario se ha basado en la reducción de los sitios de cría y la adición del organofosforado temefos. Al ser La Habana, la ciudad donde han ocurrido dos de los brotes epidémicos de dengue más importantes ocurridos en Cuba, es el escenario donde más se ha utilizado este larvicida. El primer diagnóstico de resistencia a temefos fue en 1997, con la ocurrencia del brote epidémico de dengue en Santiago de Cuba.16 Después del brote epidémico ocurrido en La Habana en el periodo 2000-2001, varios estudios han detectado resistencia a temefos en varios municipios de la ciudad, como en los municipios de Guanabacoa17 y Playa.18 En este estudio se demostró la prevalencia de la resistencia a este insecticida en el municipio Boyeros en los años 2010 y 2012, la cual fue detectada previamente en este municipio en el año 2006.19 El monitoreo de la resistencia a temefos en este municipio ha permitido detectar cambios dramáticos en los niveles de resistencia a este organofosforado como fue su incremento entre el año 2006 y 2008,5 y su disminución entre el año 2010 y 2012, detectada en este estudio, lo cual se asocia con la frecuencia en que se ha aplicado este insecticida en dicho municipio.
Para conocer como el uso intensivo de temefos puede afectar la efectividad de éste químico, se evaluó la formulación comercial utilizada en el municipio Boyeros durante el periodo 2010 y 2012. Se demostró que el efecto residual de temefos con 100 % de mortalidad en el periodo 2010 fue entre 5 y 9 días y en el 2012 entre 7 y 12 días y todas las cepas en ambos años de colecta mostraron alta resistencia (FR > 10x) a temefos con el producto grado técnico. En trabajos previos5 se demostró que en cepas con alta resistencia (FR > 10x), al insecticida temefos grado técnico, la efectividad de este en su formulación comercial resultaba entre 9 y 13 días, moderada resistencia (FR entre 5 y 10x), entre 5 y 10 días y susceptible entre 14 y 18 días. Montella y otros20 además, demostraron un efecto residual inferior a este rango cuando el FR >10x.
Las enzimas de acción metabólica constituyen el principal mecanismo de resistencia a temefos en Ae. aegypti. Algunos estudios la han asociado con un incremento de las monooxigenasas,12 pero la mayoría de las investigaciones han demostrado que son las esterasas las enzimas responsables de este fenómeno, como en Cuba,6,21,5 Brasil,22 Thailand,23 Malaysia.24 A pesar de que se observó menor nivel de resistencia en las cepas evaluadas en el año 2012 con respecto al año 2010, el comportamiento del nivel de efectividad del temefos en su formulación comercial fue similar en ambos años al igual que la actividad de ambas enzimas. Se demostró el papel tanto de las esterasas, como de las monooxigenasas en la resistencia detectada a temefos, como resultó en este municipio, en el año 2006 y 2008,5 donde el incremento de la actividad de esterasas resultó el principal mecanismo de resistencia a temefos.
En el estado adulto se observó resistencia a los piretroides y a clorpirifos en la mayoría de las cepas evaluadas. Sin embargo, a los insecticidas en que mayor número de cepas resultaron susceptibles fue a cipermetrina y clorpirifos, que han sido los insecticidas más utilizados para el control de Ae. aegypti en Cuba. En estudios previos realizados en municipios de La Habana y Santiago de Cuba se demostró que estos insecticidas resultaron efectivos a pesar de su uso intenso por el programa de control de Ae. aegypti en Cuba.25-27
El monitoreo de la resistencia a insecticidas y sus mecanismos representan una importante herramienta en el programa de control de Ae. aegypti en Cuba. Estos resultados corroboran la necesidad de establecer estrategias de control integrado para preservar la vida útil de los insecticidas disponibles para el control de Ae. aegypti en el municipio Boyeros.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization (WHO). Report of the Scientific Working Group on Dengue. WHO/TDR/SWG/08. WHO, Geneva, 2006.
2. Logjam N, McCarran L, Prapanthadara L, Hemingway J, Ranson H. Elevated activity of an Epsilon class glutathione transferase confers DDT resistance in the dengue vector, Aedes aegypti. Insect Biochem Mol Biol. 2005;35:861-71.
3. Rodriguez MM, Bisset JA, De Armas Y, Ramos F. Pyrethroid insecticide-resistant strain of Aedes aegypti from Cuba induced by deltamethrin selection. J Am Mosq Control Assoc. 2005;21:437-45.
4. Rodríguez MM, Bisset JA, Fernández D. Levels of insecticide resistance and resistance mechanisms in Aedes aegypti (Diptera: Culicidae) from some latinamerican countries. J Am Mosq Control Assoc. 2007;24:420-9.
5. Bisset JA, Rodríguez MM, Ricardo Y, Ranson H, Pérez O, Moya M, Vázquez A. Temephos resistance and esterase activity in the mosquito Aedes aegypti in Havana, Cuba increased dramatically between 2006 and 2008. Med Vet Entomol. 2011;25:233-9.
6. Rodríguez MM, Bisset, J.A, Soca A. Cross-resistance to pyrethroid and organophosphorus insecticides induced by selection with temephos in Aedes aegypti (Diptera: Culicidae) from Cuba. J Med Entomol. 2002;39:882-8.
8. MS. Instructions for determining the susceptibility or resistance of mosquito larvae Aedes to insecticides. Geneva: WHO/VBC/81.807. 1981,1-6.
9. Pardo A, Ruiz MA. SPSS 11. Guía para el análisis de datos. McGraw Hill: Madrid, 2002.
10. Mazzarri MB, Georghiou GP. Characterization of resistance to organophosphate, carbamate and pyrethroid insecticides in field populations of Aedes aegypti from Venezuela. J Am Mosq Control Assoc. 1995;11:315-22.
11. Peiris HT, Hemingway J. Effect of fenthion treatment on larval densities of insecticide-resistant Culex quinquefasciatus in an urban area of Sri Lanka. Med Vet Entomol. 1996;10:283-7.
12. Rodríguez MM, Bisset JA, Fernández D, Soca A. Adaptación de los métodos en placas de microtitulación para la cuantificación de la actividad de esterasas y glutation-s-transferasa en Aedes aegypti (L). Rev Cubana Med Trop. 2001;53:32-6.
13. Brogdon WG, McAllister JC, Vulule J. Heme peroxidase activity measured in single mosquitoes identifies individuals expressing an elevated oxidase for insecticide resistance. J Am Mosq Control Assoc. 1997;13:233-7.
14. Brogdon WG, McAllister JC. Simplification of adult mosquito bioassays through use of time-mortality determinations in glass bottles. J Am Mosq Control Assoc. 1998;14:159-64.
15. Guías CDC. Guideline for Evaluating Insecticide Resistance in Vectors Using the CDC Bottle Bioassay. In: BROGDON, G. & CHAN, B. H. (eds.) 1 ed.: Centers for Disease Control and Prevention. 2010.
16. Rodríguez MM, Bisset JA, Milá LH, Lauzán L, Soca LA. Niveles de resistencia a insecticidas y sus mecanismos en una cepa de Aedes aegypti de Santiago de Cuba. Rev Cubana Med Trop. 1999;51:83-8.
17. Rodríguez MM, Bisset JA, Fernández D, Pérez O. Resistencia a insecticidas en larvas y adultos de Aedes aegypti: prevalencia de la esterasa A4 asociada con la resistencia a temefos. Rev Cubana Med Trop. 2004;56:54-60.
18. Bisset JA, Rodríguez MM, Fernández D, Pérez O. Estado de la resistencia a insecticidas y mecanismos de resistencia en larvas del municipio Playa, colectadas durante la etapa intensiva contra el Aedes aegypti en Ciudad de La Habana, 2001–2002. Rev Cubana Med Trop. 2004;56:61-6.
19. Rodríguez MM, Bisset JA, Pérez O, Montada D, Moya M, Ricardo Y, Valdés V. Estado de la resistencia a insecticidas y sus mecanismos en Aedes aegypti en el municipio Boyeros. Rev Cubana Med Trop. 2009;61:40-51.
20. Montella IR, Martins AJ, Viana-Medeiros PF, Lima JB, Braga IA, Valle D. Insecticide resistance mechanism of Brazilian Aedes aegypti populations from 2001 to 2004. Am J Trop Med Hyg. 2007;77:467-77.
21. Rodríguez MM, Bisset JA, Fernández D. Levels of insecticide resistance and resistance mechanism in Aedes aegypti from some Latin American countries. J Am Mosq Control Assoc 2007; 23:420-9.
22. Macoris M de L, Andrrighetti MT, Takaku L, Glasser CM, Garbeloto VC, Braco, JE. Resistance of Aedes aegypti from the state of Sao Paulo, Brazil, to organophosphate insecticides. Mem Inst Oswaldo. 2003;98:703-8.
23. Saelim V, Brogdon WG, Rojanapremsuk J, Suvannadaba S, Pandii W, Jones JW. et al. Bottle and biochemical assays on temephos resistance in Aedes aegypti in Thailand. Southeast Asian J Trop Med Pub Health. 2005;36:417-25.
24. Dhang CH, Ahmad NW, Lim, LH, Benjamin S, Sofian-Azirun M. Biochemical detection of temephos resistance in Aedes (Stegomyia) aegypti (Linnaeus) from dengue-endemic areas of Selangor State, Malaysia. Parasitol. 2008;36-42.
25. Montada D, Zaldívar J, Sánchez F, Figueredo D, Suárez S, Leyva M. Eficacia de los tratamientos intradomiciliarios con los insecticidas cipermetrina, lambdacialotrina y clorpirifos en una cepa de Aedes aegypti. Rev Cubana Med Trop. 2006;58:130-5.
26. Montada D, Leyva M, Silva Y, Marquetti MC, Castex M. Susceptibilidad de 3 cepas de Aedes aegypti asociada con la aplicación de 3 insecticidas. Rev Cubana Med Trop. 2009;61(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602009000200011&lng=es
27. Bisset JA, Rodríguez MM, Ricardo Y, Perez O, Moya M, Montada D, Gato R. Efectividad de formulaciones de insecticidas para el control de Aedes aegypti de Ciudad de la Habana, Cuba. Rev Cubana Med Trop. 2011;63:166-70.
Recibido: 28 de julio de 2015
Aprobado: 14 de diciembre de 2015
Juan Andrés Bisset Lazcano. Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba. Autopista Novia del Mediodía Km 6 1/2 La Lisa. Po Box 601 Marianao 13.
Correo electrónico: bisset@ipk.sld.cu