Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760versión On-line ISSN 1561-3054
Rev Cubana Med Trop vol.68 no.1 Ciudad de la Habana abr. 2016
Rev Cubana Med Trop 2016;68(1)
ARTÍCULO ORIGINAL
Evaluación de la resistencia a insecticidas en cepas de Aedes aegypti (Diptera: Culicidae) de la Región Caribe de Costa Rica
Evaluation of insecticide resistance in strains of Aedes aegypti (Diptera: Culicidae) from the Caribbean region of Costa Rica
Ólger Calderón-Arguedas, Adriana Troyo
Universidad de Costa Rica. Facultad de Microbiología. Centro de Investigación en Enfermedades Tropicales (CIET).
RESUMEN
Introducción: el dengue y chikungunya son virosis antroponóticas transmitidas por Aedes aegypti que afectan extensas áreas del continente americano incluyendo Costa Rica. La reciente introducción del virus Zika representa un nuevo reto para los sistemas de salud. Dada la ausencia de tratamiento antiviral y vacunas, el control del vector Ae. aegypti, representa la única alternativa para minimizar el impacto de estas virosis. En Costa Rica, el control químico del vector se hace mediante la aplicación de piretroides (cipermetrina y deltametrina) y del organofosforado temefós; de ahí la importancia de detectar la aparición de resistencia a estos insecticidas.
Objetivo: determinar el nivel de resistencia a temefós, cipermetrina y deltametrina en tres cepas de Ae. aegypti de la Región Caribe de Costa Rica, así como los mecanismos de detoxificación enzimática correspondientes.
Métodos: la resistencia a temefós, cipermetrina y deltametrina se evaluó mediante bioensayos larvarios. Grupos de 20 larvas se expusieron por 24 h a 5 concentraciones de insecticidas que generaron una mortalidad entre el 2 y el 100 %. Cada concentración se evaluó mediante cinco réplicas y se calculó la concentración que causa el 50 % de letalidad (CL50). Como control susceptible se empleó la cepa Rockefeller. Con cada cepa se calculó un factor de resistencia 50 % (FR50) para cada insecticida. Cuando se observó resistencia, se repitieron los bioensayos mediante exposición previa de las larvas a butóxido de piperonilo (PB) y S,S,S, tributilfosforotritioato (DEF) para evaluar el mecanismo detoxificante relacionado.
Resultados: ninguna de las cepas evaluadas fue resistente al temefós. En las cepas Guápiles y Limón se determinó una resistencia incipiente a cipermetrina (CL50= 0,01022, FR50= 7,35 y CL 50= 0,01016, FR50= 7,30, respectivamente), mientras que en la cepa Siquirres se detectó resistencia a deltametrina (CL50= 0,01973 mg/L, FR5= 12,64). En los casos referidos hubo una disminución de la resistencia cuando se dio el pretratamiento con PB, lo que indica una detoxificación mediada por el sistema Cit P450 monooxigenasa.
Conclusiones: los resultados en el presente estudio demuestran que el temefós sigue siendo efectivo para el control larvario de Ae. aegypti en las principales localidades de la región Caribe de Costa Rica. Con respecto a los piretroides se alerta ante la aparición de resistencia, lo que conlleva la necesidad de optimizar los procesos de monitoreo y la implementación de otras alternativas de control químico.
Palabras clave: dengue, Aedes aegypti, arbovirus, enfermedades de transmisión vectorial, Costa Rica.
ABSTRACT
Introduction: dengue and chikungunya are anthroponotic virus infections transmitted by Aedes aegypti mosquitoes. These conditions affect large areas of the American continent, including Costa Rica. The recent introduction of Zika virus infection is a new challenge for health systems. Given the absence of antiviral treatment and vaccines, Aedes aegypti control is the only alternative to minimize the impact of these viral diseases. In Costa Rica chemical control of the vector is based on the use of pyrethroids (cypermethrin and deltamethrin) and the organophosphate larvicide temephos, hence the importance of detecting the emergence of resistance to these insecticides.
Objective: determine the level of resistance to temephos, cypermethrin and deltamethrin in three Aedes aegypti strains from the Caribbean region of Costa Rica, as well as the corresponding enzymatic detoxification mechanisms.
Methods: resistance to temephos, cypermethrin and deltamethrin was evaluated with larval bioassays. Groups of 20 larvae were exposed to 5 insecticide concentrations for 24 h. Mortality ranged between 2 and 100 %. Each concentration was evaluated by means of five replications, and estimation was performed of the concentration causing 50 % lethality (CL50). The Rockefeller strain was used as susceptible control. Each strain underwent estimation of a 50% resistance factor (RF50) for each insecticide. Whenever resistance was observed, the bioaasays were repeated with prior exposure of the larvae to piperonyl butoxide (PBO) and S.S.S. phosphotrithiate tributyl (DEF) to evaluate the corresponding detoxification mechanism.
Results: none of the strains evaluated was resistant to temephos. Incipient resistance to cypermethrin was detected in strains Guápiles and Limón (CL50= 0.01022, RF50= 7.35 and CL 50= 0.01016, RF50= 7.30, respectively), whereas resistance to deltamethrin was detected in the Siquirres strain (CL50= 0.01973 mg/L, RF50= 12.64). In the above-mentioned cases resistance decreased when pre-treatment with PBO was provided, indicating the presence of detoxification mediated by the Cyt P450 monooxygenase system.
Conclusions: results show that temephos continues to be effective for larval control of Aedes aegypti in the main areas of the Caribbean region of Costa Rica. A warning is hereby given about the emergence of pyrethroid resistance, leading to the need to optimize monitoring processes and the implementation of other chemical control alternatives.
Key words: dengue; Aedes aegypti; arbovirus; vector borne diseases; Costa Rica.
INTRODUCCIÓN
Aedes aegypti (L.) constituye una de las especies de mosquitos de más importancia en la salud pública mundial. Su papel como vector de los virus dengue (DENV), chikungunya (CHIKV) y Zika (ZIKV) justifican los esfuerzos que se hacen continuamente para lograr su control, dado que para estas virosis no existe vacuna de efecto comprobado ni tratamiento antiviral.1,2
En Costa Rica, gracias a una campaña basada en la aplicación de DDT, se logró la erradicación del Ae. aegypti para al inicio de la década de los años sesenta; erradicación certificada por la Organización Panamericana de la Salud.3 No obstante, en años posteriores se pudo determinar la ocurrencia de re-infestaciones, principalmente en áreas costeras.3 Para el año 1992, el Ministerio de Salud constató que el vector se había diseminado por la mayor parte del territorio nacional, lo que precedió la aparición de los primeros casos de dengue en el país, detectados en septiembre de 1993.4 Desde ese momento hasta febrero del 2016 se han reportado 347 105 casos con 23 defunciones,5 lo que hace del dengue la principal enfermedad de transmisión vectorial en Costa Rica. En el caso de chikungunya, al finalizar el mes de diciembre del 2015 se habían reportado 4 912 casos,6 los cuales procedieron en su mayoría de regiones donde el dengue ha sido tradicionalmente endémico. En este contexto se ubica la región Caribe de Costa Rica, que ha sido una de las tres regiones del país con mayor incidencia de dengue en la historia nacional de la virosis.5
La introducción del virus Zika al continente americano en el 2014 ha representado un nuevo reto para los países de la región. Su relación con problemas neurológicos como microcefalia y el síndrome de Guillain Barré han constituido un motivo de preocupación para la población y el personal médico.7 Con respecto al Zika, para marzo de 2016, el Ministerio de Salud de Costa Rica informó, por medio de la prensa, la detección de 8 casos de circulación autóctona en la provincia de Guanacaste al noroeste del país.8
Aunque el control ecológico, basado en la eliminación de criaderos, es la principal opción para impactar las poblaciones del vector, el tratamiento con insecticidas es una herramienta usual en los programas de control vectorial del país.9 En Costa Rica el insecticida que tradicionalmente ha sido utilizado para el control larvario de Ae. aegypti es temefós, mientras que cipermetrina y deltametrina son los adulticidas que se han aplicado en el territorio nacional a lo largo de la última década.9
El uso frecuente e inadecuado de los insecticidas es uno de los factores que más influye en la generación de resistencia, ya que promueve la selección artificial de insectos resistentes. Estudios previos en la Región Caribe han determinado la ocurrencia de resistencia a temefós y deltametrina en Ae. aegypti procedentes de la localidad de Cariariy resistencia incipiente a cipermetrina en insectos procedentes de Guácimo.9,10
En Costa Rica el conocimiento acerca de resistencia a insecticidas por parte de Ae. aegypti es escaso. Por esta razón, el presente trabajo tuvo como propósito determinar la resistencia a temefós, cipermetrina y deltametrina en cepas del vector procedentes de los tres centros poblacionales más grandes de la Región Caribe de Costa Rica. También se determinaron los principales mecanismos de detoxificación enzimática que median la resistencia en cada cepa.
MÉTODOS
Cepas de Ae. Aegypti
Las evaluaciones se efectuaron con base en colonias establecidas a partir de material larval procedente de las ciudades Guápiles (10°13′00″ N, 83°47′00″ O), Siquirres (10°05′01″ N, 83°30′28″ O) y Limón (9°59′00″ N, 83°02′00″ O), en la Región Caribe de Costa Rica. Para cada una de las localidades se obtuvo larvas de por lo menos cincuenta criaderos, para así garantizar su representatividad en términos de lugar, con las cuales se establecieron las colonias.
Como control de susceptibilidad se empleó la cepa Rockefeller, suministrada por el Instituto Pedro Kourí (La Habana, Cuba). Esta cepa fue establecida durante la década de los años 30 y es sensible a los insecticidas evaluados.9 Las larvas se mantuvieron en bandejas con agua libre de cloro, a una temperatura de 27,8 ± 0,1 °C, una humedad relativa del 95 % y un foto periodo de 12 h. Los mosquitos adultos fueron mantenidos en cajas entomológicas de 30 × 30 × 30 cm con un suministro de sacarosa al 10 % y un recipiente con agua libre de cloro como sitio de ovipostura. Adicionalmente se les suministró, tres veces por semana, una fuente de sangre. A partir de los huevos obtenidos en las colonias de adultos se obtuvieron las larvas correspondientes a la próxima generación.
Insecticidas y sinergistas
Temefós: Fosforotritionato de o, o, o, o'-tetrametil-o, o'-tio-di-p-fenileno (IUPAC). Chem Service. West Chester Pennsylvania. Grado Analítico. 97,6 % de pureza.
Cipermetrina: (1RS)-cis,trans-3-(2,2-diclorovinil)-2,2-dimetilciclopropano carboxilato de (RS)-ciano-3-Fenoxibencilo (IUPAC). Grado técnico. Suministrado por Fmc Corporation. 95 % de pureza.
Deltametrina: (1R,3R)-3-(2,2-dibromovinil)-2,2-dimetilciclopropano carboxilato de (S)-alfa-ciano-3-fenoxibenzilo (IUPAC). Chem Service West Chester Pennsylvania. Grado Analítico. 99,5 % de pureza.
S,S,S, tributilfosforotritioato (DEF): Chem Service. West Chester Pennsylvania. Grado Analítico. 97,5 % de pureza.
Butóxido de Piperonilo (PB): Chem Service. West Chester Pennsylvania. Grado Analítico. 98,2 % de pureza.
Bioensayos larvales para determinación de resistencia
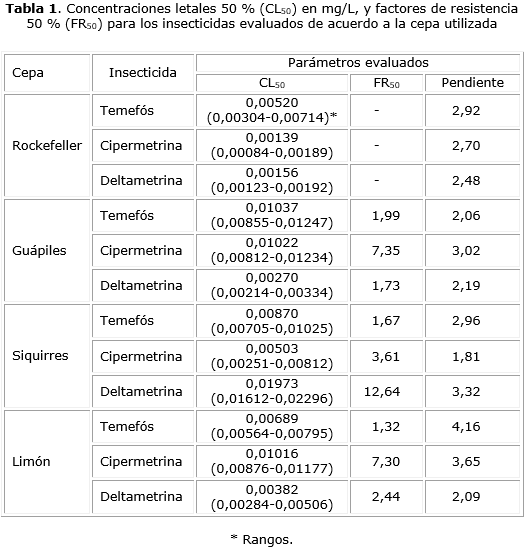
Los bioensayos larvales se llevaron a cabo de acuerdo a metodologías recomendadas por la OMS en 1981.11,12 Brevemente, se trabajaron larvas de tercero y cuarto estadio de las generaciones F1 a F5 provenientes de las colonias representativas de cada localidad. Se evaluaron cinco concentraciones de los insecticidas, las cuales generaron entre un 2 y un 100 % de mortalidad en larvas expuestas a los insecticidas. Cada concentración fue evaluada mediante cinco réplicas; para cada réplica se utilizaron 20 larvas. Los insecticidas fueron diluidos en alcohol absoluto y 1,0 mL de cada solución madre fue disuelto en 249,0 mL de agua libre de cloro para alcanzar la concentración de trabajo donde fueron colocadas las larvas. Los controles de viabilidad se montaron utilizando 1,0 mL de alcohol absoluto en lugar del insecticida. Los experimentos fueron efectuados en condiciones controladas a 27,8 ± 0,1 °C, 95 % de humedad relativa y un fotoperiodo de 12 h. La mortalidad se registró a las 24 h, contemplando para este fin la cuantificación de larvas muertas o moribundas. Posteriormente se efectuó un análisis probit-log, con el que se calculó la concentración letal 50 % (CL50). El valor de significancia utilizado como factor de heterogeneidad fue de 0,05. Para la ejecución de dicho análisis se empleó el programa SPSS v.11.5. La cepa control de susceptibilidad (Cepa Rockefeller) se procesó de la misma forma que las cepas generadas con el material colectado en el campo. Para cada insecticida se calculó un factor de resistencia 50 % (FR50) en el que se relacionó el valor de la CL50 de las cepas de campo con la CL50 de la Cepa Rockefeller. Acorde a los criterios de Mazarri y Georghiou,13 las cepas con FR inferiores a 5 se consideraron no resistentes, cepas con FR entre 5 y 10 con resistencia incipiente y cepas con FR superiores a 10 como resistentes.13
Bioensayos para determinar mecanismos de detoxificación enzimática
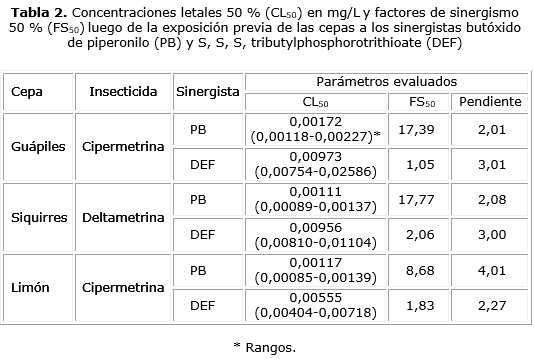
Ante condiciones de resistencia incipiente o resistencia manifiesta y con el fin de perfilar el mecanismo de detoxificación enzimático correspondiente, se realizó una réplica de los bioensayos exponiendo las larvas a concentraciones subletales de los sinergistas por un periodo de 4 h previo a su exposición a los insecticidas. Las concentraciones empleadas fueron 5 mg/L para el PB, el cual es un inhibidor de la actividad Citrocromo P450 monoxigenasa, y 0,008 mg/L para el DEF, cuyo efecto es inhibitorio sobre actividades esterasa.14 Posteriormente se calculó, para cada insecticida, un factor de sinergismo (FS50) cuya fórmula corresponde a CL50 (mg/L) sin el sinergista/CL50 (mg/L) con el sinergista9.
RESULTADOS
Con relación a temefós, todos los FR50 observados en las cepas evaluadas tuvieron valores inferiores a 2,00 (tabla 1), lo que indica la ausencia de resistencia a este insecticida por parte de dichas cepas.
En relación con cipermetrina, se pudo determinar una condición de resistencia incipiente en las cepas Guápiles y Limón (FR50 = 7,35 y 7,30, respectivamente) (tabla 1). El pretratamiento de las larvas con PB produjo una disminución del estado de resistencia que se manifestó en un FS50 de 17,39 para la cepa Guápiles y de 8,69 para la cepa Limón (tabla 2), mientras que el pretratamiento con DEF no generó ningún efecto sobre el estado de resistencia (tabla 2).
En la cepa de Siquirres se observó resistencia a deltametrina (FR50= 12,64) (tabla 1). Esta resistencia disminuyó cuando las larvas fueron pre tratadas con PB, condición que permitió calcular un FS50 de 17,77 (tabla 2). El tratamiento previo con DEF no disminuyó el estado de resistencia de dicha cepa (tabla 2).
DISCUSIÓN
A pesar de la proximidad geográfica de donde procedieron las cepas de Ae. aegypti que se evaluaron, los perfiles de resistencia observados no mostraron una homogeneidad completa. En relación con temefós, las tres cepas presentaron FR50 inferiores a 5,0, lo que indica ausencia de resistencia a dicho insecticida. Esta condición fue esperable considerando que el uso extensivo del temefós en Costa Rica como principal alternativa para el control larvario de Ae. aegypti se implementó apenas en el año 2007,10 mientras que en los lugares donde se ha evidenciado resistencia a este insecticida, se ha dado su uso generalizado por espacio de décadas.10 Además desde ese mismo año no se han empleado insecticidas organofosforados como adulticidas, lo que minimiza el riesgo de generación de resistencia cruzada con temefós.15 Estos resultados son similares a los observados en un estudio previo en el cual se evaluó una cepa procedente de la localidad de Guácimo, también en la Región Caribe de Costa Rica.9 Esa cepa presentó una CL50 para el temefós de 0,01196 mg/L (rango: 0,01056-0,01333 mg/L) con un FR50 de 4,59 que la sitúa como susceptible ante este organofosforado. A pesar de la susceptibilidad observada en el presente trabajo, Bisset y colaboradores en un estudio efectuado en el 2010 y publicado en el 2013, determinaron la ocurrencia de un FR50 de 10,83 para el temefós en una cepa de Ae. aegypti procedente de la localidad de Cariari, perteneciente a la región Caribe y cercana a las localidades incluidas en el presente estudio.9 Cáceres-Carrera evidenció resistencia manifiesta a temefós en una cepa de Barrio Escalante en el Centro Urbano de San José. Dicha cepa mostró un FR50 de 68,33.16 Estos hallazgos puntuales podrían estar relacionados con errores sistemáticos de carácter operativo en la aplicación del larvicida por parte del personal encargado del control, posiblemente utilizando concentraciones subóptimas del químico que propiciaron la aparición de individuos resistentes.15 A pesar de que el fenómeno de resistencia a temefós ha sido documentado en diversos países de lationamérica,17-20 existen varios estudios en los cuales se ha evidenciado una condición de susceptibilidad a este insecticida.21 Un trabajo efectuado en Venezuela permitió demostrar que en la mayoría de localidades rurales, donde se tiene limitaciones en la aplicación de temefós para el control larvario del Ae. aegypti, el fenómeno de resistencia no se presentó; no obstante en localidades más urbanas, donde las presiones de selección por este insecticida son frecuentes, existe mayor posibilidad de encontrar cepas del vector resistentes a dicho insecticida.21 Ante las posibles evidencias de resistencia al temefós se hace necesario contemplar otras alternativas de control larvario como Bacillus thuringiensis israelensis (BTI), spinosad o reguladores del crecimiento como difluobenzurón, piriproxifén o metopreno.22
En relación con los piretroides evaluados, para cipermetrina se pudo observar FR50 de 7,35 y 7,30 en las cepas Guápiles y Limón respectivamente, lo que denota la ocurrencia de resistencia incipiente a este insecticida. Bisset y colaboradores observaron en el 2010, que una cepa establecida con insectos de Cariari (Provincia de Limón) resultó susceptible a este piretroide, mostrando un FR50 de 4,76 respecto a la cepa Rockefeller.9 Por lo tanto, el hallazgo de resistencia incipiente representa un primer indicio de resistencia para este insecticida en la región. El fenómeno de resistencia incipiente a cipermetrina en Costa Rica fue evidenciado previamente por Cáceres-Carrera en una cepa del centro urbano de San José en la que determinó un FR50 de 7,0 con respecto a la cepa Rockefeller.16 En algunos países como Brasil, el uso continuo de cipermetrina ha conllevado el desarrollo de resistencia de Ae. aegypti a este insecticida de forma muy acelerada.23 Con respecto a deltametrina, el presente estudio permitió determinar la ocurrencia de resistencia en la cepa procedente de Siquirres con un FR50 de 12,64. Esta condición fue coexistente con un estado de susceptibilidad a cipermetrina en esta misma cepa. En el estudio efectuado por Bisset y colaboradores en el 2010, el FR50 para deltametrina, en la cepa de Cariari, fue de 81,48,9 lo que constituyó un criterio para cambiar la deltametrina por cipermetrina en las políticas ministeriales de control. Esta sustitución de deltametrina podría potenciar una reversión en el estado de resistencia a este insecticida. Aunque poco se sabe sobre los mecanismos que tienen lugar en los procesos de reversión de la resistencia, algunos estudios han podido determinar, en modelos controlados, que con piretroides como permetrina, el fenómeno de reversión ocurre luego de siete generaciones en las cuales se ha dejado de dar la presión de selección por este químico.24
En relación con los mecanismos de detoxificación enzimática, tanto para cipermetrina como para deltametrina, la disminución de la resistencia tuvo lugar cuando las larvas se sometieron al tratamiento previo con PB, lo que indica, al menos, que parte de la resistencia está relacionada con las enzimas Cit P 450 monooxigenasas. Aunque en Ae. aegypti se han identificado alrededor de 160 proteínas de este tipo, parece ser que las codificadas por los genes CYP9M6 y CYP6BB2 son las que mayormente se sobreexpresan ante el desafío con estos insecticidas y pueden ser las responsables de la detoxificación.25 Estas enzimas junto con las mutaciones en los canales de sodio que incluyen las sustituciones S989P, I1011M, I1011V, V1016G, V1016I, F1534C, y D1763Y son las principales responsables en la resistencia a piretroides por parte de Ae. aegypti.25
Los resultados del presente estudio demuestran que el insecticida temefós sigue siendo efectivo para el control larvario de Ae. aegypti en las principales localidades de la región Caribe de Costa Rica. Con respecto a los piretroides se alerta ante la aparición de resistencia, por lo que se deben de implementar procesos periódicos de monitoreo de la resistencia así como contemplar otras alternativas de control químico. Dentro de estas alternativas se incluyen la moderación de las aplicaciones, la saturación de las concentraciones que inhiben los mecanismos de defensa y los ataques múltiples con varios insecticidas.15
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Dr. Juan Bisset Lazcano del Instituto de Medicina Tropical Pedro Kourí, La Habana, Cuba por haber suministrado la Cepa Rockefeller para los ensayos efectuados y por la retroalimentación de las ideas que se presentan en el presente documento. Al Dr. Rodrigo Marín Rodríguez, a Manuel Gutiérrez y Ezequías Maynés del Ministerio de Salud de Costa Rica por el apoyo logístico en el proceso de colecta de material entomológico. También desean externar su agradecimiento a Katherine Salazar Zeledón, Paola Sequeira, Paola Jiménez, Iván Elizondo, Iván Coronado y Adrián Avendaño del Centro de Investigación en Enfermedades Tropicales (CIET) de la Universidad de Costa Rica (UCR) por su colaboración en el componente operativo de la investigación. Y a la Vicerrectoría de Investigación (UCR) por su apoyo financiero al proyecto VI-803-B2-106).
REFERENCIAS BIBLIOGRÁFICAS
1. Jansen CC, Beebe NW. The dengue vector Aedes aegypti: what comes next. Microbes and Infection. 2010;12:272-9.
2. Marcondes CB, Freire de Melo-Ximenes MFF. Zika virus in Brazil and the danger of infestation by Aedes (Stegomyia) mosquitoes. Revista da Sociedade Brasileira de Medicna Tropical. 2015; http://dx.doi.org/10.1590/0037-8682-0220-2015
3. Morice-Trejos A, Marín-Rodríguez R, Ávila-Agüero ML. El dengue en Costa Rica: evolución histórica, situación actual y desafíos. En: Escuela de Salud Pública (UCR). Estado actual, retos y perspectivas. Sistema Editorial y de difusión de la información. Universidad de Costa Rica. 2010.
4. Troyo A, Porcelain SL, Calderón-Arguedas O, Chadee DD, Beier JC. Dengue in Costa Rica: the gap in local scientific research. Rev Panam Salud Pública. 2006;20:350-60.
5. Situación del dengue 2016 [base de datos en internet]. Ministerio de Salud de Costa Rica [citado 3 mar 2016]. Disponible en: https://www.ministeriodesalud.go.cr/index.php/vigilancia-de-la-salud/analisis-de-situacion-de-salud
6. Situación de chikungunya 2015 [base de datos en internet]. Ministerio de Salud de Costa Rica [citado 3 mar 2016]. Disponible en: https://www.ministeriodesalud.go.cr/index.php/vigilancia-de-la-salud/analisis-de-situacion-de-salud
7. Fauci A, Morens DM. Zika virus in the Americas-Yet another arbovirus threat. N Engl J Med. 2016; DOI: 10.1056/NEJMp1600297.
8. Avalos A. Salud confirma ocho casos autóctonos de Zika en Costa Rica; todos en Nicoya. La Nación. 2016 Mar 12; Sec Nacional.
9. Bisset JA, Marín R, Rodríguez MM, Severson DW, French L, Díaz M et al. Insecticide resistance in two Aedes aegypti (Diptera: Culicidae) strains from Costa Rica. Vector Control. J Med Entomol. 2013;50:352-61.
10. Calderón-Arguedas O, Troyo A. Perfil de resistencia a insecticidas en una cepa de Aedes aegypti (Linnaeus) de la Región Caribe de Costa Rica. Rev Cubana Med Trop. 2014;66:351-9.
11. World Health Organization. Instructions for determining the susceptibility or resistance of adult mosquitos to organochlorine, organophosphate and carbamate insecticides diagnostic test,1981;WHO/VBC/81,806.
12. Bisset J, Blanco S, Braga I, Coto H, Massuh H, Moncayo A, et. al. Protocolo para determinar la susceptibilidad o resistencia a insecticidas de mosquitos de la especie Ae. aegypti. Puerto Iguazú: Fundación Mundo Sano/Red Latinoamericana de Control de Vectores (RELCOV);2005.
13. Mazzari MB, Geroghiou GP. 1995. Characterization of resistance to organophosphate, carbamate, and pyrethroid insecticides in field populations of Aedes aegypti from Venezuela. J Am Mosq Cont Assoc. 11:315-322.
14. Bisset JA, Rodríguez MM, Cáceres L. Niveles de resistencia a insecticidas y sus mecanismos en 2 cepas de Aedes aegypti de Panamá. Rev Cubana Med Trop. 2003;55:191-5.
15. Bisset JA. Uso correcto de insecticidas: control de la resistencia. Rev Cubana Med Trop. 2002;54:202-19.
16. Cáceres-Carrera L. Determinación de la resistencia a insecticidas y sus mecanismos en poblaciones de Aedes aegypti (Diptera: Culicidae) en algunos países de América Central [dissertation]. Ciudad de la Habana: Instituto de Medicina Tropical Pedro Kouri; 2013
17. Grisales N, Poupardin R, Gomez S, Fonseca-Gonzalez I, Ranson H, Lenhart A. Temephos resistance in Aedes aegypti in Colombia compromises Dengue Vector Control. PLoS Negl Trop Dis. 2013;7: e2438.
18. Rodríguez MM, Bisset J, de Fernández DM, Lauzán L, Soca A. Detection of insecticide resistance in Aedes aegypti (Diptera: Culicidae) from Cuba and Venezuela. J Med Entomol. 2001;38:623-8.
19. Lima JB, Da-Cunha MP, Da Silva RC, Galardo AK, Soares-Sda S, Braga IA, et al. Resistance of Aedes aegypti to organophosphates in several municipalities in the State of Rio de Janeiro and Espirito Santo, Brazil. Am J Trop Med Hyg. 2003;68:329-33.
20. Albrieu-Llinás GA, Seccacini E, Gardenal CN, Licastro S. Current resistance status to temephos in Aedes aegypti from different regions of Argentina. Mem Inst Oswaldo Cruz. 2010;105:113-6.
21. Àlvarez E, Briceño A, Oviedo M. Resistencia al temephos en poblaciones de Aedes aegypti (Diptera: Culicidae) del occidente de Venezuela. Revista Colombiana de Entomología. 2006;32:172-5.
22. Abbas A, Abbas RZ, Khan JA, Iqbal Z, Batí MMH, Sindhu ZD et al. Integrated Strategies for the Control and Prevention of Dengue Vectors with Particular Reference to Aedes aegypti. Pak Vet J. 2014;1-10.
23. Pereira da-Cunha M, Pereira-Lima JB, Brogdon WG, Moya GE, Valle D. Monitoring of resistance to the pyrethroid cypermethrin in Brazilian Aedes aegypti (Diptera: Culicidae) populations collected between 2001 and 2003. Mem Inst Oswald Cruz. 2005;100:441-4.
24. Trejo-Trejo E. Pérdida y recuperación de la resistencia al insecticida permetrina en el mosquito Aedes aegypti (Dipera:Culicidae) procedente de Ciudad Valles, San Luis Potosí [dissertation]. Montecillo, Texcoco, Edo de México: Instituto de enseñanza e investigación en Ciencias Agrícolas; 2014.
25. Kasai S, Komagata O, Itokawa K, Shono T, Ng LC, Kobayashi M et al. Mechamism of pyethroid resitance in the dengue mosquito vector, Aedes aegypti: target site insensitivity, penetration, and metabolism. PloS Negl Trop Dis. 214;8:e2948.
Recibido: 20 de enero de 2016.
Aprobado: 8 de marzo de 2016.
Ólger Calderón-Arguedas. Facultad de Microbiología, Universidad de Costa Rica. Código Postal 2060 San José, Costa Rica.
Correo electrónico: olger.calderon@ucr.ac.cr