Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760versión On-line ISSN 1561-3054
Rev Cubana Med Trop vol.70 no.2 Ciudad de la Habana mayo.-ago. 2018
ARTÍCULO ORIGINAL
Evaluación de la actividad antiviral del alga parda Sargassum fluitans frente a Echovirus 9
Evaluation of the antiviral activity of the brown alga Sargassum fluitans against Echovirus 9
Liena de Regla Ponce Rey,I Gloria del Carmen del Barrio Alonso,I Iraida Spengler Salabarría,II Sonia Resik Aguirre,III Annele Roque QuinteroI
I Departamento de Microbiología y Virología. Facultad de Biología. Universidad de La Habana. Cuba.
II Centro de Productos Naturales. Facultad de Química. Universidad de La Habana. Cuba.
III Laboratorio Nacional de Referencia de Enterovirus. Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
RESUMEN
Introducción: Echovirus 9 es un enterovirus humano de alta prevalencia que ocasiona graves enfermedades sistémicas como la meningitis aséptica y en menor medida mortalidad infantil. No existe tratamiento antiviral o vacunación para este virus, como ocurre con la mayoría de los enterovirus. Las algas del género Sargassum constituyen una fuente promisoria de compuestos con actividad antiviral, lo cual motiva la búsqueda de nuevos fármacos contra estos virus.
Objetivo: evaluar la actividad antiviral in vitro de un extracto hidroalcohólico del alga parda Sargassum fluitans frente a Echovirus 9.
Métodos: se realizó la determinación cualitativa de los tipos de metabolitos secundarios (tamizaje fitoquímico) presentes en el extracto según la técnica de Rondina y Coussio, 1969. Se evaluó la citotoxicidad del extracto en la línea celular Vero mediante el método del MTT y se calculó la CC50 mediante análisis de regresión lineal. El cálculo de la actividad antiviral (CE50) se realizó mediante la inhibición del efecto citopático en células Vero. Se determinó el índice selectivo (IS)= CC50/EC50.
Resultados: el tamizaje fitoquímico mostró la presencia de quinonas, proantocianidinas, catequinas, triterpenos polares, taninos hidrolizables, azúcares reductores, azúcares no reductores y proteínas. El extracto no fue citotóxico a las concentraciones evaluadas e inhibió de forma potente la replicación de Echovirus 9 en la línea celular empleada con un elevado IS (95,05).
Conclusiones: el extracto hidroalcohólico de S. fluitans posee actividad antiviral in vitro frente a Echovirus 9. Este es el primer informe de actividad antiviral de esta especie frente a enterovirus.
Palabras clave: Sargassum fluitans; antiviral; enterovirus; Echovirus 9.
ABSTRACT
Introduction: Echovirus 9 (E9) is a highly prevalent human enterovirus causing severe systemic diseases such as aseptic meningitis and to a lesser degree child mortality as well. No antiviral treatment or vaccine is available for this virus, as is the case with most enteroviruses. Algae from the genus Sargassum are a promising source of compounds with antiviral activity, a fact that has stimulated the search for new drugs against these viruses.
Objective: evaluate the in vitro antiviral activity of a hydroalcoholic extract from the brown alga Sargassum fluitans against Echovirus 9.
Methods: qualitative determination was made of the types of secondary metabolites (phytochemical screening) present in the extract, using the Rondina and Coussio technique, 1969. Evaluation of the cytotoxicity of the extract in the Vero cell line was performed by the MTT method, and CC50 was estimated by linear regression analysis. Estimation of antiviral activity (CE50) was conducted by inhibition of the cytophatic effect in Vero cells. Determination was made of the selective index (SI)= CC50/CE50.
Results: phytochemical screening revealed the presence of quinones, proanthocyanidins, catechins, polar triterpenes, hydrolyzable tannins, reducing sugars, non-reducing sugars and proteins. The extract was not cytotoxic at the concentrations evaluated, and strongly inhibited Echovirus 9 replication in the study cell line with a high SI (95.05).
Conclusions: the hydroalcoholic extract of S. fluitans has in vitro antiviral activity against Echovirus 9. This is the first report of antiviral activity of this species against enteroviruses.
Keywords: Sargassum fluitans; antiviral; enterovirus; Echovirus 9.
INTRODUCCIÓN
Los enterovirus (EV) incluyen más de 200 tipos de virus antigénicamente diferentes que infectan vertebrados.1 Los EV humanos infectan el tracto gastrointestinal o respiratorio; producen infecciones en el sistema nervioso central, páncreas, corazón y se relacionan con la aparición de diabetes mellitus.2 Echovirus 9 (E9) es el agente causal más común de meningitis aséptica en recién nacidos y niños pequeños; en adultos y niños mayores es causa importante de endocarditis y miocarditis.3 Se carece de antivirales contra los EV y solo el grupo de los poliovirus cuenta con un tratamiento profiláctico.4 Esto ha motivado la búsqueda de compuestos capaces de inhibir la replicación de estos virus. Los productos naturales constituyen una alternativa en la búsqueda de antivirales dado que son menos tóxicos que los productos sintéticos y poseen múltiples principios activos con mecanismos de acción particulares.5 Las algas pardas son fuentes de compuestos activos con propiedades antivirales.6
El objetivo trabajo es evaluar la actividad antiviral in vitro de un extracto hidroalcohólico del alga parda Sargassum fluitans frente a E9.
MÉTODOS
EXTRACTO DEL ALGA
El extracto hidroalcohólico del alga S. fluitans fue gentilmente brindado por la doctora Olga Valdés del Instituto de Ciencias del Mar. Este se concentró mediante rotoevaporación al vacío a 50 °C durante 2 h hasta la formación de sirope. Posteriormente se congeló en nitrógeno líquido y se liofilizó en liofilizadora Christhalpha 1-2 a -20 °C en bulbos de 5 mL. El material liofilizado se conservó a temperatura ambiente y se protegió de la luz hasta su posterior uso.
TAMIZAJE FITOQUÍMICO DEL EXTRACTO HIDROALCOHÓLICO DE S. FLUITANS
La determinación cualitativa de los tipos de metabolitos secundarios se realizó a partir de la técnica de Rondina y Coussio.7 Los metabolitos evaluados en la fracción soluble en etanol son grupos aminos, taninos, fenoles, triterpenos-esteroides, quinonas, alcaloides, cardenólidos, flavonoides, proantocianidinas, catequinas, azúcares reductores, saponinas y grupos aminos. En la fracción insoluble en etanol se evaluaron azúcares no reductores y grupos aminos.
VIRUS Y LÍNEA CELULAR
Se utilizó la cepa de referencia Hill de E9, proveniente del Instituto Nacional de Control de Estudios Biológicos de Rusia perteneciente al cepario del Laboratorio de Enterovirus del Departamento de Virología del Instituto de Medicina Tropical "Pedro Kourí" (IPK). Se empleó la línea continua normal de riñón de mono verde africano adulto (Vero, ATCC® CCL- 81TM), crecida en medio 199 de base Earle (GibcoTM) suplementado con suero de bovino fetal inactivado (SBFI) (SIGMA®) al 5 %. Esta pertenece al banco de células del Laboratorio de cultivos celulares del Departamento de Aseguramiento Científico-Técnico del IPK. Se determinó el título viral según el protocolo de titulación del Manual de Laboratorio de Polio, Organización Mundial de la Salud.8
ENSAYO DE CITOXICIDAD
Se prepararon soluciones madres (5 mg/mL-1) del material liofilizado en el medio de cultivo de la línea celular empleada. Estas se filtraron a través de filtros de celulosa con diámetro de poro de 0,2 µm (Minisart® Sartorius). Se utilizaron placas de 96 pocillos con monocapas celulares completamente confluentes. Se retiró el medio de crecimiento a las placas y se añadieron 100 µL del extracto a concentraciones crecientes. Se utilizaron 6 pocillos para cada tratamiento, mientras que a los controles de células se les adicionó 100 µL de medio de cultivo. Las placas se incubaron a 37 ºC en atmósfera con 5 % de CO2 durante 48 h. El ensayo se realizó por duplicado. La toxicidad celular del extracto se evaluó mediante el método del MTT a partir de la determinación de la viabilidad celular.9 El porcentaje de viabilidad asociado a cada concentración del extracto se calculó dividiendo el valor medio de absorbancia de los cultivos tratados entre el valor medio de absorbancia de los controles celulares, los cuales se consideraron como el 100 % de viabilidad celular. La citotoxicidad del producto se expresó como la concentración de este que provoca reducción de la viabilidad celular en el 50 % de las repeticiones empleadas (CC50). Esta se determinó mediante regresión lineal a partir de la ecuación de la línea de tendencia de la curva dosis-respuesta obtenida al graficar concentración del extracto contra por ciento de viabilidad. Para ello se utilizó el programa Statistica 6.0 y se consideró un valor de R2 mayor que 0,85.10
ENSAYOS DE EVALUACIÓN PRIMARIA DE ACTIVIDAD ANTIVIRAL
Para evaluar la actividad del extracto frente a E9 se utilizó la metodología propuesta por Álvarez y otros.11 En el ensayo se utilizaron concentraciones subtóxicas del extracto. Se emplearon 100 DICC50 del virus. Se utilizaron 6 pocillos para cada tratamiento (incluidos controles de virus y de células) y se realizó el experimento por duplicado.
Para cada concentración del extracto se determinó el porcentaje de pocillos con efecto citopático (ECP) y se obtuvo el valor de concentración que inhibe la multiplicación viral en el 50 % de los pocillos (CE50) mediante regresión lineal a partir de la ecuación de la línea de tendencia de la curva dosis-respuesta, obtenida con el programa Statistica 6.0, para un valor de coeficiente de regresión (R2) mayor que 0,859.9 Se calculó el valor del índice selectivo (IS), teniendo en cuenta la relación de la concentración citotóxica media y la concentración efectiva media (IS= CC50/CE50), se consideró IS a partir de 10 como criterio de actividad antiviral.12
RESULTADOS
TAMIZAJE FITOQUÍMICO DEL EXTRACTO HIDROALCOHÓLICO DE S. FLUITANS
Los resultados obtenidos en el tamizaje fitoquímico del extracto hidroalcohólico de S. fluitans se muestran en la tabla. Los tipos de metabolitos identificados en la fracción soluble en etanol fueron: quinonas, triterpenos de mayor polaridad, proantocianidinas y/o catequinas, taninos hidrolizables y azúcares reductores; estos dos últimos en mayor abundancia. Mientras que en la fracción insoluble en etanol se detectó un contenido abundante de grupos aminos asociados a la presencia de proteínas y azúcares no reductores o polisacáridos de alto peso molecular.
DETERMINACIÓN DE LA CITOTOXICIDAD DEL EXTRACTO
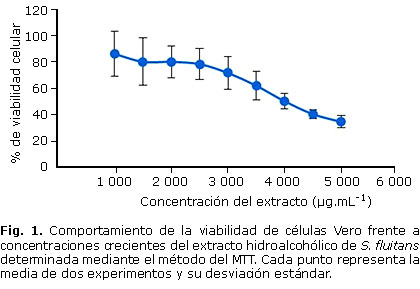
La evaluación de la citotoxicidad del extracto hidroalcohólico de S. fluitans en las células Vero mostró un comportamiento dependiente de la dosis (Fig. 1). El extracto no mostró toxicidad a las concentraciones evaluadas (5 000, 4 500, 4 000, 3 500, 3 000, 2 500, 2 000, 1 500, 1 000 µg.mL-1) y la exposición de las células a este no provocó cambios en su morfología. El análisis de regresión lineal mostró un valor de concentración citotóxica media (CC50) igual a 4315,945 ± 168,100 µg.mL-1, con R2 de 0,91.
ENSAYOS DE EVALUACIÓN PRIMARIA DE ACTIVIDAD ANTIVIRAL
El ensayo antiviral mostró que el extracto hidroalcohólico de S. fluitans inhibe la multiplicación de E9 en una manera dependiente de la dosis (Fig. 2). Se observa un incremento de la actividad protectora con concentraciones crecientes del extracto ante la multiplicación del virus, alcanzando hasta un 0 % de ECP a concentraciones mayores de 120 µg.mL-1. El análisis de regresión lineal mostró un valor de CE50 igual a 45,404 ± 0,18 µg.mL-1, con R2 de 0,96.
El cálculo del índice selectivo (IS) mostró un valor de 95,05, como se resume a continuación:
| CC50 (µg · mL-1) | CE50 (µg · mL-1) | IS (CC50/ CE50) |
| 4315,94 ± 168,10 | 45,404 ± 0,18 | 95,05 |
DISCUSIÓN
Uno de los primeros pasos hacia la evaluación del potencial terapéutico de plantas medicinales lo constituye la preparación de los extractos crudos y su caracterización fitoquímica.13 Los tipos de metabolitos identificados en este trabajo coinciden con los encontrados por otros autores para otras especies del género Sargassum, tales como carbohidratos, aminoácidos y taninos.14 Otros investigadores han identificado terpenos, fenoles y flavonoides con propiedades citotóxicas,15 así como alcaloides, esteroles, cumarinas (antronas y antraquinonas) y saponinas.15,16 Además, se ha informado la presencia de fucosterol, ácido linoleico, lípidos y proteínas.17
La primera etapa en la evaluación de un producto como candidato antiviral consiste en la determinación de sus efectos nocivos sobre las células. Estos ensayos se realizan empleando las mismas células donde será ensayado su efecto antiviral. Estas son sometidas al producto durante intervalos de tiempo similares, de modo que se pueda discriminar entre la inhibición de la multiplicación viral por acción del producto o por los daños que este pueda causarle a las células.18 La citotoxicidad de algunas especies del género Sargassum ha sido evaluada en diferentes líneas celulares tales como Vero, lo que ha mostrado valores de CC50 comprendidos en el rango desde 100 µg · mL-1 hasta 10 000 µg · mL-1.19,20 La evaluación de la actividad antiviral de estas algas ha estado dirigida principalmente contra los herpesvirus y el virus de la inmunodeficiencia humana (VIH). Los mecanismos de acción propuestos son la inhibición de la adhesión y la internalización del virus a la célula así como de la replicación del genoma viral y la síntesis proteica.21 Las moléculas responsables de esta actividad incluyen polifenoles (ej. taninos, flavonoides, lignanos, proantocianidinas, quininas), glicósidos, tiofenos, policetonas, alcaloides (ej. cafeína, colchicina, furanoquinolinas), terpenoides (ej. monoterpenos, diterpenos, triterpenos, sesquiterpenos), polisacáridos, proteínas y péptidos.22
De acuerdo con lo anterior puede sugerirse que los tipos de metabolitos encontrados en este trabajo en el extracto hidroalcohólico de Sargassum fluitans están relacionados con la actividad antiviral mostrada. Se ha informado actividad antiviral contra los EV de flavonoides y taninos.23-25 Esta se ha asociado, para otros virus, a la presencia en las algas del género Sargassum de polisacáridos sulfatados tales como los carragenanos, alginatos, fucoidanos, laminaranos y naviculanos. La identificación en este trabajo de una gran proporción de azúcares no reductores en el extracto hidroalcohólico de S. fluitans apoya la actividad antiviral mostrada. Estas moléculas son capaces de inhibir los procesos de adhesión e internalización del virus a la célula así como la replicación del genoma viral y la síntesis proteica.21 Metabolitos como las antraquinonas, triterpenos, derivados de las catequinas y polisacáridos han mostrado actividad contra el VIH, herpes simple y citomegalovirus.26 Las plastoquinonas presentes en el alga Sargassum micracanthum son capaces de inhibir la replicación de citomegalovirus y del virus del sarampión.27 Estos metabolitos fueron identificados también en este trabajo en el tamizaje fitoquímico.
Para que un producto sea considerado in vitro un antiviral, debe poseer un IS= 10,27 mientras que aquellos con un IS= 2 deben considerarse posibles candidatos terapéuticos.29 Varios autores manifiestan que este último valor es suficiente para asegurar la presencia de actividad antiviral.11,30 En este trabajo se obtuvo un valor de IS= 95,05, lo cual representa una potente actividad antiviral del extracto hidroalcohólico de S. fluitans frente a E9. En un estudio de evaluación antiviral in vitro del extracto acuoso de la planta Phyllanthus orbicularis frente a E9 informa un IS de 9,9.31 La actividad antiviral del extracto hidroalcohólico de S. fluitans frente a E9 se relaciona con la presencia de tipos de metabolitos previamente informados por poseer dicha propiedad biológica tales como: taninos, quinonas, proantocianidinas y/o catequinas, azúcares reductores y polisacáridos de alto peso molecular. Este constituye el primer informe de actividad antiviral del alga S. fluitans frente a un enterovirus.
AGRADECIMIENTOS
Se agradece la colaboración de los miembros del Laboratorio Nacional de Referencia de Enterovirus del IPK, al profesor Luis Morier y a la técnico Claudia Wilson Jiménez del Laboratorio de Cultivo de Células del Departamento de Asistencia Científico-Técnica del IPK por su valiosa colaboración en el trabajo con los cultivos de células. Además se agradece a la doctora Olga Valdés del Instituto de Ciencias del Mar por facilitar el material vegetal empleado en este trabajo.
CONFLICTO DE INTERESES
No se declara conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Racaniello VR. Picornaviridae: The Viruses and their Replication. In: Knipe D, Howley P (eds.). Fields Virology. 6th ed. Filadelfia: Lippincott Williams y Wilkins; 2013.
2. Acosta AI, Russomando G, Espínola E. Análisis filogenético y de presión evolutiva de secuencias nucleotídicas del gen VP4 de especies de enterovirus humanos. Mem Inst Investig Cienc Salud. 2016;14(2):17-24.
3. Sotelo AL, Garza AG. Infección por echovirus en un preescolar. Pautas de diagnóstico. Revista Mexicana de Pediatría. 2005;72:182-5.
4. Desmond RA, Accortt NA, Talley L, Villano SA, Soong SJ, Whitley RJ. Enteroviral meningitis: natural history and outcome of pleconaril therapy. Antimicrob. Agents Chemother. 2006;50:2409-14.
5. Khan MT, Ather A, Thompson KD, Gambari R. Extracts and molecules from medicinal plants against herpes simplex viruses. Antiviral Research. 2005;67:107-19.
6. Liu L, Heinrich M, Myers S, Dworjanyn SA. Towards a better understanding of medicinal uses of the brown seaweed Sargassum in Traditional Chinese Medicine: A phytochemical and pharmacological review. Journal of Ethnopharmacology. 2012;142:591-619.
7. Rondina RV, Coussio JD. Estudio Fitoquímico de Plantas Medicinales. Rev Invest Agropec (Serie 2. Biología y Producción Vegetal). 1969;6(2):352–66.
8. Organización Mundial de la Salud. Manual de Laboratorio de Polio. 4ta ed. Ginebra: OMS; 2004. WHO/IVB/04.10.
9. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immun Methods. 1983;65:55-63.
10. Chiang LC, Chiang W, Liu MC, Lin CC. In vitro antiviral activities of Caesalpinia pulcherrima and its related flavonoids. J Antimicrob Chemother. 2003;52:194-8.
11. Álvarez AL, del Barrio G, Kourí V, Martínez PA, Suárez B, Parra F. In vitro anti-herpetic activity of an aqueous extract from the plant Phyllanthus orbicularis. Phytomedicine. 2009;16:960-6.
12. Wyde P, Ambrose M, Meyerson L, Gilbert B. The antiviral activity of SP-303, a natural polyphenolic polymer, against respiratory syncytial and parainfluenza type 3 viruses in cotton rats. Antiviral Research. 1993;20:145-54.
13. Fuentes CM, Angulo P, Hernandez de Jesus L. La Etnofarmacología y los bioensayos como nuevas estrategias en la investigación fitoquímica de la flora medicinal Peruana. Ciencia e Investigación. 2001;4(2).
14. Casas M, Hernández H, Marín A, Águila RN. El alga marina Sargassum (Sargassaceae): una alternativa tropical para la alimentación de ganado caprino. Rev Biol Trop. 2006;54:83-92.
15. Mendoza JM, Villegas VA, Amtanus N, Muñoz M. Caracterización fitoquímica y evaluación de la actividad anticancerígena de Sargassum lapazeanum Setchell & N.L. Gardner (Ochrophyta: Fucales, Phaeophyceae). Rev Latinoamer Quím. 2016;44:117-250.
16. Rodríguez A. Actividad biológica de extractos algales con potencial cosmecéutico. [Tesis en opción al título académico de Maestro en Ciencias en Manejo de Recursos Marinos]. Bolivia: Instituto Politécnico Nacional. Centro Interdisciplinario de Ciencias Marinas; 2016.
17. Ghada SE, Abou-El-Wafa K, Shaaban A, Mohamed E, Shaaban M. Bioactive constituents and biochemical composition of the egyptian brown alga Sargassum subrepandum (Forsk). Rev Latinoamer Quím. 2011;39:1-2.
18. del Barrio G, Álvarez AL, Valdés S, Parra F. Metodología de pesquisa preclínica de actividad anti-herpesvirus a partir de productos naturales. Rev Cub Farm. 2008;42 (2):0-0.
19.Hoshino T, Toshimitsu H, Hayashi K, Hamada J, Lee JB, Sankawa U. An antivirally active sulfated polysaccharide from Sargassum horneri (Turner) C. Agardh Biol Pharm Bull. 1998;21(7):730-4.
20. García L, Casas MP, Balboa EM, Domínguez H, Mitjans M. Evaluación del potencial citotóxico in vitro para el cribado de extractos naturales con potencial uso en cosmética. Rev Latinoam Quím. 2016;44(Supl Especial) .
21. Ahmadi A, Moghadamtousi SZ, Abubakar S, Zandi K. Antiviral potential of algae polysaccharides isolated from marine sources: a review. BioMed Research International. 2015;10.
22. Jassim SA, Naji MA. Novel antiviral agents: a medicinal plant perspective. J Appl Microbiol. 2003;95:412-27.
23. Wang L, Wang J, Wang L, Ma S, Liu Y. Anti-enterovirus 71 agents of natural products. Molecules. 2015;20:16320-33.
24. Wang M, Tao L, Xu H. Chinese herbal medicines as a source of molecules with anti-enterovirus 71 activity. Chin Med. 2016;11:2-26.
25. Yang Y, Xiu J, Liu J, Zhang L, Li X, Xu Y. Chebulagic acid, hydrolyzable tannin, exhibited antiviral activity in vitro and in vivo against human enterovirus 71. Int J Mol Sci. 2013;14:9618-27.
26. Yende S, Harle U, Chaugule B. Therapeutic potential and health benefits of Sargassum species. Pharmacogn Rev. 2014;8(15):1-7.
27. Iwashima M, Shinoda D, Mori J, Saito H, Xiang T, Sankawa U. Antioxidant and antiviral activities of plastoquinones from the brown alga Sargassum micracanthum, and a new chromene derivative converted from the plastoquinones. Biological and Pharmaceutical Bulletin. 2005;28:374-7.
28. Wyde PR, Ambrose MW, Meyerson LR, Gilbert BE. The antiviral activity of SP-303, a natural polyphenolic polymers against, respiratory syncitial and Parainfluenza type 3 viruses in cotton rats. Antiviral Res. 1993;20:185-92.
29. Vander Berghe DAR, Haemers A, Vlietnick AL. Antiviral agents from higher plants and an example of structure-activity relationship of 3 methoxyflavones. In: Colegate SM, Molyneux RJ (eds). Bioactive natural products. Detection, isolation and structural determination. Boca Raton: CRC Press; 1993. p. 405-40.
30. Fortin H, Vigor C, Lohezic L, Devehat F, Robin V, Le Bosse B. In vitro antiviral activity of thirty-six plants from Reunion Island. Fitoterapia. 2002;73:346-50.
31. Acosta M. Pesquisaje de la actividad antiviral de Phyllanthus orbicularis y Ageratina havanensis frente a Enterovirus. [Tesis en opción al título académico de Maestro en Microbiología]. La Habana: Facultad de Biología. Universidad de La Habana; 2009.
Recibido: 8 de noviembre de 2017.
Aprobado: 27 de noviembre de 2017.
Annele Roque Quintero. Departamento de Microbiología y Virología. Grupo de Antivirales Naturales. Facultad de Biología. Universidad de La Habana. Calle 25, No.455, entre J e I, Vedado, Plaza de la Revolución, Código Postal: 10400 La Habana, Cuba.
Correo electrónico: aroque@fbio.uh.cu