Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop vol.70 no.3 Ciudad de la Habana set.-dic. 2018
COMUNICACIÓN BREVE
Introducción de nuevos ensayos de reacción en cadena de la polimerasa en tiempo real para el diagnóstico y vigilancia de virus respiratorios
Introduction of new assays of real time polymerase's chain reaction for the diagnosis and surveillance of respiratory viruses
María Karla Martínez Muné,I Alexander Piñón Ramos,I Belsy Acosta Herrera,II Odalys Valdés Ramírez,I Mayra Muné Jiménez,I Clara Savón Valdés,I Amely Arencibia García,I Guelsys González Báez,I Grehete González Muñoz,I Suset Oropesa Fernández,I Ángel Goyenechea Hernández,I Bárbara Hernández Fernández,I Rosmery Roque Orieta,I Javier Martínez AlonsoI
I Departamento de Virología. Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Dirección de Investigaciones y Posgrado, Vicerrectoría de Desarrollo. Escuela Latinoamericana de Medicina. Artemisa, Cuba.
RESUMEN
Las infecciones respiratorias agudas constituyen la causa fundamental de mortalidad y morbilidad en el ámbito mundial. Los principales agentes causales de estas infecciones son los virus. La detección rápida y eficaz de estos patógenos es determinante en el tratamiento y la prevención de las enfermedades que estos agentes virales pueden ocasionar. En la actualidad, los métodos moleculares para el diagnóstico virológico son muy útiles por su elevada sensibilidad, especificidad y rapidez en la obtención de los resultados. El objetivo es introducir cuatro ensayos múltiples de transcripción reversa de reacción en cadena de la polimerasa en tiempo real para el diagnóstico y vigilancia de 15 virus respiratorios. Se procesaron 2 441 muestras clínicas respiratorias recibidas en el Laboratorio Nacional de Referencia de Virus Influenza y otros Virus Respiratorios en el período comprendido entre septiembre de 2013 y abril de 2014. Se analizaron 2 352 exudados nasofaríngeos, 77 aspirados bronquiales y 12 muestras de necropsia. A estas se les realizó el diagnóstico molecular por los sistemas múltiples de transcripción reversa de reacción en cadena de la polimerasa en tiempo real mediante el empleo de cebadores y sondas TaqMan. De las 2 441 muestras clínicas estudiadas, 1 290 fueron positivas para alguno de los virus respiratorios (52,85 %). El virus sincitial respiratorio humano se detectó con mayor frecuencia (47,83 %), seguido de los virus influenza (19 %) y los rinovirus humano (14,73 %). Se concluye que la introducción de los cuatro ensayos de transcripción reversa de reacción en cadena de la polimerasa en tiempo real posibilita la actualización del algoritmo diagnóstico en el Laboratorio Nacional de Referencia de Virus Influenza y otros Virus Respiratorios para la vigilancia de estos agentes en Cuba, lo que contribuye al mejoramiento del Programa Nacional de Prevención y Control de las Infecciones Respiratorias Agudas.
Palabras clave: infecciones respiratorias agudas; reacción en cadena de la polimerasa múltiple en tiempo real.
ABSTRACT
Acute respiratory infections are the major cause of mortality and morbidity worldwide. Respiratory viruses are the main causative agents of acute respiratory infections. Rapid and accurate detection of these pathogens is critical for the treatment and prevention of the diseases these viral agents can cause. Currently, molecular diagnostic methods are useful tools for the virological detection of respiratory viruses due to its high sensitivity, specificity and their speed in obtaining results. The objective of this study was to introduce four multiplex real-time TR-RCP assays for the diagnosis and surveillance of fifteen virus causing acute respiratory infections. 2 441 clinical respiratory samples were processed in the period between September 2013 and April 2014 in the National Laboratory of Reference for Influenza Virus and other Respiratory Viruses. There were analyzed 2 352 nasopharyngeal exudates, 77 bronchial aspirations and 12 necropsy samples. Multiplex real-time TR-RCP was performed using TaqMan primers and probes previously published. From the 2 441 clinical samples studied, 1 290 were positive for some of the respiratory viruses, which represent 52.85 %. Syncytial respiratory virus was the most frequently detected virus (47.83 %), then influenza viruses (19 %) and human rhinovirus (14.73 %). The introduction at the National Reference Laboratory of the four multiplex real-time TR-RCP assays allows updating the algorithm for the diagnosis and surveillance of respiratory viruses in Cuba, as a contribution to the National Program for the Prevention and Control of Acute Respiratory Infection.
Keywords: Acute respiratory infections; multiplex real-time polymerase´s chain reaction.
Las infecciones respiratorias agudas (IRA) constituyen la causa fundamental de morbilidad y mortalidad en el ámbito mundial. Anualmente, se notifican alrededor de cuatro millones de fallecidos.1 La incidencia de las IRA es elevada en los niños, con un estimado de 1,9 millones de fallecidos anuales, el 70 % en África y en el sudeste asiático.2
Los principales agentes causales de las IRA son los virus respiratorios. La detección temprana y eficaz de estos agentes es importante para implementar una terapia antiviral oportuna y adecuada, prevenir las infecciones asociadas a la asistencia sanitaria durante el período estacional de mayor hospitalización, y en algunos casos, disminuir los costos asociados con los cuidados de salud hospitalarios. Los métodos de diagnóstico molecular constituyen en la actualidad las técnicas de elección en los laboratorios de referencia por su elevada sensibilidad, especificidad y rapidez en la obtención de los resultados.3
En Cuba, el Laboratorio Nacional de Referencia de Virus Influenza y otros Virus Respiratorios (LNRIVR) del Instituto de Medicina Tropical "Pedro Kourí" (IPK) implementó un algoritmo para el diagnóstico de varios agentes causales de IRA, que incluye las técnicas clásicas para el diagnóstico virológico, ensayos de diagnóstico molecular como los de transcripción reversa y reacción en cadena de la polimerasa (TR-RCP) convencional y un protocolo de TR-RCP en tiempo real (TR-RCPtr) para el virus influenza A (H1N1) pdm09.4 El presente trabajo tiene como objetivo introducir cuatro ensayos múltiples de TR-RCPtr desarrollados en el laboratorio para la identificación de 15 virus respiratorios.
Muestras clínicas. Las muestras clínicas utilizadas en este estudio se recibieron en el LNRIVR como parte del Programa Nacional de Vigilancia y Control de las IRA. Se procesaron 2 441 muestras clínicas respiratorias en el período comprendido entre septiembre de 2013 (semana epidemiológica 36) y abril de 2014 (semana epidemiológica 17). Se analizaron 2 352 exudados nasofaríngeos (ENF), 77 aspirados bronquiales y 12 muestras de necropsia (tejido de pulmón) provenientes de pacientes con edades comprendidas entre 1 mes y 94 años. Las muestras se conservaron de 2 a 8 ºC hasta su posterior extracción que se realizó en el intervalo de 24 h. El presente trabajo constituyó una tarea de un proyecto de investigación con financiamiento externo que contó con el Aval de la Comisión Científica Especializada y el Comité de Ética del IPK. Todos los procedimientos del estudio se desarrollaron según lo establecido por la Declaración de Helsinki.
Extracción de ácidos nucleicos. Se utilizaron 140 μL de cada muestra clínica para la extracción del ácido nucleico, en un volumen de elución final de 60 μL. El producto (ADN, ARN) se obtuvo empleando el extractor automático QIAcubeTM (QIAGEN, Alemania) con los estuches comerciales QIAamp® Viral DNA (QIAGEN, Alemania) y QIAamp® Viral RNA (QIAGEN, Alemania) y siguiendo las indicaciones del fabricante.
Diagnóstico molecular por TR-RCPtr múltiple. Se realizó el diagnóstico virológico de 15 agentes virales (virus influenza A y B, adenovirus humano (AdVH), coronavirus humano OC43 y 229E (CoVH), rinovirus humano (RVH), enterovirus humano (EVH), virus para influenza humano tipo 1-4 (VPIH), virus sincitial respiratorio humano A y B (VSRH), bocavirus humano (BoVH) y metapneumovirus humano (MPVH), mediante TR-RCPtr múltiple empleando cebadores y sondas TaqMan previamente publicados.5,6 Se utilizó el estuche comercial SuperScript® III Platinum® One-Step qTR-PCR (Invitrogen, Alemania).
Se emplearon como controles positivos el ARN previamente procesado de muestras clínicas positivas para cada virus. El control negativo consistió en agua destilada estéril libre de nucleasas (Sigma) y ENF de voluntarios supuestamente sanos sin síntomas de IRA. El control interno consistió en la enzima RNAsaP, que se encuentra presente en todas las células del organismo. Para la reacción de amplificación se utilizó un equipo de TR-RCPtr (Applied Biosystems, EUA) donado gentilmente por la Organización Panamericana de la Salud.
INTERPRETACIÓN DEL RESULTADO
Muestra negativa: Se visualizó la curva de fluorescencia en la reacción de amplificación sobrepasando la línea umbral solo con los juegos de cebadores específicos para el control interno (CI) en cada uno de los sistemas múltiples, o se visualizó además, una curva de fluorescencia correspondiente a uno de los virus respiratorios con un ciclo a partir del cual se detectó fluorescencia (Ct) > 37.
Muestra positiva: Se visualizó la curva de fluorescencia con los juegos de cebadores específicos para el CI y además una curva de fluorescencia correspondiente a los juegos de cebadores específicos para uno o más de los agentes virales en estudio con un Ct≤ 37.
Muestra inhibida: No se visualizó la curva de fluorescencia con los juegos de cebadores específicos para el CI. En este caso se repitió el procesamiento de la muestra antes de emitir el resultado de muestra no apta para el diagnóstico.
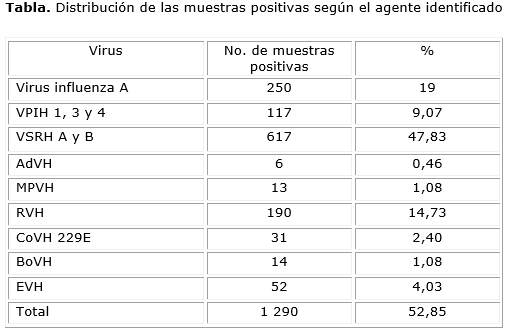
Como resultado de la aplicación de los cuatro ensayos múltiples optimizados se detectó señal de amplificación para alguno de los virus respiratorios en 1 290 muestras clínicas, lo que representó un 52,85 % de positividad. Este resultado coincide con otros estudios que demuestran que los virus se encuentran dentro de los principales agentes causales de las IRA.7 En el período de análisis, no se obtuvieron muestras positivas para los virus influenza B, VPIH 2, y CoVH OC43. En la tabla se muestran los resultados de la positividad para cada uno de los agentes virales en el período del estudio.
Los VSRH A y B se detectaron con mayor frecuencia (47,83 %), seguido de los virus influenza A (19 %), y los RVH (14,73 %). Estos resultados no son sorprendentes si se conoce que el VSRH es el agente causal más común de bronquiolitis y neumonía en los niños menores de 5 años.8 Contrario al presente estudio, otro grupo de investigadores detectó a los RVH como los agentes virales más asociados con las IRA.9 Resulta difícil establecer comparaciones debido a la diversidad en el diseño de estudios sobre la etiología viral de las IRA.
Existe un estudio previo realizado en Cuba que detectó la infección por RVH en el 11 % de los niños menores de un año de edad, asociado con mayor frecuencia a IRA grave.10 Los resultados de la presente investigación constituyen el segundo estudio sobre la detección de estos virus en muestras respiratorias. Difiere del precedente en que la detección incluyó pacientes cubanos de todas las edades, con diagnóstico clínico de diferentes tipos de IRA.
En la figura se muestra la distribución de la positividad a los diferentes virus respiratorios por semana epidemiológica durante el período objeto de estudio. Durante el año 2013 entre las semanas epidemiológicas 36 y 47 se detectaron el mayor número de muestras positivas a los VSRH.
Este hallazgo se relaciona con el contexto epidemiológico durante el período de estudio, el cual se caracterizó por un incremento en la circulación de este agente en la población pediátrica relacionado con la identificación de un nuevo genotipo de VSRH A circulante en Cuba (datos no publicados). Este resultado se notificó oportunamente por el LNRIVR a las autoridades de salud para alertar a los médicos de asistencia en el manejo adecuado de los pacientes. Durante este período en el informe sobre la Actualización Regional de Influenza y otros virus respiratorios se notificó que en algunos países de Centroamérica como Honduras, Nicaragua y Panamá se produjeron alzas en la circulación de VSRH durante igual período del año 2013 (11). Otros agentes virales como los VPIH, los EVH y los CoVH circularon asociados con casos esporádicos, con un comportamiento similar a otros países de la región de Las Américas.11
Los ensayos introducidos en el LNRIVR mejoraron la sensibilidad y la especificidad del diagnóstico virológico en pacientes con IRA, lo que contribuye a fortalecer la vigilancia de los virus respiratorios en Cuba.
Conflicto de intereses
No existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. WHO. Prevención y control de enfermedades respiratorias agudas con tendencia epidémica y pandémica durante la atención sanitaria. Pautas de la OMS. WHO/CDS/EPR/20076. 2007.
2. Khor CS, Sam IC, Hooi PS, Quek KF, Chan YF. Epidemiology and seasonality of respiratory viral infections in hospitalized children in Kuala Lumpur, Malaysia: a retrospective study of 27 years. BMC Pediatr. 2012;12:32.
3. Bierbaum S, Forster J, Berner R, Rucker G, Rohde G, Neumann-Haefelin D, et al. Detection of respiratory viruses using a multiplex real-time PCR assay in Germany, 2009/10. Archives of Virology. 2014;159:669-76.
4. Acosta B, Piñón A, Valdés O, Savón C, Arencibía A, Guilarte E, et al. Rapid Diagnosis of Pandemic (H1N1) 2009 in Cuba. Emerging Infectious Diseases. 2012;18(2).
5. Brittain-Long R, Nord S, Olofsson S, Westin J, Anderson LM, Lindh M. Multiplex real-time PCR for detection of respiratory tract infections. Journal of Clinical Virology. 2008;41(1):53-6.
6. Bonroy C, Vankeerberghen A, Boel A, De Beenhouwer H. Use of a multiplex real-time PCR to study the incidence of human metapneumovirus and human respiratory syncytial virus infections during two winter seasons in a Belgian paediatric hospital. Clinical Microbiology and Infection. 2007;13(5):504-9.
7. Gunson R, Collins TC, Carman W. Real-time TR-RCP detection of 12 respiratory viral infections in four triplex reaction.s Journal of Clinical Virology. 2005;33:341-4.
8. Nair H, Nokes DJ, Gessner BD, Dherani M, Madhi SA, Singleton RJ, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet. 2010;375:1545-55.
9. van Gageldonk-Lafeber AB, Heijnen ML, Bartelds AI, Peters MF, van der Plas SM, Wilbrink B. A case-control study of acute respiratory tract infection in general practice patients in The Netherlands. Clin Infect Dis. 2005;41(4):490-7.
10. Savon C, Valdes O, Acosta B, Gonzalez G, Piñón A, Gonzalez G, et al. Infección por rinovirus en niños hospitalizados menores de un año. Cuba 2006. Rev Biomed. 2008;19:122-3.
11. OPS. Actualización Regional sobre Influenza y otros virus respiratorios. 2014 [citado 20 sept 2017]. Disponible en: http://www.paho.org/reportesinfluenza
Recibido: 3 de octubre de 2017.
Aprobado: 9 de agosto de 2018.
Belsy Acosta Herrera. Escuela Latinoamericana de Medicina. Avenida Panamericana Km 3½ Santa Fé. La Habana, Cuba. Correo electrónico: bacosta@infomed.sld.cu