Introducción
Naegleria fowleri, diversas especies del género Acanthamoeba, Balamuthia mandrillaris y Sappinia diploidea (pedata) son amebas de vida libre (AVL) que son patógenas para humanos y animales. Estas especies de AVL habitan aguas naturales como lagos, arroyos, aguas termales, cascadas, así como aguas de acueducto residencial, piscinas y diversos lugares para baños recreativos, incluso para hidroterapia y aguas de drenaje,1,2,3,4 además se aislaron de tierra y partículas de polvo atmosférico,2,5 humidificadores y equipamiento hospitalario.6 Las infecciones por AVL producen daños en el sistema nervioso central (SNC), pueden localizarse en otros órganos, así como Acanthamoeba spp. puede producir infecciones corneales graves asociadas generalmente al uso incorrecto de lentes de contacto.2 Las AVL pueden también actuar como hospederos o vehículos de microorganismos filogenéticamente diversos llamados endocitobiontes, algunos con importancia para la salud pública (Legionella pneumophila, Mycobacterium avium complex, Listeria monocytogenes, Burkholderia pseudomallei, Vibrio cholerae, Escherichia coli O157:H7),7 donde las amebas facilitan la dispersión a varios hábitats, la resistencia a sustancias antisépticas y mayor virulencia.8 Estos protozoos y las enfermedades asociadas han acaparado la atención de científicos y del personal de salud en la actualidad, con el fin de mejorar el pronóstico desfavorable de los pacientes diagnosticados, así como trazar medidas preventivas eficaces.9
Se considera que los casos de infecciones del SNC por AVL no se encuentran reportados adecuadamente a escala global. Por una insuficiente difusión del conocimiento tanto de aspectos clínicos, como de factores de riesgo, es menos probable avizorar su presencia, a lo cual se suman las dificultades en la implementación de herramientas diagnósticas.10 No se precisa el número de reportes mundiales de infecciones con N. fowleri asociadas a la meningoencefalitis amebiana primaria (MAP), pero la compilación de casos publicados muestra alrededor de 300 hasta 2016.11 Escasos estudios epidemiológicos han prestado atención a la distribución geográfica de la MAP, pero se han reportado casos en casi todos los continentes.4,12 La mayoría de los casos reportados en la literatura científica provienen de Norteamérica.13 En Cuba, se reconoce internacionalmente la descripción de un caso de infección por N. fowleri hasta el presente.14 Un estudio previo realizado en Cuba en 1978 por García Tijera y otros15) no abarcó plenamente el perfil de cuadro clínico de MAP a la luz de la experiencia actual, posteriormente Sierra16 presentó escasas evidencias de manifestaciones clínicas, de positividad al cultivo y a la prueba de flagelación como identificación de N. fowleri en los líquidos cefalorraquídeos (LCR) de dos pacientes cubanos con meningoencefalitis. En general, no se estudiaron las probables fuentes de infección para esos casos, lo cual es necesario para abrir las puertas a la investigación del riesgo epidemiológico de estas infecciones en Cuba.
Las infecciones del SNC que muestran encefalitis granulomatosa amebiana (EGA) cuentan con más de 150 reportes de pacientes con encefalitis por Acanthamoeba spp y con B. mandrillaris alcanzan aproximadamente 200 casos.11 En solo un paciente con encefalitis se aisló S. diploidea (pedata).17Pietrucha-Dilanchian y otros18 describieron un caso único de encefalitis en el que se presentó infección con Acanthamoeba spp., B. mandrillaris y Toxoplasma gondii.
Se producen daños endoteliales durante la invasión de tejidos por AVL, estas cruzan la barrera hematoencefálica, causan inflamación granulomatosa y estimulan eventos tromboembólicos, con aumento de la permeabilidad vascular, liberación de citoquinas y en última instancia necrosis tisular.10,11 De modo que existe un amplio espectro de diagnósticos diferenciales para las infecciones con AVL como por ejemplo: meningitis virales y bacterianas, tumores cerebrales, esclerosis múltiple, encefalitis por lupus, leucoencefalopatía multifocal progresiva, choque, toxoplasmosis cerebral, enfermedades vasculares oclusivas y aneurismas,10) por lo que se requiere sospechar con agudeza la etiología amebiana por los profesionales médicos y de laboratorio para detectar y tratar tempranamente las infecciones por AVL, frente a la carencia de una terapia antimicrobiana óptima y un alto índice de fatalidad.
Este trabajo de revisión se realizó con el objetivo de proveer una visión general de los aspectos clínico-epidemiológicos y las posibilidades diagnósticas más eficaces en la meningoencefalitis amebiana primaria y la encefalitis granulomatosa amebiana, así como las experiencias de tratamiento.
Métodos
Se realizó una búsqueda de información en artículos científicos en la base de datos de Google Scholar®, PubMed y las citas relacionadas por el programa en PubMed Central, en una estrategia de complementar progresivamente la información, sin especificar el periodo de tiempo. Este análisis puede contribuir a promover el diagnóstico de las infecciones causadas por las principales AVL: N. fowleri, Acanthamoeba spp. y B. mandrillaris.
Resultados
Meningoencefalitis amebiana primaria causada por N. Fowleri
Cuadro clínico y hallazgos patológicos
Los síntomas típicos de MAP aparecen durante la primera semana después de la exposición a N. fowleri. No existen características clínicas distintivas para diferenciar MAP de otros tipos de meningitis.10 Por ello, es muy importante que el personal médico obtenga de los pacientes los antecedentes de haber estado en contacto con alguna fuente de agua que penetró por las fosas nasales mediante actividades diversas en las que predominan las recreativas,19 aunque también se han producido infecciones por prácticas religiosas y culturales, las cuales incluyen la irrigación de los senos nasales con agua de la red contaminada.3 Los síntomas iniciales son cefalea severa, fiebre alta, náuseas, vómitos y fatiga, pero la enfermedad avanza rápidamente hacia anormalidades neurológicas tales como rigidez de nuca, letargo, confusión, irritabilidad, anorexia, convulsiones, coma, diplopia, anormalidades de los nervios craneales asociadas a aumento significativo de la presión intracraneal y la presencia de hernia.4,20,21 El estudio retrospectivo de 142 casos de MAP en Estados Unidos determinó un curso clínico fulminante, con una progresión rápida desde los primeros síntomas que ocurrió con una mediana de solo 5 días.13 En esta investigación, el 79 % de las imágenes de tomografía computarizada (TC) y resonancia magnética (RM) se informaron como anormales y no específicas y se interpretaron como edema cerebral difuso con signos de aumento de la presión intracraneal (desplazamiento de la línea media y borrado de surcos corticales y de espacios basilares, particularmente cisternas), realce leptomeníngeo con contraste, disminución del tamaño de los ventrículos, áreas de hemorragia, necrosis y/o hernia.13 En los análisis post mortem de los pacientes con MAP se reveló la inflamación del encéfalo con daño tisular severo a través del área de invasión, con ulceración de la mucosa olfatoria y necrosis de los nervios olfatorios. Microscópicamente, los bulbos olfatorios se presentaron totalmente desorganizados por exudados purulentos y por vasos necróticos y hemorrágicos y en la corteza frontal adyacente se detectó un número considerable de trofozoitos invasores.12 El hallazgo post mortem de trofozoitos en órganos como bazo, pulmones, corazón, y riñones de casos de MAP, algunos donados para ser trasplantados, ha abierto la interrogante sobre la diseminación de los organismos de esta especie más allá del SNC (evento que se describe en las infecciones con Acanthamoeba spp. y B. mandrillaris) y acerca de los posibles riesgos para los receptores.22,23
Diagnóstico de laboratorio/microbiológico
N. fowleri presenta tres estados en su ciclo de vida: trofozoito, quiste y flagelado. La identificación de las características biológicas es de gran importancia para el diagnóstico4,12,24.
Tal como se muestra en la tabla, el LCR es una muestra imprescindible para la pronta identificación de la presencia de N. fowlei. El aspecto macroscópico del LCR es turbio y ligeramente hemorrágico. Además se presenta un aumento del número de células, principalmente neutrófilos, la concentración de glucosa es baja y las proteínas totales se elevan.11 Las experiencias publicadas en diversos estudios indican la necesidad urgente del empleo del diagnóstico presuntivo mediante el examen directo del LCR en busca de los trofozoitos tanto en fresco, como por la aplicación de tinciones como Wright y Giemsa. Es importante destacar que al analizar 13 casos de sobrevivientes en edad pediátrica, en todos se realizó el diagnóstico rápidamente por la observación de trofozoitos móviles en el LCR.25)
Se ha recomendado que tan pronto como sea posible después de la obtención del LCR o con líquidos bien conservados a 25 ºC, se deberá agitar levemente el tubo de la muestra para desprender amebas posiblemente adheridas, realizar una centrifugación breve de la muestra (500 g por 5 min) para concentrar las células, retirar el sobrenadante, dejando aproximadamente entre 200 y 300 µL de líquido residual y un sedimento. Ambos se mezclan para tomar la muestra que se coloca sobre una lámina portaobjeto, se cubre y se incuba brevemente entre 35 y 37 ºC para facilitar el movimiento de las amebas. Se recomienda observarlas mediante microscopía de contraste de fase. Esta muestra es útil para preparar frotis del concentrado celular, fijar y colorear con Giemsa para identificar presuntivamente los trofozoitos.26,27 Las imágenes de adecuada resolución que se obtengan pueden enviarse para compartir criterios, en espera de la confirmación.27 Es un método simple, rápido y de menor costo. Sin embargo, existen dificultades para la identificación de N. fowleri si no se indica este examen directo, si no hay habilidades para la observación microscópica, si la conservación y transporte de la muestra no se realiza a 25 ºC. En el estudio de mayor número de casos en EE UU,13 reportaron 53 LCR obtenidos premortem, aunque solamente 38 muestras resultaron positivas al examen directo. En Pakistán, se estudiaron retrospectivamente (periodo 2014-2015) los LCR de 15 pacientes cuya positividad fue comprobada por reacción en cadena de la polimerasa (PCR, del inglés, polymerase chain reaction) y solamente 7 se registraron positivos por microscopía.21
Tabla Métodos diagnósticos de laboratorio para MAP, EGA y lesiones cutáneas, pulmonares y de senos nasales causadas por infecciones con AVL
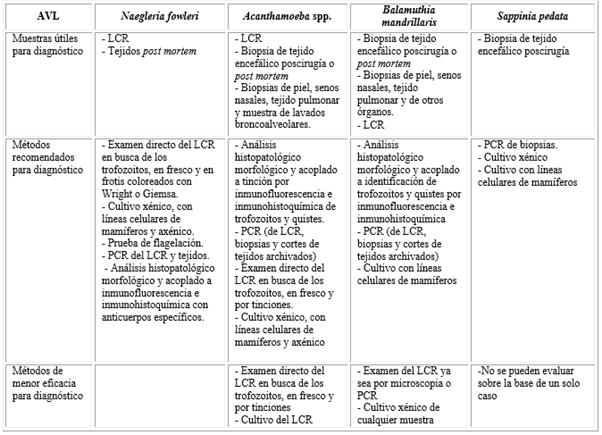
Otros autores también sugieren la detección de casos de MAP mediante cultivos del LCR o de muestras post mortem de tejido, los cuales pueden proveer evidencias confirmatorias.26,28 El cultivo puede realizarse en condiciones xénicas (medios con bacterias inactivadas), axénicas (medios que no contienen ninguna otra célula metabolizando activamente que el propio parásito), así como en co-cultivos con líneas celulares de mamíferos.29 Todas las muestras de trofozoitos de cultivo o de sedimento del LCR deben pasar la prueba de obtención de flagelados como requisito específico del género3,24) (tabla). Las técnicas de cultivo tienen como desventaja que los resultados positivos pueden demorar y dependen del número de amebas presentes en el inóculo y su estado de conservación, pueden tener interferencias por la contaminación de otros microorganismos que no puede ser eliminada con el uso de anfotericina B y azoles, solamente se recomiendan penicilina-estreptomicina o gentamicina y se requieren cultivos controles positivos en paralelo para chequear el reconocimiento del crecimiento de las amebas.29 La axenización es generalmente un paso posterior al aislamiento.30 Este protozoo ha sido considerado de gran riesgo y se recomienda su cultivo con extremo cuidado en condiciones que garanticen la bioseguridad en su manipulación.27,31 En la figura 1 podemos observar trofozoítos de Naegleria fowleri de la cepa HB-1,32 donada al Departamento de Parasitología del Instituto de Medicina Tropical “Pedro Kourí” (IPK) por el Instituto de Postgrado para Médicos y Farmacéuticos, Praga, Checoslovaquia, a partir de una impronta del crecimiento en medio de agar NN (no nutriente) según Cerva26 coloreada con la tinción tricrómica de Gomori. Se muestra la lobopodia característica (L) que hace que adopten la forma limax o de molusco, el citoplasma vacuolado (CV) y el núcleo (N) con un nucleolo grande y central con un halo blanco a su alrededor.
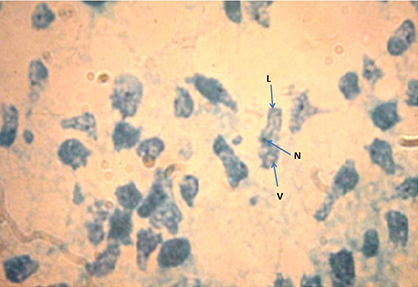 Lámina donada al Departamento de Parasitología del IPK por el Instituto de Postgrado para Médicos y Farmacéuticos, Praga, Checoslovaquia. N: núcleo, V: vacuolas y L: lobopodia.
Lámina donada al Departamento de Parasitología del IPK por el Instituto de Postgrado para Médicos y Farmacéuticos, Praga, Checoslovaquia. N: núcleo, V: vacuolas y L: lobopodia. Fig. 1 Trofozoítos de Naegleria fowleri de la cepa HB-1.32 Se coloreó una impronta del crecimiento en medio de agar NN (no nutriente) según Cerva26 con la tinción tricrómica de Gomori (400X).
Aunque el examen morfológico de las AVL ha resultado fundamental, algunos artículos refieren la observación de células con morfología atípica,33,34,35 en los cuales fue necesario aplicar análisis genéticos. Con una respuesta efectiva,20,33,34 se encuentra un ensayo PCR múltiple en tiempo real para el gen mitocondrial multicopia que codifica el ARN ribosomal 18S (18S rRNA, del inglés ribosomal ribonucleic acid) el cual ofrece un procedimiento prometedor para obtener un diagnóstico confirmatorio rápido y específico para MAP, EGA, la queratitis por Acanthamoeba spp. y la encefalitis por S. pedata,36,37 en un marco apropiado para el tratamiento, pero solamente unos pocos laboratorios de referencia tienen esta capacidad implementada y la utilizan como gold estándar.4,10,11 A las técnicas de amplificación de ADN se ha adicionado la confirmación mediante secuenciación del fragmento resultante,33,20,38 la genotipificación1,39 y recientemente, se detectó un caso de N. fowleri mediante secuenciación de nueva generación que luego se confirmó por el PCR que utilizó como diana la región del espaciador de transcriptores internos (ITS, del inglés internal transcriber spacer) concerniente al gen del ARN ribosomal 5.8S (5.8S rRNA, del inglés ribosomal ribonucleic acid).40 Ambos PCR presentaron similar sensibilidad y especificidad para detectar N. fowleri.41
Estas tecnologías basadas en el análisis genético se deben implementar con la mayor premura ya que la mayoría de las infecciones con N. fowleri (fundamentalmente las recopiladas en EE UU) se confirmaron a través del análisis histológico post mortem,10,13 en el cual predominó el análisis morfológico, aunque también se utilizó la ratificación a través de ensayos de inmunofluorescencia indirecta e inmunohistoquímica con anticuerpos policlonales o monoclonales para identificar los trofozoitos en cortes de tejido encefálico, la técnica de PCR, o recurrieron a estos tres criterios.1 En la figura 2 se muestra una imagen de los trofozoítos de N. fowleri a partir de una muestra de tejido del encéfalo de un caso fatal de un niño de 11 años de Bohemia norte que se bañó en las aguas de enfriamiento de una planta eléctrica de esta localidad en la cual los trofozoitos redondeados se distinguen en un vaso sanguíneo por el núcleo con un nucleolo grande y central con un halo blanco a su alrededor. En los tejidos no se han encontrado quistes de N. fowleri. De modo similar se identificaron trofozoitos post mortem en el caso de Cuba.14
 Lámina donada al Departamento de Parasitología del IPK por Instituto de Postgrado para Médicos y Farmacéuticos, Praga, Checoslovaquia (400X).
Lámina donada al Departamento de Parasitología del IPK por Instituto de Postgrado para Médicos y Farmacéuticos, Praga, Checoslovaquia (400X).Fig. 2 Trofozoítos de Naegleria fowleri teñidos con hematoxilina-tricrómica de Gomori en un corte histológico del encéfalo de un caso fatal de un niño de 11 años de Bohemia norte que se bañó en las aguas de enfriamiento de una planta eléctrica de esta localidad.
Aspectos generales sobre el tratamiento
Aún se desconocen los esquemas óptimos de tratamiento de MAP, la característica común de estos es el uso de anfotericina B intravenosa, la cual se utilizó para los 13 casos pediátricos que sobrevivieron a la infección.25 Sin embargo, se recomienda la adición de anfotericina B intratecal y otros agentes antimicrobianos tales como fluconazol, azitromicina, rifampicina y miltefosina, en dosis fundamentalmente descritas solo por el Centro para el Control y Prevención de Enfermedades de E. U. (CDC, del inglés Center for Disease Control and Prevention)42) en un régimen de tratamiento que se ha perfilado recientemente y que incluyó dosis máximas de cada antibiótico.43 Como coadyuvantes se recomendaron: el manejo riguroso de la presión intracraneal, dexametasona y la hipotermia terapéutica. Por ejemplo, un caso superviviente de una adolescente de 12 años fue tratado con anfotericina B convencional intravenosa a 1,5 mg/kg dividida en dos dosis por día, con fluconazol 10mg/kg/día, rifampicina 10mg/kg/día y azitromicina 10mg/kg/día. Concurrentemente se inició dexametasona. Luego de tres días, la anfotericina B iv se redujo a 1 mg/kg/día. A las 36 h de la admisión se le administró miltefosine oral, 50 mg cada 8 h. Ante el aumento de la presión intracraneal, se precisó manejo de este signo y se intercaló a las 24 h de admisión, anfotericina B intratecal 1,5 mg por dos días, seguido de una dosis de 1 mg cada dos días por 8 días. Mantuvo los antibióticos miltefosine, azitromicina, rifampicina y fluconazol durante 26 días.44 Con un tratamiento similar, sin administración intratecal, se recuperó un niño de 6 años en la India.45 No obstante seguir estas recomendaciones, la letalidad es alta y plantea interrogantes sobre los determinantes para la supervivencia, ya sea por factores patogénicos de diferentes cepas de N. fowleri o factores de la susceptibilidad del hospedero que al esclarecerse pudieran modificar las estrategias actuales de tratamiento.25
Encefalitis granulomatosa producida por Acanthamoeba spp. y B. mandrillaris.
Cuadro clínico y hallazgos patológicos
La EGA puede ser causada por B. mandrillaris y varias especies de Acanthamoeba con mayor frecuencia en individuos inmunocomprometidos, generalmente por trasplantes de órganos o médula ósea, VIH/SIDA, enfermedades linfoproliferativas o hematológicas, diabetes mellitus, pneumonitis, fallo renal, enfermedades hepáticas y gammaglobulinemia, aunque también se presentó en individuos inmunocompetentes.46 Después de la exposición primaria a través de la piel o las vías respiratorias, estas amebas invaden el torrente circulatorio y se diseminan por la sangre hacia el encéfalo. Estas pueden también dañar otros órganos como por ejemplo: los pulmones, la piel o la mucosa nasal y senos paranasales (muy raramente). Las lesiones ulcerativas o nodulares en la piel pueden estar ausentes, anteceder semanas a meses las manifestaciones neurológicas o son simultáneas.4,23,47 Sin embargo, el periodo de incubación no está definido, al difícilmente poder asociarse el momento de la exposición al agente. La enfermedad comienza lentamente y los síntomas se desarrollan entre semanas y meses. En la balamuthiasis el curso puede ser más corto, entre 1 y 30 días. Los signos típicos de EGA son fiebre, cefalea, fatiga, debilidad y náusea, que progresan a signos neurológicos como estado mental alterado, hemiparesis, convulsiones, visión borrosa y diplopia, a los cuales se le pueden adicionar posteriormente alteraciones de los nervios craneales, vértigo, ataxia, confusión y cambios de personalidad.4,7,35 Las lesiones encefálicas pueden ser detectadas por neuroimágenes obtenidas mediante TC y RM, pero los resultados no son específicos. Típicamente muestran lesiones múltiples, focales, bien definidas, ocupando espacio como anillo contrastante, con edema perilesional y resaltando las leptomeninges si las meninges están comprometidas.18,48,49 Los análisis post mortem del encéfalo revelan edema cerebral, áreas de ablandamiento cortical y de los ganglios basales, así como múltiples áreas necróticas y hemorrágicas. Se encuentran tanto trofozoitos como quistes en todos los tejidos afectados.11
Diagnóstico de laboratorio/microbiológico
La detección microscópica de las características morfológicas (de los estados de trofozoito y quiste de Acanthamoeba spp. y B. mandrillaris)4,50) ha sido el método convencional comúnmente utilizado para el diagnóstico de los agentes causantes de EGA. Con este fin se han utilizado muestras como el LCR, las biopsias de tejido encefálico (que pueden ser posteriores a la resección quirúrgica o post mortem), las biopsias de piel, senos nasales, de tejido pulmonar y muestras de lavados broncoalveolares,7 como se describe en la tabla.
El examen del LCR en los casos de EGA revela pleocitosis linfocítica no específica con niveles elevados de proteínas y concentraciones normales o inferiores de glucosa, a diferencia de los casos de MAP, donde se observan abundantes neutrófilos en similitud con la meningitis bacteriana. Además, en comparación con la MAP, en la observación microscópica de la preparación fresca de LCR se detectaron muy dispersos trofozoitos35 o estuvieron ausentes4,38,48 para los casos de EGA debidos a Acanthamoeba spp. y B. mandrillaris. Con ambos agentes, no se han observado quistes en el LCR. Incluso en una serie de casos confirmados de B. mandrillaris a través de técnicas histopatológicas y/o moleculares en el CDC, la positividad alcanzó un 88 % con la biopsia encefálica como muestra y solamente un 6% mostró positividad en el LCR.51 Algunos autores plantean que la detección de ADN de B. mandrillaris e incluso Acanthamoeba en el LCR pudiera deberse a una lisis de las amebas en el tejido encefálico afectado, pero se reportaron casos de supervivientes con LCR positivos por PCR y cultivo, que hablan a favor de preservar este tipo de muestra para su análisis.23
El empleo de técnicas de cultivo en los casos de sospecha de EGA debe dirigirse a evitar las diferencias de adaptación a los medios entre los organismos de ambos géneros, por lo que simultáneamente se deben colocar muestras de biopsia en cultivo xénico y en cultivo de tejidos de mamíferos.3 Definitivamente, el cultivo con líneas celulares de diferentes fuentes como riñón (MKC), fibroblastos de riñón (Cos-7, Vero), células ováricas (CHO) y células pulmonares embrionarias (MRC5), entre otras, ha sido propicio para todas las especies causantes de EGA.5,23 La muestra de la biopsia, al colocarla sobre agar no nutriente conteniendo bacterias inactivas e incubarse por más de 48 h a 37 ºC, dará resultados positivos si contiene Acanthamoeba spp. Mientras que si la muestra contiene B. mandrillaris, su crecimiento en cultivo con líneas celulares puede revelarse como efecto citopático hasta 14 días posteriores a la incubación, ya que su crecimiento es lento.5 Aunque es un método altamente específico, tiene baja sensibilidad, puede ser ineficiente, laborioso y requiere experiencia técnica para su interpretación.52
Actualmente, el PCR es el método de elección para la detección con mayor sensibilidad y rapidez de Acanthamoeba spp. y B. mandrillaris y en paralelo, se aplica el diagnóstico microscópico en cortes histológicos en busca de la morfología típica, que debe acoplarse a las técnicas de inmunofluorescencia y/o inmunohistoquímica para la diferenciación del género causante de EGA. Coloraciones como la del ácido peryódico de Schiff, la de metenamina-plata de Gomori o la de blanco Calcoflúor facilitan la distinción de formas quísticas en los tejidos.4,53 La sensibilidad del análisis histopatológico morfológico puede ser insatisfactoria por problemas en el procedimiento de escisión de la lesión.
Las técnicas de amplificación de ADN más utilizadas2,3 tienen como base el gen mitocondrial multicopia que codifica el ARN ribosomal 18S, la mayoría según Qvarnstrom.36 Se han diagnosticado múltiples casos por PCR con ADN de biopsias de encéfalo, piel y con muestras fijadas con formalina y en bloques de parafina que han permitido la detección retrospectiva.23,48,49 También en varios casos se comprobó la identidad del fragmento amplificado mediante secuenciación.35,38
Es importante también diagnosticar Acanthamoeba spp en infecciones de la piel, muestras de pulmón, de senos nasales y de lavados broncoalveolares. Cuando se identificó B. mandrillaris pre-mortem en ulceraciones de la piel, se presentó una oportunidad para prever la infección subsiguiente en el SNC. Aproximadamente 50 % de los supervivientes a esta infección tuvieron como antecedente una lesión de piel que alertó.4,7,54 Las infecciones pueden diseminarse al pulmón, riñones, e incluso a huesos causando osteomielitis, aunque con mayor frecuencia se observaron trofozoitos y quistes de B. mandrillaris en muestras de tejido pulmonar11 o el PCR reveló la presencia de Acanthamoeba spp en este órgano.35
En la última columna de la tabla se refleja la única experiencia derivada de la descripción de un caso de EGA causado por Sappinia diploidea (pedata). Las amebas del género Sappinia pueden distinguirse de otras AVL por la presencia de un núcleo doble, en el cual los dos cariosomas se disponen muy próximos con una separación lineal o en banda, lo cual se presentó claramente en secciones de tejido teñidas con hematoxilina-eosina, Giemsa o con ácido peryódico (Schiff).17 Además diversos aislamientos ambientales posteriores han sido cultivados en medio xénico o con líneas celulares de mamíferos.55
Aspectos generales sobre el tratamiento
La infección del SNC por B. mandrillaris no cuenta tampoco con un régimen de tratamiento altamente exitoso. El CDC recomienda los siguientes fármacos: pentamidina isetionato, miltefosina, fluconazol, flucitosina, sulfadiazina, azitromicina y/o claritromicina,56 pero no se conoce el fármaco, las dosis y la duración del tratamiento más apropiados, dadas las limitaciones para realizar ensayos clínicos aleatorios.57Vollmer y Glaser57 presentaron el análisis retrospectivo de 10 casos sobrevivientes en el periodo 2003-2016. La mayoría de los sobrevivientes recibieron pentamidina entre 1 y 4 mg/kg/día con 300 mg al día como máximo, aunque este fármaco tiene una penetración limitada de la barrera hematoencefálica y una toxicidad clínica significativa. El fármaco miltefosina se incorporó a la terapia contra AVL desde 2006 y parece prometedor ya que su presencia en el esquema múltiple a 150 mg cada 24 horas durante 12 días, luego 100 mg diarios aportó una ventaja para sobrevivir, aunque no fue el único esquema con resultados positivos.57 El tratamiento descrito57 para el caso superviviente de balamuthiasis es ejemplo del uso intensivo y prolongado de antibióticos. A partir de la tercera semana del ingreso se administró pentamidina (de forma continua por 5 semanas que al paso de estas se retiró por toxicidad), sulfadiazina (5 semanas), fluconazol (100 semanas), flucitosina (4 semanas), claritromicina (dos semanas alternas debido a la toxicidad) y miltefosina (desde la quinta semana se mantuvo 11 semanas). De este modo, después de 8 semanas de ingreso, el paciente se mantuvo tratado por un largo periodo de tiempo con fluconazol, miltefosine, azitromicina y trimetroprim-sulfa. En los casos revisados se observó que los fármacos seleccionados dependen del manejo clínico ante la evolución del paciente y están basados en la experiencia previa con casos reportados de supervivientes, los resultados de ensayos in vitro con estos fármacos y sus combinaciones, así como ensayos con modelos animales.42 Los estudios realizados in vitro indicaron muy poca actividad inhibidora del crecimiento amebiano para fluconazol, sulfadiazina y flucitosina, mientras azitromicina, pentamidina, miltefosina y voriconazol mostraron actividad amebicida o amebostática.58 Por ello los resultados de los tratamientos actuales que emplean diferentes combinaciones experimentales de estos fármacos son inconsistentes, dando sobrevivencia en unos casos y fatalidad en otros. La terapia se puede perfeccionar con la resección quirúrgica completa de lesiones únicas, lo cual se convierte en un alerta para el reconocimiento temprano de esta enfermedad que permitiría que una mayor proporción de casos mejoraran su pronóstico. (7,58
La EGA por Acanthamoeba spp. carece de un régimen terapéutico estándar, utiliza también combinaciones de 4 y 5 antibióticos, donde los más efectivos son miltefosina, azoles, pentamidina y cotrimoxazol y si es posible se acompaña de la escisión quirúrgica. Otras alternativas son: anfotericina B liposomal, voriconazol y miltefosina.7,59,60 Las brechas del conocimiento actual promueven las investigaciones en nuevos acercamientos terapéuticos,30 con nuevos métodos de administración de fármacos al SNC, hacia un mayor dominio de los mecanismos fisiopatológicos, así como esclarecer el papel de la respuesta inmune, en conjunción con los factores genéticos y ambientales que contribuyen a la mortalidad por infecciones con AVL.
Conclusiones
La mortalidad asociada con las infecciones del SNC por AVL permanece alta, aunque varios estudios compilan las experiencias útiles con los supervivientes. Lo más importante, es que el diagnóstico rápido de la infección, es necesario para un tratamiento exitoso. Del análisis de la MAP y la EGA se destaca en primer lugar la identificación de las características clínicas y epidemiológicas, a lo cual sigue que el LCR presenta gran relevancia para el diagnóstico de la MAP, mientras depende de la valoración riesgo-beneficio para los casos presuntivos de EGA. En esta última, se ha obtenido mayor éxito con el diagnóstico histopatológico de biopsias y en general se acrecienta la implementación de la investigación del ADN por diferentes métodos que brindan certeza de cada una de las especies de AVL causantes de enfermedad neurológica. El aislamiento en cultivo confirmatorio de N. fowleri, Acanthamoeba spp. y B. mandrillaris presenta diferencias de la factibilidad de crecimiento en diferentes medios de acuerdo con la especie y limitaciones adicionales, pero resulta útil para abordar diversos aspectos sobre la MAP y la EGA en relación con el conocimiento científico que está en progreso en la actualidad acerca de estos protozoos y de los factores de predisposición subyacentes en el hospedero.














