Estimado editor:
La reacción en cadena de la polimerasa en tiempo real (PCR/TR) ha sido fundamental en el diagnóstico de la enfermedad por coronavirus 2019 (COVID-19), declarada pandemia por la Organización Mundial de la Salud (OMS) el 11 de marzo de 2020.1 Requiere de laboratorios con condiciones especiales, de personal técnico entrenado y tiene un costo relativamente alto por determinación.2 El incremento acelerado de casos y la necesidad de aumentar la vigilancia y búsqueda de individuos positivos hace necesario contar con un diagnóstico precoz y rápido que permita optimizar el manejo clínico y tratamiento del paciente, y limitar la transmisión viral preferiblemente desde el lugar de atención médica.
Desde diciembre de 2020, la Unión Europea recomienda el uso de los sistemas de detección de antígenos. Estos son ampliamente utilizados en el diagnóstico de diferentes enfermedades infecciosas por ser rápidos (los resultados se leen en 30 min o menos), menos laboriosos que los métodos moleculares, pueden realizarse en el lugar de atención del paciente, no requieren de gran entrenamiento del personal y son más baratos.
El PCR/TR constituye la prueba de oro en el diagnóstico de SARS-CoV-2 (acrónimo del inglés, severe acute respiratory syndrome coronavirus 2), pero su amplio uso ha conducido a la escasez de reactivos e insumos, lo que unido a su costo relativamente alto y la necesidad de un mayor tiempo en su procesamiento, ha hecho que se recomiende la evaluación y utilización de pruebas rápidas de detección de antígenos como métodos complementarios de diagnóstico en entornos específicos.3
El objetivo de la presente carta es comunicar los resultados de la evaluación de la sensibilidad y especificidad del estuche SARS-CoV-2 Rapid antigen test, producido por SD BIOSENSOR y distribuido por ROCHE DiagnosticGmbH frente a la técnica de referencia de PCR/TR. La evaluación se realizó en el Laboratorio Nacional de Referencia (LNR) del Instituto de Medicina Tropical “Pedro Kourí” (IPK). Para esta se estudiaron, por ambos métodos, muestras de exudado nasofaríngeo colectadas de pacientes de COVID-19 y contactos asintomáticos hospitalizados en el Hospital León Cuervo Rubio, la Escuela de Medicina y la Escuela de Arte de Pinar del Río y en el Centro Hospitalario del IPK. Las muestras de casos sintomáticos provenían de pacientes confirmados por PCR/TR como COVID-19 con menos de cinco días de inicio de los síntomas. En los casos asintomáticos se tomó la fecha del PCR/TR inicial positivo con menos de una semana.
El estudio incluyó 92 personas (22 casos sintomáticos y 70 asintomáticos). A cada persona se le colectaron dos muestras de exudado nasofaríngeo simultáneamente en el lugar de hospitalización. Una muestra se utilizó para la detección del antígeno de SARS-CoV-2 (realizada en el lugar de colecta siguiendo las instrucciones del fabricante). La segunda muestra se envió en condiciones de refrigeración a 4-8 ᵒC y cumpliendo las normas de bioseguridad establecidas para el traslado de muestras, al LNR para su procesamiento inmediato por PCR/TR. El método de extracción de ácidos nucleicos utilizado fue el QC-Qiagen y por PCR/TR se estudió la presencia del gen E del SARS CoV-2 utilizando el estuche Ridas.
En la tabla se comparan los resultados obtenidos por ambos métodos en las 92 muestras procesadas (sintomáticos y asintomáticos), en los sintomáticos solamente (22) y en aquellas muestras con valores de CT (≤ 30) en el PCR/TR.
Tabla Comparación de los resultados obtenidos en el diagnóstico de COVID-19 a través de PCR/TR y utilizando el test rápido de detección de antígenos (SD BIOSENSOR) a partir de muestras de pacientes de tres centros hospitalarios de Pinar del Río y del IPK. Laboratorio Nacional de Referencia, Cuba, 2021
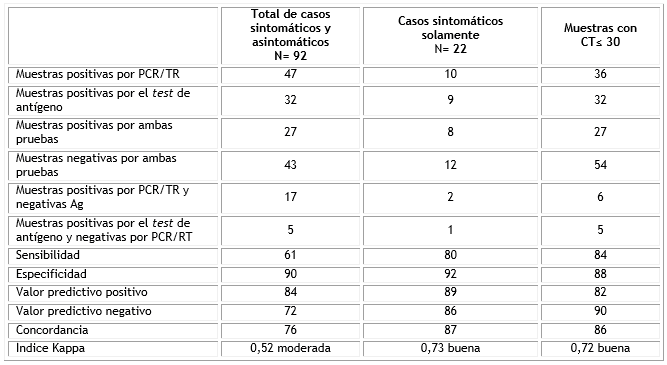
CT: del inglés Cycle threshold, o número de ciclos para alcanzar nivel detectable del ARN viral; Ag: antígeno.
El estuche SARS-CoV-2 Rapid antigen test es fácil de usar y cuenta con los reactivos e insumos necesarios para su aplicación en condiciones de campo. Su sensibilidad en los casos sintomáticos fue de 80 %, valor informado por otros autores y recomendado por diferentes organizaciones como adecuado para el empleo de los tests de antígeno.4,5 Sin embargo, su valor fue mucho menor (61 %) si se contempla el total de los casos estudiados, incluyendo los asintomáticos. Estos cambios en la sensibilidad posiblemente dependen de la cantidad de virus presente en el exudado (a mayores valores de CT menos fue positividad del test). Por tal motivo consideramos que puede ser un test para estudio de casos sintomáticos permitiendo discriminar rápidamente de otras infecciones respiratorias agudas (IRA) en la atención médica primaria. La especificidad fue buena en las tres variantes analizadas. Resultados de sensibilidad y especificidad similares han sido informados por otros autores.6,7,8
Cada prueba diagnóstica tiene una indicación determinada en función de su capacidad diagnóstica, del momento de la enfermedad y de las características del caso. No obstante, la recomendación es no sustituir el PCR/TR por las pruebas de antígenos, dada la posibilidad de resultados "falsos negativos" en casos asintomáticos y en un porcentaje de los sintomáticos, sino complementar con el objetivo de ganar en resolución diagnóstica y en costos en el manejo de la pandemia.
Como en otros estudios la recomendación es que es una prueba válida para aplicar principalmente en pacientes de IRA en los primeros 5 días de la enfermedad en que hay una mayor cantidad de virus y existe la posibilidad de transmisión viral. El sistema puede ser útil en la atención primaria de salud para diferenciar COVID-19 de otros cuadros respiratorios para establecer una respuesta inmediata, pues permite aislar rápidamente a los pacientes que tendrían la respuesta de los resultados del PCR/TR más demorada, sobre todo en aquellas comunidades más aisladas. Dado que la sensibilidad obtenida en los sintomáticos fue de 80 %, recomendamos que a los sintomáticos negativos se les realice el PCR/TR para descartar un posible falso negativo de la prueba de antígeno. Sin dudas, contribuye también epidemiológicamente al contar con una herramienta que permite cortar la transmisión al aislar rápidamente a personas sintomáticas del entorno en que se encuentran.














