Introducción
La medicina tradicional de los pueblos ha acumulado un vasto conocimiento acerca de los beneficios que representa para la salud humana el empleo de productos naturales de diversos orígenes en la cura de numerosas enfermedades incluyendo las de naturaleza infecto-contagiosa y el cáncer; tanto es así que más del 60 % de los fármacos disponibles para la terapia del cáncer se derivan de productos naturales o se encuentran relacionados con ellos.1
El cáncer cérvico-uterino es uno de los más importantes problemas para la salud mundial, constituyendo la cuarta causa más común de cáncer en las mujeres. En 2018, fueron reportados 570 000 nuevos casos y alrededor de 311000 muertes relacionadas a este; afectando fundamentalmente a mujeres entre los 50 y 60 años de edad.2 Este tipo de cáncer es provocado en muchas ocasiones por Papillomavirus tipo 16 o tipo 18.3 Cada día son más numerosos los informes del empleo de extractos naturales en ensayos de citotoxicidad y de ensayos antiproliferativos con extractos de plantas medicinales y macroalgas que han tenido resultados relevantes sobre líneas celulares transfectadas con genes de Papillomavirus tipo 18 y 16, respectivamente, como HeLa (ATCC-CCL-2),y SiHa (ATCC HTB-35).4,5,6
Se han descrito numerosas propiedades biológicas para el género Phyllanthus en el cual hay gran número de especies endémicas de Cuba. Algunas de estas han sido estudiadas en busca de propiedades anticancerígenas.7 En este sentido el presente trabajo tuvo el objetivo de evaluar la actividad citotóxica y antiproliferativa de un extracto acuoso de en tres líneas celulares, dos de origen tumoral (SiHa y HeLa) y una no tumoral (Vero).
Métodos
Colecta y preparación del extracto acuoso de P. comosus
Las plantas (hojas) de la especie P. comosus fueron colectadas en la zona de Yamanigüey, municipio de Moa, Holguín, Cuba, en abril del 2015. Se procedió a la identificación taxonómica por la doctora Banessa Falcón, especialista del Departamento de Biología Vegetal de la Facultad de Biología de la Universidad de La Habana y a su homologación con la especie depositada en la colección Vaucher del Jardín Botánico Nacional de Cuba con el número de herbario 1651.
El extracto acuoso se preparó y liofilizó como fue descrito previamente por del Barrio y Parra.7) Brevemente, las hojas fueron secadas a 50 ºC durante tres días y posteriormente molidas (molino de aspa de 8 pulgadas, marca Christy & Norris LTD, con malla 2 mm.). A partir de dicho material seco y molido (100g) se realizó una extracción acuosa 1:10 (P/V) en agua destilada y agitada durante 4h en baño María a 70 ºC. La suspensión resultante se filtró y centrifugó a 10 000 r.p.m. durante 20 min en centrífuga Beckman J21B con el rotor JA21. El sobrenadante fue liofilizado (Liofilizadora EdwardsHigh Vacuum B.O.C.Crawley England) y se conservó a temperatura ambiente hasta su uso.
Líneas celulares y medios de cultivo
Las líneas celulares utilizadas para este estudio fueron: línea celular de cáncer de cérvix uterino humano SiHa (ATCC® HTB-35™) la cual tiene integrada una o dos copias del genoma de Papillomavirus-16 (HPV-16); línea celular de cáncer de cérvix uterino humano HeLa (ATCC® CCL-2™) la cual tiene integrado una o dos copias del genoma de Papillomavirus-18 (HPV-18), línea continua de riñón de mono verde africano adulto Vero (ATCC® CCL- 81™). Las células fueron cultivadas en medio Medio Mínimo Esencial con 1 % de solución de aminoácidos no esenciales y 2 mM glutamina (GibcoTM) suplementado con 10 % de Suero Fetal Bovino inactivado por calor (SFBI) (GibcoTM). Todas las líneas celulares se mantuvieron a 37 ºC en una atmosfera de CO2 al 5 %.
Ensayo de citotoxicidad
Las tres líneas celulares fueron sembradas en placas de 96 pocillos (Costar) a una densidad de 2,5 x 105 células/mL e incubadas a 37 °C en atmósfera de 5 % de CO2 durante 48-72 h. Cuando las células alcanzaron un 90 % de confluencia, el medio se eliminó y se añadieron 100 μL del extracto acuoso de P. comosus disuelto en medio de cultivo sin suplementar, a diferentes concentraciones (5 000; 2 500; 1 250; 625; 300; 150; 75 y 37,5 μg/mL). Se incluyeron como controles negativos del ensayo 6 pocillos a los cuales se adicionó medio sin extracto. Como control positivo se empleo Cisplatino (Sigma-Aldrich). Tras 48 h de incubación a 37 ºC en atmósfera de 5 % de CO2, se añadió la solución de 3-(4,5-dimethylthiazol-2-yl)- 2,5 diphenyltetrazoliumbromide (MTT) a una concentración final de 0,5 mg/mL, incubándose durante 4 h para la producción de formazán. El precipitado sólido se disolvió con dimetilsulfóxido (Sigma) y se determinó la absorbancia a 544 nm en un espectrofotómetro lector de placas multipozos Fluostar OPTIMA®) con el programa integrado Dynex Revelation 4.02.
La proporción de células sobrevivientes se calculó como la (absorbancia de las células tratadas/la absorbancia del control) x 100. Se construyeron curvas dosis-respuesta para obtener los valores de CC50.
Índice selectivo
Para determinar la especificidad de la actividad citotóxica en las líneas celulares cancerígenas o de origen tumoral se calculó el Índice selectivo utilizando la siguiente fórmula:
Se consideró IS mayor que 1, indicativo que la sustancia es más citotóxica para las células cancerígenas que para las células no cancerígenas, menor a 1 cuando el efecto antiproliferativo para las células no cancerígenas supera al efecto en células tumorales.8
Ensayo clonogenicidad
Para evaluar la actividad antiproliferativa del extracto de P. comosus, se utilizó el ensayo clonogénico descrito por Piloto- Ferrer con algunas modificaciones.9 Para ello se sembraron 3 x103 células/mL de las tres líneas celulares en placas (Costar) de 12 pocillos en medio Medio Mínimo Esencial con 1 % de solución de aminoácidos no esenciales y 2 mM glutamina (GibcoTM) suplementado con 10 % de SFBI (GibcoTM) y fueron incubadas a 37 ºC en atmósfera de 5 % de CO2 durante 6 h. Tras la adhesión de las células se adicionaron 1,5 mL de extracto a tres concentraciones no citotóxicas, 150; 75 y 37,5 μg/mL (2 pocillos para cada concentración). Fueron incluidos controles celulares a los que se les adicionó medio sin extracto. Las placas fueron incubadas durante 7 días a 37 ºC en atmósfera de 5 % de CO2. El experimento se realizó dos veces por duplicado.
Tras este período se procedió a fijar y teñir las células con una solución al 1 % de cristal violeta en paraformaldehído al 4 % durante 30 min. Las placas se lavaron con agua corriente y se dejaron secar. Luego se procedió al conteo de los clonos celulares empleando un microscopio invertido Miotic®. Se consideraron solo aquellos clonos o colonias con más de 50 células.10
Procesamiento estadístico
Se determinó el valor de la CC50 mediante regresión lineal a partir de la ecuación de la línea de tendencia de la curva dosis- porcentaje de viabilidad celular generada a partir de los datos experimentales. Para ello se utilizó el programa Microsoft Office Excel 2013 y se consideró un valor de coeficiente de regresión (R2) mayor que 0,85.11 El ensayo de citotoxicidad fue realizado 2 veces en sextuplicados.
Para comparar el efecto del extracto acuoso de P. comosus sobre las líneas tumorales (SiHa y HeLa) se realizó una prueba de Kruskal-Wallis con un nivel de significación de p= 0,0075
Resultados
En el presente trabajo la evaluación de la citotoxicidad del extracto acuoso de P. comosus en las dos líneas celulares tumorales (HeLa, SiHa) se realizó mediante el ensayo de diferentes concentraciones (entre 37,5 y 5 000 μg/mL). El análisis de regresión lineal de las curvas dosis repuesta mostró para la línea celular HeLa un valor promedio de CC50 igual a 739,54 ± 26,7 μg/mL y para la línea celular SiHa dicho valor fue de 741,13 ± 12,3 μg/mL (de dos experimentos independientes). En la figura 1 se muestran los valores de uno de los dos experimentos independientes realizado por sextuplicado
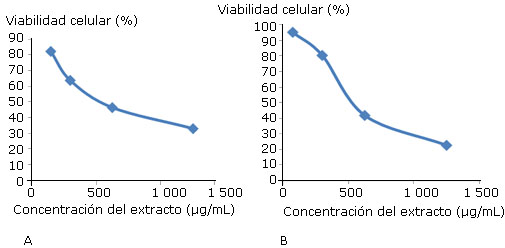
A: Línea celular SiHa. B: HeLa, determinada mediante el método del MTT. Cada valor representa la media ± la desviación estándar de 6 pocillos por concentración. Los resultados se expresan como porcentaje de viabilidad celular con respecto al control celular no tratado (100 % viabilidad).
Fig. 1 Efecto citotóxico de concentraciones crecientes del extracto acuoso de P. comosus.
El análisis estadístico indica que no hay diferencias significativas en el comportamiento citotóxico entre ambas líneas celulares para un test de Kruskal-Wallis p= 0,0075 y el valor de comparación entre estas dos líneas fue de 1.
Con la finalidad de evaluar la posible selectividad en la acción de P. comosus en modelos de cultivos celulares se estudió su efecto sobre la línea celular Vero, de origen no tumoral. Para ello se evaluaron las mismas concentraciones que para las líneas tumorales (37,5-5 000 μg/mL) El ensayo citotóxico mostró un valor de CC50 igual a 2314,8 μg/mL el cual resultó tres veces menos tóxico que para las líneas tumorales aquí en estudio. Se aprecia que la viabilidad celular se mantiene por encima del 100 % o muy cercano a este para concentraciones que fueron tóxicas en las líneas tumorales estudiadas, incluida la concentración de 300 μg/mL. El comportamiento de la viabilidad en las células Vero se muestra en la figura 2

Cada valor representa la media ± la desviación estándar de 6 pocillos por concentración. Los resultados se expresan como porcentaje de viabilidad celular con respecto al control celular no tratado (100 % viabilidad).
Fig. 2 Efecto citotóxico de concentraciones crecientes del extracto acuoso de P. comosus en la línea celular Vero determinada mediante el método del MTT.
Los valores de IS obtenidos al comparar el efecto citotóxico del extracto en estudio en líneas tumorales (HeLa y SiHa) con respecto a las células Vero, no tumoral, fueron 3,1 para ambas (Tabla 1).
Tabla 1 Actividad citotóxica (CC50 ± desviación estándar) e índice de selectividad (IS) del extracto acuoso de P. comosus en las líneas tumorales (SiHa y HeLa)

Los valores de CC50 del cisplatino en las células HeLa y Vero fueron de 18,8±1,2 μg/mL y de 20,8±0,9 μg/mL, respectivamente. El cisplatino utilizado como control positivo en este estudio mostró el valor más bajo de CC50 , lo que evidencia un efecto citotóxico, similarmente alto para ambas líneas tumorales y no tumorales.
Efecto del extracto acuoso de P. comosus en la inhibición de la proliferación celular mediante ensayo clonogénico
Con el objetivo de determinar si este extracto presenta potencial antiproliferativo se utilizaron diferentes concentraciones de P. comosus (37,5; 75; 150 μg/mL).
Después de 7 días de tratamiento, el extracto de P. comosus provocó en todas las concentraciones una disminución del número de colonias presentes en los pocillos correspondientes a células SiHa y Hela, con respecto a las no tratadas o controles, como se muestra en la figura 3.
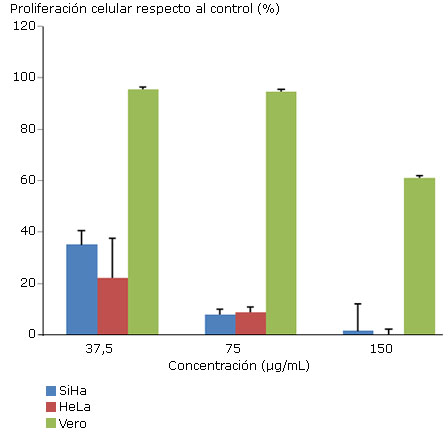
Los valores expresados en la figura representan el porcentaje de colonias presentes en cada una de las concentraciones con respecto al tratamiento control (0 μg/mL) ± desviación estándar (DE).
Fig. 3 Efecto antiproliferativo de tres concentraciones no citotóxicas del extracto acuoso de P. comosus en la línea celular SiHa, HeLa y Vero.
Esta disminución fue dependiente de la concentración. Así, en la línea SiHa el efecto inhibitorio de la proliferación celular fue de 60,32 % para la concentración de 37,5 μg/mL; de 91,15 % para 75 μg/mL y de 98,39 % para 150 μg/mL. De modo similar el efecto inhibitorio o antiproliferativo en la línea HeLa fue de 77,9%; 91,3% y 100% para las concentraciones de 37 μg/mL, 75 μg/mL y 150 μg/mL, respectivamente. Sin embargo, en la línea celular Vero los porcientos de proliferación celular fueron similares al control celular no tratado. Así, un 95,49 % y 94,67 % de proliferación en las concentraciones 37, 5 μg/mL y 75 μg/mL incluso la concentración de 150 μg/mL muestra una proliferación de un 60 %.
Discusión
Desde los inicios de la medicina antigua las plantas han sido utilizadas como tratamiento por muchas culturas en diversas enfermedades, incluido el cáncer, porque son seguros, tienen menos efectos secundarios, están más disponibles y son más baratos.12,13 Hasta 1990, el 80 % de los medicamentos químicos aceptados eran de plantas o sus derivados. 6,14
La investigación sobre nuevas drogas contra el cáncer con un menor efecto colateral es una de las principales acometidas de la investigación mundial. El género Phyllanthus tiene una larga historia de uso popular para el tratamiento de numerosas enfermedades, y han sido utilizadas como remedios antitumorales.15) P. amarus ha sido utilizado en sistemas de medicación en China.16) En este contexto, el presente trabajo se dirigió a la evaluación de las propiedades citotoxicas y antiproliferativas de P. comosus, planta endémica cuyo género está ampliamente representado en Cuba y para el cual se han demostrado diversas actividades biológicas.17,18,19,20
Los resultados aquí obtenidos demuestran que el extracto acuoso de P. comosus ejerce mayor citotoxicidad en líneas celulares de origen de tumor cervico uterino que poseen integrados genes de VPH 16 y 18, tales como SiHa y HeLa, con respecto a la línea Vero de origen no tumoral, evidenciado ello por los valores de CC50 y el IS.
Efectos inhibitorios han sido descritos por Sumalatha y colaboradores en células humanas HT-29 con la especie P emblica.21
Si bien criterios del Instituto Nacional del Cáncer de los Estados Unidos, un extracto es considerado activo si tiene una CC50≤ 30 μg/mL sobre células tumorales, también indican que un IS de 2 o más es importante ya que el compuesto es dos veces más citotóxico en líneas de células tumorales comparado con la línea celular no tumoral,22 lo cual indica selectividad en su acción y se considera de valor potencial.23
Valores de Concentración Inhibitoria Media (IC50) del cisplatino sobre los linfocitos humanos y en la línea K562 (ATCC CCL-243™) de células provenientes de una leucemia mieloide fueron de 212,81 y de 347 μg/mL, respectivamente. El índice de selectividad (IS) fue de 0,61 siendo este resultado menor que 1. Este compuesto se emplea como anticancerígeno no selectivo en la terapia del cáncer.8
Igualmente, Purnamasari y otros han informado valores de IC50> 653 μg/mL para el extracto de hojas de Ficus carica afirmando que podría inhibir el crecimiento de células cancerosas.24
Por otro lado, en el ensayo de clonogenicidad (método de elección para determinar la muerte celular reproductiva después del tratamiento con agentes citotóxicos), se obtuvieron porcientos significativos de inhibición de la proliferación celular en ambas líneas tumorales, SiHa y HeLa. Esta disminución fue dependiente de la concentración. Dichos valores igualmente están alejados de los obtenidos para la línea no tumoral Vero; de esta manera, se corrobora la especifidad o selectividad de dicho extracto y su importancia como posible antitumoral.6
Este es el primer estudio en el que se analiza la actividad o efecto del extracto acuoso de P comosus sobre el crecimiento de células tumorales de origen cérvico-uterino.
Los resultados del presente trabajo sustentan la necesidad de ulteriores estudios para aislar la posible droga con citotoxicidad específica o selectiva, y su acción sobre la expresión de los oncogenes E6 y E7 en células transformadas por el Virus del Papiloma Humano (VPH). Asimismo apoya o confirma las propiedades antitumorales de las plantas medicinales y en particular las bondades del género Phyllanthus con propiedades biológicas de interés en medicina.
















