Introducción
Los virus Zika (VZIK) y Chikungunya (VCHIK), miembros de la familia Flaviviridae y Togaviridae, respectivamente, son dos virus envueltos que poseen un genoma de ARN de cadena sencilla y polaridad positiva.1 El genoma codifica para una poliproteína, la cual, al ser procesada por proteasas virales y celulares, da origen a las proteínas estructurales y no estructurales. Ambos virus son transmitidos a los humanos por la picadura de mosquitos hembra del género Aedes (Ae.) infectados, principalmente Ae. aegypti y Ae. albopictus, y guardan una relación filogenética notable con los virus dengue, fiebre amarilla y del Nilo Occidental.2 Tanto el VZIK como el VCHIK son responsables de la enfermedad conocida como fiebre del Zika y fiebre Chikungunya, respectivamente, las cuales se caracterizan por tener un comportamiento clínico y epidemiológico similar, e incluso en muchas regiones del mundo presentan circulación concomitante.3 La sintomatología inicial se caracteriza por un cuadro febril de curso agudo y autolimitado, que se acompaña de artralgia, artritis, mialgia, erupción cutánea, cefalea e hiperemia conjuntival, que se resuelven en aproximadamente una semana.1
La significación epidemiológica del VZIK y del VCHIK surgió considerando los múltiples brotes del VCHIK reportados en 20134 y los brotes del VZIK de 2015 y 2016, los cuales se extendieron ampliamente por toda América Latina.5 La presencia de los vectores competentes en las regiones tropicales y subtropicales se asocia con el aumento en la incidencia y distribución geográfica de estas arbovirosis, que se convierten en un problema de salud pública considerable que compromete a millones de personas vulnerables de contraer ambas infecciones alrededor del mundo.6
El brote reveló que la infección indujo malformaciones en los recién nacidos, incluyendo microcefalia, defectos oftalmológicos y de audición, además de malformaciones cerebrales.7 Aunque menos frecuente, la infección también acarrea efectos negativos en personas adultas infectadas, debido a que pueden desarrollar complicaciones neurológicas graves como el síndrome de Guillain-Barré, meningitis y encefalitis, entre otras manifestaciones que llevan a secuelas graves.8 Además, se ha reportado la detección del VZIK en la placenta,9 los ojos,10 los ovarios, los testículos11,12,13 y, particularmente, la persistencia del VZIK en el fluido vaginal y el semen meses después de cesar la etapa sintomática de la infección y la viremia,14,15 lo que da como resultado la posible propagación por vía sexual.16,17,18,19,20
El primer caso notificado de transmisión sexual por el VZIK corresponde al de un hombre procedente de Colorado, Estados Unidos de América, quien se infectó durante un viaje a Senegal en 2008, y presentó síntomas de prostatitis y hemospermia; al regresar a su país, el hombre infectó a su pareja, quien, pese a no haber viajado a una región endémica del virus, presentó los síntomas característicos de la fiebre del Zika.21 Este hecho sugirió que el virus es gonadotrópico y se podría mantener en los testículos -incluso con replicación activa- y en el semen por más tiempo de lo que dura el aclaramiento del virus en sangre, conservando sus características infecciosas.22,23
La persistencia en el tejido testicular se ha asociado con cambios en la morfología y la movilidad espermática, además de alteraciones hormonales que repercuten negativamente en la fertilidad.24,25,26,27,28 En el semen infectado por el VZIK se ha reportado la alteración en el patrón de producción de citoquinas proinflamatorias desde las etapas tempranas de la infección, que se mantiene incluso después de la eliminación del virus.29 Los altos niveles de factores inflamatorios pueden alterar la integridad de la mucosa del tracto reproductor femenino y así aumentar la susceptibilidad a la infección viral, de igual modo que puede alterar la función de los espermatozoides y, por ende, el proceso de fecundación.30
Por su parte, el VCHIK es considerado un virus artrogénico capaz de producir dolores articulares intensos, que pueden persistir durante varios meses en aproximadamente el 30 al 60 % de los pacientes.31 La cronicidad de los síntomas se ha asociado con la persistencia del virus en las articulaciones, en particular, a través de macrófagos sinoviales infectados y una exacerbada la respuesta inflamatoria.32Bandeira y otros en el 2016 reportaron la presencia de ARN del VCHIK en la orina y el semen 30 días después de la aparición de los síntomas de la fiebre Chikungunya, aunque no se logró detectar partículas virales en el suero.33 Si bien no se ha demostrado la presencia de partículas virales infecciosas en el semen, esos hallazgos sugieren una posible transmisión del virus por contacto sexual.
En las regiones endémicas o en las zonas donde la prevalencia del VZIK es alta, no es posible distinguir la transmisión vectorial de la transmisión sexual, o evaluar la relación entre las rutas de transmisión (Fig. 1).23 Una situación similar ocurriría con el VCHIK en caso de corroborarse el contagio por vía sexual. De otro lado, podrían existir dificultades para diferenciar entre ambos virus, teniendo en cuenta su constante cocirculación, similar sintomatología y que el diagnóstico de estas infecciones es, por lo general, de carácter clínico-epidemiológico y no confirmado por estudios de laboratorio.34
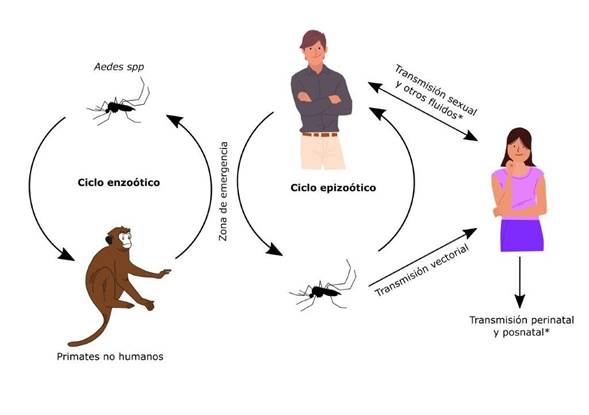
Fig. 1 Ciclos de transmisión del virus Zika (VZIK) y Chikungunya (VCHIK). Los ciclos de transmisión coexisten en una zona de emergencia; los transmitidos por vectores comprenden un ciclo enzoótico con una circulación viral entre primates no humanos y mosquitos zoofílicos del género Aedes, y un ciclo epizoótico con humanos como reservorios y amplificadores, y Aedes aegypti como principal vector. Los ciclos no transmitidos por vectores comprenden la transmisión a través de fluidos por el contacto directo humano-humano, que podrían incrementar el número de infecciones durante los brotes epidémicos. *Las transmisiones sexual, perinatal y posnatal se han establecido solo para el VZIK, pero no para el VCHIK.
La presencia y persistencia de VZIK en el semen y, probablemente del VCHIK, permiten el planteamiento de algunas preguntas relacionadas con los efectos fisiopatológicos de esas infecciones en el tracto reproductor masculino. En consecuencia, el objetivo de la presente revisión es discutir la relevancia y las implicaciones de la presencia del VZIK y del VCHIK en el semen, y su relación con la transmisión sexual y la fertilidad masculina.
Métodos
Para esta revisión narrativa de la literatura se realizó una búsqueda del material bibliográfico publicado en PubMed (Medline), Embase y Scopus hasta diciembre de 2020, sin límite de tiempo, y se emplearon los términos “virus Zika”, “virus Chikungunya”, “tracto reproductivo masculino”, “fertilidad”, “semen” y “testículos”. Se recuperó un total de 362 artículos, se preseleccionaron artículos originales, revisiones del tema e investigaciones y se analizaron los artículos que presentaban la información relevante según el criterio de los autores. Finalmente, se revisó la bibliografía reportada en cada artículo con el propósito de ampliar los resultados.
Tracto reproductivo masculino
El sistema reproductivo masculino está conformado por los testículos, los epidídimos, los conductos testiculares, las glándulas accesorias y el pene, y su función principal es la producción de hormonas sexuales y espermatozoides mediante la regulación del eje hipotálamo-hipófisis-gónada.
En los testículos se encuentra la barrera hematotesticular (BHT), compuesta por tejido intersticial y células de Sertoli de los túbulos seminíferos, que se enlazan mediante complejas uniones estrechas para estabilizar la barrera y dividir el epitelio seminífero en dos compartimientos: basal y apical. La BHT, que coexiste y se interrelaciona funcionalmente con uniones de tipo gap, con especializaciones ectoplásmicas y con desmosomas, permite restringir el paso de moléculas de gran tamaño y prevenir la respuesta inmunitaria contra los autoantígenos de los espermatozoides, generando así un sitio inmunológicamente privilegiado que aísla los compartimientos donde ocurre la espermatogénesis.28 Las células de Sertoli contribuyen tanto en la composición química del lumen de los túbulos seminíferos, como en el control del microambiente en el que se lleva a cabo la espermatogénesis.35
Por su parte, en el tejido intersticial se encuentran vasos sanguíneos, vasos linfáticos, fibroblastos y células de Leydig, estas últimas de gran importancia dado que se encargan de producir la hormona testosterona. Asimismo, en ese tejido están presentes células del sistema inmunitario como macrófagos, células dendríticas (CD), células asesinas naturales (NK), linfocitos T y B, entre otras,36 que garantizan la protección del epitelio germinal.
Tracto reproductivo masculino e infección por el virus del Zika
La presencia de virus, bacterias, hongos e incluso parásitos en el semen, y su estrecha relación con esos agentes patógenos que pueden ser transmitidos por vía sexual, ha sido documentado ampliamente.37,38,39,40 En el caso del VZIK, su detección en el semen semanas después que han concluido los síntomas sugiere la persistencia del virus en el tejido testicular, lo que podría afectar la integridad de la BHT (Fig. 2).41 Varios estudios han demostrado que los testículos y los epidídimos son infectados con el VZIK y el virus se ha reportado en las células de Sertoli, de Leydig, espermatogonias e incluso en los espermatozoides maduros.24,25,27,42,43
Sin embargo, se ha reportado que, a diferencia de las células de Sertoli, las células de Leydig no son capaces de replicar de manera eficiente el virus.30 Estudios en ratones con deficiencia del receptor del interferón (IFNAR) y explantes testiculares humanos, permitieron demostrar que el VZIK infecta macrófagos.44 Con base en esos estudios, se ha sugerido que los macrófagos testiculares pueden constituir la principal célula blanco de la infección temprana por el VZIK en el intersticio testicular. A pesar de la clara evidencia de la infección de los testículos en humanos, aún se discute el establecimiento de la infección de las vesículas seminales y la próstata, dado que se ha evidenciado el desarrollo de prostatitis aguda y crónica durante la infección por el VZIK.45,46,47
Como reservorio, los testículos tienen el potencial para iniciar nuevos ciclos de transmisión de la infección por el VZIK y, dado que se ha reportado replicación en diferentes tipos de células del tejido testicular, se ha asociado con una carga viral alta en el semen.27 Incluso, se ha postulado que el eyaculado de hombres vasectomizados puede transmitir la infección,48,49 resaltando la importancia de las glándulas sexuales accesorias durante la transmisión.12 Existen evidencias en modelos murinos que permiten explicar lo que ocurre en el humano. Clancy y otros50) encontraron en el plasma seminal y el fluido epididimario de ratones infectados con VZIK, partículas virales infecciosas.
Tracto reproductivo masculino e infección por el virus del Chikungunya
Con base en lo reportado en la literatura, no existen suficientes estudios que permitan confirmar la infección del TRM por el VCHIK; solo existe uno que notifica ARN viral en el semen.33 En dicho estudio, Bandeira y otros describen el caso de un paciente que, previo a la aparición de los síntomas clásicos de la fiebre Chikungunya, manifestó sensación de quemazón en la uretra y la región genital, y además pudo haber tenido afectación transitoria de la próstata.
De la misma manera, se reportó el caso de un hombre de 64 años, que presentó un aumento súbito del antígeno prostático mientras se encontraba en seguimiento por adenocarcinoma de próstata.51 El caso se relacionó con infección clínica sintomática por el VCHIK, confirmada por detección de IgM específica para VCHIK, planteando un diagnóstico de prostatitis subclínica, debido a la ausencia de síntomas genitourinarios.
Inmunopatogénesis de la infección por el VZIK y el VCHIK en los testículos
Diferentes receptores celulares han sido involucrados en la entrada del virus a las células blanco. Entre ellos se encuentran DC-SIGN y miembros de la familia de receptores de fosfatidilserina, como el receptor de células T con dominio de inmunoglobulina y mucina 3 (TIM), y la subfamilia de proteínas tirosina quinasa compuesta por tres subunidades Tyro3, Axl y MerTk (TAM).52 Recientemente, Strange y otros en el 2019 reportaron que la proteína Axl no solo es altamente expresada en células de Sertoli, en comparación con otras células testiculares, sino que, además, permite la entrada del VZIK y regula negativamente el estado antiviral.53,59 Los resultados de ese estudio son congruentes con la documentación del receptor tirosina quinasa Axl en las células gliales y su potencial como factor de entrada del VZIK, así como su participación en la modulación de la repuesta inmunitaria innata a la infección.54 Se ha descrito por ejemplo, para el virus que produce parotiditis, que alrededor del 20 % de los hombres pospuberales infectados pueden manifestar epidídimo-orquitis, donde se altera el desarrollo y función de las células germinales y de Leydig, produciendo la afectación de la producción y función de espermatozoides e infertilidad masculina.27,55
En el caso del VZIK, se ha sugerido que una vez que alcanza las células endoteliales de los capilares testiculares, el virus se replica y acto seguido, los viriones son liberados al espacio intersticial.56 Existe evidencia de que el VZIK se replica en las células de Sertoli, los fibroblastos testiculares, las células germinales y los espermatocitos,42,57 lo cual induce tanto el aumento de un estado inflamatorio como la alteración de la permeabilidad de la BHT, facilitando la infección de otros tipos celulares en los túbulos seminíferos.56
En el 2016 se determinó que la infección por el VZIK inducía una respuesta inflamatoria en testículos y epidídimos, y son las células de Sertoli, las células de Leydig y las células epiteliales inflamatorias las principales células encargadas de iniciar una respuesta inmunitaria innata al expresar altos niveles de moléculas inflamatorias críticas en el control de la infección.25In vitro, la infección de las células de Sertoli favorece la producción de citoquinas proinflamatorias, incluyendo CCL5 y CX3CL1, y la expresión de moléculas de adhesión, tales como VCAM-1 e ICAM-1, lo que facilita el reclutamiento y activación de leucocitos, lo cual contribuye a la alteración de la BHT.41 Tras la infección de los macrófagos testiculares se estimula la producción y secreción de citoquinas y quimioquinas: IFN-α, TNF-α, IL-1, IL-8, GRO, IP-10 y MCP-1 (Fig. 2),27,34 mientras que, en los túbulos seminíferos, la infección de las células de Sertoli promueve la producción de citoquinas proinflamatorias, la activación de la cascada de señalización del IFN tipo I y la expresión de genes asociados a la presentación antigénica, además de factores de transcripción inherentes a la inflamación, como NF-κB y STAT.58
Sin embargo, en etapas tempranas de la infección por el VZIK, Axl tiene la capacidad de suprimir el estado antiviral dependiente del IFNAR en células de Sertoli, mediante la señalización Axl-IFNAR que involucra la fosforilación de STAT1, lo que resulta en un aumento en la susceptibilidad a la infección.59 Además, se ha determinado que durante la infección por el VZIK, la proteína viral NS5 inhibe STAT2, suprime la respuesta del interferón tipo I (IFN-I), lo que facilita la replicación del virus.60,61,62 En ratones inmunodeficientes, se observa que al bloquear la señalización del IFN-I, aumenta la infección en testículos por el VZIK.63 Respecto a la respuesta inmunitaria adaptativa a la infección, aunque no ha sido plenamente estudiada en los testículos, se ha observado que los LT CD4+, CD8+ y los anticuerpos neutralizantes participan en el control de la replicación viral, la resolución de la infección e inclusive, pueden conferir protección frente a la diseminación del VZIK.64
Para el caso del VCHIK, aunque a la fecha no hay evidencia que sustente la infección de los diferentes linajes celulares presentes en el tejido testicular, es importante señalar que se ha descrito la posible diseminación del virus a diferentes tejidos por vía linfática y sanguínea, ya sea a través de la infección de células blanco como monocitos y macrófagos, o directamente por el virus libre.65 Igualmente, se ha reportado que el VCHIK tiene tropismo por células endoteliales y epiteliales humanas, fibroblastos y macrófagos derivados de monocitos, las cuales también permiten su replicación viral,66,67,68 y se encuentra presente en los tejidos testiculares y del TRM en general.
Los macrófagos, células susceptibles/permisivas a la infección por VCHIK, pueden actuar como reservorios del virus y moduladores de la respuesta inflamatoria resultante de la infección, lo cual tiene relación con el establecimiento de enfermedades persistentes como la artropatía reactiva.69,70 En efecto, el VCHIK puede activar los macrófagos e inducir la producción de citoquinas, tales como MCP-1, IL-8 e IFN tipo I, las cuales participan en el reclutamiento y la diferenciación de monocitos sanguíneos a macrófagos en los tejidos periféricos.68,71
Igualmente, se ha reportado que la producción de citoquinas consecuencia de la activación de la respuesta inmunitaria innata en respuesta a la infección viral, puede contribuir a la permeabilización de barreras,65 como la barrera hematosanguínea del sistema nervioso central,72 de plexos coroides y leptomeninges,73 ocasionando la diseminación a dichos órganos. En consecuencia, en la fase virémica de la infección, el VCHIK podría diseminarse al TRM, y en los testículos podría infectar y replicarse en células endoteliales de los capilares sanguíneos, como sucede en la infección por el VZIK.56
A partir de ahí, el virus podría ser liberado posteriormente al espacio intersticial donde interactuaría con los macrófagos, que son células blanco clave de la infección. De igual modo, la infección de los macrófagos peritubulares en el tejido testicular podría afectar la función normal de las células de Leydig, con las cuales se encuentran en estrecha relación en el intersticio, donde se ha evidenciado la producción de IFN-I como respuesta a la infección viral, lo cual afectaría la síntesis de hormonas esteroideas a través de la regulación de la expresión y producción de la proteína reguladora aguda esteroidogénica.74 De manera similar, la estructura de la BHT se podría ver alterada durante la infección por el VCHIK, consecuencia de un desbalance en la producción de citoquinas proinflamatorias, incluyendo TNF-α, IFN-γ, IL-6 e IL-17, responsables de aumentar la permeabilidad de la BHT75,76,77,78 y la afectación del estado inmunosupresor protector normal del testículo. Adicionado al potencial perfil de citoquinas proinflamatorias en la infección, otras células inmunitarias como los mastocitos podrían, por estimulación paracrina, liberar mediadores que actuarían como estimuladores de la división celular de fibroblastos y células peritubulares, cuyo resultado son procesos fibróticos en la pared tubular.79 Finalmente, el aumento del catabolismo del tejido conectivo, el constituyente principal de la BHT, podría estar relacionado con la infección aguda por VCHIK.80
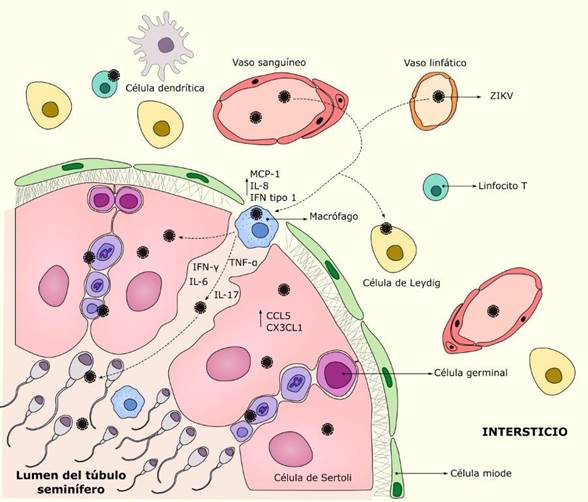
Fig. 2 Mecanismo potencial de interacción del virus Zika y el tejido testicular. El virus Zika puede llegar al tejido testicular por vía sanguínea o linfática como virus libre o asociado a células inmunes infectadas (macrófagos, linfocitos T y células dendríticas). En el espacio intersticial, el virus puede infectar a las células de Leydig, con el fin de aumentar la producción de virus localmente y puede además alterar el patrón hormonal. Los macrófagos pueden estar infectados, cumplir una función de transportador o actuar como reservorios del virus; una vez activados, secretan citoquinas que alteran la barrera hematotesticular y sus uniones estrechas, permitiendo el paso del virus al túbulo seminífero para la interacción con las células de Sertoli y germinales, y cambiando el microambiente inmunosupresor protector a una respuesta antiviral robusta.
Efecto de la infección persistente del virus Zika en el tracto reproductivo masculino
La persistencia del VZIK en el TRM varía en función de diversos aspectos como la incidencia de la infección en la población, la exposición previa a otros flavivirus, la circulación vectorial continua, y la respuesta inmunitaria celular y humoral que se establezca contra el virus.81
Varios estudios evidencian la persistencia del VZIK en el semen humano por largos periodos después de la aparición de los síntomas iniciales, incluso por periodos más largos a los reportados en otros fluidos corporales como sangre, orina o saliva.11,12,14,17,48,81,82,83,84,85
Esos hallazgos de infección persistente por semanas, e incluso meses después de la fase aguda de la infección, sugieren que el tracto urogenital masculino actúa como reservorio natural del virus, proporcionando un ambiente propicio para la infección. Si bien la mayoría de esos estudios notifican la detección de ARN viral en el semen por RT-PCR, la presencia del genoma viral no se relaciona directamente con los títulos infecciosos o la cantidad de partículas virales infecciosas; para tal fin es necesario el aislamiento viral en cultivos celulares, lo cual pocos estudios investigativos abordan. En efecto, solo determinadas muestras de semen que contienen ARN del VZIK tienen virus infecciosos y, por tanto, están implicadas en la transmisión sexual.14,83 Sin embargo, es necesario tener presente que, dadas las características del genoma viral -un ARN de cadena sencilla y polaridad positiva-, la sola entrada en una célula permisiva garantizaría la liberación de nueva progenie viral.
La presencia del virus por un tiempo prolongado en el TRM y en el fluido eyaculatorio, se ha asociado independientemente con factores como la edad, frecuencia de eyaculación y síntomas presentados durante la fase temprana de la infección.12 Además, la inmunopatogénesis de la infección por el VZIK podría explicar algunos hallazgos clínicos genitourinarios y alteración en parámetros seminales evidenciados en ciertos individuos infectados, como hematospermia,21,81,86,87 disuria,12 dolor perineal,21 dolor testicular,88 eyaculación dolorosa,14 secreción peneana,14 oligospermia81 y disminución en el conteo total y movilidad de espermatozoides.84
Las implicaciones de la infección persistente en el TRM y en la fertilidad aún no se conocen muy bien. Sin embargo, los hallazgos clínicos y de laboratorio sugieren que hay un daño importante en el tracto urogenital. En ese sentido, algunos estudios en modelos murinos reportaron alteraciones significativas como la atrofia testicular progresiva y reducción de la testosterona sérica en ratones IFNAR1 -/- ,26 orquitis y epididimitis,25 lo que sugiere posibles consecuencias en la fertilidad humana.26 Además, la infección persistente con la cepa africana del VZIK se ha vinculado con una pérdida de la integridad de la BHT, consecuencia de la respuesta inflamatoria ocasionada por los macrófagos intersticiales.24
Las alteraciones en el perfil hormonal también han sido documentadas tanto en estudios humanos como en modelos murinos. Dichos estudios reportan que la infección por el VZIK resulta en una disminución de los niveles de testosterona e inhibina B, y en un aumento de la hormona luteinizante, lo cual se relaciona con un detrimento de las células de Leydig y de Sertoli,24,26,85 que podría tener efectos nocivos en la esteroidogénesis y espermatogénesis.
Discusión
La detección en el semen humano de los arbovirus emergentes y reemergentes como el VZIK y VCHIK resalta el papel de la transmisión sexual de ambos virus. Hasta la fecha, la magnitud de las implicaciones del contagio por vía sexual es aún incierta, dadas las limitaciones que existen para determinar este tipo de transmisión en las zonas epidémicas de ambos virus, por lo que puede ser subestimado el número de casos resultantes por tal ruta de infección. Adicionalmente, la cantidad de viriones en el semen no parece ser una cantidad que explique o sostenga los brotes por el VZIK y el VCHIK, por lo que la transmisión vectorial sigue siendo la de mayor relevancia en áreas endémicas; mientras que en las zonas no endémicas pueden representar una ruta importante de transmisión.
La evidencia del VZIK en el aparato genitourinario masculino, concretamente en el testículo, se puede asociar con diversas alteraciones estructurales y funcionales relacionadas con el tropismo del virus por el TRM. Común a diversos estudios, se ha observado que la susceptibilidad a la infección por el VZIK es específica del tipo celular, y el daño ocasionado en las células de Sertoli, células de Leydig, espermatogonias y demás células testiculares que pueden ser infectadas y afectadas en los túbulos seminíferos, conduce a la principal complicación que es sinónimo de preocupación en hombres en edad fértil, la disfunción espermática. Si bien los testículos son considerados un sitio inmunoprivilegiado por sus propiedades tolerogénicas que protegen a las células germinales autoantigénicas de una respuesta inmunitaria perjudicial, es precisamente la respuesta inmunitaria que se establece frente a la infección la que determina si el virus es aclarado o persiste en el tejido testicular.
No obstante, factores diferentes a la infección misma también pueden influenciar el perfil de inmunotolerancia normal de cada individuo en el testículo, incluyendo medicamentos de uso común en la población que afectan la espermatogénesis como analgésicos, antibióticos, antidepresivos, antihipertensivos y agentes antiinflamatorios.89 Por tanto, en hombres en quienes no se pudo obtener el historial médico completo, es difícil establecer si el deterioro de la función espermática en los reportes de la infección por el VZIK es producto de la patogenia del virus, o existen otros elementos causantes del detrimento.
En individuos virémicos, se ha sugerido que los títulos del VZIK infeccioso son mayormente elevados en los tejidos reproductivos, considerando los altos niveles de ARN viral reportados en el semen, comparado con los niveles encontrados en el suero.83 De ser así, las partículas virales infecciosas presentes en el semen pueden ser transportadas al tracto reproductivo femenino, ocasionando la transmisión del virus.90 En contraste, Müller y otros91 reportaron que el eyaculado fresco es un inhibidor potente de la infección por el VZIK en la región anogenital. Según los investigadores, dicho efecto se podría explicar por factores solubles en el líquido seminal que inhiben la etapa inicial del ciclo de replicación viral. Un posible mecanismo podría ser el descrito por Wang y otros, quienes notificaron que las vesículas extracelulares presentes en el semen se podrían fusionar con el virus y alterar su integridad, afectando así fases iniciales de la infección.92
La capacidad del VCHIK de resistir a los factores inhibidores presentes en el semen y ser transmitido por vía sexual en regiones donde no hay presencia de mosquitos, aún sigue siendo una gran interrogante. Aunque se ha detectado la diseminación del VCHIK al semen en individuos infectados, hasta el momento no se ha determinado qué tipos celulares son portadores del VCHIK ni cuál es el mecanismo fisiopatológico potencial de la infección en el TRM. Con un solo caso reportado,33 es difícil establecer de manera precisa una asociación entre la detección del virus por RT-PCR en la orina y el semen con la patogenia del virus per se; quizás otros factores que pudieron haber contribuido a la infección persistente son la coinfección por el virus dengue (DENV) tipo 3 y el uso de prednisona a partir del segundo día de aparición de los síntomas. En efecto, recientemente se reportó la transmisión sexual del DENV, en ausencia de otra explicación plausible.93
Las recomendaciones generales promovidas en el 2016 por la Organización Mundial de la Salud94 para la prevención de la transmisión sexual del VZIK de hombres a mujeres en edad fértil se basan en la abstinencia y la protección con preservativo en parejas sexualmente activas y que residan en regiones endémicas. En el caso de hombres y mujeres que no residan en tales áreas, pero regresan de zonas donde se ha demostrado transmisión del VZIK, la recomendación se extiende a un periodo de al menos 6 meses. Sin embargo, esas recomendaciones deben ser actualizadas sobre la base de la nueva evidencia referente a la fisiopatología de la infección por el VZIK en los testículos y la cinética de propagación. Esto permitirá definir de manera óptima la duración de tales recomendaciones y establecer pautas de control en áreas epidémicas y no epidémicas de la infección, incrementando la vigilancia clínica y epidemiológica de la infección en el TRM.
Igualmente, se debería hacer un tamizaje para el VZIK en hombres que consulten por problemas de fertilidad y recomendar hacer detección del virus en el semen de hombres donadores de esperma que hayan presentado infección clínica o confirmada por el VZIK, o una exposición potencial significativa al virus. En tales casos, el diagnóstico se debería hacer por RT-PCR para detectar la presencia de genoma viral. Tanto las personas sintomáticas como asintomáticas que regresan de áreas con transmisión continua del VZIK transmitida por vectores deberían someterse a ese tipo de pruebas. En lo que respecta al VCHIK, a pesar de que teóricamente podría tener la capacidad de transmitirse sexualmente, no es apropiado dar las mismas recomendaciones por cuanto no se ha estudiado su comportamiento en el semen.
Conclusiones
La infección persistente evidenciada tanto para el VZIK como para el VCHIK en el semen no solo se podría asociar con la transmisión sexual del virus por largos periodos, sino también, con la alteración en la producción y calidad de los espermatozoides, con consecuencias clínicas graves en la salud sexual y reproductiva de los hombres infectados. La evidencia actual de la interacción del VZIK con los tejidos del TRM proviene esencialmente de modelos animales, específicamente, de ratones inmunosuprimidos y cultivos celulares, que permiten estudiar los efectos nocivos sobre la función testicular y los parámetros espermáticos. El aumento en los reportes de caso de la fiebre del Zika ocurridos a través del contagio por la ruta sexual conduce a la necesidad de abordar la prevención de la infección no solo desde su control vectorial, sino además desde el control de la transmisión sexual. Debido a que la transmisión del VZIK por esta ruta ocurre independientemente de las fases de instauración de los síntomas, y las diferencias en la dinámica sexual de cada pareja pueden afectar la transmisión de la infección a través de la actividad sexual, es importante promover sistemáticamente la adopción de prácticas sexuales seguras.
Finalmente, es primordial la comprensión exhaustiva de ambas infecciones para construir abordajes integrales y actualizar las recomendaciones propuestas por el Centro para el Control y la Prevención de Enfermedades (CDC) y la OMS para la prevención del contagio vía contacto sexual. Además, se debería encaminar a la incorporación de nuevas políticas de salud pública como el desarrollo de vacunas de alta eficacia con inmunidad protectora a largo plazo, que en áreas endémicas podrían ser superiores frente a otras intervenciones en controlar los brotes del VZIK y reducir significativamente la prevalencia de la infección.















