Introducción
La Sociedad Americana de Enfermedades Infecciosas considera a Acinetobacter spp. como una de las seis especies más importantes de microorganismos multirresistentes en el mundo.1
Este microorganismo causa un amplio espectro de infecciones, como la neumonía asociada a la ventilación, bacteriemia, infecciones relacionadas con catéteres intravasculares e infecciones del sitio quirúrgico y quemaduras, entre las más importantes.2
Los pacientes hospitalizados son los que más se afectan por este patógeno, sobre todo los sometidos a cirugía o procederes invasivos, con uso de antibióticos de amplio espectro e ingresos prolongados, principalmente en unidades de cuidados intensivos (UCI).3) Por ello, en nuestros días Acinetobacter spp. constituye un verdadero paradigma de las infecciones asociadas a la asistencia sanitaria a nivel mundial.
La diseminación intra- e interhospitalaria y la emergencia de aislados multidrogorresistentes se favorece por la habilidad que posee esta bacteria de adquirir diversos mecanismos de resistencia y su dotación de múltiples mecanismos de supervivencia en una variedad de entornos.3,4,5
Sin embargo, datos aportados en un informe resumido de la Red Latinoamericana de Vigilancia de la Resistencia a los Antimicrobianos (ReLAVRA) muestran una alta frecuencia de Acinetobacter baumannii resistente a carbapenémicos, tratamiento de elección frente a infecciones graves por este microorganismo.6
Todo esto constituye un grave problema de salud, pues la circulación de clones del complejo ABC pandrogorresistentes (PDR) o extremodrogorresistentes (XDR) limita en gran medida las alternativas terapéuticas eficaces.3
En Cuba, estudios puntuales y resultados de la vigilancia nacional frente a este patógeno notifican una alta frecuencia de infecciones graves causadas por este género, principalmente por el complejo ABC.7
Teniendo en cuenta lo antes citado, es necesario mantener la vigilancia de este patógeno con el fin de detectar nuevos fenotipos y corroborar la presencia de clones multidrogorresistentes. Por eso, este estudio se propuso caracterizar los aislamientos de Acinetobacter obtenidos de pacientes ingresados en hospitales cubanos.
Métodos
Se realizó un estudio retrospectivo en el Laboratorio de Infecciones Asociadas a la Asistencia Sanitaria del Instituto de Medicina Tropical Pedro Kourí, que incluyó 278 aislados (solo un aislado por paciente) pertenecientes a la colección de cultivos de dicho laboratorio y procedentes de 21 hospitales del país, distribuidos en nueve provincias (Pinar del Río, La Habana, Matanzas, Cienfuegos, Ciego de Ávila, Camagüey, Holguín, Santiago de Cuba y Guantánamo). Estos fueron recuperados de diferentes muestras clínicas y conservados durante el periodo de junio de 2011 a julio de 2012.
Criterios de inclusión: Se seleccionaron los aislados viables en los que se corroboró que pertenecían al género Acinetobacter y que se acompañaban del modelo de recolección de datos.
Criterios de exclusión: Se excluyeron los aislados que resultaron contaminados y los que se identificaron como Grupo NO-1, por tratarse de una especie no causante de infección clínica en el humano.
Operacionalización de variables
Especies de Acinetobacter: se incluyeron el complejo Acinetobacter baumannii-calcoaceticus (ABC), A. haemolyticus, A. jonhsonii, A. junnii y A. lwoffi.
Tipo de muestra clínica: secreción endotraqueal, catéter, exudado de lesión, sangre, secreción del sitio quirúrgico, líquido cefalorraquídeo, esputo, loquios y orina.
Tipo de servicio hospitalario: Cirugía, Unidad de Cuidados Intensivos, Caumatología, Medicina, Hematología y otros (Hemodiálisis, Miscelánea, Nefrología, Neonatología, Neurología, Ortopedia, Puerperio y Respiratorio).
Categorías clínicas de pruebas de susceptibilidad:
Sensible: aislamiento bacteriano que se inhibe in vitro por una concentración de un antimicrobiano que se asocia a una alta probabilidad con el éxito terapéutico.
Resistente: aislamiento bacteriano que no se inhibe in vitro por una concentración de un antimicrobiano que se asocia a una alta probabilidad de fracaso terapéutico.
Categorización de la multirresistencia:8
Multidrogorresistencia: cuando una cepa bacteriana no es susceptible a uno o más agentes antimicrobianos en tres o más categorías antimicrobianas.
Extremodrogorresistente: cuando una cepa no es susceptible a uno o más agentes en todas las categorías, excepto en una o dos de ellas.
Pandrogorresistente: cuando una cepa no es susceptible a ninguno de los agentes antimicrobianos en todas las categorías antimicrobianas existentes.
Confirmación de género e identificación de las especies: se realizó mediante pruebas bioquímicas por métodos convencionales.9 Para confirmar la identificación se empleó el sistema comercial API 20 NE (BioMérieux, Francia) para bacilos gramnegativos no fermentadores.
Determinación de la susceptibilidad a los antimicrobianos: se aplicaron los métodos recomendados por el Instituto de Estandarización de Laboratorio Clínico del 2019 de los Estados Unidos de América.10 El método de E-test para la colistina (0,016 µg-256 µg) y el método de difusión por disco (Bauer-Kirby) en agar Mueller-Hinton (Biolife, Italy) para el resto de los antimicrobianos: piperacilina (100 µg), piperacilina/tazobactan (100/10 µg), ticarcilina/ácido clavulánico 85 µg, ceftazidima (30 µg), cefotaxima (30 µg), ceftriaxona (30 µg), imipenem (10 µg), meropenem (10 µg), aztreonam (30 µg), gentamicina (10 µg), amikacina (30 µg), ciprofloxacino (5 µg), levofloxacino (5 µg), tetraciclina (30 µg), doxiciclina (30 µg) y trimetoprim/sulfametoxazol (1,25/23,75 µg). La rifampicina (5 µg) se evaluó según los criterios del Comité de Antibiograma de la Sociedad Francesa de Microbiología.11
Todos los antimicrobianos fueron suministrados por Liofilchem (Italia), excepto la colistina que fue suministrada por BioMérieux (Francia).
Para el control de calidad de los antimicrobianos se utilizaron cepas de referencia con valores conocidos de susceptibilidad, como Escherichia coli ATCC 25922, Escherichia coli ATCC 35218 (para discos con inhibidores de betalactamasas) y Pseudomonas aeruginosa 27853.
Recolección y análisis de datos: los datos clínico-microbiológicos de los aislamientos de Acinetobacter spp. se obtuvieron de la base de datos disponible en el LN-IAAS del IPK. Estos se procesaron mediante los programas Microsoft Excel 2010 y Microsoft Access 2010 y se organizaron en tablas y figuras. Se utilizó el porcentaje como medida de estadística descriptiva para el análisis, interpretación y presentación de los resultados.
Aspectos éticos: la investigación fue evaluada y aprobada por la Comisión Científica Especializada de Microbiología y el Comité de Ética del IPK.
Resultados
Se identificaron cinco especies del género Acinetobacter causantes de infecciones graves. El complejo ABC constituyó la especie predominante con el 95,3 %. En menor proporción se identificaron A. haemolyticus (2,2 %), A. lwoffi (1,1 %), A. junnii (1,1 %) y A. johnsonii (0,3 %).
En relación con el tipo de muestra, la mayoría de los aislados se obtuvo de secreción endotraqueal (42,4 %) y sangre (27,7 %), seguidas por punta de catéter, lesiones de piel y del sitio quirúrgico (Fig. 1).
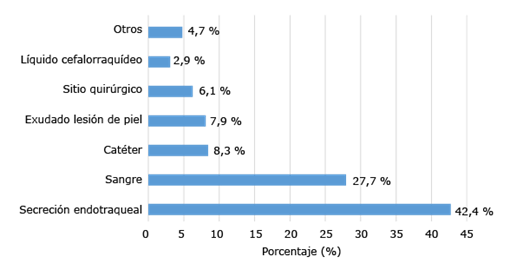
Fuente: Base de datos del LNR-IAAS. IPK, 2020-2021.
Fig. 1 -Distribución de los aislamientos de Acinetobacter spp., según el tipo de muestra.
Los servicios hospitalarios que mayor número de aislados aportaron fueron las UCI (74,5 %) y el Servicio de Caumatología (7,2 %) (Fig. 2).
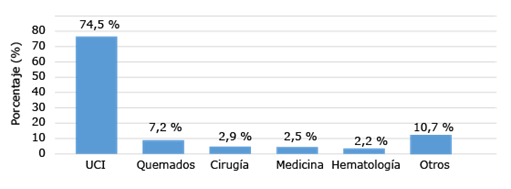
Fuente: Base de datos del LNR-IAAS. IPK, 2020-2021.
Fig. 2 -Distribución de los aislamientos de Acinetobacter spp., según el tipo de servicio hospitalario de procedencia (n = 278).
Se hallaron altos niveles de resistencia frente a los betalactámicos, entre el 76 % y el 94 % así como para los aminoglucósidos, entre 66 % y 80 %, las quinolonas, entre 60 % y 89 %, la rifampicina, con 65 % y el trimetropim-sulfametoxasol, con 56 %. La colistina, con 0,3 %, doxiciclina, con 4,5 % y la tetraciclina, con 8 % mostraron mayor actividad in vitro al presentar los porcentajes más bajos de resistencia (Tabla).
Tabla -Porcentajes de resistencia de los aislamientos de Acinetobacter spp.
| Grupo antimicrobiano | Medicamento antimicrobiano | Resistencia (%) |
|---|---|---|
| Betalactámico | Piperacilina1 | 83 |
| Piperacilina/tazobactan2 | 88 | |
| Ticarcilina/ ácido clavulánico2 | 86 | |
| Ceftazidima3 | 91 | |
| Ceftriaxona3 | 94 | |
| Cefotaxima3 | 83 | |
| Imipenem4 | 76 | |
| Meropenem4 | 81 | |
| Monobactámico | Aztreonam | 98 |
| Aminoglucósidos | Amikacina | 66 |
| Gentamicina | 80 | |
| Tetraciclina | Tetraciclina | 8,0 |
| Doxiciclina | 4,5 | |
| Quinolonas | Ciprofloxacino | 89 |
| Levofloxacino | 60 | |
| Inhibidor de la síntesis de los folatos | Trimetropim-sulfametoxasol | 56 |
| Rifampicina | Rifampicina | 65 |
| Polimixinas | Colistina | 0,3 |
1Penicilinas; 2inhibidores de la betalactamasa; 3cefalosporinas; 4carbapenémicos.
Fuente: Base de datos del LN-IAAS. IPK, 2020-2021.
Del total de aislados, el 91 % mostró resistencia a al menos un agente antimicrobiano en tres o más categorías antimicrobianas. De estos, el 73,5 % presentó multidrogorresistencia y el 26,1 % extremodrogorresistencia. Se detectó además la presencia de un aislado pandrogorresistente (0,4 %). Estos procedían mayoritariamente de sangre y secreciones endotraqueales de pacientes hospitalizados en la UCI.
Discusión
A la par de lo que describen autores internacionales, en el presente estudio el complejo ABC constituyó la especie dentro del género con mayor implicación clínica en pacientes con infecciones graves en hospitales cubanos.12 La formación de biopelículas es un factor clave de virulencia que permite a este microorganismo colonizar y persistir en las superficies bióticas y abióticas, causando infecciones asociadas con dispositivos médicos permanentes. Estudios recientes han demostrado que las especies del complejo de ABC son tres veces más propensas a formar biopelículas en una interfaz líquido-sólido que otras especies del género.13 Aunque otras especies de este género se asocian con menos frecuencia a infecciones en humanos, cada día son más los autores que reportan infecciones graves causadas por estas.14,15 En el presente estudio estas especies (A. haemolitycus, A. jonhsonii, A. junnii y A. lwoffi) fueron causantes de infecciones graves como neumonía, septicemia e infección de heridas quirúrgicas.
El complejo ABC, convertido en las dos últimas décadas en un agente patógeno potencial a nivel mundial, provoca infecciones a todos los niveles en el hombre, pero numerosos investigadores lo reportan con frecuencia en neumonía asociada a la ventilación mecánica (NAVM) y bacteriemias primarias.3,5
En Asia y algunos países de Latinoamérica, Acinetobacter es uno de los tres microorganismos más frecuentes causantes de bacteriemia y neumonía intrahospitalaria.13 En un estudio realizado por Lisboa en Brasil notifica el tracto respiratorio y la sangre como los sitios más afectados por dicho patógeno.16Medell y otros en investigación realizada en Cuba notifican que este fue el patógeno preponderante en pacientes con neumonía asociada a la ventilación mecánica (NAVM).17) Por esta razón, los principales sitios de aislamiento de este microorganismo son las muestras del tracto respiratorio inferior y la sangre. Los resultados del presente estudio concuerdan con esto último.
El complejo ABC es un patógeno que afecta en su mayoría a pacientes hospitalizados en la UCI.18 La presente investigación corroboró este hecho, dado que la mayoría de los aislados eran procedentes de este servicio sin dejar de tener en cuenta el Servicio de Caumatología. En Cuba, este último se considera un servicio cerrado por las características de los pacientes que se hospitalizan allí. La gravedad de las lesiones que estos pacientes presentan dada la agresión que sufre la más importante barrera natural del organismo (piel y mucosas) implica el uso de antibióticos de amplio espectro y de procedimientos invasivos. Esto los clasifica como inmunodeprimidos y los hacen especialmente vulnerables a padecer infecciones. Gupta y otros en un estudio realizado en la India (2015) reportan que la UCI fue el servicio hospitalario donde se obtuvo la mayoría de los aislados de Acinetobacter con predominio del complejo ABC. Por demás, fue en este servicio donde se exhibieron los porcentajes más altos de resistencia y donde se demostró además la presencia de una combinación de mecanismos complejos de resistencia.19
Las pruebas de susceptibilidad a los antimicrobianos son una de las tareas de mayor impacto del laboratorio de microbiología en cuanto al manejo del paciente. La información que estas generan son fundamentales para conocer las tendencias en la resistencia en microorganismos de relevancia clínica y para definir la política de utilización de antimicrobianos. La rápida emergencia global de cepas del complejo ABC resistentes demuestra la habilidad de este microorganismo para responder a los cambios bajo presión ambiental selectiva. La regulación positiva de los mecanismos de resistencia innatos y adquiridos hace de este patógeno una gran amenaza para la salud humana.20,21
En la presente investigación se observaron elevados porcentajes de resistencia frente a los betalactámicos, grupo farmacológico donde se encuentra la terapia de elección frente a este patógeno (carbapenémicos), así como para el resto de los antimicrobianos evaluados, con excepción de las tetraciclinas y la colistina.
En el caso de las cefalosporinas estudiadas en la presente investigación, fue la ceftriaxona la droga menos activa; no obstante, la ceftazidima y cefotaxima exhibieron altos valores de resistencia. Los aislados estudiados mostraron una elevada resistencia también frente a piperacilina-tazobactam.
Esto concuerda con un estudio realizado por Casellas en Argentina donde analizó las resistencias emergentes más frecuentes y destacó que A. baumannii presentaba un 80 % de resistencia a aminopenicilinas, piperacilina/tazobactam y cefalosporinas de tercera generación.22
En un estudio realizado en Cuba en el Hospital Comandante Manuel Fajardo Rivero donde se testaron 280 aislados del complejo ABC se notificaron también altos porcentajes de resistencia frente a ceftazidima y cefotaxima.23
En el caso del aztreonam, a pesar de que el CLSI no recomienda testarlo para Acinetobacter sp., consideramos hacerlo en nuestro estudio dado que la primera NDM reportada en Cuba fue en una especie de este género24) y se conoce que este antimicrobiano es activo y considerado tratamiento de elección frente a microorganismos con este tipo de enzimas, en combinación terapéutica con otros antimicrobianos.25 Desafortunadamente la resistencia frente a este antimicrobiano en el presente estudio fue alta, lo que impone la necesidad de buscar otros mecanismos de resistencia asociados.
Este incremento de la resistencia de aislamientos del complejo ABC a los betalactámicos y dentro de estos a los carbapenémicos provoca en la actualidad graves inconvenientes en la terapéutica hospitalaria habitual. Los resultados de la presente investigación concuerdan con numerosos autores, como Principe en Italia y Novovic en Serbia, quienes encontraron un 100 % de resistencia a carbapenémicos en sus aislamientos.26,27 Otro estudio realizado en China en pacientes pediátricos con NAVM notifica que el 100 % de los aislamientos eran resistentes a carbapenémicos.28
Desde el año 2006, en Cuba se han realizado algunos estudios que alertan acerca de la resistencia creciente de Acinetobacter spp. a carbapenémicos, principalmente en las UCI.29) En un estudio realizado en una UCI en Cienfuegos en el periodo 2007-2009, Pérez encontró niveles muy elevados de resistencia a meropenem.30) Por otra parte, en el Hospital Hermanos Ameijeiras, Espinosa y Hart, en dos investigaciones realizados en los años 2008 y 2010, respectivamente, observaron un marcado incremento de la resistencia a meropenem.31,32Medell y otros en la misma institución en el 2011, en un estudio realizado a pacientes con NAVM reportó altos niveles de resistencia para este grupo farmacológico.17) La elevada resistencia frente a meropenem encontrada en el presente estudio pudiera deberse a la presencia de oxacilinasas, mecanismo de resistencia más frecuente en este género. No obstante, no se debe descartar la disminución de la permeabilidad de la membrana externa por pérdida o reducción de la expresión de porinas y la sobreexpresión de bombas de eflujo A de ABC como otro de los mecanismos implicados en dicha resistencia.18) De ahí la importancia de la implementación de estudios genotípicos que permitan dilucidar mecanismos de resistencia frente a estos antimicrobianos que constituyen tratamiento de elección.
Los resultados de la vigilancia nacional del Laboratorio de Infecciones Asociadas a la Asistencia Sanitaria del IPK ratifican que la resistencia a carbapenémicos en el complejo ABC es un fenómeno que afecta a diferentes instituciones y evidencia que es un problema de salud en Cuba.7
Cuando fallan los mecanismos de control higiénico-epidemiológicos se tiende al incremento y a la diseminación de este patógeno de áreas de mayor resistencia a otras de menor resistencia. De ahí la importancia del reforzamiento de las medidas de control higiénico-epidemiológico, así como del monitoreo sistemático y vigilancia de la resistencia de este patógeno en cada institución hospitalaria.
En el caso de los aminoglucósidos, en la presente investigación se estudiaron la gentamicina y amikacina. Para ambos, se confirmó altos niveles de resistencia. En estudios realizados en Cuba en el Hospital Hermanos Ameijeiras, por Espinosa y Hart, así como en el Hospital Comandante Manuel Fajardo Rivero, por Aguilera y otros, los aislados estudiados mostraron también muy baja sensibilidad frente a estas drogas.23,31,32) De ahí que sea imprescindible vigilar la resistencia de este patógeno frente a este grupo de antimicrobianos, sobre todo si tenemos en cuenta su transferencia plasmídica y la emergencia y circulación de complejos clonales portadores de genes que codifican para la producción de enzimas que confieren a este microorganismo altos niveles de resistencia frente a carbapenémicos y aminoglucósidos simultáneamente.33 La tasa de resistencia frente a amikacina obtenida en el presente estudio concuerda con lo reportado a nivel mundial.12 Esto es de suma importancia si tenemos en cuenta que es la amikacina el antibiótico que más se usa en combinación terapéutica con meropenem.
Los aislados también mostraron una resistencia elevada a las quinolonas, lo que concuerda con datos internacionales que reportan un incremento de esta en aislados clínicos.16,26 En el estudio realizado en el 2019 por Aguilera y otros en nuestro país la tasa de resistencia reportada frente a ciprofloxacino (59,6 %) fue elevada,23 aunque el presente estudio la superó. Respecto al trimetoprim-sulfametoxasol, los aislados en estudio no mostraron un porcentaje elevado de resistencia frente a este antimicrobiano, sin embargo, se debe señalar una tendencia al incremento.
Para la rifampicina los niveles de resistencia en el presente estudio fueron altos. Es importante señalar que en el 2013 el National Committee for Clinical Laboratory Standars (NCCLS) reportó la resistencia intrínseca de este antimicrobiano en bacilos gramnegativos no fermentadores.34
Sin embargo, un ensayo clínico aleatorizado realizado por Durante-Mangoni en Italia mostró una tasa de erradicación microbiológica significativamente mayor en el grupo donde se combinó colistina-rifampicina respecto al grupo donde se utilizó colistina como monoterapia.35 Además, estudios realizados muestran que el uso de terapia combinada de tigeciclina o colistina + rifampicina ± tobramicina o amikacina en infecciones graves bacteriémicas y no bacteriémicas, se asocian de manera significativa con mayor porcentaje de curaciones que el grupo de tratamiento con monoterapia.36
Esto denota la importancia de su evaluación como alternativa frente a aislados XDR sin dejar de tener en cuenta que no se debe combinar de manera rutinaria en la práctica clínica, ya que en Cuba esta es una droga reservada para el tratamiento de pacientes tuberculosos y su uso podría generar resistencia y limitar las alternativas terapéuticas frente a esta enfermedad.
La colistina y las tetraciclinas constituyeron los medicamentos antimicrobianos más activos en la presente investigación. En el caso de las tetraciclinas, los resultados del presente estudio concuerdan con lo reportado por Lisboa en Brasil y Azimi en Irán, que notificaron buenas tasas de susceptibilidad en los aislados resistentes, incluso a carbapenémicos.16,37
Por otra parte, los resultados de la vigilancia nacional corroboran la eficacia in vitro de este grupo de antimicrobianos frente a aislamientos multidrogorresistentes.7
En cuanto a la colistina, los resultados de la presente investigación son congruentes con los de Principe en Italia, que notifica un 100 % de susceptibilidad frente a aislamientos resistentes a carbapenémicos.26) Este resultado es de suma importancia, pues la colistina puede constituir un medicamento de elección en el tratamiento de infecciones graves. En este sentido, un estudio realizado en Cuba en el Hospital Hermanos Ameijeiras se notificó cifras bajas de resistencia a colistina (2 %).31 Además, como resultado de la vigilancia nacional, Quiñones informó cifras de resistencia a colistina menores del 5 %.7 A pesar de este bajo porcentaje, es necesario estrechar la vigilancia sobre este antibiótico, único disponible en el país para enfrentar las infecciones producidas por aislamientos resistentes a carbapenémicos.
Los porcentajes de multidrogorresistencia y extremodrogorresistencia de Acinetobacter observadas en el presente estudio revelan que Cuba no escapa a la realidad mundial, donde este fenómeno es cada vez mayor y requiere la acción urgente ante la posibilidad de brotes epidémicos en nuestros hospitales, así como replantearse las alternativas terapéuticas en estos casos. La situación resulta alarmante, pues demuestra la circulación de cepas resistentes a los carbapenémicos, lo que solo deja como alternativa terapeútica a la colistina y tigeciclina. Esto resulta un problema, dado que la tigeciclina no forma parte del Cuadro Básico de Medicamentos de Cuba. Es importante señalar que en el presente estudio se detectó un aislado pandrogorresistente correspondiente al complejo ABC, lo que constituye un hallazgo importante, ya que para esta no existen alternativas terapéuticas en Cuba, por lo que se evidencia la necesidad del monitoreo sistemático de la susceptibilidad a la colistina en los laboratorios de microbiología de los hospitales de la red para una notificación inmediata.
Recientemente se han aprobado nuevas metodologías confiables y factibles para laboratorios de microbiología clínica como: Predifusión con Tabletas COL, COL-Agar Spot, COL-TEST, Elución Discos de COL, Rapid Polymyxin NP test38) y el COL-DROP TEST,39 cuya implementación permitiría lo expuesto anteriormente. Es importante señalar que, dada la disponibilidad de recursos, son el primero y el último los más factibles a utilizar en la red de laboratorios de nuestro país.
La principal limitación de este estudio fue la imposibilidad de evaluar la resistencia a la tigeciclina. Conocer cómo se comportan los aislados de este microorganismo frente a este antimicrobiano sería muy útil, teniendo en cuenta las limitadas opciones terapéuticas existentes.
La presente investigación evidencia el impacto clínico del género Acinetobacter y dentro de este, del complejo ABC, al causar infecciones graves asociadas a una extremodrogorresistencia marcada, lo que constituye un grave problema desde el punto de vista terapéutico en hospitales cubanos. Por esto, es sumamente necesario continuar la vigilancia clínica, epidemiológica y microbiológica de este género en aras de minimizar la morbilidad y mortalidad por este patógeno, así como evitar la ocurrencia de brotes nosocomiales que constituyan endemias, el uso indiscriminado de antimicrobianos y mayores gastos económicos.
Conclusiones
Los aislados de Acinetobacter spp. estudiados mostraron alta resistencia a la mayoría de los medicamentos antimicrobianos disponibles, por lo que constituyen un serio problema de salud en hospitales cubanos. La marcada resistencia de este patógeno revela la necesidad de un monitoreo continuo de su susceptibilidad, además del reforzamiento de las medidas de control en dichos hospitales, principalmente en las unidades de cuidados intensivos.















