Introducción
El 31 de diciembre de 2019 la Comisión Municipal de Salud de Wuhan, en la provincia china de Hubei, reportó un conjunto de pacientes con una neumonía de causa desconocida. En los primeros días de enero de 2020 se identificó que el agente causal era un nuevo coronavirus.1 Aunque aún se mantiene en discusión el origen del virus, se conoce que comparte un 96 % de similitud con los coronavirus de murciélagos y se determinó que pertenece a la especie SARS-CoV.2 El Comité Internacional de Taxonomía de Virus lo nombró como SARS-CoV-2 y la enfermedad que provoca se denominó COVID-19.3 Esta es una enfermedad respiratoria que se puede presentar desde la forma clínica asintomática hasta el síndrome respiratorio agudo severo y provocar la muerte. El SARS-CoV-2 se transmite principalmente mediante el contacto directo con una persona infectada o mediante la transmisión indirecta a través de superficies y objetos contaminados.4
El 11 de marzo de 2020 la Organización Mundial de la Salud (OMS, Reporte 51)5 informó 4620 nuevos casos de pacientes infectados por el SARS-CoV-2 a nivel mundial y 280 fallecidos, para un total de 118 319 casos positivos y 4292 muertes por esta enfermedad. Además, se habían detectado casos positivos en más de 110 países que abarcaban todos los continentes. La rápida diseminación del virus y el aumento del número de casos provocaron una situación crítica de salud, por lo que la OMS la declaró pandemia.6
La secuenciación del genoma se realizó en las primeras semanas y la información se hizo pública con el objetivo de que la comunidad científica contribuyera en el desarrollo de estrategias de diagnóstico y en el diseño de candidatos vacunales.7 La reacción en cadena de la polimerasa con reverso transcripción (RT-PCR, del inglés reverse transcription - polymerase chain reaction) en tiempo real se considera la técnica de referencia para el diagnóstico molecular de la COVID-19.8 El 23 de enero de 2020 se dio a conocer el primer protocolo de RT-PCR para el diagnóstico de COVID-19, este detectaba la presencia del virus a través de la amplificación de los genes relacionados con la nucleocápside (N), la RNA polimerasa RNA dependiente (RdRp) y la envoltura viral (E).9 Actualmente existen en el mercado un conjunto de estuches comerciales para la detección del virus por esta técnica.10,11
Los primeros casos de COVID-19 en Cuba se informaron el 11 de marzo de 2020 y se trató de turistas italianos procedentes de la región de Lombardía, Italia.12 Desde los primeros días de enero, se elaboró un Plan Nacional de enfrentamiento a la enfermedad, lo que permitió planificar las estrategias clínicas y epidemiológicas con un componente intersectorial e interdisciplinario.13 El ascenso en los casos positivos requirió el aumento de las capacidades de diagnóstico, por esta razón se comenzó a implementar y desarrollar laboratorios de biología molecular dedicados al diagnóstico molecular de la COVID-19 en diferentes instituciones, creándose una red de laboratorios, de este tipo, en el país.
La Unidad Empresarial de Base (UEB) Laboratorios LIORAD perteneciente a la Empresa Farmacéutica Laboratorios AICA+ es productora de parenterales de pequeño volumen entre los que se encuentran: anestésicos, antibióticos, vitaminas, anticoagulantes, bloqueadores neuromusculares, estimulantes cardiacos y antiulcerosos.14,15 Además, se reconoce por los altos estándares de calidad y el cumplimiento de las buenas prácticas de producción.14 Sin embargo, no contaba con un laboratorio que pudiera incorporarse a la detección del SARS-CoV-2, a pesar de presentar un diseño adecuado de la instalación para realizar esta actividad. Las autoridades del Ministerio de Salud Pública aprobaron la implementación en la UEB de un laboratorio de biología molecular donde se inició el diagnóstico de la COVID-19 el 10 de septiembre de 2020.
Por ello, este trabajo se trazó como objetivo analizar la experiencia de un año de trabajo, en el diagnóstico molecular de la COVID-19, del Laboratorio de Biología Molecular de la UEB LIORAD.
Métodos
Para la puesta en marcha del laboratorio y la actividad de diagnóstico se desarrolló un conjunto de acciones, en las que se siguieron las Orientaciones sobre la bioseguridad en el laboratorio relacionada con la COVID-19 de la OMS.16 Estas estuvieron destinadas a la evaluación de los riesgos, establecimiento de las áreas y flujo de trabajo, formación de equipos de trabajo, capacitación del personal, documentación, limpieza y desinfección, control de la calidad y trazabilidad del proceso.
Evaluación de los riesgos
Se realizó una evaluación de los riesgos teniendo en cuenta las recomendaciones de la OMS.16,17 Para ello, se identificaron los peligros en cada una de las áreas. Se creó una matriz de probabilidad-consecuencia y se trazaron las medidas de mitigación de los riesgos.
Establecimiento de las áreas y flujo de trabajo
En el laboratorio se establecieron tres áreas de trabajo físicamente separadas: (1) Inactivación, (2) Mezcla y (3) Amplificación. Además, se instauró un área de recepción de muestras. Cada una de las áreas cumplió con los requisitos y la infraestructura requerida para desarrollar el trabajo con muestras infecciosas para el diagnóstico y fueron evaluadas por un comité de expertos del Instituto de Medicina Tropical Pedro Kourí y del Ministerio de Salud Pública. Se estableció un flujo de trabajo unidireccional para la actividad de diagnóstico.
Equipos de trabajo
Se organizaron cuatro equipos de trabajos integrados por técnicos y especialistas en el análisis físico-químico de las UEB Laboratorios LIORAD y UEB Laboratorios AICA, egresados de las carreras de Licenciatura en Microbiología, Farmacia, Bioquímica, Química, Técnicos Medios en Química y Técnicos en Laboratorio Clínico. Los equipos se completaron con estudiantes y profesores de las carreras de Microbiología y Virología, Bioquímica, Biología Molecular y Biología de la Facultad de Biología de la Universidad de La Habana.
Capacitación del personal
El personal se capacitó teniendo en cuenta los Procedimientos Normativos Operacionales para el trabajo en la Industria Farmacéutica del Departamento de Capacitación de la UEB Laboratorios LIORAD (Código PNO-SGC8-011, Edición 01). El sistema de capacitación estuvo dirigido a los temas de bioseguridad, procedimientos, análisis e interpretación de los resultados. Para la capacitación de bioseguridad en el Laboratorio de Microbiología, se aplicó la estrategia propuesta por Burguet y Campaña.18 En esta se hace uso de boletines temáticos, charlas y encuestas para evaluar el conocimiento. El plan de capacitación contempló tanto conferencias presenciales, no presenciales como actividades prácticas. El personal responsable de la limpieza y esterilización se capacitó teniendo en cuenta la nueva actividad a desarrollar. Las capacitaciones se impartieron por especialistas del Instituto de Medicina Tropical Pedro Kourí (IPK), el Centro de Ingeniería Genética y Biotecnología (CIGB), el Centro de Inmunología Molecular (CIM) y un profesor del Departamento de Microbiología y Virología de la Facultad de Biología de la Universidad de La Habana.
Documentación
Se elaboraron y aprobaron los Procedimientos Normalizados de Operación (PNO) e Instructivas. Además, se diseñaron nuevos registros para reflejar cada una de las actividades como parte del aseguramiento de la calidad, la trazabilidad del proceso y la validez de los resultados. Se actualizó el manual de bioseguridad del laboratorio.
Limpieza y esterilización
Se estableció un sistema de limpieza y esterilización. Se destinaron instrumentos de limpieza únicos para cada área. Se emplearon desinfectantes comerciales, además de soluciones de hipoclorito al 5 % y alcohol al 70 % (v/v). Se establecieron programas de esterilización y desinfección para el material limpio y los desechos, respectivamente.
Control de la calidad
Para el diagnóstico certero se establecieron diferentes controles de calidad durante el flujo de trabajo siguiendo las recomendaciones de la Organización Mundial de la Salud y la Organización Panamericana de la Salud.16,17,19 Estos quedaron explícitos en los procedimientos e instructivas de cada una de las áreas.
Resultados
Evaluación de los riesgos
La evaluación de los riesgos permitió identificar más de 20 riesgos relacionados con el trabajo con muestras infecciosas para el diagnóstico molecular del SARS-CoV-2. Se destacan la rotura o derrame de muestras potencialmente infecciosas o recipientes contaminados, la formación de aerosoles al destapar los viales después de la agitación y el uso incorrecto de los medios de protección personal. También se identificaron como riesgos la contaminación externa de las bolsas que protegen las muestras, el almacenamiento de muestras biológicas fuera del lugar establecido, la rotura de bolsas de desechos que contienen material contaminado y material genético, este último constituye un riesgo potencial para el diagnóstico certero, debido a que es una fuente de contaminación por material genético. Además, se establecieron más de 20 medidas para mitigar los riesgos las que se basaban principalmente en el estricto cumplimiento de los procedimientos e instructivas diseñados en cada una de las áreas.
Flujo de trabajo
El flujo de trabajo unidireccional que se estableció en el laboratorio, para el diagnóstico, se relaciona en la figura 1. Las muestras se reciben en el área de recepción donde, cumpliendo las medidas de bioseguridad, se chequean el estado y documentación de estas. Seguidamente se conservan a 4 °C hasta su procesamiento.
En el Área de Inactivación se lleva a cabo la lisis de la muestra a través del tampón de lisis (Sample Release Reagent, de Sansure Biotech) siguiendo las instrucciones del fabricante. En el Área de Mezcla se preparan todas las soluciones y la mezcla de reacción -que contiene los componentes de la reacción, excepto el material genético a amplificar-, necesarias para llevar a cabo la PCR. En el Área de Amplificación se adiciona a la mezcla una alícuota de la muestra lisada y se lleva a cabo la amplificación del material genético en el termociclador (SLAN-96P, Shanghai Hongshi Medical Technology Co. Ltd), siguiendo el programa indicado por el fabricante en el estuche comercial que se emplea. El laboratorio durante el año trabajó con diferentes estuches comerciales para realizar la RT-PCR en tiempo real, que tenía principalmente como dianas, el marco abierto de lectura (ORF del inglés, Open Reading Frames) específicamente el ORF1ab, el gen N de la nucleocápside y el gen E de la envoltura del virus. En cada área de trabajo se estableció un personal especializado en los procedimientos e instructivas.
Capacitación
Se impartieron un total de 23 capacitaciones las que se enumeran a continuación:
Buenas Prácticas Inicial en la Industria Farmacéutica.
Instrucción General Inicial de Seguridad y Salud en el Trabajo.
Instrucción Específica de Seguridad y Salud en el Trabajo. Medidas de seguridad. Área de Microbiología. PCR.
Medio Ambiente.
Normas ISO.
Seminario Bioseguridad para el trabajo con muestras infecciosas (SARS-CoV-2).
Buenas Prácticas de Limpieza en la Industria farmacéutica.
Análisis de Riesgo del Laboratorio de Biología Molecular.
Bioseguridad. Boletín temático.
Protocolo de trabajo con muestras biológicas para la detección de SARS-CoV-2 en ensayo PCR. INS-MB6-004.
Cambio de ropa para el área de Inactivación.
Lisis Manual INS-MB6-003.
Preparación de soluciones y de la mezcla de la PCR. INS-MB6-002.
Desarrollo del método de lisis manual para el diagnóstico molecular del SARS-CoV-2.
Medición de la PCR. INS-MB6-001.
Biología Molecular: Reacción en Cadena de la Polimerasa (PCR).
Dinámica de trabajo en el laboratorio para el diagnóstico del SARS-CoV-2 mediante la RT-PCR en tiempo real.
Modo de operación del termociclador SLAN-96. PNO-MB1-002.
Limpieza y desinfección. INS-MB3-003.
Regulación de Buenas Prácticas de Laboratorio para el Control de Medicamentos.
Diagnóstico del SARS-CoV-2 por RT-PCR en tiempo real: Análisis de los resultados.
Entrega de guardia del laboratorio de PCR-LIORAD. INS-MB11-007.
Recepción y traslado de muestras biológicas. INS-MB11-006.
Además, después de un año de trabajo se aplicaron un examen integral de conocimientos y uno relacionado con el puesto de trabajo donde el 100 % del personal del laboratorio de Biología Molecular obtuvo resultados excelentes. Las evidencias de estas actividades se reflejaron en los Registros de Capacitación de la UEB Laboratorios LIORAD, como parte del cumplimiento de Buenas Prácticas.
Documentación
Se elaboraron un total de ocho Procedimientos Normalizados de Operación e Instructivas para el diagnóstico molecular del SARS-CoV-2 mediante RT-PCR en tiempo real, los que se relacionan a continuación:
INS-MB11-007. Entrega de guardia del Laboratorio de PCR-LIORAD.
INS-MB6-001. Medición de la RT-PCR en tiempo real.
INS-MB6-002. Preparación de soluciones y de la mezcla de reacción de la RT-PCR en tiempo real.
INS-MB6-003. Lisis Manual.
INS-MB6-004. Protocolo de trabajo con muestras biológicas para la detección del SARS-CoV-2 mediante RT-PCR en tiempo real.
INS-MB11-006. Recepción y traslado de muestras biológicas.
PNO-MB1-002. Modo de operación del termociclador SLAN-96P (Shanghai Hongshi Medical Technology Co. Ltd.).
INS-MB3-003. Limpieza y desinfección de las áreas del Laboratorio de PCR.
Se elaboró un registro de recepción de muestras en el que se reflejó el número de muestras que recibe el laboratorio, procedencia, fecha, hora de entrada y la identificación de las personas que reciben y entregan, así como el número de muestras rechazadas y el criterio de rechazo. Además, se elaboró un registro para el trabajo con el termociclador donde se monitorea el uso del equipo y el personal responsable. Todos estos documentos se oficializaron por el sistema documental como parte del cumplimiento de las buenas prácticas de la empresa. El Laboratorio de Microbiología contaba con registros de uso del resto de los equipos y de acceso a cada una de las áreas.
Limpieza, esterilización y desinfección
El programa de desinfección de los puestos de trabajo se reflejó en las instructivas de cada área. Los gabinetes de seguridad biológica se desinfectaron con una solución de hipoclorito al 5 % (v/v) que se dejó actuar durante 10 min, posteriormente se aplicó alcohol al 70 % (v/v) para eliminar el hipoclorito y se aplicó luz ultravioleta de 15 a 30 mins. Los delantales, gradillas y bandejas se sumergieron en hipoclorito durante 30 min y posteriormente se lavaron con agua y se secaron en el horno. Los desechos biológicos se descontaminaron en la autoclave y posteriormente se incineraron.
Control de la calidad
Se establecieron varios controles de calidad: en el área de inactivación se incorporaron controles de agua (consistió en un vial con una alícuota de agua que se procesó como otra muestra infecciosa más) cada 25 muestras procesadas; un control de la mezcla de reacción (consistió en una alícuota de esta) que indicó la calidad y el trabajo en esta área; además, se emplearon los controles propios del estuche comercial (control positivo y negativo).
La trazabilidad del proceso se logró con el cumplimiento de las Buenas Prácticas de Documentación. Se dejaron registrados digitalmente todos los resultados del día, los que abarcaron las bases de datos con los resultados, informe del día, diseño de las placas y los gráficos de la PCR. Además, los resultados se actualizaron en la plataforma Monitor Epidemiológico (mipcr.sld.cu) del Ministerio de Salud Pública.
Resultados del Laboratorio de Biología Molecular
El laboratorio procesó en un año de trabajo un total de 125 154 muestras, desde el 10 de septiembre de 2020 hasta el 10 de septiembre de 2021 (Fig. 2). La capacidad de procesamiento inicial fue de 300 muestras y posteriormente aumentó a 500, aunque hubo días donde se procesaron más de 600 muestras. El laboratorio dio cobertura a la situación sanitaria del territorio, y además ofreció servicios a otras provincias al procesar muestras de Camagüey, Cienfuegos y Pinar del Río.
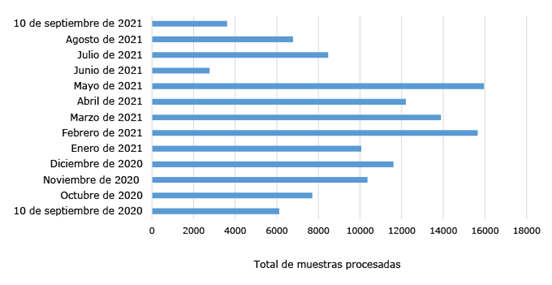
Fig. 2 Muestras procesadas, por meses, por el Laboratorio de Biología Molecular de la UEB LIORAD-AICA+ desde el 10 de septiembre de 2020 hasta el 31 de julio de 2021 para el diagnóstico molecular del SARS-CoV-2.
La actividad diagnóstica se evaluó por el IPK a través de paneles de competencia (proficiency panel, del inglés) y el análisis diario de una muestra negativa (seleccionada al azar) y todas las muestras positivas que se detectaron durante la jornada de trabajo. Los buenos resultados obtenidos en estas evaluaciones permitieron que, a partir de agosto de 2021, el laboratorio pasara a ser un laboratorio confirmatorio del diagnóstico.
Discusión
La implementación de un laboratorio de biología molecular destinado al diagnóstico del SARS-CoV-2 en una planta de genéricos permitió aumentar las capacidades de diagnóstico y un mejor manejo de la enfermedad en el país. La evaluación de los riesgos se considera el pilar de la práctica de la bioseguridad y constituye una de las primeras acciones que recomienda la OMS, antes de iniciar el trabajo en el laboratorio.16,17 Este constituye un proceso sistemático que permite obtener información relacionada con la probabilidad de ocurrencia del riesgo y las consecuencias de exposición. A su vez va a determinar el nivel de seguridad biológica que el laboratorio adopta y, por lo tanto, los procedimientos operativos estándar.
En el caso del trabajo con muestras infecciosas para el diagnóstico molecular por RT-PCR en tiempo real del SARS-CoV-2 se recomienda desarrollarlo en un nivel de seguridad biológica 2 con fortalecimiento en las prácticas del nivel de seguridad biológica 3.17) Teniendo en cuenta esto, el plan de capacitación desarrollado contempló un fuerte componente en el tema de bioseguridad. La capacitación del personal constituye una herramienta esencial, ya que cuando la formación del personal es insuficiente aumentan las posibilidades de que se produzcan errores o incidentes.16
La PCR es una de las técnicas que más se aplican en el diagnóstico. La contaminación por material genético constituye el principal inconveniente en los laboratorios de biología molecular que desarrollan la PCR. La contaminación es la presencia indeseada de material genético (ADN o ARN) que puede actuar como moldes en la PCR. Esto trae como consecuencia la aparición de falsos negativos, lo que afecta el resultado del diagnóstico. El establecimiento adecuado de las áreas y el cumplimiento estricto del flujo de trabajo es clave para evitar la contaminación.20,21
Para la emisión del resultado se tiene en cuenta la morfología de la curva de amplificación (la que debe ser sigmoidal) de los genes diana del virus. Además de la curva del control interno, el que se corresponde generalmente con un gen que tiene expresión constitutiva en el hospedero, es muy frecuente el empleo del gen RNAasa P. La amplificación de este gen indica que no existió inhibición de la reacción. Asimismo, se analizan las curvas de los controles del estuche comercial: el control positivo (en la que los genes del virus amplifican al igual que el control interno) y el control negativo (en el que no hay amplificación debido a que, en muchos casos, este es solución salina).
La experiencia de otros laboratorios de biología molecular del país en el diagnóstico del SARS-CoV-2 se informa en la literatura, tal es el caso del Centro de Investigaciones Científicas de la Defensa Civil22 y el Laboratorio de Biología Molecular de Villa Clara.23
Conclusiones
El cumplimiento de las buenas prácticas y la capacitación del personal permitió el diagnóstico certero del SARS-CoV-2, lo que demostró que estos son dos de los aspectos esenciales para lograr la calidad del proceso. El diagnóstico del SARS-CoV-2 en la UEB LIORAD constituye otro de los logros de la industria biofarmacéutica cubana y en especial de la Empresa Laboratorios AICA+. La implementación del Laboratorio de Biología Molecular permitió la formación de un personal que ha demostrado competencia en la actividad de diagnóstico molecular del SARS-CoV-2.















