Introducción
Las especies reactivas de oxígeno, nitrógeno y azufre (ERONS) son moléculas como el óxido nítrico (ON), el anión superóxido (O2 •−), el peróxido de hidrógeno (H2O2) y el radical tiilo (RS) que se generan constantemente en los organismos como productos de sus funciones fisiológicas.1 Las ERONS se encuentran en diversas localizaciones en los organismos tratando siempre de capturar electrones, con el fin de lograr su estabilidad electroquímica y produciendo reacciones con diferentes moléculas. También constituyen señales moleculares que activan respuestas de estrés, beneficiosas o perjudiciales para el organismo.2,3,4 Las moléculas que inhiben las vías de generación de las ERONS o que las eliminan directamente e interfieren con las vías de degradación pueden actuar como antioxidantes. El organismo mantiene sistemas complejos con múltiples tipos de antioxidantes, como el glutatión, las vitaminas C y E y enzimas como la catalasa (CAT), la superóxido dismutasa (SOD) y varias peroxidasas.2,5 Las reacciones de oxidación en las que intervienen las ERONS son cruciales para la vida y contribuyen a funciones complejas. Entre estas funciones se pueden mencionar la regulación de la presión arterial y funciones cognitivas e nmunitarias.3,4,5,6,7 El eustrés oxidativo (EUO) se ha definido como el desequilibrio entre la producción de oxidantes (ERONS) y la capacidad del sistema antioxidante para atenuar y eliminar el daño oxidativo a diferentes biomoléculas por factores exógenos o endógenos que ocurren en condiciones normales (Fig. 1).
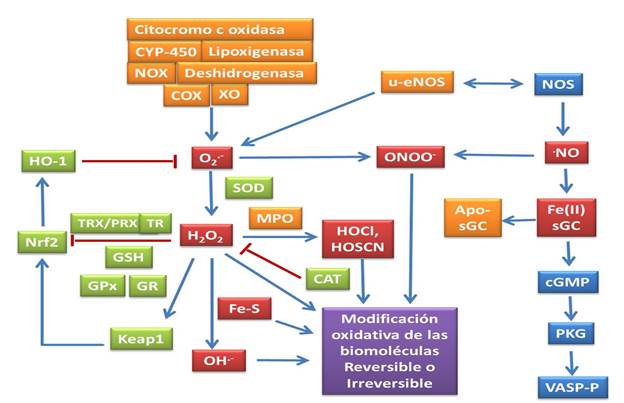 Leyenda: peróxido de hidrógeno (H2O2), superóxido (O2
•-), radical hidroxilo (OH•-), ácido hipocloroso (HOCl), catalasa (CAT), peroxirredoxina (PRX), glutatión peroxidasa (GPX), superóxido dismutasa (SOD), peroxinitrito (ONOO−), óxido nítrico sintasa (NOS), tiorredoxina (TRX), tiorredoxina reductasa (TR), glutatión (GSH), mieloperoxidasa (MPO), glutatión reductasa (GR), NADPH oxidasa (NOX), óxido nítrico (NO), factor nuclear (derivado de eritroide 2)- similar a 2 (Nrf2), hemoxigenasa 1 (HO-1), ácido hipotiocianoso (HOSCN), factor nuclear kappa subunidad B (NF-κB); proteína 1 asociada a ECH similar a Kelch (Keap1), guanilato ciclasa soluble (sGC), xantina oxidasa (XO), proteína quinasa G (PKG), ciclooxigenasa (COX), monofosfato de guanosina cíclica (cGMP), fosfoproteína estimulada por vasodilatadores (VASP) forma ferrosa de sGC [Fe(II)sGC], grupos de Fe (Fe-S), citocromo P450 (CYP-450), NO sintasa endotelial no acoplada (u-eNOS).
Leyenda: peróxido de hidrógeno (H2O2), superóxido (O2
•-), radical hidroxilo (OH•-), ácido hipocloroso (HOCl), catalasa (CAT), peroxirredoxina (PRX), glutatión peroxidasa (GPX), superóxido dismutasa (SOD), peroxinitrito (ONOO−), óxido nítrico sintasa (NOS), tiorredoxina (TRX), tiorredoxina reductasa (TR), glutatión (GSH), mieloperoxidasa (MPO), glutatión reductasa (GR), NADPH oxidasa (NOX), óxido nítrico (NO), factor nuclear (derivado de eritroide 2)- similar a 2 (Nrf2), hemoxigenasa 1 (HO-1), ácido hipotiocianoso (HOSCN), factor nuclear kappa subunidad B (NF-κB); proteína 1 asociada a ECH similar a Kelch (Keap1), guanilato ciclasa soluble (sGC), xantina oxidasa (XO), proteína quinasa G (PKG), ciclooxigenasa (COX), monofosfato de guanosina cíclica (cGMP), fosfoproteína estimulada por vasodilatadores (VASP) forma ferrosa de sGC [Fe(II)sGC], grupos de Fe (Fe-S), citocromo P450 (CYP-450), NO sintasa endotelial no acoplada (u-eNOS).Fig. 1 Diagrama del balance de oxidación reducción entre especies oxidantes y antioxidantes. En verde se muestran las moléculas de señalización protectoras y sus vías de activación. En rojo, las especies reactivas de oxígeno, nitrógeno y azufre. En naranja, las enzimas que participan en la generación de las especies oxidantes. En violeta, los resultados resumidos de la señalización o el efecto de otras moléculas que contribuyen a la respuesta a ERONS. Las flechas azules se emplearon en las vías que se involucran en la activación y las líneas rojas se refieren a los eventos de inhibición.
Los oxidantes (ERONS) están involucrados en los procesos fisiológicos. En condiciones oxidativas (es decir, distrés oxidativo) o reducciones en la capacidad antioxidante del organismo, las modificaciones oxidativas en las biomoléculas ocurren de manera diferente (reversible o irreversible) según la naturaleza del estímulo.
La activación de las vías moleculares también depende de las especies formadas y su concentración.
Como consecuencia del EUO, se producen lentamente y de forma continua un nivel bajo de lesiones oxidativas en los sistemas biomoleculares celulares que dependiendo de la tasa de eliminación, pueden acumularse.3,6 Algunos metabolitos oxidados generados se han asociado con la activación de factores transcripcionales específicos, que conducen a la modulación del sistema antioxidante. Los elementos antioxidantes activados producen una disminución de los oxidantes. La adaptación de un organismo al EUO, o el llamado precondicionamiento, es una respuesta moduladora que previene el daño fisiopatológico.4,8,9,10 La alteración más frecuente de las ERONS y el metabolismo dependiente del oxígeno (O2) promueve la función eficiente sostenida de las mitocondrias, lo que a su vez conduce a la prolongación de las reacciones de radicales libres (RL) y la peroxidación de lípidos de membrana en la célula.
La naturaleza oscilatoria de la concentración de ERONS/O2 y las sustancias reguladoras relacionadas constituye, según algunos especialistas, el aspecto menos estudiado en la biología de las ERONS.1,11 En ese sentido, las ERONS contribuyen a la citotoxicidad porque diferentes metabolitos que se producen por oxidación de las biomoléculas son señales que a ciertas concentraciones conducen a la muerte celular por varias vías con funciones de recambio a nivel fisiológico.5,8 Se ha sugerido que la concentración de las ERONS determina el cambio de los efectos ventajosos a los efectos perjudiciales, pero generalmente no se conocen las concentraciones a las que ocurre este cambio. Cuando el desequilibrio se asocia a la desregulación de los circuitos redox, se manifiesta el estado de distrés oxidativo (DO) y se produce el radical hidroxilo (•OH). El DO se ha asociado con la patogenia de muchas enfermedades humanas, incluidas las enfermedades no transmisibles y el envejecimiento.12,13,14,15
El manejo adecuado del EUO celular es una tarea esencial, tanto para preservar los componentes celulares como para conservar, en la célula hospedera, un estado libre de gérmenes. Algunas ERONS con capacidad microbicida se producen en el curso de una infección por NOX, iNOS y otras enzimas en células activadas del sistema inmunitario innato. Estas moléculas químicamente reactivas no pueden discriminar entre la estructura de las moléculas del hospedero, las células y los tejidos y los agentes infecciosos. El conocimiento del resultado de la interacción hospedero-patógeno es un requisito imprescindible para desarrollar una estrategia farmacológica eficaz, para controlar tanto las infecciones como el DO.10,13,16,17
El DO se ha convertido en un tema de investigación multidisciplinaria en muchas áreas de la medicina antiinfecciosa, en la que aparecen con frecuencia resultados controvertidos. Por lo tanto, la presente revisión tuvo como objetivo recopilar la información más actualizada sobre los hallazgos moleculares que relacionan el DO y algunos patógenos que producen enfermedades infecciosas, sobre la base de una revisión crítica.
Métodos
Se realizó una búsqueda bibliográfica en las bases de datos PubMed, Science Direct, LILACS, EMBASE, SciELO e Infomed en español e inglés mediante los buscadores Google y Google Académico. Se utilizaron las palabras “distrés oxidativo”, “enfermedades infecciosas”, “inflamación”, “eustrés oxidativo”, “estado fisiológico en humanos”.
La búsqueda se centró en artículos de investigación o de revisión que fueron a) publicados entre 2000 y 2022; b) relacionados con DO e infecciones; c) publicados antes de 2000, pero citados en los artículos seleccionados originalmente. Los artículos relacionados con otros temas no se restringieron a ningún periodo.
El proceso de selección de artículos realizado se describe en la figura 2. Se excluyeron numerosos artículos identificados en la búsqueda inicial, entre otros aspectos, los que se centraban solo en las características clínicas de los pacientes, pruebas de laboratorio o tratamientos o se presentaban como preprints. La selección final incluyó 48 artículos originales, 25 artículos de revisión y 5 capítulos de libros.
Información, análisis y síntesis
Aspectos generales de las interacciones hospedero-patógeno y la relación por circuitos redox
El sistema inmunitario innato está involucrado en la respuesta inmediata por exposición a los patógenos. Los eventos se inician con los receptores de reconocimiento de patrones (PRR), que reconocen estructuras moleculares de los patógenos. Existen receptores que reconcen patrones moleculares asociados a patógenos (PAMP) y patrones moleculares asociados a daños endógenos (DAMP), ambos son PRR y median en la activación de las vías de defensa inmunitaria del hospedero18,19,20 (Fig. 3).
Las ERONS actúan como intermediarios en muchas vías de transducción de señales celulares, como la señalización de PRR de leucocitos.
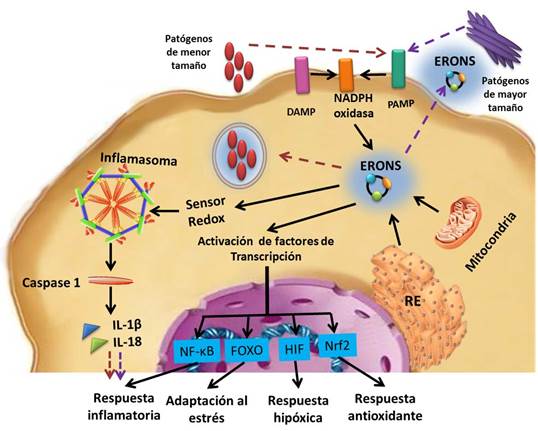 Leyenda: patrones moleculares asociados a patógenos (PAMP), patrones moleculares asociados a daño (DAMP), factor inducible por hipoxia-1 alfa (HIF-1α), Forkhead-box O (FOXO, por sus siglas en inglés), subunidad B del factor nuclear kappa (NF-κB); factor nuclear (derivado de eritroide 2) (Nrf2).
Leyenda: patrones moleculares asociados a patógenos (PAMP), patrones moleculares asociados a daño (DAMP), factor inducible por hipoxia-1 alfa (HIF-1α), Forkhead-box O (FOXO, por sus siglas en inglés), subunidad B del factor nuclear kappa (NF-κB); factor nuclear (derivado de eritroide 2) (Nrf2).Fig. 3 Interrelación entre especies reactivas de oxígeno, nitrógeno y azufre (ERONS) y vías de señalización celular según la naturaleza del patógeno (micro- o macrobiológico) identificado por receptores de patrones moleculares asociados a patógenos (PAMP) o biomoléculas dañadas identificadas por receptores de patrones moleculares asociados a daño (DAMP). Lo que se muestra con la flecha discontinua violeta está relacionado con el estímulo de patógenos macro que da como resultado que la interleucina 1 β (IL-1β) amplifique el reclutamiento y la agrupación de neutrófilos. Lo que se muestra con la flecha discontinua roja está relacionado con el estímulo de patógenos micro que da como resultado una respuesta inflamatoria que suprime la expresión de IL-1β para limitar el reclutamiento de neutrófilos.
Las ERONS son un requisito previo para la formación de trampas extracelulares de neutrófilos (NET), que participan activamente en la formación de fagolisosomas y la degradación enzimática. Además las ERONS y las NET también se involucran en la inhibición de la quinasa de rapamicina (mTOR) y de la autofagia en mamíferos; quimioatracción e inflamación y muerte celular de células reservorios de infección. También en la presentación antigénica, polarización de células T colaboradoras (Th) y proliferación de linfocitos; redistribución del hierro entre los tejidos y disponibilidad de hierro en los compartimentos celulares; y la formación de las células espumosas.15,21 El daño oxidativo causado por las ERONS puede identificarse directamente en los patógenos expuestos. Muchos de estos mecanismos promueven la eliminación de estos, mientras que otros pueden contribuir potencialmente a su persistencia.22
La liberación de citocinas mediada por inflamasomas sigue una vía de activación de varios pasos: primero, una regulación dependiente de NF-κB de las preformas inactivas de IL-1β, IL-18 e IL-33 y también de algunos NLR como NLRP3; en segundo lugar, la activación del NLR u otras moléculas y la formación del inflamasoma. De acuerdo con estudios previos, el resultado posterior al aumento de los niveles de ERONS mejoró la señalización dependiente de c-Jun quinasas amino-terminales (JNK) y NF-κB.12,18,23
Los microorganismos que suelen procesarse por fagosomas desencadenan ERONS intracelularmente, al suprimir la expresión de IL-1β para limitar el reclutamiento de neutrófilos a medida que cada fagocito elimina numerosos patógenos. Por el contrario, los patógenos de mayor tamaño activan ERONS extracelularmente, al amplificar la expresión de IL-1β para reclutar numerosos neutrófilos y formar grupos cooperativos. (Fig. 3) Los defectos en la detección de los patógenos mediada por ERONS, dan como resultado grandes infiltrados y grupos de neutrófilos que contribuyen al proceso inflamatorio.18,24,25
Las enfermedades infecciosas se consideran que producen un estadio fisiopatológico complejo donde se combina el entorno proinflamatorio [principalmente por interleucinas (IL)-1β, IL-6, IL-12, IL-23, factor de necrosis tumoral (TNF)- α y otras citocinas], daño tisular inducido por macrófagos activados (similares a M1) y reparación de heridas producida por otros macrófagos activados (similares a M2) con un escenario antiinflamatorio (predominantemente por IL-10, factor de crecimiento transformante (TGF)- α, ligando de quimiocina (CCL)1, CCL2, CCL17, CCL18 y CCL22).21,26 Informes recientes indican que las ERONS tienen una doble implicación durante las infecciones. Son generados por mieloperoxidasa (MPO), NADPH oxidasa (NOX) u óxido nítrico sintasa inducible (iNOS), también por enzimas biotransformadoras como espermina oxidasa, xantina oxidasa y citocromo P450, para combatir patógenos, pero pueden interactúar con elementos de la célula hospedero como la mitocondria, el núcleo y el retículo endoplásmico produciendo nuevos ciclos de generación. Influyen por tanto en el daño celular y tisular y en consecuencia, se produce tanto la reprogramación metabólica como la regulación génica.4 Los fagocitos y en menor medida las células no fagocíticas se han considerado durante mucho tiempo como fuentes de ERONS de potencialidad antimicrobiana.18
Sin embargo, diferentes autores han aportado evidencias de que los anticuerpos pueden contribuir además a la producción de cantidades suficientes de ERONS para eliminar los patógenos.27 La reproducción o replicación de algunos patógenos se potencia en el entorno oxidativo alterado. Algunas manifestaciones y patologías que acompañan al proceso infeccioso pueden atribuirse al desequilibrio del sistema oxidante-antioxidante y al incremento en la generación de ERONS.20
El estado de reducción del citosol generalmente se logra mediante la competencia de “tampón redox” de los tioles intracelulares, como la tiorredoxina y el glutatión, que previenen el estrés oxidativo celular. La concentración alta de formas reducidas es preservada por la actividad de glutatión reductasa y tiorredoxina reductasa, correspondientemente. Con independencia de la vía por la que las ERONS inicien la señalización celular, existe una creciente evidencia de que sus cantidades celulares están estrechamente relacionadas con la modulación de los niveles de antioxidantes celulares. Un ejemplo de este evento es la regulación de factores de transcripción como el factor 2 relacionado con el factor nuclear E2 (Nrf2) y Fox O (Forkhead-box, por sus siglas en inglés).20
La vía de defensa citoprotectora y antioxidante de Nrf2 regula la expresión de varios cientos de genes relacionados con la respuesta antioxidante. Esta vía es utilizada por las células para preservar la homeostasis redox.18,23 La activación de Nrf2 orquesta una respuesta tolerante que puede proteger los tejidos del daño causado por la inflamación, la agresión infecciosa y oxidativa. El sistema inmunitario está especializado en proporcionar resistencia contra las infecciones, pero los tejidos corporales tratan directamente con los patógenos y se defienden mediante disímiles mecanismos entre los que se reconoce la vía de Nrf2.28,29
Se ha informado que la disminución de Nrf2 en enfermedades infecciosas tiene consecuencias perjudiciales para las moléculas/tejidos del hospedero. Los oxidantes también activan la vía de señalización NF-κB sensible a redox, que induce la expresión de receptores de adhesión celular, citoquinas proinflamatorias y quimioquinas, involucradas en la producción de radicales libres y la persistencia de la inflamación.18,23
La familia FOXO participa en la regulación de los procesos de diferenciación celular modulados por ERONS. Los FOXO estimulan la biosíntesis de proteínas reductoras de ERONS ubicadas en las mitocondrias como superóxido dismutasa 2 (SOD2) y peroxirredoxinas 3 y 5 y en los peroxisomas se inducen CAT y la selenoproteína P extracelular (SelP).19
Las ERONS no solo están involucrados en la regulación de la expresión de genes antioxidantes a través de la activación transcripcional, sino que también interactúan con enzimas relacionadas con modificaciones epigenéticas de micro-ARN, histonas y moléculas de ADN. Esas enzimas contribuyen a la modificación del marco del ADN y permitieron la exposición de genes de expresión de proteínas críticas asociadas a moléculas de señalización esenciales como MAP quinasas, PI3 quinasa y proteína tirosina fosfatasas.28,30
Hay enzimas con la capacidad de proteger tanto a los patógenos como a las células hospederas de las ERONS. Los genes que codifican enzimas de resistencia a algunas ERONS son diversos y están ampliamente distribuidos, lo que sugiere que la presión evolutiva plantea diferentes desafíos bioquímicos.2,22
Investigaciones recientes revelaron que los circuitos redox y la generación de energía metabólica en forma de ATP están estrechamente relacionados con las ERONS y los antioxidantes.4,8,29
El incremento en la producción de ERONS durante las infecciones da como resultado diversas alteraciones y daños celulares que favorecen las reacciones inflamatorias y pueden conducir en algunas condiciones a la inflamación crónica, así como a mayor concentración de ERONS, situación en la que se activa la vía apoptótica intrínseca.25,31
El proceso de oxidación que se favorece en individuos infectados puede conducir a algunas modificaciones de las condiciones endógenas de los metales, lo que puede influir en la evolución del DO.15,26
Con los elementos disponibles, se reconocen las implicaciones de las ERONS en el contexto fisiopatológico, pero dada la complejidad de los sistemas biológicos deben considerarse numerosos elementos y factores.30,32,33
El DO también puede iniciarse por la actividad metabólica del patógeno o durante la alteración del metabolismo del hospedero como consecuencia de la interacción con el patógeno. En este caso, numerosos componentes moleculares de los organismos patógenos, esencialmente en el medio biológico, son biotransformados para su eliminación por enzimas, como varias isoformas del citocromo P 450 (CYP3A4), que generalmente producen el radical anión superóxido. Otras enzimas intracelulares, como la espermina oxidasa, interactúan de manera similar con biomoléculas de patógenos y producen otras ERONS. Ciertas biomoléculas de patógenos interrelacionan con el retículo endoplásmico y las mitocondrias, donde potencian su actividad y alteran el potencial de membrana. Los metabolitos redox son diversos según el patógeno involucrado y la interacción con el hospedero podría producir diferentes condiciones fisiopatológicas.33
Distrés oxidativo e infecciones por bacterias
La mayoría de las bacterias es, al menos parcialmente, susceptible a las ERONS producidas por los fagocitos. En estas infecciones, el DO surge generalmente de rutas metabólicas alteradas y también se ha implicado en el daño de órganos y el desarrollo de neoplasias malignas. Las ERONS de diferentes orígenes celulares producen una alarma inducida por el estrés celular y pueden contribuir a orquestar el inflamasoma NLR. Los investigadores en el tema sugirien que el ADN mitocondrial oxidado dañado por una infección bacteriana u otros medios se une a DAMP y activa la liberación de mediadores proinflamatorios como la IL-1β. Además, la activación del inflamasoma mediada por ERONS conduce a la muerte celular apoptótica como evento clave en la respuesta del hospedero a los patógenos bacterianos, en lo que también se produce quimiotaxis de las células inmunitarias y mediadores proinflamatorios.21,24,34,35
Una amplia variedad de microorganismos patógenos como E. coli, Vibrio cholerae, Bacillus anthracis, Citrobacter rodentium, Burkholderia pseudomallei, Chlamydia pneumonia, Chromobacterium violaceum, Franciscella tularensis, Streptococcus del grupo B, Legionella pneumophila, Mycobacterium tuberculosis, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Salmonella enterica serovar. Typhimurium, Shigella flexneri, Staphylococcus aureus, Streptococcus pneumonia, Serratia marcescens, Acinetobacter baumannii, Yersinia pestis, entre otros, pueden activar la señal PAMP y DAMP que conduce a la generación de ERONS en el hospedero para eliminar el patógeno microbiano.
El mecanismo oxidante para aniquilar patógenos sigue siendo un tema de debate.4,8,18 Primero se ha reconocido una función principal para MPO produciendo HOCl que puede interactuar con cualquier grupo oxidable. Por ejemplo, induce la peroxidación de lípidos poliinsaturados y se combina con aminoácidos que contienen azufre y aminas. La reacción con las aminas produce cloraminas, que tienen capacidad oxidante y dan como resultado el aumento de la actividad citotóxica. Luego, las cloraminas también oxidan y desactivan las proteasas granulares. Se ha propuesto que estos productos pueden, de hecho, “extender el control microbiano en el tiempo y el espacio”. Además, se genera H2O2, cuyas concentraciones requeridas para desencadenar una lesión son considerablemente diferentes y dependen en gran medida de los microorganismos y sus mecanismos antioxidantes. El H2O2 podría reaccionar con enzimas que contengan grupos Fe o Fe-azufre y producir su liberación. El Fe libre puede desarrollar la reacción de Fenton y aumentar la concentración de HO•.13,20
La oxidación de las bacterias en la superficie de los eritrocitos elimina a la mayoría de las especies bacterianas, pero las bacterias causantes de sepsis han desarrollado numerosos mecanismos de adaptación contra la oxidación que les permiten sobrevivir en el torrente sanguíneo. En particular, la formación de biopelículas, la producción de una cápsula densa y el cambio a la forma de L.19,24
Casi todas las bacterias han evolucionado conteniendo mecanismos de defensa antioxidante adaptables e inducibles para controlar los efectos tóxicos de las ERONS. Estos son activados por diversas rutas que involucran reguladores transcripcionales específicos (regulador de estrés por peróxido (PerR) u OxyR, factores sigma, sistemas de componentes y supuestos ARN no codificantes.24,36
Se conocen tres categorías de antimicrobianos que implican la generación de ERONS: primero, los antimicrobianos de ciclo redox (O2 -); segundo, los péptidos antimicrobianos disruptores de membrana (AMP) que afectan la arquitectura de la cadena respiratoria; y, por último, los antibióticos bactericidas que se sugiere que produzcan ERONS en determinadas concentraciones y estas se involucran en el mecanismo de muerte.4,27,35
Una caracterización de las respuestas adaptativas a ERONS en varios modelos de bacterias encontró tres aspectos claves. Primero, cada especie de ERONS desencadena su respuesta afín; segundo, la respuesta a ERONS está bajo el control del regulador transcripcional requerido para la inducción de las proteínas y enzimas de defensa antioxidante; y, por último, los circuitos de respuesta están relativamente conservados en la mayoría de las especies bacterianas. Por lo tanto, las células bacterianas mantienen un nivel basal de enzimas que eliminan las ERONS viables, como O2 - y H2O2, y mantienen así sus concentraciones dentro de límites seguros.37,38
Durante la sepsis, el glutatión disminuye y las ERONS estimulan fuertemente la expresión del factor de transcripción activador 3 (ATF3) a través de la activación de Nrf2. Se requiere ATF3 para proteger contra el shock endotóxico. Pero la expresión de ATF3 también se correlaciona con una mayor sensibilidad a las infecciones secundarias, debido a la inhibición de las expresiones transcripcionales de la IL-6. La muerte celular se estimula a través de circuitos redox como en el caso de Shigella spp. y Francisella tularensis principalmente por piroptosis.13,39,40,41
En otros casos, como en la infección por Pseudomonas aeruginosa, se produce necrosis (neumonía y sepsis) mediada por ERONS. Mycobacterium abscessus y Mycobacterium tuberculosis se reproducen favorablemente en un ambiente oxidativo potenciado por un aumento de ERONS, ya que cuentan con un sistema antioxidante para evadir la producción de ERONS en el hospedero.40,42,43,44,45
Otros estudios han argumentado que el tratamiento con antibióticos también apunta al DO en las bacterias, lo que aumenta secuencialmente el grado de mutación y puede influir en la resistencia de estos a los antibióticos.36,46
La eliminación de patógenos mediada por lactobacilos (p. ej., S. entérica y E. coli) se ha relacionado estrechamente con la producción de H2O2. De lo contrario, varios patógenos CAT negativos utilizan la producción endógena de H2O2 para la señalización intra- e interbacteriana.23,40,47
La estrecha relación bacteria-hospedero es evidente en la producción de toxinas bacterianas que altera la regulación redox en este último.20,22,24
Muchos estados patológicos, incluidas las enfermedades cardiovasculares, las enfermedades renales, el cáncer, la diabetes, la trombosis, la infertilidad, la fibrosis, el daño pulmonar y la piel, entre otras, están asociadas con niveles elevados de ERONS circulantes causados por infecciones bacterianas.10,22,43,48
Distrés oxidativo e infecciones por virus
La mayoría de los virus son eliminados rápidamente por el sistema de defensa inmunitario del hospedero, principalmente por el fagocito. Lo anterior está respaldado por los hallazgos del papel de ERONS en la inducción de la apoptosis como primera línea de defensa contra el reservorio de infección.34,49 La replicación viral depende completamente de las funciones metabólicas y de señalización del hospedero. El metabolismo celular del hospedero podría estar influenciado por cambios inducidos por el virus. En ese sentido, es obligatorio un mecanismo ajustado para minimizar sus efectos potencialmente desfavorables en la salud global.26,50,51
Cuando los virus ingresan a la célula hospedera, se producen niveles bajos de generación de oxidantes para promover la actividad mitogénica y al mismo tiempo se inducen respuestas antioxidantes mediadas por Nrf-2 para proteger la célula hospedera, suprimir la actividad inmunitaria y permitir que la infección avance.52
El mantenimiento de un delicado equilibrio oxidante-antioxidante es imperativo para la replicación viral, también para la protección del material genético viral y de la célula hospedera.49,52
La expresión de una serie de proteínas estructurales y no estructurales dentro de la célula hospedera respalda la replicación del genoma viral y el ensamblaje de un nuevo virión.53,54,55 Se han discutido algunas evidencias de modulaciones positivas y negativas de la vía Nrf2 por varios virus clínicamente relevantes y sus implicaciones en la patogénesis inducida por virus.4,23,30
El ARN y cierta variedad de virus de ADN están interrelacionados con el aumento del DO que media una alta mutagenicidad, deterioro del ADN e iniciación o progresión de neoplasias.10,56
Algunos virus, incluidos los virus de la hepatitis transmitidos por la sangre (B, C y D), la influenza A, el virus de Epstein-Barr, el virus sincitial respiratorio, el virus herpes, el virus de la inmunodeficiencia humana (VIH) y otros, pueden causar infecciones latentes o recurrentes con DO crónico asociado. Las ERONS se han implicado en la lesión del tejido pulmonar y la disfunción de la barrera epitelial en las infecciones virales respiratorias agudas, lo que contribuye a una mayor susceptibilidad a las infecciones secundarias. Se demostró que en la hepatitis viral crónica, el DO promueve la fibrosis hepática, la cirrosis y el cáncer, así como la disfunción metabólica. También el DO inducido por el VIH contribuye a las complicaciones neurodegenerativas.43,54,57,58,59,60
Hay varios genes virales vinculados a a la regulación de las vías redox del hospedero y otros genes asociados, que se modulan durante una infección viral y combinados permiten la propagación y la patogénesis del virus.51,52,61
En el caso de la infección por VIH, uno de los procesos relacionados con el DO es la apoptosis de los linfocitos T CD4+, a través de vías complejas que incluyen FasL, caspasa 8 y Bcl-2, todos mediados por ERONS. La alteración de las vías oxidativas, evaluados por la disminución de antioxidantes secundarios y de las enzimas antioxidantes demostraron, a través de diferentes reportes, la relación con la replicación viral, la evolución de la infección y también con las terapias específicas como antirretrovirales. La alteración del estado redox también se vio influenciada por el uso de medicamentos para tratar algunas comorbilidades o enfermedades oportunistas en los pacientes con VIH.57 Las ERONS también pueden facilitar o incluso promover la replicación viral, según el tipo de células y el tipo de virus involucrado. Por lo general, el incremento en la generación de oxidantes puede inducir la activación de transcriptores celulares como NF-κB, HF-1, Nrf2.34,45 Entre ellos, NF-κB potencia la replicación de múltiples tipos de virus como virus ARN (flavivirus y alfavirus). Otros reportes han observado alteraciones en la regulación redox en pacientes con virus del papiloma humano, hepadnavirus, flavivirus, virus de la encefalitis japonesa, ortomixovirus, paramixovirus, virus chikungunya, togavirus y otros.19,21
Los virus, en general, tienen mecanismos patogénicos comunes que acentúan la producción de ERONS por activación de NOX y NOS, también por inhibición de la expresión en el hospedero de enzimas antioxidantes primarias, ambos efectos como consecuencia de la acción de proteínas virales reguladoras sobre la actividad celular.4
La compleja interacción hospedero-patógeno induce diversos mecanismos biológicos y conduce a diversas condiciones fisiopatológicas con manifestaciones agudas o crónicas. Los virus están asociados con enfermedades cardiovasculares y renales, cáncer, diabetes, trombosis, infertilidad, fibrosis, daño pulmonar, daño a la piel y otros.31,34,62,63,64,65,66,67
Distrés oxidativo e infecciones por hongos
En algunos individuos, los hongos que no suelen establecerse sobre o dentro del organismo pueden colonizarlo y producir infección. En otra situación, los hongos que están habitualmente presentes sobre o dentro del organismo pueden multiplicarse sin control y producir una infección. Los hongos rara vez causan infecciones en personas sanas (p. ej., algunas especies de Entomophthoromycota, Ascomycota y Basidiomycota), porque los sistemas inmunitarios evolucionaron en respuesta constante a los desafíos fúngicos; pero el resutado de la interacción puede ser muy grave para las personas inmunodeprimidas (Ascomycota, Basidiomycota- Malassezia furfur, Trichosporon asahii, Mucorales-Mucor circillenoides, Rhizopus oryzae, Mucor mucedo).68
Los patógenos fúngicos muestran diferentes rutas de infección, lo que influye en la exposición al arsenal químico de las defensas inmunitarias del hospedero, en las que se incluyen las ERONS. Según el sitio de colonización, estos patógenos producen algunas de las enfermedades más difíciles de controlar en los humanos. Por lo tanto, las diferentes rutas de infección también pueden haber contribuido a la divergencia evolutiva de la sensibilidad y las respuestas al estrés en estas especies donde las ERONS se producen principalmente por fagocitosis y estimulación de citocinas del hospedero. Los resultados de la acción de NOX, NOS y MPO sirven para neutralizar patógenos fúngicos.20,69,70
De los hongos, los neutrófilos engullen y destruyen las hifas pequeñas, mientras que las hifas más grandes se eliminan por la liberación extracelular de ERONS y péptidos antimicrobianos. Dependiendo de los PRR como TLR2 y 4, y dectina-1, la regulación de esta vía molecular conduce a la inflamación. La generación deficiente de ERONS afecta el mecanismo de eliminación de patógenos, pero también fomenta una respuesta de estrés para tolerar niveles más altos de ERONS. Por lo tanto, bajo ciertas circunstancias, los bajos niveles de ERONS podrían causar más daño que beneficio al hospedero.69,70
Algunos patógenos fúngicos, oportunistas en humanos, tienen la capacidad de tolerar la producción de ERONS en las células inmunitarias del hospedero, ya que presentan tanto antioxidantes primarios como secundarios que protegen sus biomoléculas estructurales.12,18 Los patógenos fúngicos parecen activar conjuntos análogos de módulos conservados de genes que contribuyen a la inducción de estas respuestas protectoras (p. ej., factores de transcripción Hog1, Pap1, Cap1 y Yap1). Según reportes previos los análisis del transcriptoma y proteoma inducidos por DO mostraron que Candida albicans responde a ERONS activando la síntesis de mecanismos de desintoxicación que incluyen CAT, SOD y componentes de los sistemas de tiorredoxina y glutarredoxina. Además, algunos hongos muestran características comunes en sus respuestas por exposición a ERONS basadas en la información contenida en el genoma.18,69
Otros factores de transcripción como Msn2p y Msn4p también están involucrados en la respuesta de levadura hacia el DO.20
Las funciones enzimáticas involucradas en la reparación del daño causado por el estrés en hongos (p. ej., chaperonas, oxidorreductasa y tiorredoxina reductasa) y la desintoxicación del estrés (p. ej., flavohemoglobina denitrosilasa y NADPH deshidrogenasa) son inducidas por factores de transcripción como Yap1p.70
Se sabe que la melanina es un factor de virulencia importante al proteger las células fúngicas de las ERONS producida por las células fagocíticas y al modular la respuesta inmunitaria del hospedero.70
La importancia de las ERONS para la eliminación de hongos ha sido reconocida; sin embargo, existen varios ejemplos de ERONS del hospedero que no son necesarios para controlar el crecimiento de hongos (A. nidulans) o que no contribuyen a la patogénesis fúngica. Una mayor comprensión tanto de la dinámica de las reacciones oxidativas como de las consecuencias de la producción defectuosa de ERONS de fagocitos en el crecimiento y la morfología fúngica in vivo podría tener un impacto en el tratamiento de pacientes con infecciones fúngicas invasivas.20,70
Los hongos causan enfermedad de la submucosa de la nariz, senos paranasales y cara central, desfiguración, dificultad para respirar, neumonía, infección sistémica, úlceras, quistes, abscesos cerebrales, queratitis, obstrucción de vasos, infarto, alteración cerebral, endocarditis, miocarditis, daño pulmonar, endoftalmitis, osteomielitis, lesiones cutáneas e infecciones nosocomiales entre otras.68,70
Distrés oxidativo e infecciones por parásitos
Los parásitos tienen genomas complejos, ciclos de vida y estrategias de evasión del sistema inmunitario de los mamíferos y las ERONS pueden tener diferentes efectos según el tipo de célula infectada o el compartimento que ocupa el parásito. Se ha informado que las infecciones por T. annulata y T. sergenti, babesiosis, trypanosomosis, D. viviparous, Fasciola sp., Trichostrongylus sp., Eimeria sp., coccidiosis y larvas de Taenia saginata están asociadas con la peroxidación lipídica.71,72,73,74,75
Los parásitos de Leishmania major desencadenan un incremento de la producción de ERONS por macrófagos tras la infección, a diferencia de L. amazonensis, que procede a través de una invasión celular. Las ERONS derivadas de NOX2 no contribuyen a eliminar L. major dentro de los macrófagos, pero interfiere con el establecimiento de respuestas inmunitarias posteriores. Además, Leishmania spp. ha desarrollado un lipofosfoglicano complejo que les permite evitar cuidadosamente la unión a los receptores de manosa, que desencadenan el estallido respiratorio y otros mecanismos microbicidas en los fagocitos.32,76,77
L. guyanensis y L. brasiliensis activan el estallido respiratorio fagocítico capaz de aniquilar los parásitos. Cuando P. berghei ANKA, P. yoelli o P. chabaudi son expuestos al estallido respiratorio de fagocitos no se reduce la parasitemia en una etapa temprana de la infección, lo que indica que el estallido no participa en la eliminación de Plasmodium. T. cruzi tambien induce liberación de ERONS conduciendo al DO, que causa gran parte del daño cardiaco asociado con la enfermedad de Chagas.75
El proceso de piroptosis que ocurre en los eritrocitos se denomina eriptosis y puede ser inducido por Plasmodium falciparum y otros patógenos.74
Las infecciones por Trypanosoma cruzy y Plasmodium falciparum, ambas con alta morbilidad, ocurren con la disminución de la actividad de Nrf2 por inhibición y favorecen la supervivencia del patógeno.77,78
Entamoeba histolytica potencia la acumulación de ERONS generada por NOX en las células hospederas, lo que influye en la señalización de la quinasa 1/2 relacionada con la señal extracelular y, finalmente, estimula la muerte de la célula hospedera por apoptosis.76
Las ERONS pueden modular no solo la respuesta celular en las células parasitarias, sino también activar y apoyar las defensas del hospedero. La activación de la respuesta inflamatoria a los parásitos agota los antioxidantes y expone al hospedero a un mayor riesgo de DO. Como resultado, diferentes procesos como la adhesión celular, la expresión génica, el metabolismo y varios tipos de muerte celular se modifican y contribuyen a la fisiopatología relacionada.32,75
Los parásitos producen diferentes síntomas asociados con daños en diversos tejidos, como fiebre, dolores y molestias en el cuerpo, erupción cutánea, dolor de cabeza, náuseas y vómitos, diarrea e inflamación de las glándulas, anemia, infecciones gastrointestinales por nemátodos, cáncer y otros.72,76,77
Patógenos que prosperan en el ambiente oxidativo
Las interacciones entre el hospedero y el patógeno influyen tanto en la patogenia como en las respuestas del hospedero, que determinan el resultado de estas, el control o la persistencia infecciosa. Ambos organismos usan rutas metabólicas similares y comparten diversos intermediarios. La superposición entre estas redes moleculares es una fuente potencial de competencia entre el hospedero y el patógeno durante la infección.7,71
Casi todos los patógenos han desarrollado una maquinaria molecular compleja y circuitos reguladores para elaborar una amplia gama de estrategias de defensa y reparación para responder a la presencia de ERONS. La activación de estas puede inducir respuestas sostenidas o transitorias.
La presencia de enzimas como catalasa (Kat), superóxido dismutasa (SodA, SodB y SodC) o moléculas como glutatión/glutarredoxina (glutatión 1, TTR1) y sistemas de tiorredoxina (TSA1, tiorredoxina 1, TRR1), entre otros, se ha demostrado en diversos patógenos.37,47,69,71,78 Las funciones de esas enzimas (como SodA, SodB y Kat) en la supervivencia de los patógenos y la patogénesis varían mucho según la especie; pero principalmente permiten su función en el clima hostil de la interfaz hospedero-patógeno. Una respuesta adicional y muy rápida al aumento de la generación de ERONS, que precede a la activación transcripcional, es la redirección dinámica del flujo metabólico de la glucólisis a la vía de las pentosas fosfato en algunos patógenos. Para los genes de expresión de antioxidantes, los patógenos poseen factores de transcripción como OxyR, SoxR, Yap1, Cap1 y Atf1, entre otros, diferentes a los de los mamíferos.40,50,70
Esas respuestas de adaptación del patógeno en combinación con otras funciones moleculares, le confieren resistencia al tono oxidativo, que conjuntamente con otros mecanismos del hospedero y, junto con otras combinaciones de estímulos, influirán en los resultados de sobrevivencia del patógeno. Los diferentes aspectos de la respuesta adaptativa tienen lugar en disímiles escalas de tiempo que conducen a la disponibilidad de metabolitos como glutatión, tiorredoxina y otros que garantizan una respuesta creciente del hospedero que contrarresta el estrés y da como resultado el daño al patógeno.21,76
Los polimorfismos reconocidos en los genes que codifican para las proteínas que conforman los sistemas generadores de ERONS del hospedero o en los genes productores de antioxidantes (enzimáticos o no) podrían contribuir a la persistencia del incremento de oxidantes alterados mediando estados de inflamación crónica relacionada con estados perjudiciales en las infecciones. Las deficiencias en la producción o respuesta de citocinas también podrían interferir con el estado redox, favoreciendo la resistencia oxidativa del patógeno y la lesión al hospedero.22
Durante la interacción de los patógenos con elementos del metabolismo oxidativo y del sistema inmunitario del hospedero, se han identificado diferentes situaciones que determinan la resistencia microbiana:15,78
Interferencia con la producción o absorción de ERONS.
Mecanismos susceptibles de implicar la conversión de ERONS a formas menos tóxicas (desintoxicación, scanveger, entre otros).
Mecanismos que probablemente impliquen la reparación de lesiones dependientes de ERONS.
Quelación de metales (Zn, Fe y Cu, entre otros).
Otros mecanismos desconocidos.
Los procesos deletéreos asociados a ERONS en las infecciones virales son inhibidas más frecuentemente por los antioxidantes. Los virus suelen ser el objetivo de la autofagia, pero los PRR apenas los detectan en la superficie de los fagocitos para su absorción y posterior exposición a ERONS.34
Algunos patógenos que codifican y expresan sus propios antioxidantes regulan la expresión de estos en respuesta al incremento de oxidantes. Existe un beneficio reconocido, ya que los antioxidantes afectan inespecíficamente los mecanismos de destrucción de patógenos. El secuestro de hierro podría ser uno de estos mecanismos, ya que el aumento de oxidantes influye en la liberación de hierro de la ferritina del hospedero.21
Limitaciones
Esta revisión crítica tiene algunas limitaciones. El alcance de esta revisión se centró en la información bibliográfica que trata sobre EUO en condiciones fisiológicas y el DO y las enfermedades infecciosas según las referencias consultadas. No se obtuvo acceso a todos los documentos identificados debido a limitaciones financieras. Además, solo se incluyó manuscritos en inglés y español. La selección de artículos se restringió a la salida del sistema disponible utilizado. Finalmente, hubo dos revisores por razones pragmáticas.
Perspectivas futuras
Un nuevo campo de la medicina redox se desarrolla identificando las dianas en la generación y eliminación de oxidantes como una estrategia de salud en las enfermedades infecciosas. Debido a las características pleiotrópicas de las ERONS y sus funciones como biomoléculas fisiológicas mediadoras, es difícil definir su accionar en términos de interacción causa-efecto. Es de crucial importancia que se caracterice de manera integral y en los diferentes contextos los biomarcadores a evaluar para diseñar estrategias de modulación redox adecuadas. Las tecnologías emergentes proporcionarán una mejor comprensión de los mecanismos, la interacción y los efectos farmacológicos para un tratamiento eficaz y seguro en este contexto.
Conclusiones
El DO en las enfermedades infecciosas ocurre como un proceso multifactorial, relacionado con el agente causal y los mecanismos moleculares y celulares en los que las ERONS desempeñan varios papeles: el proceso inflamatorio, la eliminación de patógenos y sus componentes y eventos celulares regulados por la interacción hospedero-patógeno. Todo lo anterior tiene repercusiones sobre el daño oxidativo y la supervivencia o muerte celular, aún con muchos aspectos por esclarecer. La integración y comprensión de los disímiles eventos en los que participan tanto oxidantes como antioxidantes permitirá un mejor abordaje de la terapia y atención de los pacientes.















