Introducción
Las biopelículas son comunidades de una o varias especies de bacterias adheridas a un sustrato que se encuentran embebidas en una matriz extracelular.1 La estructura de la biopelícula le confiere resistencia a las bacterias frente a antimicrobianos.2 Entre los mecanismos responsables de la resistencia están los siguientes: la barrera de difusión física y química a la penetración de los antimicrobianos que constituye la matriz de exopolisacáridos; el crecimiento ralentizado de las bacterias de la biopelícula debido a la limitación de nutrientes; la existencia de microambientes que antagonizan con la acción de los antimicrobianos y la activación de respuestas de estrés que provocan cambios en la fisiología de la bacteria.3 Además, pueden evadir de manera parcial o total la respuesta inmunitaria del huésped, pues se convierten en estructuras demasiado grandes como para ser fagocitadas, reduciendo la accesibilidad del sistema inmunitario a las bacterias.4
Las infecciones relacionadas con biopelículas, característicamente infecciones crónicas persistentes refractarias a tratamiento antimicrobiano, son un importante problema sanitario, ya que representan entre un 65-80 % de todas las infecciones.5Escherichia coli es frecuentemente aislada en infecciones nosocomiales. Algunas cepas hipermutables de E. coli han estado implicadas en infecciones del tracto urinario y pulmonares de pacientes con fibrosis quística.6,7 Además, el surgimiento y diseminación de genes de resistencia a diferentes familias de antibióticos en estas especies son particularmente preocupantes.8
Los estudios clásicos de sensibilidad a los antimicrobianos se realizan con bacterias en estado planctónico. Por lo tanto, en general, los resultados de las pruebas de sensibilidad clásicas pueden no ser extrapolables a infecciones relacionadas con la formación de biopelículas. En los últimos años se han implementado y probado diferentes modelos de desarrollo de biopelículas in vitro.9 Sin embargo, la falta de estandarización de los métodos, parámetros e interpretación de los resultados limita la aplicación de los datos obtenidos en el entorno clínico, incluyendo la comparación de diferentes estrategias de tratamiento.9,10
La escasa eficacia de los distintos tratamientos y la toxicidad in vivo de los antibióticos disponibles impulsan a los investigadores hacia el descubrimiento de productos naturales antibiopelículas, pues son más eficaces que sus homólogos de síntesis química y tienen menos efectos secundarios.11 El objetivo de este trabajo fue estandarizar un ensayo de adhesión en microplaca de Escherichia coli para su uso en el cribado de potenciales agentes antibiopelículas.
Métodos
Se realizó un estudio comparativo para evaluar la adherencia de E. coli a placas considerando las variables siguientes: concentración bacteriana, tipo de medio de cultivo y tiempo de incubación.
La cepa Escherichia coli ATCC 25922 se cultivó en placas de agar triptona soya (BIOCEN, Cuba), suplementado con un 5 % de sangre de cordero, a 37 ºC durante 24 h. A partir de este cultivo se inocularon cinco colonias de E. coli en tubos con 5 mL de medio Luria Bertani (LB) (BIOCEN, Cuba) y se incubaron a 37 ºC durante 24 h. La concentración de los cultivos se ajustó a 1 x 108 unidades formadoras de colonia (UFC)/mL (según datos de densidad óptica (DO) a 620 nm y conteo de UFC en placas). La capacidad de formación de biopelículas se evaluó con el método de adhesión en microplaca propuesto por Naves y otros,12 con algunas modificaciones.
A partir de una suspensión de la bacteria ajustada a 1 x 108 UFC/mL se realizaron diluciones seriadas 1:10 en NaCl al 0,9 % (en el rango 108-104 UFC/mL). En una microplaca de 96 pocillos no tratada para cultivo celular y de fondo plano (COSTAR, EE. UU.), se añadieron por pocillo 150 μL de cada medio: medio mínimo M9 suplementado con 8 g/L de glucosa y medio LB, seguidamente 50 μL de cada concentración bacteriana. Se incubaron en condiciones estáticas a 37 °C durante 24 y 48 horas.
El control negativo correspondió a cada uno de los medios de cultivo sin inocular. Luego de la incubación, los medios de cultivo se retiraron y se lavaron los pocillos con 150 μL de agua destilada, y después se secaron a 60 ºC durante una hora en el horno (Hotpack, EE. UU.). La tinción de los pocillos se realizó con 150 μL de violeta cristal (Sigma-Aldrich, EE. UU.) al 1 % durante 10 min.13 Seguidamente se retiró el colorante y se lavaron los pocillos cuatro veces con 150 μL de agua destilada y se secaron durante una hora a temperatura ambiente. A continuación, se añadió 200 μL de ácido acético (FLUKA, EE. UU.) al 33 % y se midió la DO a una longitud de onda de 530 nm en lector de microplacas (SUMA, PR-621, Cuba).
Se emplearon los datos de DO530 nm y las ecuacionessiguientes:14
donde DOc: valor de corte; c: promedio de la DO del control negativo; DEc: desviación estándar del control negativo; DOa: densidad óptica ajustada; m: promedio de la DO de la muestra.
Según los valores de corte y de DO ajustada obtenidos en el procedimiento anterior, la capacidad de producción de biopelículas se clasificó en cuatro grupos diferentes como indica la tabla 1.15
Tabla 1 Clasificación según la capacidad de producción de biopelículas
| Valores | Clasificación |
| DOa
|
Fuertemente productora (FP) |
| 2DOc
|
Moderadamente productora (MP) |
| DOc
|
Débilmente productora (DP) |
| DOa
|
No productora (NP) |
Leyenda: DOc: valor de corte; DOa: densidad óptica ajustada.
Una vez clasificada cada una de las condiciones estudiadas, se escogió como condición óptima aquella en que E. coli mostró el mayor valor de DOa y por tanto se clasificó como fuertemente productora.
Todos los experimentos se realizaron por triplicado en tres ensayos independientes. El análisis estadístico se realizó con el software GraphPad Prism versión 5. Para evaluar la significación de las diferencias entre las concentraciones bacterianas, los medios LB y M9 y entre los dos periodos de incubación se empleó la prueba de Kruskal-Wallis. Las medias se compararon mediante la prueba de comparación múltiple de Dunn con una probabilidad de error del 5 % (p < 0,05).
Resultados
En la figura 1 se observa que los máximos valores de crecimiento planctónico de E. coli se obtuvieron en el medio LB a las 24 horas (Fig. A) y ocurrió una diminución a las 48 h (Fig. B). La carga inicial no influyó en los valores de DO alcanzados en cada combinación.
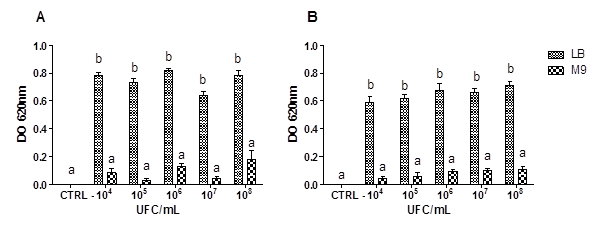 Leyenda: CTRL-:control negativo; DO620 nm de medio no inoculado.
Leyenda: CTRL-:control negativo; DO620 nm de medio no inoculado.Fig Crecimiento planctónico a partir de diferentes concentraciones de unidades formadoras de colonia de E. coli a las 24 (A) y 48 (B) horas de incubación en dos medios de cultivo diferentes. El crecimiento planctónico de las bacterias se expresó mediante los valores de DO a 620 nm. Los resultados se representan como la media ± DE de tres experimentos independientes realizados por triplicado. El análisis estadístico se realizó con la prueba de Kruskal-Wallis y las medias se compararon mediante la prueba de comparación múltiple de Dunn. Letras diferentes indican diferencias significativas p ≤ 0,05.
Las condiciones evaluadas: dos tiempos de incubación, dos medios de cultivo y cinco concentraciones de UFC/mL de la bacteria, resultaron en 20 combinaciones. En cuanto a la capacidad de producción de biopelículas, 5 de estas combinaciones fueron clasificadas como fuertemente productoras, una moderadamente productora, 10 débilmente productoras y 4 no productoras de biopelículas (Tabla 2).
De manera similar a lo ocurrido en el crecimiento planctónico, las 5 concentraciones de UFC/mL de E. coli en el medio LB a las 24 h de incubación permitieron una fuerte producción de biopelículas obteniendo los máximos valores de DOa; mientras que en 48 h hubo una disminución de los valores de DOa, por lo que se obtuvo una débil producción de biopelículas. La utilización del medio de cultivo M9 mostró generalmente una capacidad débilmente productora o no productora de biopelículas. Por ello, se obtuvieron mejores resultados con el empleo del medio LB y un tiempo de 24 h de incubación. En el medio LB, las concentraciones bacterianas 107 y 108 UFC/mL tuvieron los menores valores de DOa. Mientras las concentraciones 104, 105 y 106UFC/mL alcanzaron valores superiores, pero similares entre ellas, por lo que podría usarse cualquiera de estas concentraciones. Sin embargo, se escogió 105 UFC/mL por tener el mayor valor de DOa. Por tanto, se identificaron como condiciones óptimas para la formación de biopelículas: el medio LB, la concentración bacteriana 105 UFC/mL y un tiempo de incubación de 24 h.
Tabla 2 Valores de DOa obtenidos en el ensayo de adherencia para diferentes concentraciones de E. coli cultivadas en dos medios de cultivo y con dos tiempos de incubación diferentes
| Concentración (UFC/mL) | Medio de cultivo | Tiempo (horas) | DOc | DOa | Clasificación | |
| 104 | LB | 24 | 0,047 | 0,590 | DOa
|
FP |
| 48 | 0,098 | 0,123 | DOc
|
DP | ||
| M9 | 24 | 0,076 | 0,135 | DOc
|
DP | |
| 48 | 0,086 | 0,081 | DOa
|
NP | ||
| 105 | LB | 24 | 0,047 | 0,606 | DOa
|
FP |
| 48 | 0,098 | 0,113 | DOc
|
DP | ||
| M9 | 24 | 0,076 | 0,126 | DOc
|
DP | |
| 48 | 0,086 | 0,102 | DOc
|
DP | ||
| 106 | LB | 24 | 0,047 | 0,584 | DOa
|
FP |
| 48 | 0,098 | 0,119 | DOc
|
DP | ||
| M9 | 24 | 0,076 | 0,139 | DOc
|
DP | |
| 48 | 0,086 | 0,098 | DOc
|
DP | ||
| 107 | LB | 24 | 0,047 | 0,403 | DOa
|
FP |
| 48 | 0,098 | 0,088 | DOa
|
NP | ||
| M9 | 24 | 0,076 | 0,055 | DOa
|
NP | |
| 48 | 0,086 | 0,026 | DOa
|
NP | ||
| 108 | LB | 24 | 0,047 | 0,371 | DOa
|
FP |
| 48 | 0,098 | 0,147 | DOc
|
DP | ||
| M9 | 24 | 0,076 | 0,187 | 2DOc
|
MP | |
| 48 | 0,086 | 0,098 | DOc
|
DP | ||
Leyenda: DOc: valor de corte; DOa: densidad óptica ajustada; FP: fuertemente productora; MP: moderadamente productora; DP: débilmente productora; NP: no Productora; LB: medio Luria Bertani; M9: medio mínimo M9.
Discusión
El desarrollo de estrategias fiables contra las biopelículas depende en gran medida de que se comprendan claramente los mecanismos que subyacen al desarrollo de la biopelícula. Existen varios métodos de detección de biopelículas, sin embargo, la falta de estandarización sigue siendo un punto ciego en la comunidad de las biopelículas. La búsqueda de la estandarización es problemática, ya que las biopelículas son estructuras vivas, es decir, complejas y dinámicas. La estructura y las propiedades de la biopelícula dependen en gran medida del entorno de crecimiento. En general, las condiciones de crecimiento actúan sobre el comportamiento biológico y físico de las bacterias en función de su potencial de supervivencia.16 La comparación entre los resultados publicados en la literatura suele ser difícil, debido al uso de diferentes aproximaciones estandarizadas, técnicas de preparación de inóculos, tamaño del inóculo, medio de crecimiento y condiciones de incubación. Los criterios empleados para definir la formación de biopelículas varían considerablemente de un estudio a otro.17
Se han descrito varios métodos de ensayo para la cuantificación de biopelículas en placas de microtitulación. El método de adhesión en microplaca combinado con la tinción con violeta cristal es el procedimiento más común para evaluar la formación de biopelículas. El violeta cristal es un colorante básico que se une a las moléculas cargadas negativamente en la matriz extracelular. Este ensayo se ha empleado debido a su facilidad de uso y la adaptabilidad del protocolo a una variedad de aplicaciones.18
Como se ha establecido, la interpretación de los resultados obtenidos de DO530 nm requiere la definición de un valor de corte (DOc) que distinga las cepas productoras de biopelículas de las no productoras. Algunos investigadores determinan este valor umbral sobre la base de tres veces la desviación estándar por encima del valor de DO del medio no inoculado (control negativo)19 o del valor alcanzado por una cepa control no productora de biopelículas.20 Otros investigadores usan valores de corte predefinidos 0,1;21 0,1222 o 0,2.23 En algunos estudios el resultado de la cepa control positivo se usó como punto de partida para el cálculo,24 mientras que en otros, una cepa se consideró formadora de biopelículas si su DO fue dos veces mayor que la DO de la cepa control negativo utilizada.25 El uso de cepas como controles negativos o positivos, como referencia para los cálculos, puede dar lugar a ciertas incoherencias debido a numerosos factores que influyen en la producción de biopelículas. Por eso, los autores de este estudio consideran que la mejor opción para la interpretación de los resultados es el uso del control negativo (medio de cultivo) como punto de partida para todos los cálculos.
Las condiciones ambientales, incluyendo el medio de cultivo y los nutrientes disponibles, pueden modular la producción de biopelículas microbianas y su función. Tienen un gran impacto en el crecimiento y desarrollo de la biopelícula y la actividad metabólica de las células que la componen.26 Incluso se ha sugerido que la composición del medio es el factor más importante que influye en la capacidad de las bacterias para producir biopelículas en condiciones in vitro.27
Algunos autores han descrito una intensa formación de biopelículas para cepas de E. coli en medios ricos, como LB, y una baja formación en caldos mínimos suplementados con una única fuente de carbono como glucosa o glicerol,28 lo cual coincide con los resultados de este estudio. Sin embargo, otros autores han descrito una mayor producción de biopelículas en medios mínimos, teniendo como estímulo la escasez de nutrientes en el medio,29 sugiriendo que diferencias en la metodología influyen en el comportamiento de las cepas estudiadas.
La formación de biopelículas es una estrategia de sobrevivencia, que incrementa la transición de la bacteria de un modo de vida planctónico a una condición sésil, en un ambiente generalmente limitado nutricionalmente; pues al colonizar la superficie, la bacteria captura nutrientes absorbidos sobre esta. Sin embargo, en medios ricos en nutrientes las proteínas se adhieren a la superficie, afectando la adherencia de la bacteria. En este estudio el LB es un medio rico en proteínas que permitió la mayor adherencia de la bacteria.
Estudios dirigidos a determinar la concentración adecuada de bacterias para la formación de biopelículas han mostrado resultados semejantes a los de esta investigación. Palanisamy y otros determinaron que varias cepas de Pseudomonas aeruginosa formaron biopelículas a la concentración de 103 UFC/mL,30 mientras que Leon y Bojacá identificaron 104 UFC/mL como la mejor concentración para las bacterias: E. coli, Staphylococcus aureus, Serratia marcescens y Klebsiella pneumoniae.31
Según los datos disponibles, el tiempo de incubación también desempeña un papel crucial en el desarrollo de la biopelícula.32 Habitualmente, se utilizan distintos tiempos de incubación para los ensayos de formación de biopelículas en condiciones estáticas, que varían desde 24 h hasta 5 días o más.33 Al igual que en este estudio, también se detectó una reducción de biomasa de 24 a 48 h en biopelículas formadas por Gardnerella vaginalis.34 Esto sugiere que el agotamiento de nutrientes o la acumulación de productos de desecho, con el tiempo, podría afectar la formación de biopelículas. El protocolo de 24 h es ampliamente recomendado, ya que se ha usado en la gran mayoría de los estudios con biopelículas.21,23
Sin embargo, una limitación del ensayo estandarizado en microplacas con tinción con violeta cristal en este estudio es la incapacidad de distinguir entre poblaciones bacterianas vivas y muertas. Este problema contribuye a una gran variabilidad entre las muestras y puede complicar la interpretación de los resultados del cribado de moléculas con acción antibiopelículas.
Conclusiones
Los resultados indican que la formación de biopelículas de E. coli in vitro depende de las condiciones experimentales. Aunque el medio LB permitió la mayor producción de biopelículas, el estudio también reveló que este proceso se ve influenciado por otras condiciones como la concentración bacteriana y el tiempo de incubación. Las condiciones de cultivo identificadas podrían emplearse en estudios adicionales sobre el potencial efecto de productos naturales sobre la inhibición o destrucción de biopelículas.















