Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.1 Ciudad de la Habana ene.-abr. 1999
Técnicas
Instituto de Hematologia e InmunologíaDescripción de un inmunoensayo enzimático que reconoce anticuerpos anti-factor VIII/von Willebrand obtenidos a partir de hibridomas múridos
Dra. Renée González Sampedro, Lic. René Rivero Jiménez, Lic. Lilia Suárez Batista, Dr. Juan M. González González, Lic. Alina Díaz Concepción, Lic. Alberto González García y Lic. Rodolfo Rubio RubioResumen
Se describe un inmunoensayo enzimático (ELISA) que detecta anticuerpos anti-Factor-VIII/von Willebrand (FVIII/vW), con una relación de enlace > 5, que permite reconocer dichos anticuerpos tempranamente en los cultivos de hibridomas múridos. Para la adsorción de las placas del inmunoensayo se utilizaron preparados semipurificados de FVIII/vW obtenidos en Cuba. Se inmunizaron ratones Balb/c con la finalidad de generar los anticuerpos monoclonales detectados por este ELISA. Se obtuvo un clon con crecimiento estable y varios subclones positivos por el ELISA con actividad biológica específica de anticuerpos inhibidores de FVIII.Descriptores DeCS: FACTOR DE VON WILLEBRAND; HIBRIDOMAS; ANTICUERPOS; TEST DE ELISA/métodos.
El Factor VIII-factor/von Willebrand (F-VIII/vW) humano es un complejo glicoproteico plasmático de alto peso molecular, cuyas mitades con funciones e inmunogenicidad propias se pueden aislar por separado: la mitad F-VIII corresponde a la actividad procoagulante F-VIIIC y al antígeno F-VIIIC:Ag, y la otra de vW que corresponde al antígeno relacionado con el F-VIII (F-VIIIR:Ag), actúa como proteína estabilizadora/transportadora de la anterior y participa en las interacciones entre las plaquetas y en la adhesión de éstas al endotelio subvascular. La ausencia de esta actividad biológica se observa en la enfermedad de von Willebrand, mientras que la actividad FVIII:C está ausente o muy disminuida en la hemofilia A y en la enfermedad de von Willebrand severa.1
El F-VIII se sintetiza en el hígado, bazo, ganglios linfáticos y riñón.2 La proteína madura consta de 2 332 aminoácidos y presenta una estructura de dominio triple con 2 homólogos repetidos y uno único, el B, colocados en la siguiente forma:
A1-A2-B-A3-C1-C2.
Además consta de pequeñas regiones ricas en residuos aminoacídicos (AR) situadas entre los distintos dominios: A1-AR1-A2-AR2-B, que constituyen la cadena pesada y AR3A3-C1C2, la ligera. La presencia de los dominios A y C es esencial para la actividad de F-VIII como cofactor del F-IX.3 Las cadenas ligeras y pesadas están ligadas en forma no covalente por calcio y el F-vW se encuentra unido a la cadena ligera del F-VIII, de la cual puede liberarse por ruptura con trombina en el residuo 1 689.4
El F-vW se sintetiza por las células endoteliales y también por los megacariocitos. Está constituido por una glicoproteína multimérica con más de 100 subunidades idénticas. El monómero maduro consta de 2 050 residuos de aminoácidos. Posee 3 dominios con homología interna: los dominios-A, que contienen al A1 con el sitio de unión de la molécula de vW al receptor específico de las plaquetas. En la región 272 se une al F-VIII para trasladarse con éste.5
Se han obtenido un número elevado de anticuerpos monoclonales (AcMo) que reconocen sitios antigénicos con actividades funcionales monoespecíficas, tanto por los métodos clásicos de producción de hibridomas múridos como con el empleo de plásmidos que expresan fragmentos de F-VIII, bien para obtener las preparaciones de F-VIII y F-vW altamente purificadas con fines terapéuticos, diagnósticos, y para estudios funcionales o estructurales.1,6,7
La detección de dichos AcMo múridos se realiza fundamentalmente por técnicas de inmunoensayos enzimáticos en fase sólida (ELISA). Estos métodos tienen la ventaja de reconocer los Acs con una sensibilidad de hasta menos de 1 µg/mL. Se han comunicado numerosos ensayos ELISA adaptados a cada estudio específico,8-10 por lo que en este trabajo se describe el desarrollo de un método de ELISA indirecto en el que se emplea F-VIII/vW humano purificado en Cuba como antígeno inmovilizado por adsorción pasiva en la fase sólida y que permite reconocer anticuerpos anti-F-VIII/vW, para evaluar la respuesta inmunológica provocada por los esquemas de inmunización para la obtención de ratones hiperinmunes, con vistas a su utilización en la generación de hibridomas múridos productores de dichos anticuerpos.
Métodos
Ensayo inmunoenzimático
Se emplearon placas plásticas NUNC de 96 pozos, de fondo plano y se realizó el ensayo según las etapas siguientes:Se cubrió la placa con 50 µL de Ag (F-VIII/vW) semipurificado11 a diferentes concentraciones: 3, 6, 12 y 25 µg/mL, para detectar la capacidad de enlace óptima, en solución balanceada (SB) de carbonato, a pH 9,6. Otras placas se sensibilizaron también con fibronectina o fibrinógeno para descartar la posible presencia de trazas contaminantes de estas sustancias en el F-VIII/vW. Además se utilizó F-VIII y F-vW comerciales para conocer la especificidad de los Acs producidos por los clones de hibridomas generados con crecimiento estable. Se incubó 18 horas a 4 °C o 90 minutos a 37 °C. se lavó 3 veces (3 x) con PBS, PBS-Tween 20 o PBS-gelatina-(0,1 %)-Tween (0,2 %). Se bloquearon los sitios con reacciones inespecíficas durante 1 hora a 37 °C, bien con 100 µL de suero ovino 1:4, albúmina bovina (BSA) al 3 %, gelatina o leche descremada o la combinación de éstas para hallar la óptima reducción de enlaces inespecíficos. Se lavó 3 x. Se añadieron 20-60 µL de las muestras: sobrenadante (SN) del cultivo celular, líquido ascítico o suero murino hiperinmune, el cual se utilizó como control positivo (C+). Como controles negativos (C-) se usaron: mezclas de suero de ratones BALB/c no inmunizados y/o SN de células de línea. Las muestras se dispensaron en diluciones seriadas desde 1:100 a 1:64 000, para determinar la sensibilidad y se incubaron 1, 2 ó 3 horas a 37 °C o 18 horas a 4 °C, para hallar el tiempo de incubación óptimo. Se lavó 3 x. Se agregó suero de carnero diluido 1:3 en SB de lavado (150 µL) y se incubó 15 minutos a temperatura ambiente para intentar reducir más los enlaces inespecíficos. Se lavó 3 x. Se agregó un antisuero IgG anti-ratón obtenido en carnero conjugado con peroxidasa (100 µL por pozo). Se probaron diluciones seriadas desde 1:250 hasta 1:8000. Se incubó de 1 a 3 horas a 37 °C. Se lavó 3 x. Se utilizó para el revelado el cromógeno-sustrato dihidro-cloruro de ortofenilen-diamina 0,4 % P/V y 0,04 % V/V de H2O2 (OPD/H2O2), 100 µL/pozo. Se incubó 30 minutos a oscuras. Se agregaron 50 mL/pozo de SO4H2 2N. Se midió la densidad óptica (DO) en el lector de placas de ELISA (Multiskan plus, Flow Lab.) o en el equipo SUMA PR-521, A 492 nm.
Todas las muestras y las diluciones a ensayar se dispensaron por duplicado. El valor límite se calculó por la fórmula (4N + P) 0.2, donde N es la media del control negativo y P es la media del control positivo.
Se calculó la relación de enlace (RE) según la fórmula: lectura de la DO a 492 nm de la dilución del control positivo/lectura de la DO a 492 nm de la dilución correspondiente del control negativo.
La reproducibilidad se determinó como el coeficiente de variación (CV = DS.100/valor promedio) interplacas en muestras similares en 14 experimentos diferentes y la repetibilidad por el coeficiente de variación de 5 muestras repetidas en un mismo experimento.12-14
Obtención de los Anticuerpos anti-FVIII/vW
Esquemas de Inmunización
Se inmunizaron 12 ratones Balb/c: I = 3 ratones con 25 µg de Ag (F-VIII/vW) semipurificado en Cuba y adyuvante completo de Freund (0,3 mL intraperitoneal); II = 3 con 15 µg y adyuvante completo; III = 3 ratones con 25 µg, mezcla desnaturalizante (Tris 0,002 M, EDTA 0,2 mM, SDS 0,2 % y ß-mercaptoetanol al 1 %) y adyuvante completo; y IV = 3 ratones con 40 µg de Ag sin adyuvante. A la semana se reinmunizaron de igual forma, pero susti-tuyendo el adyuvante completo por el incompleto. A la semana siguiente se realizó la segunda reinmunización igual a la anterior. A la cuarta semana se volvieron a inmunizar los ratones de igual forma y se les extrajo sangre para determinar la presencia de anticuerpos y de inhibidores de F-VIII. A los ratones de los 2 grupos I y III se les realizó una quinta reinmunización con 30 µg/mL de Ag. La última dosis de F-VIII/vW se aplicó siempre de 3 a 4 días antes de la fusión.Esquema de fusión
Se realizaron 2 fusiones. Para la hibridización celular se empleó la línea de mieloma de ratón P3X63Ag-8-653 no secretora de inmunoglobulinas y los esplenocitos de 2 ratones Balb/c hiperinmunes. Para la fusión se usó 30 % v/v de PEG. Las células híbridas se resuspendieron en medio RPMI 1640 con SFB al 20 %, antibióticos, L-glutamina 2 mM, piruvato de sodio 1 mM, hipoxantina-aminopterina-timidina (HAT) y se sembraron en placas de 96 pocillos con fondo plano. Se utilizó como suplemento capa alimentadora células de peritoneales de ratón (CPR) o medio condicionado de cultivo de glioblastoma productores de interleucina-6 (MCG). A los 15 días de cultivo se observó con una lupa de espejo el número de pocillos con crecimiento celular para calcular el porcentaje de los positivos por placa (eficiencia de fusión) y para comprobar si correspondían a los positivos hallados por el método ELISA.15,16Clonaje y subclonajes
Los clonajes se realizaron por dilución limitante y los clones positivos por ELISA, y con actividad biológica específica se reclonaron 3 veces para asegurar la monoclonalidad del anticuerpo.Obtención de líquido ascítico
El líquido ascítico se obtuvo a partir de los clones positivos por medio de la inyección intraperitoneal de 106 células a ratones Balb/c que habían recibido el día anterior 0,5 mL de adyuvante incompleto de Freund.17Actividad biológica específica
La dosificación de inhibidores de F-VIII se realizó con 50 µL del plasma de los ratones hiperinmunes o SN, según el método de Kasper y otros.18Resultados
Las condiciones óptimas del ELISA fueron las siguientes:La concentración de Ag adsorbida a la microplaca que determina los valores de DO más elevados para el suero C+ fue de 12 µg/mL, con un tiempo de sensibilización de la placa de 90 minutos a 37 °C o 18 horas a 4 °C, indistintamente; lavados por 3 veces con PBS-gelatina-Tween; bloqueo con leche descremada y suero de la especie animal correspondiente al antisuero usado en el conjugado. Se realiza este paso 2x, antes de dispensar las muestras durante 1 hora y antes de añadir el conjugado por 15 minutos; incubación de las muestras durante 2 horas a 37 °C y dilución óptima del conjugado: 1:2 000 en PBS-Tween.
Para obtener un resultado reproducible fue necesario diluir el conjugado y el peróxido inmediatamente antes de ser utilizados y no almacenar nunca la SB de carbonato por más de 7 días a 4 °C.
La RE resultó máxima: 9,3, cuando ambos sueros C+ y C- se diluyeron 1:4 000 y resultó de 4 a 5 en las diluciones siguientes hasta, 1:64 000 (fig. 1).
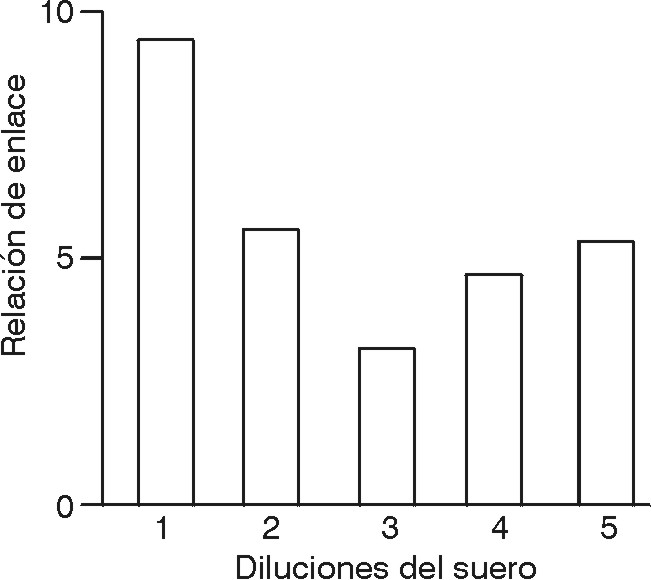
La RE promedio resultó 6,84 +/- 1,99 (n = 10).
La curva de las concentraciones de los Acs anti-F-VIII/vW en el suero murino hiperinmune (logaritmo de las diluciones de los C+ - C-, en el eje X, y la DO a 492 nm, en el eje Y) realizada por el método ELISA, en las placas sensibilizadas con el F-VIII/vW purificado en Cuba como Ag, se representa en la figura 2.
]
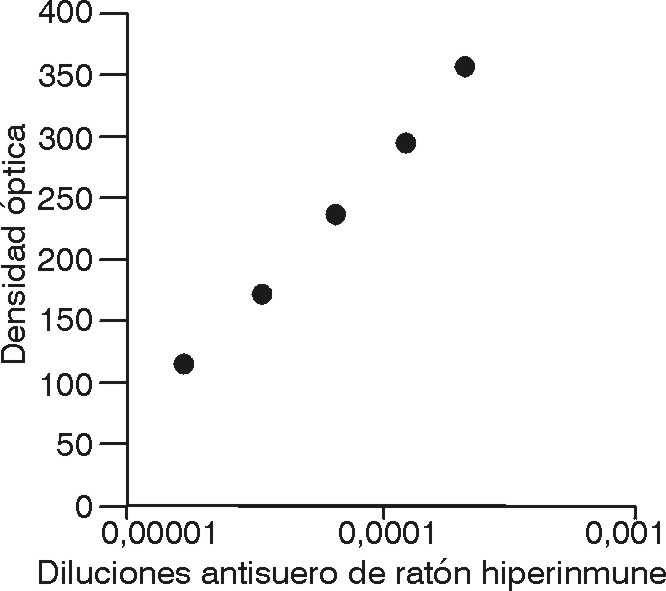
La dilución 1:64 000 del suero con Ac anti-F-VIII/vW correspondió a la DO de 1,30 (valor límite < 0,4).
El coeficiente de variación interplacas para el C+ (suero murino hiperinmune) fue de 8,03 % y el coeficiente de variación intraplaca para el C+ fue de 9,54 %.
Se obtuvieron resultados positivos (lecturas de DO > 0,4 de acuerdo con el valor límite y con RE > 3,5) en los ratones inmunizados con 50 µg de Ag y con la combinación de 25 µg de Ag y mezcla desnaturalizante a partir de la tercera inmunización.
Después de la cuarta dosis, los sueros de todos los ratones inmunizados fueron positivos con todas las combinaciones ensayadas.
El resultado de la determinación de Acs inhibidores de F-VIII (actividad biológica específica), correspondió con el obtenido por este método ELISA.
La eficiencia de fusión fue de 91,27 % cuando se empleó CPR como suplemento y 95,31 % con MCG.
Se obtuvieron varios clones positivos y el subclon 1H8.2D8, fue estable con valores positivos por la técnica descritas y con actividad biológica específica.
El resultado del ELISA realizado a los subclones (S) con buen crecimiento celular y en los líquidos ascíticos (A), en las placas sensibilizadas con los reactivos comerciales: F-VIII, F-vW, y fibrinógeno, se representan en la tabla. Se encontró actividad biológica específica en los 4 últimos subclones.
| No. | | | | |
| A-24 | | | | |
| A-25 | | | | |
| A-26 | | | | |
| A-28 | | | | |
| S-7 | | | | |
| S-8 | | | | |
| S-9 | | | | |
| A-30 | | | | |
| A-31 | | | | |
| A-32 | | | | |
| A-34 | | | | |
Discusión
Este sistema ELISA detecta Ac anti-F-VIII/vW en suero de ratones Balb/c hiperinmunes en diluciones de hasta 1:64 000, con una RE generalmente > 5 y también en SN de los cultivos de hibridomas productores de estos anticuerpos con la posibilidad de distinguir bien entre las reacciones positivas y negativas, aún poco tiempo después de la fusión o del aislamiento de colonias recién clonadas con pocas células viables, y por lo tanto, con concentraciones relativamente bajas de anticuerpos.Como en este ELISA se utilizaron en la fase sólida preparaciones semipurificadas, es posible que no se uniera una gran cantidad de proteína específica a la misma, y como también las proteínas contaminantes pudieron interferir en la técnica, fue necesario utilizar varias sustancias para bloquear los sitios inespecíficos y obtener los resultados esperados; además, fue necesario no prolongar el tiempo de incubación de las muestras por más de 2 horas para evitar las reacciones inespecíficas. Se ha planteado que las preparaciones de F-VIII/vW, aún las altamente purificadas, suelen estar muy contaminadas con otras proteínas plasmáticas tales como el fibrinógeno, lo cual crea dificultades en los pesquisajes, por lo que se utilizó como control negativo esta proteína y también fibronectina humana, además de los SN de líneas celulares humanas y múridas para descartar la presencia de reacciones cruzadas, las cuales no se observaron en la mayoría de los experimentos, lo que indica una adecuada especificidad del Ac.
Es posible que lo señalado anteriormente influya en que la reproducibilidad y la repetibilidad se correspondan con los valores permisibles de CV correspondientes a los estudios enzimáticos ( < 10), en lugar de encontrarse dentro del rango aceptado para las determinaciones químicas.19
La obtención de un clon de hibridoma estable productor de AcMo anti-F-VIII/vW permitió comprobar la utilidad de este ELISA, de los esquemas de inmunización y de la metodología de fusiones y clonajes descritas, las cuales se pueden emplear en la obtención futura de otros AcMo múridos que permitan la purificación de concentrados de F-VIII/vW por la adhesión del Ac a una matriz.
Este método de purificación por inmunoafinidad permitiría no sólo la producción de preparados altamente purificados con fines terapéuticos, sino también la de plasma depletado de F-VIII, lo cual es un proceder ético en la actualidad, debido a la relativamente alta prevalencia de seropositividad al VIH en los pacientes con hemofilia A, cuyo plasma se suele utilizar como sustrato específico en ensayos de coagulación.20
Es importante destacar que aunque varios subclones tenían especificidad anti-F-vW o anti-F-VIII solamente, lo cual puede ser útil en la purificación de esas proteínas por separado con fines diagnóstico-específico o para estudios de estructura/función, la mayoría de los subclones, con actividad biológica positiva eran productores de AcMo contra el complejo anti-F-VIII/vW, lo que resulta muy útil en los pacientes con los distintos tipos de hemofilia, ya que la mitad F-VIII:C está muy relacionada con la mitad F-vW, que la protege, estabiliza y transporta.
La técnica de ELISA indirecto desarrollada resulta útil para el pesquisaje de AcMo anti-FVIII/vW tanto en suero hiperinmune, como en SN de cultivo de hibridomas o en ascitis múrida. Se podría utilizar, luego de modificada, como ELISA sandwich para el diagnóstico de la deficiencia de FVIII en humanos, todo lo cual es de interés científico y social, además resultó económica, pues los inmunorreactivos fundamentales que se utilizaron se produjeron en Cuba: Ag F-VIII/vW semipurificado y conjugados, de los que se ensayaron, además del comercial, otros 2 producidos en el Instituto de Hematología e Inmunología.
Además, los esquemas de inmunización de ratones Balb/c presentados y los métodos de fusión, clonajes y producción de ascitis múrida con resultados positivos en la generación de AcMo anti-FVII/vW comprobado por el ELISA y por la actividad específica de anticuerpos inhibidores de F-VIII, se pueden aplicar a la generación de un nuevo AcMo anti-FVIII/vW para la ulterior purificación por inmunoafinidad del complejo proteico FVIII/vW con fines terapéutico/diagnóstico: tratamiento de la hemofilia y confección de estuches ELISA para diagnóstico de estas afecciones. Es la primera vez que en Cuba se normaliza un ELISA con este fin, y que se obtiene un AcMo con actividad anti-FVIII/vW.
Summary
An enzime immunoassay (ELISA) that detects anti-Factor VIII/von Willebrand (FVIII/vw) antibodies with a binding relationship > 5 that allows the early recognition of such antibodies in the cultures of murine hybridomas is described. Semipurified preparations of FVIII/vw obtained in Cuba were used for the adsorption of the immunoassay plates. Balb/c mice were immunized in order to generate the monoclonal antibodies detected by this ELISA. A clone with stable growth and several positive subclones were obtained by ELISA with specific biological activity of FVIII-inhibiting antibodies.Subject headings: VON WILLEBRAND FACTOR; HYBRIDOMAS; ANTIBODIES; ENZYME-LINKED IMMUNOSORBENT.
Referencias Bibliográficas
1. Stel HV, Sakariassen KS, Scholte BJ, Veerman EC, van der Kwast ThH, de Groot PhG, et al. Characterization of 25 monoclonal antibodies to Factor VIII-von Willbrand Factor: relationship between ristocetin-induced platelet aggregation and platelet adherence to subendothelium. Blood 1984;63:1408-15.
2. Wion KL, Kelly D, Summerfield JA, Tuddenham EG, Lawn RM. Distribution of Factor VIII mRNA and antigen in human liver and other tissues. Nature 1985;317:726-9.
3. Vehar GA, Keyt B, Eaton D, Rodríguez H, OBrien DP, Rotblat F, et al. Structure of human Factor VIII. Nature 1984;312:337-42.
4. Aronson DL, Ping CH. Activated F-VIII in the therapeutic preparations: analysis by ultracentrifugation. Vox Sang 1996;71:142-9.
5. Schulte AM, Esch J, Cruz MA, Siegel JB, Anrather J, Robson SC. Activation of human platelets by the membrane-expressed A1 domain of von Willebrand Factor. Blood 1997;90:4425-4437.
6. Precup JW, Kline BC, Fass DN. A monoclonal antibody to Factor VIII inhibits von Willebrand Factor binding and thrombine clivage. Blood 1991;77:1929-36.
7. Meyer D, Zimmerman TS, Obert B, Edgington TS. Hybridoma antibodies to human von Willebrand Factor. Caracterization of seven clones. Br J Haematol 1984;57:597-608.
8. Handley HH, Glassy MC, Cleveland PH, Royston I. Development of a rapid microELISA assay for screening hybridoma supernatans for murine monoclonal antibodies. J Immunol Meth 1982;54:291-296.
9. Benson RE, Catalfamo JL, Brooks M, and Dodds J. A sensitive immunoassay for von Willebrand Factor. J Immun 1991;12:371-90.
10. Ingerslev J, Stenbjerg. Enzyme linked immunosorbent assay (ELISA) for the measurement of factor VIII coagulant antigen (CAg) using hemophilic antibodies. Br J Haematol 1986;2:325-32.
11. Rubio R, Almagro D, Alberto G. Determinación de Factor VIII/von Willebrand mediante un antisuero de producción nacional. Rev Cubana Hematol Inmunol Hemoter 1987;3(2):241-50.
12. McCullough KC, Parkinson D. The standardization of a spot-test ELISA for the rapid screening of sera and hybridoma cell products I. The determination of the optimum buffering system. J Biol Stand 1984;112:64-74.
13. _____. The standardization of a spot-test ELISA for the rapid screening of sera and hybridoma cell products I. The determination of binding capacity, binding ratio and coefficient of variation of differnt ELISA plates in sandwich and indirect ELISA. J Biol Stand 1984;112:75-86.
14. De la Guardia E, Riverón L, Dubed M, Navea L, Rivero R. Normalización de una técnica de inmunoensayo (ELISA inidirecto) para el pesquisaje de anticuerpos monoclonales de ratón anti-VIH-1. Rev Cubana Hematol Inmunol Hemoter 1992;8:111-9.
15. Avner P, Arnaud D, Sultan Y, Maisonneuve P, Jeanneau. Internacional Symposium on Monoclonal Antibodies: standardization of their characterization and use. Paris, 1983. Develop Biol Stand 1984;57:69-76. S Karger, Basel.
16. González R, Suárez LE, Rivero RA, Martínez M, Guevara A, González JM, et al. Utilización de glioblastomas en la obtención de medios condicionados para la generación de hibridomas múridos secretores de anticuerpos monoclonales. Rev Cubana Hematol Inmunol Hemoter 1993;9:81-5.
17. Rivero RA, Suárez LE, Bencomo AA, González R, González JM, Palma LE, et al. Generación de un hibridoma de ratón secretor de anticuerpos monoclonales contra el antígeno del grupo sanguíneo A del sistema ABO humano. Biotecnol Aplicada 1995;12:23-9.
18. Kasper CK. A More uniform mesurements fo Factor VIII inhibitors. Tromb Diath Haemonh 1975;34:869.
19. Thielmann K. Principios de Metodología en Bioquímica Clínica. La Habana: Ed. Organismos, Instituto Cubano del Libro, 1973:63.
20. Rothschild C, Amiral J, Adam M, Medyer D. Preparation of Factor-VIII-depleted plasma with antibodies and its use for the assay of Factor-VIII. Haemostasis 1990;20:321-8.
Recibido: 18 de septiembre de 1998. Aprobado: 28 de diciembre de 1998.
Dra. Renée González Sampedro. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba.
Teléf. (537)578268. Fax(537)338979.e-mail:ihidir@hemato.sld.cu














