Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.1 Ciudad de la Habana ene.-abr. 1999
Producción
Instituto de Hematología e InmunologíaPurificación del componente C1s del sistema complemento y obtención de un antisuero específico
Lic. Ada A. Arce Hernández,1 Ing. Ed J. Nieuwahuys2 y Dr. Andrew J. Hannema2Resumen
Se describe un método de purificación del componente C1s del sistema complemento a partir de una mezcla de sueros normales mediante cromatografías secuenciales en DEAE-celulosa, TEAE-celulosa y Sephacryl S-200. La presencia de C1s en las fracciones eluídas en las diferentes corridas cromatográficas se detectó por nefelometría. La pureza del C1s obtenido se determinó por inmunoelectroforesis contra un suero antiproteínas séricas humanas y un antisuero específico. A partir del C1s purificado se produjo en conejos un antisuero de buena calidad, útil para la cuantificación del C1s sérico.Descriptores DeCS: COMPLEMENTO 1S/aislamiento & purificación; CROMATOGRAFIA DEAE-CELULOSA/métodos; SUEROS INMUNES.
El C1s es el primer componente de la vía clásica del sistema del complemento, el cual es un complejo formado por 3 proteínas: El C1q, el C1r y el C1s.1 Después de la unión de la molécula del C1 a la región Fc de las inmunoglobulinas IgG e IgM por la sub-unidad C1q, se inician procesos intramoleculares que dan lugar a la genera-ción de una enzima proteolítica (C1s), la cual puede escindir el C2 y el C4 de la vía clásica del complemento.2
Para el estudio de los eventos involucrados en el proceso intramolecular de activación del C1s, es esencial obtener proteínas altamente purificadas, inmuno-químicamente homogéneas en forma no activada y en estado nativo.3
Se ha demostrado que niveles disminuidos de C1s favorecen un aclara-miento defectuoso de inmunocomplejos de la circulación, así como una ineficiente activación del sistema del complemento a través de la vía clásica, lo que explica la posible asociación con enfermedades asociadas con inmunocomplejos como el lupus eritematoso sistémico y las infecciones con bacterias piógenas, de ahí la importancia de su medición.4,5
El objetivo de este trabajo fue la purificación del C1s mediante una combinación de cromatografías de intercambio iónico y filtración en gel, y la posterior obtención de un antisuero específico.
Métodos
Fuente de C1s: 1 200 mL de suero normal humano de donantes del Central Laboratory of The Netherlands Red Cross Blood Transfusion Service. La sangre se dejó coagular a temperatura ambiente por espacio de 2 horas, se centrigugó a 2 000 rev/min durante 20 minutos y el suero obtenido se conservó a -80 °C hasta su uso.Aislamiento de C1s: 1 200 mL de suero normal con una concentración de 35 µg/mL, determinada por nefelometría,6 se precipitaron a pH 7,0 con ácido acético glacial puro a 0 °C, manteniendo un control estricto de la temperatura. El precipitado se dializó a 0 °C durante 4 horas con 10 L de solución amortiguadora de fosfato de sodio 0,013 M, pH 7,0 conductividad 1,8 mmhos/cm. Se centrifugó a 9 000 rev/min durante 30 minutos a 4 °C (Sorval G-53), y el precipitado obtenido se lavó 2 veces con 250 mL de la solución amortiguadora de diálisis y se disolvió en 250 mL de solución amortiguadora de fosfato de sodio 0,047 M, pH 7, 0, 0,04 M NaCl, 0,001 M EDTA.
La muestra se fraccionó mediante cromatografía de intercambio iónico en una resina de DEAE-celulosa en una columna de 10,5 x 12 cm equilibrada con solución amortiguadora de fosfato de sodio 0,047 M, pH 705, 0,04 M NaCl, 0,001 M EDTA con una conductividad de 9,3 mmhos/cm. Se lavó la columna con 2 L de la solución amortiguadora inicial, eluyéndose una parte de las proteínas. A continuación se empleó un gradiente lineal de concentración de NaCl (1,8 L de la solución amortiguadora inicial - 1,8 L de la misma solución amortiguadora que contenía 0,18 M NaCl), con un flujo de 20 mL/h. Las fracciones que contenían el C1s se unieron y se ajustaron a pH 8,0 con NaOH 2 N y conductividad de 14 mmhos/cm, aplicándose a una columna de 2,5 x 35 cm de TEAE - celulosa equilibrada con solución amortiguadora de fosfato de sodio 0,047 M, pH 8,0, 0,09 M NaCl, 0,001 M EDTA (14 mmhos/cm).
La columna se lavó con 1,5 L de esta misma solución amortiguadora y las proteínas adsorbidas se eluyeron con un gradiente de concentración de NaCl (1,5 L de la solución amortiguadora inicial -1,5 L de la misma solución que contenía 0,2 M NaCl). Las fracciones eluidas en el pico que contenía el C1s se unieron y se concentraron por ultrafiltración con un filtro de Amicon YM 10 (Amicon Corporation) hasta un volumen de 1,5 mL, y se aplicó a una columna de 2 x 100 cm de Sephacryl S-200 equilibrada con una solución amortiguadora de fosfato de sodio 0,0047 M, pH 7,5, 0,1 M NaCl, 0,001 M EDTA, con una conductividad de 15 mmhos/cm. Se unieron las fracciones en las que se detectó la presencia de C1s por nefelometría y se realizó una precipitación diferencial con sulfato de amonio al 33 %.7
El precipitado se redisolvió en solución amortiguadora fosfato salina y se controló la fuerza por inmunoelectroforesis,8 con el empleo de un suero anti-proteínas séricas humanas y un suero anti C1s; se observó en ambos casos una sola línea de precipitación al C1s.
El C1s purificado se concentró por ultrafiltración con un filtro Amicon Ym 10 hasta 50 mL y se conservó a -80 °C.
La concentración del C1s se determinó mediante inmunodifusión radial simple, con el uso de placas comerciales.9
Preparación de un suero anti C1s: el suero anti C1s se obtuvo en conejos, después de una inyección de 100 mg de C1s con adyuvante completo de Freund cerca de los nódulos linfáticos poplíteos.
Cuatro semanas después se inyectaron por vía intramuscular y subcutánea 150 mg de C1s con adyuvante incompleto de Freund, después de una semana los animales se desangraron,10 y se comprobó la especificidad del antisuero por inmunoelectroforesis.
Resultados
En la figura 1 se observa el cromatograma en DEAE-celulosa a pH 7,5. Las proteínas adsorbidas en la resina eluyeron con un gradiente lineal de concentración salina.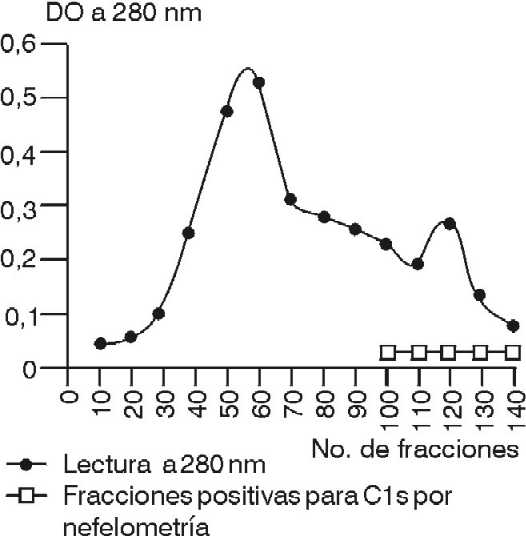
Con las condiciones empleadas en la cromatografía de intercambio iónico en TEAE-celulosa, una gran cantidad de proteínas pasaron a través de la columna. La aplicación de un gradiente salino lineal dio como resultado la elución del C1s (fig. 2).
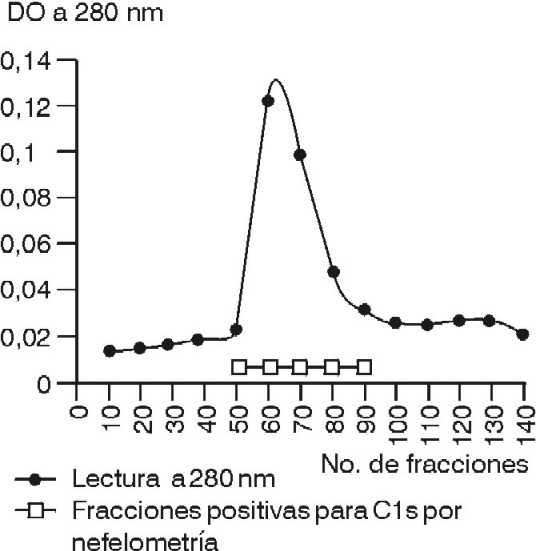
El resultado obtenido producto de la cromatografía de filtración en Sephacryl S-200, se presenta en la figura 3, donde el pico de proteína del C1s eluye a una posición intermedia.

Se comprobó la obtención de C1s relativamente puro mediante una inmunoelectroforesis con el empleo de un suero anti-proteínas séricas humanas y un suero anti C1s comercial. De igual forma se obtuvo una línea de precipitación en la inmunoelectroforesis, empleando el suero anti C1s obtenido contra suero normal humano.
El rendimiento logrado a partir de los 1 200 mL de muestra inicial fue del 35 %.
Discusión
Estudios anteriores de Sakai y Stroud11 indicaron que el C1s se puede precipitar del suero a un pH entre 5,4 y 7,0, manteniendo un control estricto de la temperatura durante la precipitación inicial a 0 °C; sin embargo, este control no es necesario para los siguientes pasos.La cromatografía de intercambio iónico es uno de los procedimientos más comunes empleados en la purificación de componentes del sistema complemento.12-14 La utilización de cromatografías de intercambio iónico en DEAE-celulosa y TEAE-celulosa son pasos necesarios para la obtención de altos rendimientos de C1s.15
En la fase inicial del proceso de purificación de C1s se emplearon 2 inter-cambiadores iónicos, DEAE-celulosa y TEAE-celulosa, que son celulosas de elevada capacidad especialmente para moléculas grandes, además de ser resinas estables y duraderas.16
La cromatografía en DEAE-celulosa se utilizó como una primera etapa en una columna corta y ancha que facilitaba el procesamiento de un gran volumen de muestra, con el objetivo de concentrarla, y eliminar gran parte de los contaminantes.
En una segunda etapa se utilizó una columna de menor volumen, larga y estrecha, que contenía resina de TEAE-celulosa, para lograr el fraccionamiento de las proteínas y una mejor separación con el gradiente empleado. A partir de las condiciones empleadas, una gran cantidad de proteínas pasaron a través de la columna, incluyendo las inmunoglobulinas G y M, factor D y lipoproteínas. Por medio de inmunoelectroforesis se detectó la presencia de algunos contaminantes, en las fracciones que contenían C1s.
Las condiciones de la solución amortiguadora de elución se ajustaron tomando en cuenta que a bajas concentraciones y pH de 7,0 o menores, no se logra un buen intercambio en la resina con diversas proteínas, lo que facilita la elución posterior del C1s.17 A continuación se empleó un gradiente lineal de concentración con el objetivo de desunir al C1s de la resina.
La cromatografía de filtración en Sephacryl S-200 permitió separar el C1s de los contaminantes, que se separaron en 2 pequeños picos, que eluyeron antes y después del pico principal que contenía el C1s.
Con el objetivo de concentrar el C1s se efectuó una precipitación con sulfato de amonio al 33 %. Estudios preliminares han revelado que el C1s precipita completamente al 33 % de saturación.18 El resultado es un C1s relativamente puro, según se comprobó mediante la inmunoelectroforesis con un antisuero anti-proteínas séricas humanas y otro específico.
Se obtuvo un redimiento del 35 % de C1s relativamente puro, lo que es similar a lo planteado por otros autores.11,19 Se inmunizó a un grupo de conejos con el C1s aislado, para lo cual se utilizó adyuvante de Freund, que favorece una buena respuesta por parte del animal, dirigida principalmente al componente principal, en este caso el C1s, ya que no se descarta que pudieran existir trazas de algún contaminante.10
Además, el empleo de bajas concentraciones de antígeno permite la síntesis de anticuerpos de alta afinidad, muy útil en diversas técnicas.20
Resulta importante destacar el alto costo de este producto: 53,90 USD 50 µg de C1s (SIGMA Chemical Co.), y el costo aproximado de su producción en el laboratorio es de 4,50 USD. A esto se añade su utilidad en el seguimiento de diversas enfermedades y en procesos sépticos.
Los resultados presentados muestran la aplicación de un método de purificación del componente C1s del sistema complemento a partir de suero normal humano, con el cual se logra un buen redimiento, con una pureza adecuada, lo que se demostró mediante la producción de un antisuero de calidad.
Summary
A method to purify the C1s component of the complement system starting from a mix of anormal sera by sequential chromatographies in DEAE-cellulose, TEAE cellulose and Sephacryl S-200 is described. The presence of C1s in the fractions eluted in the different chromatographic runs is detected by nephelometry. The purity of the C1s obtained is determined by immunoelectrophoresis against an antihuman serum protein serum and a specific antiserum. A good quality antiserum, useful for the quatitation of serum Cls, was produced in rabbits starting from purified C1s.Subject headings: COMPLEMENT 1S/isolation & purification; CHROMATOGRAPHY, DEAE-CELLULOSE/methods; IMMUNE SERA.
Referencias Bibliográficas
1. Lepow IH, Naff GB, Todd EW, Pensky J, Hiz CF. Chromatographic resolution of the first component of human complement into three activities. J Exp Med 1963;117:983-1008.
2. Porter RR, Reid KBM. The biochemistry of complement. Nature 1978;275:699-703.
3. Sledge CR, Bing DH. Purification of the human complement protein C1q by affinity chromatography. J Immunol 1973;111:661-6.
4. Figueroa JE, Densen P. Infectious diseases associated with complement deficiences. Clin Microbiol Rev 1991;4:359-95.
5. Colten HR, Rosen FS. Complement deficiencies. Annu Rev Immunol 1992;10:809-34.
6. Stites DP. Métodos clínicos de laboratorio para la detección de antígenos y anticuerpos. En: Stites DP, Stobo JD, Fudenberg HH, Wells VJ, eds. Inmunología básica y clínica. 5 ed. La Habana;1985:338-9. (Edición Revolucionaria).
7. Heide K, Schwick HG. Salt fractionation of immunoglobulins. En: Weir DM, ed. Handbook of experimental immunology. Immunochemistry. London: Blackwell Scientific, 1978;vol:7,1-7,11.
8. Ouchterlony O, Nilson LA. Immunodiffusion and immunoelectrophoresis. En: Weir DM, ed. Handbook of experimental immunology. Vol. 1. Oxford: Blackwell Scientific, 1986;vol 1:32,1-32,50.
9. Mancini G, Carbonara AO, Heremans JF. Inmunochemical quantitation of antigens by single radial inmunodiffusion. Inmunochemistry. 1965;193:265-373.
10. Margni R. Inmunología e inmunoquímica. La Habana: 1982:121-3 (Edición Revolucionaria).
11. Sakai K, Stroud RM. The activation of C1s with purified C1r. Immunochemistry 1974;11:191-6.
12. Harrison RA, Lachman PJ. Complement technology. En: Weir DM, ed. Handbook of experimental immunology. Oxford: Blackwell Scientific, 1986;vol 1:39,1-39,49.
13. Karlsson E, Ryden L, Brewer J. Ion exchange chromatography. En: Janson JC, Ryden L, eds. Protein purification, principles, high resolution methods and application. New York: VCH Publishers, 1989:107-48.
14. Lowe CR, Dean PDG. The principles of affinity chromatography. En: Lowe CR, Dean PDG, eds. Affinity chromatography. London: Wiley and Sons, 1974:12-89.
15. Lesavre PH, Huglic TE, Esser AF, Muller-Eberhard HJ. The alternative pathway C3/C5 convertase. Chemical basis of factor B activation. J Immunol 1979;123:529-34.
16. Margni R. Inmunología e inmunoquímica. La Habana: 1982:459-62 (Edición Revolucionaria).
17. Fahey JL. Chromatography separation of immunoglobulins. En: Williams CA, Chase MW, eds. Methods in immunology and immunochemistry. New York: Academic, 1967; vol 1:321-32.
18. Grabar P, Williams CA. Méthode permettant letude conjuguée des proprietés électrophoretiques et immunochímiques dun melange de protéines. Application au sérum sanguin. Biochim Biophys Acta 1953;10:193-8.
19. Valet G, Cooper NR. Isolation and characterization of the proenzyme form of C1s subunit of tyhe first complement component. J Inmunol 1974;112:339-50.
20. Steward MW. Intruction to methods used to study the affinity and kinetics of antibody-antigen reactions. En: Weir DM, ed. Handbook of experimental immunology. Vol I. Oxford: Blackwell Scientfic, 1986;vol 1:25,1-25-30.
Recibido: 2 de junio de 1998. Aprobado: 2 de octubre de 1998.
Lic. Ada A. Arce Hernández. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba.
Teléf. (537)578268. Fax(537)338979.e-mail:ihidir@hemato.sld.cu
1 Instituto de Hematología e Inmunología, Ciudad de La Habana, Cuba.
2 Central Laboratory of Blood Transfusion. The Netherlands.














