Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.3 Ciudad de la Habana sep.-dic. 1999
Instituto de Hematología e Inmunología
Efecto agregante plaquetario de 2 citolisinas: Sti y Stii purificadas de la anémona marina Stichodactyla Helianthus
Lic. Alina Díaz Concepción,1 Lic. Alberto Brito Martínez,1 Dra. Mayra Tejuca Martínez,2 Dr. Carlos Álvarez Valcárcel,2 Dra. María E. Lanio,2 Dra. Delfina Almagro Vázquez1 y Dra. Marianela Estrada del Cueto1RESUMEN
Las citolisinas Sticholysina I (St I) y Sticholysina II (St II) inducen la agregación plaquetaria en el plasma rico en plaquetas en el rango de concentraciones ensayadas (0,5 a 10 µg/mL). Para ambas citolisinas se obtienen porcentajes de agregación plaquetaria superiores al 90 % con menos del 50 % de lisis celular. La agregación plaquetaria se mantiene elevada aún cuando la lisis celular disminuye a menos del 20 %. El EDTA 2 mM/L y el verapamilo 100 mM/L inhiben significativamente la agregación inducida por StI, lo que evidencia que el calcio extracelular tiene una función importante en este proceso y probablemente esta citolisina tiene una función similar a la de un ionóforo de calcio. Con StII no se obtuvo inhibición significativa de la agregación en presencia de EDTA y verapamilo. La agregación inducida por ambas citolisinas no está influida por el aumento del AMPc intracelular y es independiente de la formación de tromboxano A2 en la plaqueta.Descriptores DeCS: CITOTOXINAS/aislamiento & purificación; CRO-MATOGRAFIA EN GEL/métodos; CROMATOGRAFIA POR INTERCAMBIO IONICO/métodos; ANEMONAS DEL MAR; AGREGACION PLAQUETARIA.
Stichodactyla helianthus es una anémona relativamente abundante en los mares de Cuba que presenta grandes potencialidades como fuente de polipéptidos bioactivos. Desde que en 1974 se informó por primera vez la presencia en este organismo de un polipétido con actividad lítica sobre eritrocitos, muchos han sido los esfuerzos dirigidos a la caracterización de las entidades moleculares presentes en el veneno que produce esta anémona. Entre los polipéptidos que componen este veneno se encuentran inhibidores de proteasas,1 un bloqueador de canales K+,2 una fosfolipasa3 y 2 citolisinas: Sticholysina I (StI) y Sticholysina II (StII).4
Las citolisinas de las anémonas (actinaria) se denominan de forma general Actinoporinas, nombre que tiene en cuenta el orden del cual ellas son purificadas y además la propiedad demostrada por algunas de estas proteínas de formar poros en la membrana. Las St I y St II son polipéptidos básicos (PI=9,2 y 9,8) respectivamente y presentan pesos moleculares de 20 KD aproximadamente.4
Las StI y II presentan un mecanismo de lisis que transita por la formación de un poro en la membrana con un radio funcional del orden de 1 nM, originado por la agregación probable de entre 3 y 4 monómeros.5,6 Los iones divalentes muestran una acción selectiva sobre la actividad lítica de ambas citolisinas. El calcio y el manganeso potencian dicha actividad, en tanto el cobalto y el manganeso la inhiben.7
Un estudio anterior sobre el efecto de las citolisinas StI y StII en el mecanismo de la coagulación realizado en nuestro laboratorio, reveló el efecto anticoagulante de StI y StII, al prolongar el tiempo de coagulación en el tiempo parcial de tromboplastina con caolín, el tiempo de protrombina y el tiempo de Stypvencefalina, efecto que se intensifica al preincubar estas citolisinas con el reactivo fosfolipídico.8
El objetivo de este trabajo es estudiar la interacción entre las plaquetas y las citolisinas StI Y StII, así como determinar el efecto de varios agentes farmacológicos en la agregación inducida por StI y StII.
MÉTODOS
Purificación de las citolisinas StI Y StII
Las citolisinas se aislaron a partir del extracto total de la anémona marina Stichodactyla helianthus consistente en un homogenado del cuerpo completo del animal preparado según el procedimiento descrito por Gómez y otros.4 El fraccionamiento de los extractos se realizó mediante la combinación de los métodos cromatográficos de filtración en gel y de intercambio iónico (Tejuca M. Mecanismo de lisis de Sticholisina I, una citolisina de la anémona Stichodactyla helianthus. Tesis doctoral. Facultad de Biología, Universidad de La Habana, 1995).Determinación de la concentración de proteínas
La concentración de proteínas del extracto total y de las diferentes fracciones se determinó mediante el método de Lowry y otros.9 La concentración de proteínas de las citolisinas StI y StII se determinó utilizando los coeficientes de extinción determinados a 280 nm de 2,13 y 1,87 (referidos a una concentración de 1 mg/mL y 1 cm de paso de luz) respectivamente, previamente determinados.10Determinación de la actividad hemolítica
Para la determinación de la actividad hemolítica de StI y StII se preparó una suspensión de eritrocitos frescos humanos lavados y resuspendidos en tampón Tris-HCl 0,145M, pH 7,4. La concentración del estándar de células fue ajustada por adición del tampón para obtener una concentración de células de aproximadamente 1 x 108 células/mL. Para determinar la actividad hemolítica se adicionó StI y StII a 1 mL de la solución del estándar de eritrocitos.Después de adicionar la proteína se incubó durante 30 minutos a 37 °C. Transcurrido este tiempo, las muestras se centrifugaron a 300 g durante 15 min y se determinó la absorbancia del sobrenadante a 540 nm utilizando como referencia un control de 100 % de hemólisis (DO540 nm=1,4).11
Estudios de agregación plaquetaria
La agregación plaquetaria se llevó a cabo mediante el método turbidimétrico de Born12 en un agregómetro Payton, modelo 80 C de doble canal.La investigación del efecto de las citolisinas StI y StII en la agregación plaquetaria se realizó adicionando 25 m L de diferentes concentraciones de las citolisinas (0,5; 1; 1,8; 2,5; 5 y 10 m g/mL) a 500 m L de plasma rico en plaquetas (PRP), cuya cifra de plaquetas fue previamente ajustada a 250 x 109/L con el plasma pobre en plaquetas.
Para estudiar el efecto de algunos agentes farmacológicos en la agregación plaquetaria inducida por StI y StII se incubó el PRP durante 1 min con una de las siguientes sustancias: ácido etilendiaminoitetracélico (EDTA)(2mM/L), ácido acetilsalicítico (ASA)(0,6 mM/L), prostaciclina (PGI2)(3 ng/mL), teofilina (1 mM/L) y verapamilo (100 mM/L) previo a la adición de las citolisinas, las cuales se ensayaron a las concentraciones de 1 y 5 m g/mL. En todos los casos se hace referencia a la concentración final.
Determinación de lactato deshidrogenasa (ldh)
La determinación de LDH se realizó según el método de Wroblewski y otros.13 La agregación plaquetaria en PRP producida por StI y StII se detuvo a los 6 minutos con la adición de 50 m L de EDTA 0,121 M/L. Se estudió el efecto de diferentes concentraciones de StI y StII (1; 2,5; 5 y 10 m g/mL). Las muestras se centrifugaron a 200 g para eliminar los agregados presentes y se determinó la actividad de la LDH en el sobrenadante. Se consideró como lisis plaquetaria total la que se produce al adicionar tritón x-100 al 0,1 % al PRP.RESULTADOS
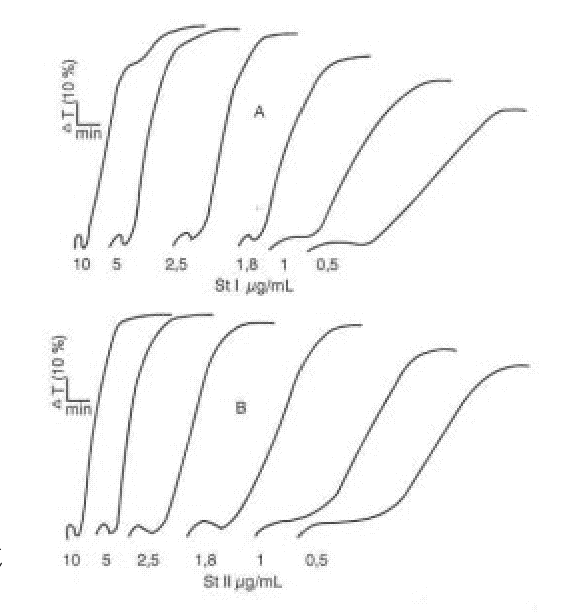
En la figura 1 se muestra el efecto obtenido al adicionar diferentes concentraciones de ambas citolisinas StI y StII al PRP.FIG. 1. Agregación plaquetaria inducida por St I (A) y St II (B).
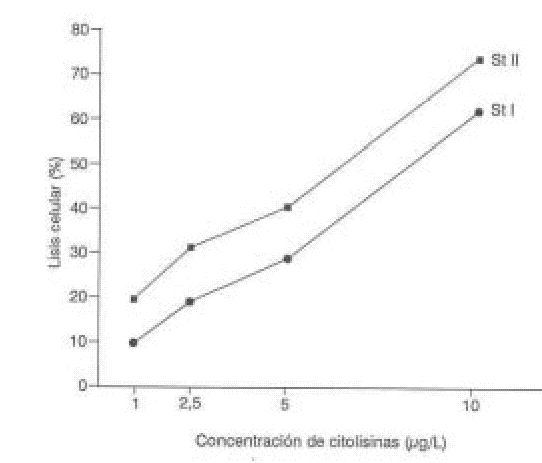
Para determinar la contribución del factor lítico a la agregación plaquetaria, se determinó la actividad de la LDH como marcador de lisis celular en los sobrenadantes obtenidos al centrifugar muestras provenientes de la agregación con diferentes concentraciones de StI y StII. Como se muestra en las figuras 2 y 3, ambas citolisinas causan un aumento progresivo de la lisis plaquetaria.
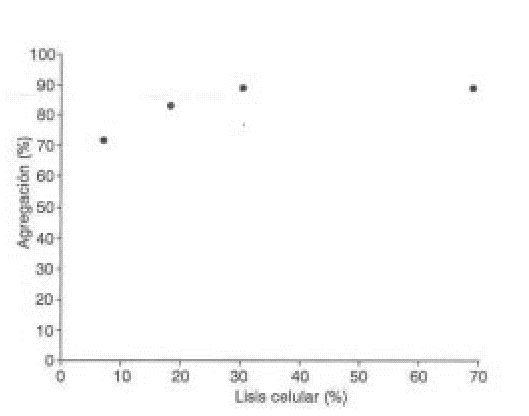
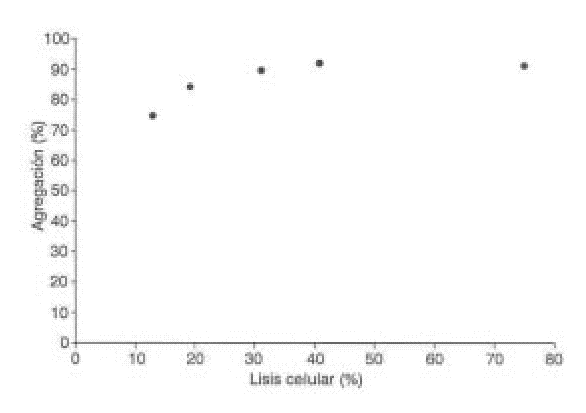
FIG. 3. Relación entre la agregación y la lisis plaquetaria inducida por S tII.
La figura 4 relaciona los porcentajes de lisis celular obtenidos con las diferentes concentraciones de las citolisinas. A la concentración de 10 g/mL se produce la lisis de más del 50 % de las células, que se corresponde con un alto porcentaje de agregación (más del 90 %), la lisis celular cae drásticamente al disminuir la concentración de las citolisinas y se mantiene una agregación superior al 80 %.
En la figura 4 se demuestra que StII es más eficiente líticamente que StI, ya que a los 6 minutos de incubación y para una misma concentración de proteína, con StII se obtiene un 10 % mayor de lisis con respecto a StI.
Al estudiar el efecto de la adición de EDTA 2 mM/L (concentración final) en la agregación plaquetaria inducida por StI y StII, se obtuvo que el EDTA disminuye significativamente la agregación inducida por StI (p < 0,001) en las 2 concentraciones de citolisina ensayadas (fig. 5). El verapamilo es un bloqueador de canales de calcio que inhibe así el influjo de calcio extracelular, es un relajante de la musculatura lisa e inhibe la agregación plaquetaria inducida por colágeno. El verapamilo (100 m m/L) inhibe significativamente la agregación inducida por StI (p < 0,01 para 5 m g/mL y p < 0,001 para 1 m g/mL) (fig. 5).
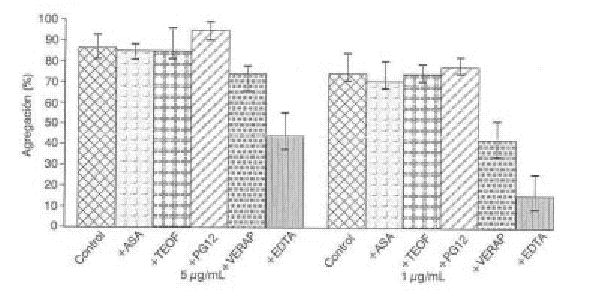
FIG. 5. Efecto de algunos agentes farmacológicos en la agregación plaquetaria inducida por St I. Los porcentajes de agregación están presentados como X ± DE.
ASA: ácido acetilsalicílico; TEO: teofilina; PGI2: prostaciclina; VERAP: verapamilo; EDTA: ácido etilendiaminotetracético.
En la figura 6 se muestra que no hubo inhibición significativa de la agregación inducida por StII en presencia de EDTA y de verapamilo. Se determinó además el efecto de otros agentes farmacológicos en la agregación plaquetaria inducida por ambas citolisinas, como se observa en las figuras 5 y 6. En ningún caso se obtuvo diferencia estadísticamente significativa con respecto al control en la agregación plaquetaria en presencia de ASA 0,6 mM/L, teofilina 100 mM/L y PGI2 3 ng/mL.
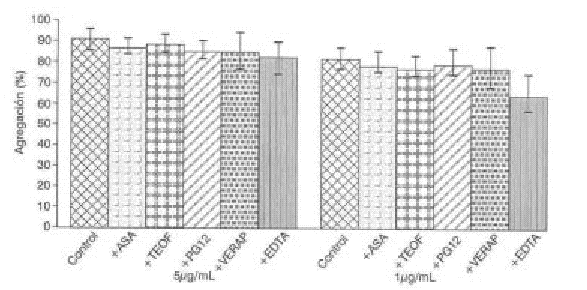
FIG. 6. Efecto de algunos agentes farmacológicos en la agregación plaquetaria inducida por St II. Los porcentajes de agregación están presentados X como ± DE.
ASA: ácido acetilsalicílico; TEO: teofilina; PGI2: prostaciclina; VERAP: verapamilo; EDTA: ácido etilendiaminotetracético.
DISCUSIÓN
Las citolisinas StI y StII son potentes inductores de la agregación plaquetaria en el rango de concentraciones ensayadas, tal como se observa en la figura 1. El efecto agregante fue dependiente de la dosis y alcanzó un máximo entre 10 y 5 m g/mL.Además de la agregación, ambas citolisinas causan un aumento progresivo de la lisis plaquetaria. Como se demuestra en las figuras 2 y 3, aún con bajos porcentajes de lisis (menos del 20 %) se obtuvo una agregación plaquetaria entre 70 y 80 %, resultado similar al obtenido con la equinatoxina14 aislada de la anémona marina Actinia equina, la cual se comporta también como un inductor potente de la agregación plaquetaria. El mecanismo de lisis de StI y StII transita por la formación de un poro en la membrana celular con un radio funcional del orden de 1 nm5,6 que permite la entrada de calcio y de otros iones a las células, lo cual fue demostrado en eritrocitos.
Al parecer StI y StII forman poros también en la membrana plaquetaria, con la consiguiente entrada de iones de calcio del medio extracelular, lo que conduce a la activación de una población de plaquetas las cuales liberan sustancias al medio (ADP, tromboxano A2, serotonina) que amplifican el fenómeno posibilitando la agregación aún con bajos porcentajes de lisis celular.
Esto se comprueba al estudiar el efecto de la adición de EDTA 2 mM/L en la agregación plaquetaria inducida por ambas citolisinas. El EDTA disminuye signi-ficativamente la agregación inducida por StI (p < 0,001). El EDTA es un agente quelante del calcio, por lo que disminuye la concentración de calcio disponible en el medio extracelular. Esto hace que la apertura de poros en la membrana plaquetaria tiene menor efecto desde el punto de vista de la activación y la agregación, ya que la disponibilidad de calcio en el medio no es suficiente para "disparar" dichos eventos con igual intensidad, lo cual corresponde con los resultados obtenidos con el verapamilo (100 m m/L), el cual inhibió significativamente la agregación inducida por StI (fig. 5). El efecto inhibitorio del verapamilo se intensifica al disminuir la concentración de StI, o sea, al disminuir la capacidad líica de la citolisina (por formación de menor número de poros).
El hecho de que el EDTA no inhibió significativamente la agregación inducida por StII (fig. 6), podría explicarse por la mayor capacidad lítica de StII, como se muestra en la figura 4, así como por su mayor actividad hemolítica (dato no mostrado). El verapamilo no inhibió significativamente la agregación inducida por StII (fig. 6), lo que también puede explicarse por el mayor poder de lisis de esta proteína que evita que se manifieste de manera evidente la acción bloqueadora del verapamilo.
Por otra parte, el hecho de no obtener diferencias estadísticamente significativas con respecto al control en la agregación plaquetaria inducida por ambas citolisinas en presencia de ASA 0,6 mM/L, teofilina 100 mM/L y PGI2 3 ng/mL (figs. 5 y 6), indica que la agregación plaquetaria inducida por StI y StII no depende de la formación de tromboxano A2 en la plaqueta ni está influida por el aumento del AMPc.
En conclusión, nuestros resultados indican que el calcio en el medio extracelular tiene un papel importante en la agregación plaquetaria inducida por StI, tal como lo demuestra la inhibición significativa de la agregación plaquetaria en presencia de EDTA y el efecto inhibitorio obtenido por la adición de un agente bloqueador de canales de calcio en la plaqueta como el verapamilo, por lo que es probable que el efecto de StI se asemeje al producido por un ionóforo de calcio; el hecho de que esto no se manifieste significativamente en la agregación plaquetaria inducida por StII se debe probablemente a la mayor capacidad lítica de esta proteína.
SUMMARY
Cytolysing Sticholysina I (St I) and Sticholysina II (St II) induce platelet aggregation in the plasma rich in platelets in the range of assayed concentrations (0.5 to 10 m g/mL). Percentages of platelet aggregation over 90 % with less than 50 % of cellular lysis were obtained for both cytolysins. The platelet aggregation is high even when the cellular lysis decreases to less than 20 %. EDTA 2 mM/L and verapamyl 100 mM/L significantly inhibit the aggregation induced by StI, which shows that extracellular calcium has an important function in this process and that probably this cytolysin plays a role similar to that of a calcium ionophore. With StII there was no significant inhibition of the aggregation in the presence of EDTA and verapamyl. The aggregation induced by both cytolysins is not influenced by the increase of intracellular AMPc and it is independent of the formation of thromboxane A2 in the platelet.Subject headings: CITOTOXINS/isolation & purification; CHROMATOGRAPHY, GEL/methods; CHROMATOGRAPHY, ION EXCHANGE/methods; SEA ANEMONES; PLATELET AGGREGATION.
REFERENCIAS BIBLIOGRÁFICAS
1. Delfín J, González Y, Díaz J, Chávez M. Proteinase inhibitor from Stichodactyla helianthus: purification, characterization and inmobilization. Arch Med Res 1994;25:199-204.
2. Castañeda O, Sotolongo V, Amor AM, Stocklin R, Anderson A, Harvey AL, et al. Characterization of a potasium channel blocker from the Caribbean sea anemone Stichodactyla helianthus. Toxicon 1995;33:603-13.
3. Pazos IF, Álvarez C, Rodeiro I, Lanio ME. Purificación de una fosfolipasa A2 de la anémona marina Stichodactyla helianthus. Rev Biol 1996;19:350-8.
4. Gómez T, Romero L, Wong I, Barral AM, Martínez JR, Mas R, et al. Aislamiento y purificación parcial de dos toxinas y un inhibidor de proteasas de la anémona marina Stichodactyla helianthus. Rev Cubana Invest Biomed 1986;5:117-25.
5. Tejuca M, Dalla Seira M, Ferreras M, Lanio ME, Menestrina G. Mechanism of membrane permabilization by Sticholysin I, a cytolisin isolated from the venom of the sea anemone Stichodactyla helianthus. Biochemistry 1996;35:14947-57.
6. Ríos V de los, Mancheno JM, Lanio ME, Oñaderra M, Gavilanes JE. Mechanism of the leakage induce on lipid model membranes by the Stichodatyla helianthus. Eur J Biochem 1998;252:284-9.
7. Veitía R, Tejuca M, Álvarez C, Lanio ME, Pazos IF. Cinética de la hemólisis inducida por una citolisina de Stichodactyla helianthus: efecto de la temperatura y de cationes divalentes. Rev Biol 1995;9:15-21.
8. Díaz A, Tejuca M, Álvarez C, Lanio ME, Almagro D. Efecto anticoagulante del extracto total y de algunas fracciones aisladas de la anémona marina Stichodactyla helianthus. Rev Iberam Trombol Hemost 1993;5:8-11.
9. Lowry OH, Rosenbrough NJ, Farr AL, Randall RJ. Protein measurements with the folin phenol reagents. J Biol Chem 195;193:265-75.
10. Lanio ME, Morera V, Álvarez C, Tejuca M, Gómez T, Pazos F, et al. Purification and characterization of two hemolysines from Stichodactyla helianthus. Febs Lett 1998 (en prensa).
11. Pazos IF, Álvarez C, Lanio ME, Martínez D, Morera V, Lissi E, et al. Modification of Sticholipin II hemolitic activity by free radicals. Toxicon 1998;36:1383-93.
12. Born G. Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature 1962;194:927-9.
13. Wroblewski F, Ladve JS. Lactic dehydrogenase activity in blood. Proc Soc Exp Biol Med 1955;90:210-3.
14. Teng CM, Lee LG, Lee CY, Ferlan J. Platelet aggregation induced by equinatoxin. Thrombol Res 1988;52:401-11.Recibido: 31 de diciembre de 1998. Aprobado: 29 de enero de 1999.
Lic. Alina Díaz Concepción. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono: (537) 578268. Fax: (537)338979. e-mail:ihidir@hemato.sld.cu
1 Instituto de Hematología e Inmunología.
2 Facultad de Biología. Universidad de La Habana.