Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.17 n.3 Ciudad de la Habana sep.-dic. 2001
Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"
Nuevo sistema homólogo autocatalítico para evaluar citotoxicidad mediada por células dependientes de anticuerpos
Resumen
Se propone un sistema que no requiere marcaje radioisotópico, sensible y sencillo que utiliza células efectoras, células diana y anticuerpos de la misma especie para evaluar citotoxicidad mediada por células dependientes de anticuerpos. La actividad citotóxica se evaluó en células mononucleares periféricas de donantes voluntarios de sangre, aparentemente sanos, y se amplificó en el proceso de lisis mediante la actividad peroxidasa de la hemoglobina liberada por células diana constituidas por eritrocitos O+, papainizados y recubiertos con anti-D. No se evidenció correlación lineal entre índices citotóxicos y relación linfocito/monocito. El método propuesto puede ser utilizado en exploraciones clínicas y experimentales sistemáticas.
DeCS: CITOTOXICIDAD CELULAR ANTICUERPO-DEPENDIENTE/inmunología; INMUNIDAD CELULAR; ERITROCITOR.
En la práctica clínica, la evaluación de la citotoxicidad mediada por células depedientes de anticuerpos es útil para la valoración de la inmunidad celular en pacientes afectados por cáncer, infección viral, bacteriana o autoinmunidad.
Varias poblaciones de linfocitos, los neutrófilos, fagocitos mononucleares y especialmente las células asesinas naturales (NK), son capaces de lisar diferentes tipos de celulas diana. En muchos casos, la muerte de la célula diana requiere que esté recubierta por IgG específica. A este proceso de lisis se le denomina citotoxicidad mediada por células dependientes de anticuerpos (CCDA).1-3
Entre los numerosos métodos in vitro para la evaluación de la CCDA, el radioisotópico, por su sensibilidad y carácter cuantitativo, es más utilizado que los visuales y colorimétricos. Esta superioridad implica instalaciones especiales y equipamiento de alto costo inexistentes en algunos laboratorios cubanos, así como personal entrenado y leyes reguladoras destinadas a proteger al personal técnico y al medio ambiente. Una alternativa sería amplificar la reacción citotóxica aprovechando la actividad enzimática de compuestos presentes sólo en las células diana, que elimina las desventajas de los métodos actuales. Es por esta razón que se ha utilizado en el presente trabajo la actividad peroxidasa de la hemoglobina, liberada por los eritrocitos humanos lisados, para evidenciar la CCDA.4-9
Métodos
Muestra
Se tomaron muestras de sangre venosa de 36 individuos aparentemente sanos, de ambos sexos, donantes voluntarios de sangre que acudieron al Servicio de Transfusiones del Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto" y que cumplían los siguientes criterios de inclusión: adultos menores de 55 años, que no hubieran recibido ningún tipo de hemoterapia ni tratamiento con inmuno-moduladores en los 3 meses previos al estudio. A todos los donantes se les realizó leucograma y se les calculó la relación linfocitos/monocitos.
Aislamiento de células mononucleares periféricas
Las muestras de sangre obtenidas por punción venosa y anticoagulada con heparina libre de preservo (50 UI/mL), diluidas 2:3 con buffer fosfato salino (0,1 mol/L) y pH 7,4 (PBS), se depositaron sobre la mitad del volumen de urovideo 75 % (d = 1,077 g/cm3), en tubos de 13 x 100 mm y se centrifugaron a 2 500 rpm durante 20 min a temperatura ambiente. Posteriormente se extrajo con una pipeta "Pasteur" el anillo que contenía las células mononucleares periféricas (CMP) en la interfaces, y se lavaron 2 veces mediante centrifugación a 1500 rpm durante 15 min con PBS. La concentración se ajustó a 8 x 106 cél/mL en medio esencial mínimo (MEM), libre de rojo fenol.
Obtención y preparación de células diana
En calidad de células diana fueron utilizados eritrocitos O+, conservados en solución de ácido cítrico 7,3 g/L, citrato de sodio 22,0 g/L y dextrosa 24,5 g/L (ACD), por no más de 7 días a 4 °C.
Los eritrocitos O + el día del ensayo se lavaron con solución de cloruro de sodio (0,15 mol/L), y se trataron enzimáticamente con una solución acuosa de papaína al 1 % durante 4 min. Posteriormente se sensibi-lizaron con suero hemoclasificador anti-D durante 1 h a temperatura ambiente y se lavaron con MEM para eliminar los anticuerpos no pegados. Una alícuota de hematíes fue también incubada en las mismas condiciones, pero esta vez, con albúmina 2,5 % como control. Se ajustó la concentración a 8 x 105 cél/mL.10-12
Diseño
El ensayo de CCDA se realizó por cuadruplicado en placas de cultivo de 96 pozos de fondo plano. Los reactivos y la metodología utilizada se detallan en la tabla 1.
Tabla 1. Concentraciones celulares y volúmenes de reacción en microlitros necesarios en el ensayo
| Relación (10:1) Célula efectora/célula diana | Lisis experimental | Lisis espontánea | Lisis máxima |
| CMP 8 ´ 106 cél/mL | 50 |
50 | |
| Eritrocitos sensibilizados/anti-D 4 ´ 105 cél/mL |
100 | ||
| Eritrocitos sensibilizados/albúmina 4 ´ 105 cél/mL | 100 | ||
| Eritrocitos sin sensibilizar 8 ´ 105 cél/mL | 50 | ||
| Agua destilada | 100 |
Una vez dispensadas las células (efectoras y diana) en los pozos de la placa de cultivo, ésta fue centrifugada a 1 000 rpm durante 1 min e incubada a 37 °C durante 4 h. Después de este proceso, se homogeneizó la mezcla de reacción en cada pozo por resuspensión, con ayuda de una pipeta "Pasteur", y se centrifugó a 1 000 rpm durante 5 min. Seguidamente se tomó una alícuota de 70 mL del sobrenadante y se mezcló con 100 mL de buffer citrato (0,1 mol/L) y pH 5,6, se le adicionaron 0,5 mL/L de peróxido de hidrógeno al 30 % y 0,6 g/L orto fenilendiamino (OPD), y se incubó a 37 °C durante 30 min en la oscuridad. La reacción enzimática fue detenida por la adición de 30 mL de una solución de metabisulfito de sodio (0,5 mol/L) y la densidad óptica se midió a 450 nm contra blanco reactivo en un espectrofotómetro UV/visible.
El grado de lisis de las células diana fue fijado por la liberación de hemoglobina durante 4 h de incubación a 37 °C (densidsad óptica, DO 450 nm) y expresado en porcentaje (%) de lisis específica mediante la fórmula:
![]()
Procesamiento estadístico
Los datos primarios se procesaron de forma automatizada mediante el paquete estadístico STATISTICA. Se aplicó un test T a las cifras medias de hemólisis, expresadas en DO a 450 nm, para conocer diferencias entre sustancias sensibilizantes, y un test de correlación entre porcentaje de lisis específica y relación linfocito/monocito. El nivel de significación se fijó en una p £ 0,05.
Resultados
Los valores promedios de hemólisis cuando se utilizaron hematíes recubiertos con anti-D fueron estadísticamente diferentes a los de los hematíes control, es decir, a los tratados con albúmina al 2,5 % que no fueron recubiertos con anti-D (tabla 2).
Tabla 2. Indicadores de actividad citotóxica, expresados en unidades de densidad óptica
| Sensibilización | Densidad óptica | Significación p < 0,05 (*) | |
| Media | DE | ||
|
Anti-D | 0,217 | 0,046 | |
| Albúmina 2,5 % | 0,161 | 0,053 | * |
La distribución de frecuencia de los índices citotóxicos determinados en el ensayo CCDA propuesto, se muestra en la figura.
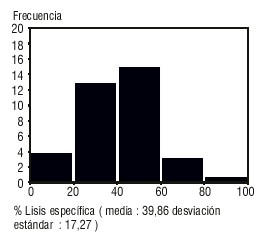
Fig. Distribución de frecuencia de los índices citotóxicos determinados.
La relación linfocito/monocito (5,69/1) en los donantes estudiados no mostró influencia sobre los índices citotóxicos según el test de correlación lineal aplicado, en el que se obtuvo un índice de correlación de - 0,01.
Discusión
Con el sistema propuesto para evaluar CCDA, que utiliza hematíes O+ de amplia distribución en la población y cuyos resultados se revelan por la actividad catalítica de la hemoglobina liberada en el proceso de lisis celular, se pudieron obviar las limitaciones de los métodos radioisotópicos citadas al inicio, lo que justifica su incorporación en la evaluación de este tipo de respuesta celular.
Además, los resultados alcanzados permitieron afirmar que el sistema homólogo empleado fue estadísticamente confiable y atribuir las diferencias entre lisis experimental y espontánea solamente a la inmunoglobulina anti-D, marcador empleado y facilitador de dicho proceso (tabla 2).
Aunque se informa que los monocitos incrementan la fragilidad osmótica de los eritrocitos sensibilizados con anti-D,13 en este ensayo no se constató correlación entre relación linfocito/monocito e índices citotóxicos, lo que permitió utilizar para la evaluación células mononucleares y evitar de este modo la depleción de una u otra estirpe celular. La variabilidad amplia de los índices citotóxicos entre individuos encontradas por este proceder, es similar a la informada por otros autores.14
El método homólogo autocatalítico desarrollado, que utilizó la actividad peroxidasa de la hemoglobina para amplificar la reacción citotóxica, no requiere de reactivos, equipamiento ni instalaciones especiales para su empleo, lo cual lo hace económicamente superior y más factible que los existentes.
Summary
A simple, sensitive system which does not require radioisotope markers and uses effector cells, target cells and antibodies of the same kind to evaluate antibody-dependent cell-mediated citotoxicity is presented in this paper. Citotoxic activity is assessed in peripheral mononuclear cells from apparently healthy voluntary blood donors and was extended in the lysis process through the peroxidase activity of hemoglobin released by target cells made up of anti-D coated O+ erythrocytes. There was no linear correlation between cytotoxic indexes and lymphocyte/monocyte ratio. The suggested method may be used in systematic experimental and clinical scanning.
Subject headings: ANTIBODY-DEPENDENT CELL CITOTOXICITY/immunology; IMMUNITY, CELLULAR; ERYTHROCYTE.
Referencias bibliográficas
1. Abbas AK. Inmunología celular y molecular. Madrid: Editorial Interamericana, 1995:60-1.
2. Male D, Roitt I. Introducción al sistema inmunitario. En: Roitt I. Inmunología. Madrid: Editorial Interamericana, 1993:1.4-1.5.
3. Rook G. Reacciones inmunitarias mediadas por células. En: Roitt I. Inmunología. Madrid: Editorial Interamericana, 1993:8.4-8.7.
4. Shlager SL. Use of radioisotope markers in cytotoxicity test. Methods Enzimol 1983;93:233-5.
5. Edin M. A rapid, quantitative fluorescence assay for cell damage by cytotoxic antibodies. J Inmunol 1970;104:5-6.
6. Dark C. An evaluation of the ethidium bromide microcytotoxicity test. J Inmunol Methods 1974;4:161-72.
7. Carmichael J. Evaluation of tetrazolium based semiautomatic colorimetric assay: assasement of chemosensitivity testing. Cancer Res 1987;47:936-42.
8. Stward M, Male D. Pruebas inmunológicas. En: Roitt I. Inmunología. Madrid: Editorial Interamericana, 1993:25.16-25-17.
9. Kurlander RJ, Rosse WF. Lymphocyte-mediated lysis of antibody coated human red cell in the presence of human serum. Blood 1979;53(6):1197-202.
10. Urbaniak SJ. ADCC (K-cell) lysis of human erythrocytes sensibilized with rheus alloantibodies. Br J Hematol 1979;42:315-28.
11. Yust I. Antibody - dependent cell - mediated cytotoxicity against human red blood cells: correlation of effector cell type with enzimatic alteration of the target cell surface. Eur J Immunol 1980;10(2):127-30.
12. ———. Hemolysis due to human antibody - dependent cell - mediated cytotoxicity. Lysis of erythrocytes treated with anti - D. Isr J Med Sci 1980;16(3):174-80.
13. Fleer A. Monocyte - induced increase in osmotic fragility of human red cells sensitized with anti - D alloantibodies. Br J Haematol 1978;40(3):439-46.
14. Alfonso ME. Estandarización de la técnica de citotoxicidad mediada por células destructoras naturales (NK). Rev Cubana Hematol Hemoter 1986;2(1):76-84.
Recibido; 21 de junio del 2001. Aprobado: 12 de septiembre del 2001.
Lic. José de la Paz Naranjo. Ave. Monumental y Carretera del Asilo. Habana del Este, CP 11700, Ciudad de La Habana, Cuba. e-mail:ismmds@infomed.sld.cu
1 Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto".














