Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.18 n.2 Ciudad de la Habana Mayo-ago. 2002
Artículos de revisión
Instituto de Hematología e Inmunología
Aspectos del aseguramiento de la calidad en los laboratorios de Hemostasia
Lic. Alina Díaz Concepción
Resumen
En concepto de control de la calidad se ha expandido en los últimos años y actualmente se está sustituyendo por el término de garantía de la calidad como concepto más abarcador, que comprende todo el proceso de la actividad relacionada con el laboratorio clínico, desde que se genera la petición analítica hasta que el resultado llega a manos del solicitante. Estas prácticas se requieren para la acreditación de los laboratorios clínicos y servicios de transfusión, en la que la palabra clave es la documentación de los sistemas de aseguramiento de la calidad. En la hemostasia, la etapa pre-analítica es una etapa fundamental; de ella depende en gran medida el resultado final, la preparación adecuada de controles, así como el uso de calibradores para la determinación de la actividad de los factores individuales y la detección de inhibidores. La determinación del tiempo de protrombina (TP), de la relación normalizada internacional y del tiempo parcial de tromboplastina activado (TPTA), son determinaciones usuales en el control externo de la calidad (CEC), mientras que la determinación de la concentración de fibrinógeno, factor VIII coagulante, otros factores e inhibidores fisiológicos de la coagulación, se incluyen de forma más esporádica. Actualmente se están llevando a cabo programas internacionales para la estandarización de varias pruebas de laboratorio. Para implementar la estandarización de las pruebas y materiales usados en la hemostasia, varias instituciones han decidido dirigir sus esfuerzos para lograr sistemas comunes de referencia.
DeCS: CONTROL DE CALIDAD; TECNICAS DE LABORATORIO CLINICO/normas; TESTS DE COAGULACION SANGUINEA/normas.
Los avances en el conocimiento de los aspectos básicos de los procesos de la coagulación y de la fibrinólisis han traído como consecuencia la introducción de nuevos métodos diagnósticos para la determinación de los factores de la coagulación y de los productos de las reacciones.1 Entre los parámetros con relevancia diagnóstica o cuya determinación ha sido esencialmente perfeccionada se encuentran: la proteína C, proteína S, el factor V Leiden, factor XIII, cofactor II de la heparina, trombomodulina, activador tisular del plasminógeno y el inhibidor del activador tisular del plasminógeno. Otras sustancias formadas en el proceso de la coagulación y de la fibrinólisis, también de gran importancia son: factor VII activado, fragmento 1+2 de la protombina, complejo trombina- antitrombina III y monómeros de fibrina, también llamada fibrina soluble, dímero D y complejo plasmina-antiplasmina. El desarrollo de tecnologías modernas y la introducción de analizadores computadorizados han conducido al desarrollo de ensayos coagulométricos, cromogénicos e inmunoquímicos para la determinación de estos analitos, así como las pruebas clásicas de la coagulación.
La introducción de un gran números de nuevos ensayos e instrumentos ha hecho necesario la aplicación de medidas de control de la calidad que aplican los fabricantes y los usuarios.2
Para el desempeño adecuado de un laboratorio clínico se deben cumplir las condiciones siguientes:
- Los resultados de los exámenes practicados en dicho laboratorio deben ser confiables, reproducibles y exactos.
- Los exámenes por sí mismos deben ser relevantes para el diagnóstico y vigilancia clínica de los pacientes y también para la realización de estudios epidemiológicos o de vigilancia de salud pública.
- La gestión del laboratorio debe ser eficiente, efectiva y lo más económica posible sin afectar la calidad.
Para lograr estos objetivos se requiere de una administración experta que supervise el trabajo del laboratorio, que garantice que se logre el nivel necesario de las buenas prácticas de laboratorio y que este se mantenga constantemente, para lo cual es necesario llevar a cabo un programa de aseguramiento de la calidad.3 Dicho programa contempla 4 aspectos:
- Control preanalítico y posanalítico.
- Control interno de la calidad.
- Control externo de la calidad.
- Estandarización.
El término control de la calidad se comenzó a utilizar en el ámbito de la producción industrial a finales de los años 20, con el objeto de comprobar la constancia de la calidad de un producto en su línea de producción. Los primeros planteamientos de la necesidad de controlar la calidad en el laboratorio clínico no aparecen hasta la década de los 40, y en 1950, Levey y Jennings4 introducen la idea de analizar un material de control conjuntamente con cada serie de muestras de pacientes y expresar los resultados mediante gráficos de control.
El primitivo concepto de control de la calidad estaba limitado a la fase analítica, considerada como la única fuente de errores, sin embargo, con el tiempo, se hizo evidente que los problemas pueden presentarse desde la preparación del paciente y obtención de la muestra, pasando a través del procesamiento técnico, hasta la entrega del resultado final al médico que solicitó el estudio, por lo que actualmente se usa preferentemente el término de garantía de la calidad, como sinónimo de un concepto más amplio que abarca todo el proceso de la actividad relacionada con el laboratorio clínico, desde que se genera la petición analítica hasta que el resultado llega a manos del solicitante.
Usualmente el laboratorio tiene que mantener una documentación exacta, realizar procedimientos de calibración regularmente, así como realizar el control de calidad para cada método utilizado.
En algunos países, los sistemas de acreditación de los laboratorios se han establecido en forma de inspección o auditoría de la organización de toda la actividad del laboratorio y los programas de control de la calidad son obligatorios para aquellos que deseen ser acreditados.5
Control en la etapa preanalítica
En realidad se le ha prestado menos atención al establecimiento de las medidas de control de la calidad en las etapas de obtención, procesamiento y almacenamiento de las muestras que al resto del procesamiento analítico.6 En la hemostasia, la etapa preanalítica es una etapa clave, y de ella depende en gran medida el resultado final. Los objetivos de las normas de control de la calidad en la fase preanalítica son:
- La correcta identificación del paciente, del solicitante y de la prueba solicitada.
- Reducir al máximo la variabilidad intraindividual de los parámetros a medir.
- Evitar el deterioro de la muestra mediante los procesos de obtención, manipulación transporte y conservación.
Una tecnología de laboratorio altamente controlada y sofisticada no es efectiva si ocurren errores en la identificación de las muestras. Una apropiada obtención de la muestra y manipulación de esta son, por lo tanto, de máxima importancia; la probabilidad de error en esas áreas son posiblemente mayores que la probabilidad de error que pueda ocurrir durante las determinaciones de laboratorio.7
Los errores en la obtención de la muestra abarcan desde la incorrecta identificación de la muestra hasta la obtención de muestras hemolizadas o el uso inapropiado de anticoagulantes. Se ha demostrado que alrededor del 8 % de errores en el nombre del paciente, edad, sexo y número de identificación, no se detecta aún con chequeos manuales extensivos.8 El Comité Internacional de Estandarización en Hematología ha publicado pautas para la estandarización de la obtención de muestras de sangre y para el establecimiento de valores de referencia.9
Como medidas generales para evitar errores en la etapa de identificación del paciente, es importante disponer de un formato de petición específico, en el que además del nombre y apellidos, se identifique de forma inequívoca a cada paciente mediante su número de historia clínica, así como al facultativo solicitante. En los laboratorios medianos y grandes se utilizan las hojas de petición, en las que la identificación del paciente se realiza mediante código de barras, lo cual elimina el error humano de la actividad extraanalítica. Debe rechazarse cualquier solicitud que no se cumplimente debidamente.10
Reducción de la Variabilidad Individual
La variabilidad individual no puede eliminarse totalmente, pero puede minimizarse; las variaciones individuales incluyen todas las fuentes de error no analíticas. Los factores que influyen en las variaciones incluyen el uso de medicamentos o drogas, la actividad física, el estrés emocional, la postura del paciente, variaciones diurnas y otras causas variadas. La actividad física es una causa exógena conocida de variabilidad que es importante tener en cuenta cuando se va a determinar la actividad del factor VIII y del factor von Willebrand.11 La causa endógena principal de variación es los ritmos circadianos que modifican los niveles de un parámetro a lo largo del día, importante a tener en cuenta al determinar los parámetros del sistemas fibrinolítico.12 La gestación se asocia con cambios significativos en el sistema hemostático: se produce un aumento en varios factores procoagulantes como el factor von Willebrand, factor VIII, factor V fibrinógeno, resistencia adquirida a la proteína C activada y una disminución de los valores plasmáticos de proteínas S, así como un aumento del inhibidor del activador tisular del plasminógeno tipo 2.13
Obtención, manipulación, transporte y conservación de la muestra
Múltiples factores asociados con el manejo y procesamiento de las muestras de sangre pueden introducir imprecisión de las pruebas o un error sistemático después que la muestra ha sido obtenida y antes que la prueba sea realizada. Se deben controlar aspectos como evitar el contacto prolongado de las células con el suero o plasma, los cambios de concentración debido a la evaporación o la lisis o el deterioro del analito debido a un almacenamiento impropio o al uso de anticoagulantes inadecuados.
Cuando se va a obtener una muestra para un estudio de la hemostasia es importante no prolongar excesivamente la aplicación del torniquete, el cual no se debe mantener por más de un minuto y utilizarlo para la punción venosa, pero no durante la toma de la muestra.14 El efecto de la hemólisis en los resultados de las pruebas hematológicas no está bien documentado. La mayoría de los laboratorios rechazan las muestra de sangre si se detecta algún signo de hemólisis.7 Existen evidencias de que la hemólisis no afecta al tiempo de protrombina (TP), siempre que la hemólisis no sea el resultado de una extracción traumática.15
Los tubos destinados a las pruebas de coagulación deben llenarse después de los destinados a otras pruebas. Es aceptable que en caso de que el de coagulación sea el único tubo, no se incluya un tubo previo de limpieza (o jeringuilla) con excepción del tiempo parcial de tromboplastina activado (TPTA) en pacientes tratados con heparina, en que es 20 % más corto en el primer tubo que en el segundo.16 El citrato trisódico Na3C6H5O7 es el anticoagulante usual para las investigaciones de la hemostasia en concentraciones de 109 ó 129 mmol/L (32g/L ó 38g/L de la forma dihidratada), en una proporción de una parte de anticoagulante para 9 partes de sangre; sin embargo, solo la solución 109 mmol/L ha sido recomendada por el Comité Internacional de Trombosis y Hemostasia.17 Concentraciones más altas como 136 mmol/L dan lugar a ligeras prolongaciones de los tiempos de coagulación de las diversas pruebas, especialmente en caso de resultados patológicos, si la cantidad de sangre en el tubo es menor que la requerida para mantener la proporción de 9:1 sangre/anticoagulante, el exceso de anticoagulante podría alterar la exactitud del resultado.18
La estabilidad de las pruebas de coagulación es crítica para el diagnóstico y para el mantenimiento de la terapia anticoagulante; en dependencia de la temperatura mantenida durante el transporte y almacenamiento de las muestras, se han recomendado intervalos de tiempo entre la obtención de las muestras y la realización de las pruebas: 2 horas cuando la muestra es mantenida a 22-24 °C, 4 horas cuando es almacenada a 4 °C, 2 semanas a -20 °C y 6 meses a - 70 °C. (National Comittee for Clinical Laboratory Standards (NCCLS) H3-A3: Procedures for the collection of diagnostic blood specimen by venipuncture. Approved standard. Villanova PA. NCCLS. (ISBN 1-56238-108-3;1991).Actualmente se considera preferible la conservación a temperatura ambiente, especialmente para las valoraciones del TP y de factor VII, con lo cual se evita la progresiva activación del factor VII. Más importante que la temperatura es el tiempo de conservación, que debe ser no superior a 2 horas para la determinación de factor VIII, pero que se puede prolongar a 6 horas para el TP y el TPTA, siempre que el tubo se conserve tapado hasta su valoración analítica (incluido el tiempo de la centrifugación), para evitar la pérdida de CO2 y la elevación del pH.19
Para pruebas cuyos reactivos contienen un exceso de fofolípidos como el TP o el TPTA, se considera suficiente la centrifugación a 1 000 ´ g durante 10 minutos (National Comittee for Clinical Laboratory Standars (NCCLS). Tentative guidelines for the standardized collection, transport and preparation of blood specimens for coagulation testing and perfomance of coagulation assays. NCCLS Publication. Vol 2 N 14 Villanova PA;1982:103-28). Para la determinación del factor VIII se ha recomendado la centrifugación a 2 500 ´ g durante 15 minutos. En cuanto a los tubos destinados a la investigación del anticoagulante lúpico y la mezcla de plasmas normales destinadas a esta misma prueba, se aconseja someterlos a doble centrifugación a 3 000 ´ g durante 30 minutos.22
Control Interno de la Calidad: Fase analítica
El propósito del control interno de la calidad es el de inspeccionar diversos aspectos de los procedimientos analíticos que se llevan a cabo en el laboratorio, suministra una vigilancia continua del trabajo del laboratorio y evalúa el resultado con el objetivo de decidir si ellos son los suficientemente confiables para ser emitidos.5 Es fundamental disminuir la imprecisión o error aleatorio y la inexactitud o error sistemático de las determinaciones.
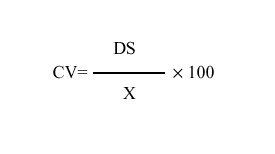
La precisión es la suma de todos los errores aleatorios que ocurren mientras se está llevando a cabo el procedimiento. La suma usualmente se expresa como desviación estándar (DS) o coeficiente de variación (CV). Para valorar su magnitud se utiliza el control interno de la calidad, el cual consiste en intercalar determinados materiales de control entre las muestras de los pacientes y evaluar la dispersión de los resultados obtenidos.10 Los materiales de control son alícuotas de plasma comerciales o preparadas en el laboratorio, cuyo valor exacto para el parámetro controlado, a diferencia de los que ocurre con los materiales de calibración, no es importante. Su característica fundamental es la estabilidad y la repetibilidad, también deben poseer características similares a las de las muestras de pacientes, para que se comporten de manera similar en la realización de los procedimientos.
En las pruebas de coagulación se utilizan frecuentemente 3 niveles de plasmas controles: dentro del rango de referencia, moderadamente patológicos y marcadamente patológicos. Es apropiado utilizar muestras controles al nivel de decisión, al cual los clínicos pueden ajustar la dosis de warfarina o pueden o no ordenar la infusión de crioprecipitado.21
Para la valoración de la dispersión de los resultados obtenidos el método más clásico es el de Levey y Jennings,4 que es todavía el más utilizado en el laboratorio de coagulación, ya que es el único disponible en la mayoría de los coagulómetros. Antes de poder aplicar el método, se analiza un mínimo de 20 alícuotas del material de control de cada uno de los niveles en el plazo de una semana y se establece la media y la DS; posteriormente en la aplicación del control a las series analíticas se considera como límite aceptable la desviación a partir de la media de ± 2DS y se admite que menos del 5 % de los resultados pueden exceder ese límite. El resultado se expresa gráficamente (gráfico de Levey- Jennings) y la imprecisión se cuantifica mediante el CV.
El valor de CV aceptable es diferente para cada parámetro controlado y depende de la metodología empleada (manual, automática con lectura mecánica u óptica). En general, para los coagulómetros modernos suele ser del 5 % para las pruebas básicas (TP y TPTA) y menor del 10 % para la determinación de fibrinógeno y factores VIII y IX.
Otro método aplicable es la suma acumulativa o CUSUM, 22 en el que el valor de la desviación con respecto a la media se expresa con signo + ó - según sea superior o inferior a ella. Es especialmente útil para la detección de cambios consistentes en el desempeño debido a la dispersión aleatoria, en el que habrá un aumento progresivo de la desviación (+ ó -) ; cuando existen solo diferencias aleatorias con respecto a la media, algunas serán positivas y algunas negativas, de tal forma que la suma acumulativa oscilará alrededor de O.
La inexactitud o error sistemático es el grado de discordancia entre nuestro resultado y el valor verdadero. La inexactitud es una desviación sistemática debida a una deficiente calibración. Las pruebas de la coagulación se distinguen de las determinaciones bioquímicas en que en ellas se mide el tiempo de reacción en un sistema complejo muy alejado de las condiciones fisiológicas y muy influenciado por las propiedades de los reactivos. El TP y TPTA están entre los ensayos de pesquisaje más solicitados en los laboratorio clínicos, 23 y son solicitados para cualquiera de los propósitos siguientes:
- Chequeos preoperatorios especialmente en pacientes con un riesgo hemorrágico
incrementado. - Para evaluar la actividad de los factores de la coagulación.
- Para el control de la anticoagulación oral en el caso del TP o de la terapia antitrombótica por heparina o hirudina.
- Para detectar inhibidores adquiridos especialmente inhibidores del factor VIII y anticoagulante lúpico.
En el caso de estas pruebas globales no se puede hablar de calibración propiamente, y los resultados se dan en relación con el tiempo de coagulación del plasma control. Hace algunos años, la tendencia es expresar los resultados como el cociente entre el tiempo de coagulación del plasma problema y el del plasma control: razón P/C, donde el plasma control es una mezcla de plasma de individuos sanos preparada en el laboratorio usando 10 donantes como mínimo, o preferentemente un plasma comercial, siempre utilizando un factor de corrección para que este valor se ajuste al de la población. Para calcular los límites de referencia se utilizan los resultados de un mínimo de 40- 50 sujetos sanos, se calcula la media y la DS y se eliminan los valores que superen ± 3DS, se repite el cálculo de la media y la DS y se consideran valores de referencia los resultados entre media ± 2 DS.
Cuando se determinan factores de la coagulación o inhibidores, los resultados de su actividad (determinación funcional) o concentración (determinación inmunológica) se expresan con referencia a un estándar internacional siempre que esté disponible. La calibración se realiza con un calibrador comercial con trazabilidad para una preparación internacional de referencia. No es válido el uso de mezclas de plasma normales para la calibración cuando se disponga de una preparación de referencia. Los límites de referencia se calculan de la forma habitual y los resultados se dan de acuerdo con las recomendaciones internacionales.24
Control externo de la calidad (CEC)
Es una comparación restrospectiva y objetiva de los resultados de los diferentes laboratorios en una o más muestras que son suministradas para ese propósito por una agencia externa; es una instantánea de un evento singular en la función del laboratorio y su evaluación está basada en la suposición de que esta refleja el funcionamiento diario del laboratorio.
Otras funciones del CEC son: permite la comparación de diferentes instrumentos y métodos para el mismo ensayo y evalúa su confiabilidad, posibilita el estudio de nuevos controles y calibradores por medio de chequeos regulares, monitorear lotes de reactivos, materiales controles y juegos diagnósticos. De los datos del CEC se pueden recomendar métodos y establecer la necesidad de entrenamientos en forma de talleres. Los resultados del CEC también revelan diferencias atribuibles a los fabricantes de reactivos.25
En coagulación, la determinación del TP, de la relación normalizada internacional y del TPTA, son determinaciones usuales en los CEC, mientras que la determinación de la concentración de fibrinógeno, factor VIII coagulante, otros factores e inhibidores fisiológicos de la coagulación, se incluyen de forma más esporádica. Aunque existen diferencias entre plasmas frescos y liofilizados en varias pruebas,26plasmas liofilizados obtenidos por plasmaféresis de pacientes con hemofilia moderada o ligera o enfermedad de von Willebrand, así como de pacientes con otros defectos de la coagulación, se han utilizado como fuente de grandes volúmenes de material; la incidencia incrementada de anticuerpos contra el virus de la inmunodeficiencia humana y de otras enfermedades virales emergentes hace difícil la obtención de un material apropiado procedente de estas fuentes.
Con los resultados de todos los participantes se establece la media de consenso, se puede establecer la media de consenso global y otras para cada uno de los métodos (generalmente conjunto de aparatos y su reactivo) de los participantes. Para cada muestra y cada parámetro analizado la información remitida al participante comprende datos globales de la dispersión de los resultados, en forma de CV, y datos individuales de su desviación con respecto a la media de consenso para su método analítico y para el conjunto de los métodos. Esta se expresa en forma de índice de desviación (ID):
Los datos de los ID de todos los participantes se enfrentan en las gráficas de Youden,27 donde se aprecia fácilmente el grado de desviación del participante. Los resultados individuales se distribuyen en categorías de acuerdo con el ID:
Excelentes: 0- 0, 5.
Buenos: > 0,5-1,0.
Satisfactorios: >1,0-2,0.
No aceptables: >2,0.
Estándares, Materiales de Referencia y Métodos de Referencia
Para lograr un aseguramiento total de la calidad es necesario garantizar la calidad de los sistemas analíticos usados en la hemostasia mediante el uso de sistemas de medición de referencia. Tales sistemas incluyen: regulaciones nacionales e internacionales, datos de referencia, unidades de medición, procedimientos de medición de referencia y materiales de referencia.28
Las medidas necesarias para mejorar la comparación de los resultados de laboratorios incluyen el desarrollo de materiales de referencia apropiados, el establecimiento de métodos de optimizados y estandarizados así como de rasgos de referencia apropiados.29Los aspectos esenciales para la estandarización internacional de las pruebas de la hemostasia son:
- Materiales de referencia.
- Estándares primarios.
- Materiales de referencia de matriz secundaria.
- Calibradores comerciales estandarizados.
2. Métodos de referencia.
3. Valores de referencia.
4. Rangos terapéuticos para la terapia médica.
Actualmente se están llevando a cabo programas internacionales para la estandarización de varias pruebas de laboratorio. Para implementar la estandarización de las pruebas y materiales usados en la hemostasia, varias instituciones han decidido dirigir sus esfuerzos para lograr sistemas comunes de referencia. Es necesario lograr acuerdos en cuanto a:
- Procedimientos para regulaciones, aprobación de procedimientos y métodos de referencia.
- Intercambio de información para el desarrollo de nuevos materiales de referencia.
- Apoyo a programas para la preparación de materiales de referencia.
- Intercambio entre los programas nacionales existentes para el establecimiento de los estándares.
El Comité Internacional de Estandarización en Hematología ha definido una preparación de referencia como aquella sustancia o instrumento con una o más propiedades suficientemente establecidas como para ser usado para la calibración de un instrumento, para el chequeo de un método de medición o para asignar valores de un material. Existen 3 categorías: estándar primario (internacional), estándar secundario (nacional o regional) y terciario (comercial o local).30 En las ciencias biomédicas la autoridad en estándares internacionales es la Organización Mundial de la Salud, y más recientemente se han incorporado a esta actividad el Comité Internacional de Estandarización en Hematología, la Federación Internacional de Química Clínica, también el Instituto Nacional para Estándares Biológicos y Control del Reino Unido y el Instituto Nacional para Estándar y Tecnologías del Reino Unido. Estas organizaciones son también responsables de la producción de estándares secundarios; relacionando tales estándares a un estándar internacional, cumplen indirectamente los requisitos de trazabilidad que le permiten asignarle un valor sin necesidad de realizar un estudio cooperativo extenso. En la tabla se muestran los materiales de referencia disponibles en Hemostasia.
Tabla. Materiales de referencia en Hemostasia
| OMS. Materiales de referencia | Indentificación |
| Antitrombina (ATIII) | 93/768 |
| Beta- tromboglobulina (BTG) | 83/501 |
| Factores de coagulación, FII, FVII, FIX, FX (plasma) | 84/665 |
| Factor de coagulación VII: A (concentrado) | 89/688 |
| Factor de coagulaciónVIII: C (concentrado) | 88/640 |
| Factor de coagulación VIII - actividades relativas | |
| [FVIII: C, F VIII: AG, FvW, coFR, FvW: Ag] (plasma) | 91/666 |
| Factor de coagulación IX (concentrado) | 84/683 |
| Fibrinógeno (plasma) | 89/644 |
| Heparina | 82/502 |
| Heparina de bajo peso molecular | 85/600 |
| Plasmina | 77/588 |
| Activador titular del plasminógeno | 86/670 |
| Factor plaquetario 4 (FP4) | 83/505 |
| Activador precalicreína (APC) | 82/530 |
| Protamina | 54/5 |
| Proteína C (plasma) | 86/622 |
| Estreptoquinasa | 88/826 |
| Trombina, tipo a | 89/588 |
| Tromboplastina: humana conejo bovina | BCT/253 |
| RBT/90 | |
| OBT/79 | |
| Uroquinasa | 87/594 |
| Materiales de referencia BCR | |
| Tromboplastina: humana | CRM147 |
| CDM148 | |
| CRM149S | |
| Estandares británicos | |
| Batroxobina | 75/527 |
| Factor de coagulación VII (concentrado) | 89/590 |
| Factor de coagulación VIII: C(concentrado) | 86/514 |
| Factor de coagulación VIII: C(plasma) | 93/600 |
| Factores de coagulación FII, FIX, FX (concentrado) | 97/724 |
| Factores de coagulación FvW, coFR, FvW: Ag FIX, antitrombina, proteína C, antígeno proteína S (plasma) | 93/622 |
Las 2 organizaciones principales que se ocupan de los estándares escritos son las Organización de Estandarización (ISO) y la Organización Electrotecnia Internacional. ISO es una federación de organizaciones nacionales para la estandarización, su trabajo es realizado principalmente por cerca de 200 comités técnicos, con un gran número de grupos de trabajo.
Un estándar escrito o procedimiento de referencia es un procedimiento extensivamente investigado, cuyas características analíticas permiten su uso para evaluar la exactitud de otros procedimientos y caracterizar materiales de referencia. (European Commitee for Standardization (CEN: TC 140 WG 4. Measurement of quantities in samples of biological origin. Presentation of references measurements procedures. Draft 1993-07. CEN, Brussels). Por último, en el ámbito internacional, el Comité Internacional de Estandarización en Hematología (parcialmente en cooperación con la Sociedad Internacional de Trombosis y Hemostasia), ha publicado diferentes procedimientos de referencia, como son:
- Prueba del tiempo de protrombina: efecto de varias concentraciones de citrato (ICSH/ISTH).
- Método de referencia para el tiempo de protrombina en una etapa (ICSH).
- ICSH/ICTH: recomendaciones para el informe de tiempo de protrombina en el control de anticoagulantes orales (ICSH/ISTH).
- Tiempo parcial de tromboplastina: pautas para su realización (ICSH).
Summary
The concept of quality control has extended in the last few years and nowadays, it is being replaced by the term quality assurance as a more comprehensive concept that comprises the whole process of the activity related to the clinical lab, from the moment the analytical request is made up to the reception of the final result by the requester. This practice is required for accreditation of clinical labs and blood transfusion services in which the key word is the documentation of the quality assurance systems. In hemostasia, the pre-clinical phase is a fundamental stage since the final result, the adequate preparation of controls and the use of gages for determining the activity of individual factors and the detection of inhibitors largely depend on it. The determination of prothrombin time, of the international standardized relation and of the activated partial thromboplastin time are usual determinations in the External Quality Control whereas the estimation of fibrinogen concentration, the coagulating factor VIII, other factors and physiological inhibitors of coagulation are sporadically included. At present, international programs for the standardization of several lab tests are being carried out. To implement the standardization of tests and materials used in hemostasia, a number of institutions have decided to aim their efforts to achieve common reference systems.
Subject headings: QUALITY CONTROL; CLINICAL LABORATORY TECHNIQUES/standards; BLOOD COAGULATION TESTS/standards.
Referencias Bibliográficas
- Hassouna H. Laboratory evaluation of hemostatic disorder. Hematol/Oncol Clin North Am 1993;7:1161-9.
- Walenga JM, Fareed I. Automation and quality control in the coagulation laboratory. Clin Lab Med 1994;14:709-28.
- Dati F. Quality management and standardization programs in Hemostaseology. JIFCC 1996;8:111-6.
- Levey S, Jennings ER. The use of control charts in clinical laboratories. Am J Clin Pathol 1950;20:1059-66.
- Koepke JA, Bull BS. The intralaboratory control quality. En: Lewis SM, Koepke JA (eds). Hematology: Laboratory Management and Practice. Oxford: Butterworth-Heinemann; 1995.p.183-98.
- Borne DJ. Comments on random errors in haematologist test. Clin Lab Haematol 1990;12 (Suppl):169-70.
- Assendelft OW van, Simmons A. Specimen collection, handling, storage and variability En: Lewis SM, Koepke JA (eds). Hematology: Laboratory Management and Practice. Oxford: Butterworth-Heinemann;1995. p.109-3.
- Taswue FH, Smith AM, Sweatt MA. Quality control in the blood bank. A new approach. Am J Clin Pathol 1974;62:491-5.
- ICSH. Standardization of blood specimen collection procedure for reference value. Clin Lab Haematol 1982;4:83-6.
- Martínez Brotons F. Garantía de la calidad en un laboratorio de hemostasia. Rev Iberoamer Tromb Hemost 1999;12:14-21.
- Vlot AJ. Factor VIII and von Willebrand factor. Thromb Haemost 1998;78:456-65.
- Buckell M, Ellint FA. Effect of butter lipaemic on the rate of clot lysis in normal males. Lancet 1959;i:662-3.
- Soto I. Trombofilia y complicaciones del embarazo. Rev Iberoamer Tromb Hemost 2000;13 (Suppl):72-81.
- Gilmer PR. Preanalytical variables in coagulation testing. En: Triplett DA (ed). Standardization of coagulation assays: An overview. Illinois: College of American Pathologist Skokie; 1982. p.1-8.
- Engstrom AW. Effect of hemolysis on the one stage prothrombin time. Am J Clin Pathol 1968;49:742-5.
- Van Putten JJ, van de Ruit M, Beunis M, Hemker HC. Heparin neutralization during collection and processing of blood inhibited by piridoxal 5´phosphate. Haemostasis 1984;14:253-61.
- Ingram GIC, Hills M. The prothrombin time test. Effect of varyning citrate concentrations. Thromb Haemost 1976;36:230-6.
- Humphreys RE, Mc Phedran P. False evaluation of partial thromboplastin time and prothombin time. JAMA 1970;214:1702-4.
- Koepke JA, Rodgers H, Ollivier MJ. Preanalytical instrumental variables in coagulation testing. Am J Clin Pathol 1975;64:591-6.
- Exner T, Triplett DA, Taberner D, Machín SJ. Guidelines for testing and revised criteria for Lupus Anticoagulants. SSC Subcommitee for the standardization of Lupus Anticoagulant. Thromb Haemost 1991;63(3):320-2.
- Koepke JA, Koepke JF. How hematologist use coagulation test (abstract). Blood 1986;68:335.
- Bisell AP. Statistical foreword En: Cavill I (ed). A Quality Control: Methods in Haematology. Vol 4. Edinburg: Churchill Livingstone;1982.p.1-12.
- Schman AL, Griner PP. Diagnostic uses of the partial thromboplastin time and prothrombin time. Ann Intern Med 1986;104:810-6.
- England JM. Harmonization, concordance and truth of measurement. En: Lewis SM, Koepke JA (eds). Hematology: Laboratory management and Practice. Oxford: Butterworth-Heinemann;1995.p.136-46.
- Lewis SM. External quality assesment. En: Lewis SM, Koepke JA (eds). Hematology. Laboratory Management and Practice. Oxford: Butterworth-Heinemann;1995.p.199-217.
- Van den Baselaar AMHP, Bertina RM. Standardization and quality control in blood coagulation assays. En: Lewis SM, Verwilghen Rl (eds). Quality Assurance in Haematology. London: Bailliére Tindall;1988.p.119-50.
- Youden WJ. The sample, the procedures and the laboratory. Anal Chem 1960;32:23-7.
- Buttner J. Reference methods as a basis for accurate measuring systems. Eur J Clin Chem Clin Biochem 1991;29:223-35.
- Colinet E. The development of reference methods in clinical chemistry. The contribution of the Community Bureau of Reference of the Commission of the European Communities. Eur J Clin Chem Clin Biochem 1991;237-40.
- Lewis SM. Standards, reference materials and reference methods. En: Lewis SM, Koepke JA (eds). Hematology: Laboratory Management and Practice. Oxford: Butterworth-Heinemann;1995.p.129-35.
Recibido: 7 de enero del 2003. Aprobado: 10 de enero del 2003.
Lic. Alina Díaz Concepción. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 57-8268. Fax (537) 44-2334. e-mail: ihidir@hemato.sld.cu