Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.18 n.2 Ciudad de la Habana Mayo-ago. 2002
Efecto in vitro de la hemina sobre la proliferación de los linfocitos humanos
Lic. Lázaro del Valle Pérez, Dra. Consuelo Macías Abraham, Lic. Isabel Torres Leyva, Dra. Vianed Marsán Suárez, Lic. Berta B. Socarrás Ferrer, Dra. Miriam Sánchez Segura, Dr. Porfirio Hernández Ramírez y Dr. José M. Ballester Santovenia
Resumen
Se estudió el efecto in vitro de la hemina sobre los linfocitos humanos. Se seleccionaron 30 donantes del Banco de Sangre del Instituto de Hematología e Inmunología a los que se les realizaron las pruebas de roseta activa, transformación blástica con criterio de timidina tritiada y la expresión de los antígenos de activación HLA-DR y CD-25 por el ultramicrométodo inmunocitoquímico en presencia y ausencia de la hemina. Se hallaron diferencias estadísticamente significativas en las condiciones experimentales con y sin hemina. Se comprobó que la hemina sola es capaz de promover la transformación blástica, aumentar la formación de roseta activa y aumentar la expresión de los antígenos de activación HLA-DR y CD25. En la literatura revisada no se hallaron resultados similares a los expresados anteriormente. La hemina es un producto capaz de activar a los linfocitos humanos induciendo su proliferación, y por lo tanto, la expresión de antígenos de activación. Se sugiere realizar estudios preclínicos y clínicos para evaluar la hemina como un probable medicamento para el tratamiento de las inmunodeficiencias celulares.
DeCS: HEMINA/aislamiento & purificación; LINFOCITOS; ANTIGENOS HLA-DR; FORMACION DE ROSETA; DONADORES DE SANGRE; TRANSFORMACION LINFOCITICA.
La hemina o hematina (H) es una protoporforina IX que forma un quelato complejo con el hierro III, a diferencia del grupo hemo que lo hace con el hierro II.1
La H tiene un efecto conocido sobre la proliferación y diferenciación de los progenitores hematopoyéticos, incrementando la formación de colonias en las células progenitoras eritropoyéticas in vitro en donantes sanos,2 induce la maduración de líneas celulares transformadas de origen humano, como la línea de eritroleucemia humana K-562,.3-5 induce la formación de hemoglobina fetal (HbF), lo que hace importante su utilización en el tratamiento de enfermos con hemoglobinopatías como la anemia drepanocítica y la b talasemia, pues mejora los síntomas clínicos de la enfermedad, ya que la HbF inhibe la proliferación de la HbS.6
Los mecanismos de acción de la H pueden estar relacionados con su efecto sobre el gen de transcripción de la globina, suministra el grupo prostético para el ensamblaje de la Hb, incrementa la HbF en células derivadas de pacientes sicklémicos y b talasémicos, así como de células procedentes de donantes sanos.2-7
En combinación con otras drogas citotóxicas como la hidroxiurea, la H incrementa la Hb con un efecto sinérgico en su utilización terapéutica y reduce los efectos de citotoxicidad de la hidroxiurea.8
No existen datos reportados por otros autores sobre la acción de la H sobre la proliferación o diferenciación de los linfocitos. Por lo anterior, nos propusimos estudiar el efecto de la H sobre la proliferación de los linfocitos humanos de sangre periférica, y evaluar su acción mediante la prueba de transformación linfoblástica por el criterio de timidina tritiada con la H sola y en presencia de la estimulación inespecífica del mitógeno (PHA) a concentración óptima.
Métodos
Preparación de la solución de hemina:
La solución de stock de 5 mmol/L se preparó como se describe: 32,5 mg de H bovina (Gibsco, Inglaterra, donación del Dr. Luis Sánchez Medal, fueron disueltos en 0,5 mL de NaOH, 1 N por 30 minutos; la mezcla fue neutralizada con 0,5 mL de HCl, 1 N, se le añadieron 0,5 mL de solución de Tris base de 0,5 mol/L y se llevó a un volumen final de 10 mL con medio RPMI 1640 al 10 % de suero bovino (Sigma, EE.UU.). Finalmente la mezcla se esterilizó por un filtro de 0,45 mµ (Sartorius, RFA) y se almacenó a 4 °C por no más de 48 horas. Se realizaron diluciones dobles desde 1:2 hasta 1:2048.
Se obtuvieron 20 mL de sangre periférica de 30 donantes voluntarios de sangre del Instituto de Hematología e Inmunología que no habían recibido tratamiento medicamentoso en los 6 meses previos al estudio.
El aislamiento de células mononucleares se efectuó según el método de Böyum modificado.9 Para valorar la respuesta de la H se incubaron durante 72 horas en placas de 96 pozos de fondo en U (NUNC, Dinamarca), 2 ´ 105 linfocitos/pocillo en 200 µL de RPMI 1640 al 20 % de suero fetal bovino (Sigma, EE.UU.) con diluciones dobles de H con y sin PHA (Sigma, EE.UU.), concentración óptima de 5 µg/pocillo. El cultivo duró 72 horas a 37 °C y atmósfera húmeda de CO2 al 5 % (Incubadora ASSAB, Suecia). Seis horas antes de culminar el cultivo se le añadió a cada pozo 1 µCi de timidina tritiada (Amersham, Inglaterra) (actividad específica 20 Ci/mmol). Las placas se procesaron en un cosechador de células (Flow Laboratories, Inglaterra). La detección de partículas b se realizó en un equipo RAKb1 (LKB, Suecia). Los resultados se expresaron en conteos por minuto (cpm).10
La determinación de los antígenos de activación HLA-DR y CD25, se realizó antes y después de la estimulación con H a la dilución 1/256 durante 72 horas, en las mismas condiciones empleadas para la transformación blástica, y el porcentaje de expresión de estos antígenos se realizó por el método inmunoenzimático UMICIQ.11
El estudio del efecto de la H sobre la formación de roseta activa (RA) se efectuó sin y con incubación de los linfocitos con H (1/256) durante 24 horas previas a la formación de la misma y comparando el porcentaje de formación de RA entre los linfocitos con y sin incubación con la H.12
Los resultados se expresan en media y desviación estándar y para comparar el efecto de la H en los linfocitos con y sin incubación en las condiciones experimentales se utiliza la t de Student para muestras pareadas.
Resultados
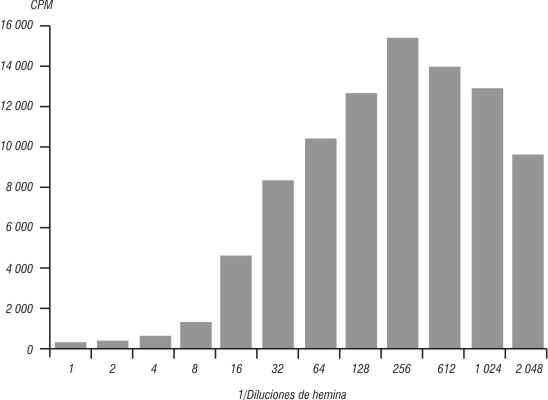
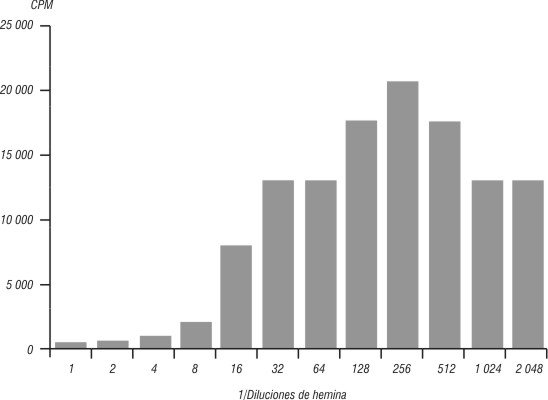
En las figuras 1 y 2 se expresa el efecto de la H en los linfocitos humanos mediante la prueba de transformación blástica (TB) en conteos por minuto (CPM), sin y con PHA a su concentración óptima (0,5 ng/mL).
Fig. 1. Proliferación linfocitaria en presencia de hemina.
Fig.2. Proliferación linfocitaria en presencia de hemina +PHA.
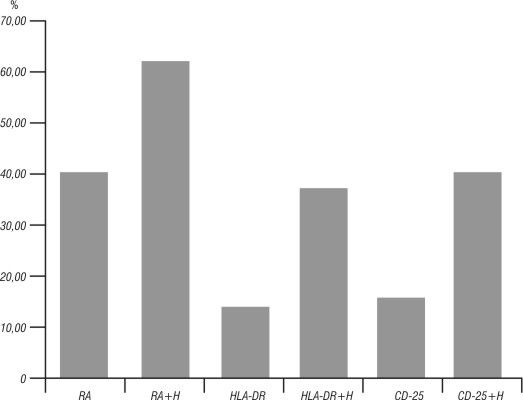
En la fig. 3 se representan los resultados de la formación de roseta activa y la expresión de los antígenos de activación HLA-DR y CD25 en ausencia de la H y después de incubación con H (dilución 1/256) de los linfocitos.
Fig.3. Efecto in vitro de la hemina sobre los linfocitos humanos.
Discusión
En la literatura revisada hasta el momento, no encontramos resultados similares a los nuestros.
La H induce la proliferación de los linfocitos humanos a la concentración óptima correspondiente a la dilución 1/256, cercano al valor utilizado en otros experimentos de cultivo de líneas celulares y de células de médula ósea. Se observa que a altas concentraciones hay un efecto inhibitorio, pues no existió afectación de la viabilidad celular y no hubo proliferación linfocitaria en esas diluciones. Sin embargo, a la dilución 1/256 de la H sola con los linfocitos, existió una proliferación de hasta 15161,67. La proliferación linfocitaria fue elevada con la H sola y la estimulación simultánea de la H con PHA a concentración óptima, lo que permite comprobar el efecto de la H sobre el ciclo celular de los linfocitos humanos. Las concentraciones subóptima, óptima y supraóptima de estimulación linfocitaria con la H corresponden con las diluciones 1/128, 1/256 y 1/512, respectivamente.
Nuestros resultados corroboran además un aumento de la formación de roseta activa y de la expresión de los antígenos de activación celular HLA-DR y CD25, que permite comprobar el efecto de activación de la H sobre los linfocitos humanos. La H podría ser utilizada como inmunoestimulante para elevar la respuesta inmune celular en enfermos con el diagnóstico de inmunodeficiencia, donde se haya comprobado un defecto de la activación y de la proliferación de los linfocitos, así como en personas de la tercera edad que presenten un deterioro de la respuesta inmune celular, por lo que es necesario realizar ensayos clínicos con la H que permitan corroborar in vivo sus efectos inmunomoduladores in vitro.
Summary
The effect in vitro of hemin on human lymphocytes was studied. Thirty donors from the blood bank of the Institute of Hematology and Immunology were selected, who were performed tests of active rosette, of blastic transformation with tritiated thymidine and the expression of HLA-DR and CD-25 activation antigens by immunocytochemical ultramicromethod with and without hemin. Statistically significant differences under experimental conditions with and without hemin were found. It was confirmed that hemin by itself is capable of promoting blastic transformation, increasing the formation of active rosette and the expression of HLA-DR and CD25 activation antigens. In the literature review, no results similar to the above-mentioned were found. Hemin is a product that can activate human lymphocytes by inducing their proliferation and therefore, the expression of activation antigens. The paper suggests that preclinical and clinical studies should be carried out to evaluate hemin as a probable drug for the treatment of cell immunodeficiencies.
Subject headings: HEMIN/isolation / purification; LYMPHOCYTES; HLA-DR ANTIGENS; ROSETTE FORMATION; BLOOD DONORS; LYMPHOCYTE TRANSFORMATION.
Referencias bibliográficas
- Lehninger AL. Bioquímica. 2 ed. La Habana: Ed. Pueblo y Educación; 1981.p.500-3.
- Abraham NG, Levere RD, Lutton JD. Eclectic mechanisms of hematopoyesis. Int J Cell Cloning 1991;9:185.
- Lu I, Broxmeyer HE. The selective enhancig influence of hemin and products of human erythroytes on colony formation by human multipotencial (FCU-GEMM) and erythroid (BFU-E) progenitor cell in vitro. Exp Hematol 1983;11:721-9.
- Koiso Y, Fujimoto Y, Matsumara D,Nakajima O, Hashimoto Y.Modification by heme oxygenase inhibidor, in protoporhyrin of cellular differentiation of human myeloid leukemia K-562 cell line. Biol Pharm Bull 1999;439-40.
- Cortesi R, Gui V, Osti F, Nastruzzi C, Gambari R.Human leukemic K-562 cell treated with cytosine arabinoside: enhancement of erythroid differenciation by retinoic acid and retinol. Eur J Haematol 1998;61:295-301.
- Noguchi C T,Schechter A N. The intracellular polymerization of sickle hemoglobin and its relevance to sickle disease. Blood 1981;58:1057-68.
- Fibach E, Kollia P, Schechter A N, Noguchi C T, Rodger G P. Hemin- induced acceleration of hemoglobin production in immature cultured erythroid cell: preferential enhancement of fetal hemoglobin. Blood 1995;185:2967-74.
- Rodger GP, Dover GJ, Noguchi CT, Schecheter AN, Nienhuis AW.Hematologic responses of patients with sickle cell diseases to treatment with hydroxyurea. N Engl J Med 1990;322:1037.
- Böyum A. Isolation of mononuclear cell and granulocytes from human blood. Scand J Clin Lab Invest 1968;10:1041-9.
- Valle L del, Aranda RE, Rivero R, Almagro D, Roque MC, Alfonso ME. Determinación de anticuerpos antiplaquetarios mediante estimulación linfocitaria. Rev Cubana Hematol Inmunol Hemoter 1986;2:154-64.
- Suárez L,Cruz C, Rivero RA. Ultramicrómetodo inmunológico. Titulación de anticuerpos utilizados para el inmunofenotipaje celular. Rev Cubana Hematol Inmunol Hemoter 1995;11:57-62.
- Cruz C, Fernández ML, Bernal B, Hernández P, Ballester JM. Técnica de rosetas. La aplicación en pacientes con alteraciones inmunológicas. Rev Cubana Med 1981;20: 379-87.
Recibido: 14 de marzo del 2001. Aprobado: 25 de junio del 2002.
Lic. Lázaro del Valle Pérez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de la Habana, Cuba. Tel.(537) 578268. Fax (537)442334. e- mail: ihidir@hemato.sld.cu