Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.21 n.3 Ciudad de la Habana sep.-dic. 2005
Instituto de Hematología e Inmunología
Detección y cuantificación de autoanticuerpos en los hematíes de pacientes con anemia hemolítica autoinmune con prueba de Coombs negativa
Dr. Antonio A. Bencomo Hernández, Dra. María Elena Alfonso Valdés, Dr. Onel M. Ávila Cabrera, Dr. Juan Carlos Jaime Fagundo y Dr. Porfirio Hernández Ramírez
Resumen
Se estudiaron 18 pacientes, 15 adultos y 3 niños, con anemia hemolítica y sospecha de etiología inmune, en los cuales se observó una respuesta favorable al tratamiento con prednisona . Todos los pacientes habían mostrado resultados negativos en la prueba de antiglobulina directa e indirecta (Coombs). A las muestras de sangre se les realizó la técnica de polibreno directa (TPD), la detección de autoanticuerpos en el eluato de los hematíes en la técnica de microplacas ( Mp ), así como la cuantificación de autoanticuerpos asociados con los hematíes mediante un ELISA. Los pacientes investigados representaron el 13,3 % del total de casos de AHAI diagnosticados en el período de estudio. La TPD detectó los anticuerpos en 5 casos (28 %), la Mp resultó positiva en 11 pacientes (61 %) y el ELISA demostró autoanticuerpos en todos los pacientes. El ELISA reveló la presencia de autoanticuerpos IgG en 17 casos (94,4 %), de IgA en 8 pacientes (44,4 %) y de IgM en un caso (5,5 %). En 10 pacientes (55,5 %) la cuantificación de autoanticuerpos IgG se comportó en un rango de 200 a 460 moléculas por hematíe y en el resto se obtuvieron valores superiores a 900 moléculas por hematíe. Los resultados muestran que el ELISA aplicado es particularmente útil para la detección y cuantificación de autoanticuerpos en los hematíes de los pacientes con AHAI con prueba de Coombs negativa y nos provee de un procedimiento para el diagnóstico inmunohematológico de esta identidad.
Palabras clave: anemia hemolítica autoinmune Coombs negativa, ELISA, cuantificación de anticuerpos.
Las anemias hemolíticas autoinmunes (AHAI) se caracterizan por la destrucción, mediada por autoanticuerpos , de los eritrocitos del paciente. Los autoanticuerpos causantes del proceso hemolítico se clasifican en calientes y fríos en dependencia de la temperatura óptima de su reacción in vitro.1 La AHAI más frecuente se debe a la presencia de autoanticuerpos reactivos a 37o C, que constituye el 70 % del total de casos.2 Debido a esto, la mayoría de los investigadores emplean el término AHAI para referirse a la ocasionada por los autoanticuerpos calientes y es la nomenclatura adoptada en este trabajo.
Dada la importancia de las inmunoglobulinas (Igs) en la hemólisis inmune, su detección es un proceder muy empleado en inmunohematología. La prueba de antiglobulina directa (PAD) o prueba de Coombs ha sido utilizada comúnmente para la detección de los autoanticuerpos eritrocitarios. Sin embargo, la PAD tiene limitaciones, ya que existe una cantidad límite de anticuerpos en los hematíes por debajo de la cual la prueba resulta negativa, aunque a estas bajas concentraciones los anticuerpos son capaces de producir hemólisis.3
Existen otros ensayos de mayor sensibilidad que las técnicas de aglutinación que se han aplicado para la detección de los autoanticuerpos eritrocitarios. Dentro de estos se incluyen el empleo de antiglobulina marcada con radioisótopo y la citometría de flujo. Estos métodos requieren de un equipamiento costoso y en algunos casos, de la utilización de compuestos radioactivos de manipulación riesgosa.3,4
Los ensayos inmunoenzimáticos son sensibles y rápidos; pueden aplicarse en la investigación de las inmunoproteínas asociadas con los eritrocitos y en la detección de anticuerpos no revelados por las técnicas convencionales. Además de las ventajas ya expuestas, su bajo costo, la no utilización de material radioactivo y la posibilidad de cuantificar autoanticuerpos unidos a estas células, lo señalan como un método a elegir para estos estudios.5,6
En este trabajo comunicamos los hallazgos de la cuantificación de autoanticuerpros asociados con los hematíes en pacientes con AHAI con prueba de Coombs negativa y la factibilidad de utilizar esta determinación como prueba para el diagnóstico inmunohematológico de esta entidad.
Métodos
Se estudiaron 18 pacientes: 15 adultos (10 femeninos y 5 masculinos) y 3 niños (1 femenino y 2 masculinos), con anemia hemolítica de etiología desconocida y con sospecha de etiología inmune, en los cuales se observó un incremento de las cifras de hemoglobina y una disminución de los reticulocitos después del tratamiento con prednisona. El rango de edad de los pacientes adultos fue de 21 a 67 años y de 2 a 6 años en los niños. En 12 pacientes (67 %) la anemia hemolítica se consideró idiopática y en el resto estuvo asociada con otras enfermedades como: 2 pacientes con hepatitis B, 2 con linfoma no- hodgkiniano, 1 con neutropenia autoinmune y uno con síndrome mielodisplásico. Los pacientes fueron seleccionados de entre los 135 casos de AHAI que fueron investigados en el Departamento de Inmunohematología del Instituto de Hematología e Inmunología en el período comprendido entre octubre del 1995 y septiembre del 2001.
Todos los pacientes habían mostrado resultados negativos en la prueba de antiglobulina directa (PAD) y la prueba de antiglobulina indirecta (PAI) con los sueros antiglobulínicos poliespecíficos y monoespecíficos.7 En todos los casos se habían descartado las hemoglobinopatías y las enzimopatías por las técnicas habituales.
A las muestras de sangre se les realizó la detección de autoanticuerpos en el eluato de los hematíes, obtenido por el método del éter,7 en la técnica de microplacas y la cuantificación de autoanticuerpos en el eluato mediante un ensayo inmunoenzimático (ELISA) para la cuantificación de inmunoglobulinas en los hematíes como se describe a continuación.
Técnica de microplacas (Mp) para la detección de autoanticuerpos eritrocitarios en el eluato de los hematíes:8
Se sensibilizó una mezcla de hematíes de donantes de sangre de grupo O y de fenotipo Rh , R 1 R 1 , R 2 R 2 y rr , con cada uno de los eluatos de los pacientes de la siguiente forma: en tubos de cristal de 12 x 75 mm se añadieron 10 m L de la mezcla de hematíes de donantes y 100 m L de los eluatos, los que se incubaron a 37 ºC durante 1 hora. Posteriormente, los hematíes se lavaron 3 veces con solución salina al 0,9 % y se resuspendieron al 0,5 % en solución salina. En microplacas rígidas de 96 pocillos de fondo en V (Greiner) se mezclaron, en el pocillo correspondiente, 25 m L de la suspensión de los hematíes sensibilizados con 25 m L de las diluciones de los reactivos antiglobulínicos monoespecíficos. Los reactivos utilizados fueron: anti-IgG (Dako), anti-IgA y anti-IgM ( Behring ) en las diluciones 1:20, 1:40 y 1:20, respectivamente, en solución salina balanceada de fosfato 0,15 mol /L, pH 7,2 (SSBF) que contenía suero fetal bovino al 1 %. Como controles positivos se utilizaron hematíes sensibilizados con anticuerpos anti-D de los isotipos IgG , IgA y anticuerpos anti -Le a de la clase IgM , y como control negativo hematíes del grupo O no sensibilizados. La placa se incubó durante 12 horas a 4 ° C y la lectura se realizó después de inclinarla en un ángulo de 45 0 durante 10 minutos. Se consideró un resultado positivo la presencia de un botón de hematíes en el fondo del pozo y como negativo el corrimiento de los hematíes hasta los bordes externos del pozo.
Ensayo inmunoenzimático (ELISA) para la cuantificación de IgG, IgA e IgM asociadas con los hematíes: 9
La técnica se realizó en placas de poliestireno de 96 pocillos de fondo plano (Nunc, Immunoplates) que se recubrieron con 100 m L ,en el pocillo correspondiente, de la fracción IgG de anticuerpos de carnero anti-IgG (g), anti-IgA (a) o anti-IgM (m) humano (Sigma) en una concentración de 5 m g/ mL en solución balanceada de carbonato bicarbonato 0;05M a pH 9,6. Las placas se incubaron a 4 0 C durante 16-18 horas y fueron posteriormente lavadas 4 veces con solución salina balanceada con fosfato 0,15 mol /L pH 7,2 con tween 20 al 0,2 % (SSBF-Tw). Los eluatos de los hematíes de los pacientes y la curva patrón de IgG , IgA e IgM diluidos en SSBF- Tw 0,05 % con albúmina bovina al 0,4 % (SSBF-Tw-A) se añadieron a razón de 100 m lL por pocillo y se incubaron a 37 0 C durante 1 hora. Las curvas de cuantificación se prepararon a partir del suero de referencia Nor-Partigen, Behring, en concentraciones desde 0,0025 a 0,07 m g/ mL de IgG e IgM y de 0,0025 m g a 0,06 m g/ mL de IgA. Los 4 lavados posteriores se realizaron con SSBF-Tw 0,05 % y se añadieron a los pocillos apropiados 100 m L de la fracción IgG de carnero conjugado con peroxidasa (Sigma) anti-Fc de la IgG e IgM humana diluidos 1: 5000 o anti-Fc de la IgA humana diluido 1:1000 en SSBF- Tw 0,05 %. Las placas se incubaron con los conjugados 1 hora a 370 C y fueron posteriormente lavadas 4 veces con SSBF- Tw 0,05 %. La reacción se reveló con la adición de 100 m L por pocillo de ortofenilendiamina (Merck) a una concentración de 0,24 mg/mL en solución balanceada de ácido cítrico pH 5,0 que contenía peróxido de hidrógeno al 0,024 %. La reacción se detuvo a los 15 minutos con la adición de 100 m L por pocillo de H 2 SO 4 al 3M y las densidades ópticas de cada muestra en duplicado se leyeron a 492 nm en un lector de microelisa (Titertek Multiscan). Las concentraciones de inmunoglobulinas (Igs) en los eluatos de los hematíes fueron calculadas a partir de la curva patrón a través de un ensayo de regresión lineal. El resultado se expresó como un aproximado del número de moléculas de Igs por hematíe con el uso del número de Avogadro y del peso molecular de la IgG o IgA (160,000 D) y de la IgM (970,000 D). De acuerdo con el número de Avogadro 1 m g contiene 370 ´ 10 10 moléculas de IgG o IgA y 62 ´ 10 10 moléculas de IgM . El número de moléculas de Igs por hematíe es igual a la concentración de Igs en m g/ mL del eluato multiplicado por el número de moléculas de Igs en 1 m g y dividido entre el número de hematíes en 1 mL (1,1 ´ 10 10 hematíes). Se consideró un valor positivo en el ELISA un número de moléculas por hematíe de IgG ³ 163, de IgA ³ 90 y de IgM ³ 20 moléculas que corresponde con la media más 3 desviaciones estándar de los valores obtenidos en los individuos normales.
Se determinó también la presencia de autoanticuerpos en los hematíes en la técnica manual de polibreno directa (TPD) de acuerdo con el método siguiente:
En un tubo de cristal de 13 x 100 mm se añadió una gota de la suspensión al 3 % en solución salina 0,9 % de los hematíes del paciente, 2 gotas de suero autólogo y 1 mL del medio de baja fuerza iónica de dextrosa-EDTA. La mezcla se incubó durante 1 minuto a temperatura ambiente. Después se añadieron 2 gotas de una solución al 0,05 % en solución salina al 0,9 % de polibreno (Sigma) y se incubó durante 30 segundos. Posteriormente se centrifugó a 150 g durante 30 segundos y se decantó el sobrenadante. La primera lectura de la aglutinación se realizó después de añadir 2 gotas de la solución de resuspensión de citratro-dextrosa. Posteriormente se añadieron 2 gotas adicionales de la solución de resuspensión y se realizaron 3 lavados de los hematíes con solución salina para la lectura en la fase de antiglobulina con el uso del suero antiglobulínico anti-IgG.10
A todos los pacientes se les realizó la cuantificación sérica de IgG , IgA e IgM por la técnica de inmunodifusión radial simple.11
Resultados
Los 18 pacientes estudiados con AHAI Coombs negativa representaron el 13,3 % de los 135 casos de AHAI diagnosticados en el período en que se realizó la investigación.
Los 3 procedimientos técnicos empleados detectaron anticuerpos eritrocitarios que no fueron revelados en la PAD. La TPD detectó los anticuerpos en 5 casos (28 %), la Mp resultó positiva en 11 pacientes (61 %) y el ELISA demostró un aumento del número de moléculas de Igs por eritrocito en todos los pacientes (tabla 1). Este último ensayo reveló la presencia de anticuerpos de la clase IgG en 17 casos (94,4 %), de la clase IgA en 8 pacientes (44,4 %) y de la clase IgM en un caso (5,5 %) ( tabla 2). En todos los casos se evidenció hemoglobinemia , reticulocitosis e hiperbilirrubinemia .
Tabla 1. Resultados de las técnicas de aglutinación y el elisa en la detección de autoanticuerpos eritrocitarios en pacientes con AHAI con prueba de antiglobulina negativa.
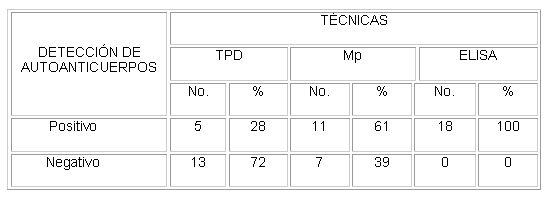
TPD: técnica de polibreno directa
Mp: Técnica de microplacas
En 10 pacientes (55,5 %) la cuantificación de IgG asociada con los eritrocitos se comportó en una rango de 200 a 460 moléculas por hematíe (casos 1,3, 6, 9, 10, 11, 12, 13, 15,17). En el resto se obtuvieron valores superiores a 900 moléculas de IgG por hematíe (tabla 2).
Tabla 2. Hallazgos inmunohematológicos en 18 pacientes con ahai y prueba de antiglobulina directa (coombs) negativa.
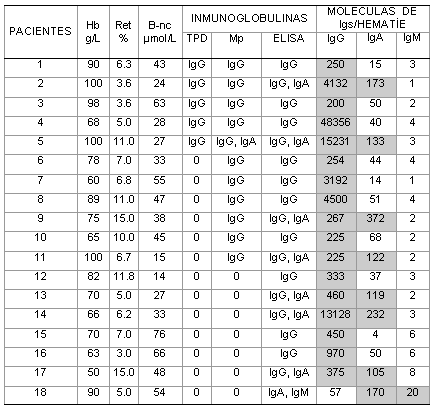
B-nc: bilirrubina no conjugada
TPD: técnica de polibreno directa
Mp: técnica de microplacas
Las áreas sombreadas señalan los resultados positivos en el ELISA
En todos los pacientes la cuantificación de Igs en el suero se encontró dentro de los valores normales. En los niños se obtuvieron valores de cuantificación sérica de IgG en un rango de 6,13 a 10,24 g/L, de IgA de 0,92 a 2,17g/L y de IgM de 0,3 a 1,10 g/L. En los adultos la cuantificación sérica de IgG se comportó entre 9,65 y 15,0 g/L, de IgA entre 2,36 y 4,25g/L y de IgM entre 0,5 y 1,3g/L.
Discusión
Es bien conocido que en algunos pacientes con evidencias clínicas de hemólisis inmune no se detectan anticuerpos eritrocitarios por los métodos convencionales.2
Este estudio documenta los hallazgos inmunohematológicos en 18 pacientes con AHAI y prueba de Coombs negativa, que constituyeron el 13,3 % de todas los casos de AHAI diagnosticados en el período en que se efectuó la investigación. Estos resultados son similares a los de otros autores, que comunican una frecuencia del 10 % de pacientes con AHAI con PAD negativa.12,13
El hallazgo de una PAD negativa en la AHAI se asocia con diferentes causas inherentes a la realización de esta prueba, por lo que es necesario el empleo de técnicas de mayor sensibilidad como la citometría de flujo, la prueba de polibreno directa y el ELISA, para detectar los autoanticuerpos eritrocitarios causantes de la hemólisis.7
Nuestros resultados sugieren el empleo del ELISA para estos fines, ya que reveló la presencia de los autoanticuerpos en todos los pacientes.
Un estudio previo con la introducción de un inmunoensayo , que detecta las Igs directamente sobre los eritrocitos, mostró un incremento de la IgG asociada con los hematíes en el 40 % de los casos.14 Sokol y colaboradores,15 con la aplicación también de un ELISA directo, demostró una asociación entre la presencia de bajas concentraciones de IgG, IgA e IgM en los hematíes y la hemólisis autoinmune en el 75 % de los pacientes con AHAI con PAD negativa.
El ensayo inmunoenzimático utilizado en este estudio es al parecer más sensible que los descritos previamente, debido probablemente a que la cuantificación de Igs se realizó a partir del eluato obtenido por el método del éter que concentra los anticuerpos y suele ser más sensibles que la detección los anticuerpos directamente en los hematíes. Por otra parte, este método permite la identificación de todos los isotipos de Igs causantes de la hemólisis en la AHAI, lo que avala este proceder en la identificación de autoanticuerpos no revelados en la PAD.9
La técnica de Mp es un método que también ofrece ventajas, ya que además de identificar los autoanticuerpos en el 61 % de los casos, corrobora el diagnóstico al demostrar la reacción de las Igs con los hematíes en el ensayo de antiglobulina indirecta. La ausencia de anticuerpos demostrables en este ensayo y detectados únicamente en el ELISA, podría estar relacionado con un aumento de Igs asociadas con los hematíes en pacientes con hipergammaglobulinemia o con hemoglobinopatías sin hemólisis inmune.16
Sin embargo, en la serie estudiada, estas 2 condiciones fueron excluidas, ya que se descartaron las hemoglobinopatías y se encontraron valores de cuantificación de Igs séricas dentro de los parámetros normales en todos los casos. Estos hallazgos permiten asumir que el ELISA detectó autoanticuerpos en los hematíes de los pacientes con AHAI Coombs negativa.17
La TPD es más sensible que la PAD para la detección de los autoanticuerpos de la clase IgG . 14,18 Aunque en nuestra casuística resultó positiva solo en el 28 % de los pacientes, debe tenerse en cuenta como una alternativa, por ser una técnica fácil de realizar y por la rapidez con que se obtienen los resultados.
La presencia de autoanticuerpos de los isotipos IgA e IgM no fijadores de complemento en los hematíes, puede ocasionar una PAD negativa, al no ser detectados estos por el suero antiglobulina humana poliespecífico, cuyos componentes principales son los anticuerpos anti-IgG y anti-C3.19,20 Sin embargo, en los pacientes estudiados, la PAD fue igualmente negativa con los reactivos monoespecíficos anti- IgA y anti - IgM . Resultados similares se han comunicado en otras series en las que se empleó igual metodología para el diagnóstico inmunohematológico.2
Aunque la mayoría de los investigadores han centrado su atención en demostrar la presencia de anticuerpos IgG en los hematíes 21-23 de los pacientes con AHAI Coombs negativa, se han encontrado también autoanticuerpos de la clase IgA e IgM involucrados en la hemólisis.10 Al respecto, Sokol y colaboradores 24 detectaron anticuerpos IgA e IgM por medio de un ELISA directo en los hematíes de 4 de los 16 pacientes con PAD negativa. Salama y colaboradores,25 demostraron autoanticuerpos IgM en los hematíes de 8 casos mediante un ensayo inmunorradiométrico. Otros autores identificaron autoanticuerpos IgA en los hematíes de este grupo de pacientes en la técnica de aglutinación en gel o por un ensayo de citometría.26
Los resultados negativos de la prueba de Coombs en el 55,5 % de los casos estudiados, pueden ser atribuibles a la presencia de 200 a 500 moléculas de IgG por hematíe, que es el límite de sensibilidad de la técnica de antiglobulina.27 Sin embargo, la teoría cuantitativa no es aplicable a todos los pacientes, ya que en el resto de los casos estudiados, se encontraron valores superiores a 900 moléculas de IgG por hematíe, e incluso en un paciente se detectaron 48 356 moléculas de IgG por célula, donde la PAD debía resultar francamente positiva.
Garratty17 obtuvo resultados similares, y plantea como teoría aún no comprobada, que el hallazgo de una PAD negativa en la AHAI no es atribuible únicamente a la sensibilidad de la técnica, sino que es debido también a que las moléculas de anticuerpos muestran una orientación espacial que no permite que el reactivo antiglobulínico forme puentes entre los hematíes y se produzca la aglutinación. De esta forma, los autoanticuerpos pueden ser detectados por ensayos que no dependan de la aglutinación.
Los resultados de nuestro estudio muestran que el ensayo inmunoenzimático aplicado es particularmente útil para la detección y cuantificación de autoanticuerpos en los hematíes de los pacientes con AHAI y prueba de Coombs negativa, y nos provee de un procedimiento muy sensible para el diagnóstico inmunohematológico de esta identidad.
Summary
18 patients, 15 adults and 3 children, with hemolytic anemia and suspicion of immune etiology were studied. A favorable response to prednisone was observed among them. All the patients had had negative results in the direct and indirect antiglobulin test (Coombs). The blood specimens were applied the direct polybrene technique (DPT), the detection of antibodies in the eulate of the red cells by the microplaque technique (Mp), and the quantification of autoantibodies associated with red cells by ELISA. These patients accounted for 13.3 % of the total of AIHA cases diagnosed. The direct polybrene test detected the antibodies in 5 cases (28 %), whereas Mp tested positive in 11 patients (61 %), and ELISA showed autoantibodies in all the patients. ELISA revealed the presence of IgG autoantibodies in 17 cases (94.4 %), of IgA in 8 patients (44.4 %), and of IgM in one case (5.5 %). In 10 patients (55.5 %), the quantification of IgG autoantibodies behaved in a range from 200 to 460 molecules per red cell. In the rest, values over 900 molecules per red cell were obtained. The results demonstrated that ELISA is particularly useful for the detection and quantification of autoantibodies in the red cells of the patients with Coombs negative AIHA, and that it provides a procedure for the immunohematological diagnosis of this entity.
Key words: Coombs negative autoimmune hemolytic anemia, ELISA, antibody quantification
Referencias bibliográficas
1. Gehrs BC, Friedberg EC. Autoimmune hemolytic anemia. Am J Hematol 2002 ;69:258-71.
2. Petz LD, Garraty G. Immune hemolytic anemias. 2 ed. Philadelphia: Churchill Livinstone; 2004.
3. Kumpel BM, Austin EB, Lee D, Jackson DJ, Judson PA, Chapman GE. Comparison of flow cytometric assays with isotopic assays of 51 chromium-labeled cells for estimation of red cell clearance or survival in vivo. Transfusion 2000;70:228 -39.
4. Garratty G, Arndt PA. Applications of flow cytofluorometry to red blood cell immunology. Cytometry 1999 ;38:259 -67.
5. Lambin P, Debbia M, Beolet M, Brossard Y, Le Pennec PY, Rouger P. Quantitative estimation by ELISA of IgG anti-D (RH1) antibodies in immunoglobulin preparations and in the sera of immunized donors. Transfus Clin Biol 2001 ;8:17-22.
6. Sokol RJ, Hudson G. Quantitation of red cell bound immunoprotein . Transfusion 1998 ;38:782 -95.
7. Brecher ME, ed. Technical manual. 14 ed. Bethesda : American Association of Blood Banks; 2002.
8. Alfonso Y, Bencomo AA, Díaz M, Alfonso ME. Micrométodo para la detección de clases y subclases de inmunoglobulinas en el eluido de eritrocitos de pacientes con AHAI. Rev Cubana Hematol Inmunol Hemoter 2002;18:20-6.
9. Bencomo AA, Díaz M, Alfonso Y, Valdés O, Alfonso ME. Quantitation of red cell-bound IgG, IgA and IgM in patients with autoimmune hemolytic anemia and blood donors by enzyme-linked immunosorbent assay. Immunohematology 2003;19:47-53.
10. Rubino M, Kavitsky DM, Nance S. Serologic testing in autoimmune haemolytic anemia (AIHA) with negative direct antiglobulin test (DAT). Transfusion 2002;42:104S .
11. Mancini G, Carbonara AO, Heremans JF. Single radial diffusion methos for the immunological quantitation of proteins. Int Prot Biol Fluids, 11th Colloquious. Oxford: Pergamon Press; 1964.p.370-3.
12. Mollison PL, Engelfriet CP, Contreras M. Blood transfusion in clinical medicine. 10 ed. Oxford: Blackwell Science; 1997.
13. Garraty G. Pathophysiology of autoimmune hemolytic anemia. AABB: Annual Meeting; 2001: 505-511.
14. Garraty G, Postoway N, Nance S, Brunt D. The detection of IgG on the red cells of Coombs negative autoimmune hemolytic anemias.Transfusion 1982;22:430.
15. Sokol RJ, Hewitt S, Booker DJ, Stamps R. Small quantities of erythrocyte bound immunoglobulins and autoimmune haemolysis. J Clin Pathol 1987 ;40:254-7.
16. Garratty G. Effect of cell-bound proteins on the in vivo survival of circulating blood cells. Gerontol 1991;37:68-94.
17. ----------. Factor affecting the pathogenicity of red cell auto and alloantibodies. En: Nance S, ed. Immune destruccion of red cell. Arlington : American Association of Blood Banks; 1989. p.109-69 .
18. Braga GW, Bordin JO, Moreira JG, Kuroda A. Laboratory diagnosis of auto-immune hemolytic anemia: Characteristics of the manual direct test of polybrene . Rev Assoc Med Bras 1998;44:16 -20.
19. Case J, Ford DS, Chung A, Collins R, Kochman S, Mazda T, et al. International reference reagents: Antihuman globulin. Vox Sang 1999;77:121-7.
20. Harmening DM. Clinical hematology and fundamentals of homeostasis. 4 ed. Philadelphia: F.A. Davis Company; 2001.
21. Kondo H, Oyamada T, Mori A, Sumi H, Kurosu K, Kajii E. Direct-antiglobulin-test-negative immune haemolytic anaemia and trombocytopenia in a patients with Hodgkin´s disease. Acta Haematol 2001 ;105:233 -6.
22. Kerr R, Rawlinson PS, Cachia PG. Direct antiglobulin test negative, non spherocytic autoimmune haemolytic anaemia. Clin Lab Haematol 2000;22:265-367.
23. Lai M, Rumi C, D`Onofrio G, Voso MT, Leone G. Clinically significant autoimmune hemolytic anemia with a negative direct antiglobulin test by routine tube test and positive by column agglutination method. Immunohematology 2002;18:109-13.
24. Sokol RJ, Hewitt S, Booker DJ, Stamps R. Enzyme linked direct antiglobulin test in patients with autoimmune haemolysis. J Clin Pathol 1985;38:912-4.
25. Salama A, Mueller- Eckhardt C, Bhadi S. A two-stage immunoradiometric assay with 125 I-staphylococcal protein A for the detection of antibodies and complement on human blood cells. Vox Sang 1985 ;48:239-45.
26. Meyer F, Garin L, Smati C, Gaspard M, Giannoli C, Rigal D. Application du gel test utilisant une antiglobuline anti-IgA au diagnostic immunologique d´anémie hémolytique auto-immune à test de Coombs direct négatif. Transfus Clin Biol 1999;6:221-6.
27. Gilliland BC . Blood cells: Autoimmune hemolytic anemia. En: Rose NR, Mackay IR, eds. The autoimmune diseases. Academic Press; 1998.p.245-68.
Recibido: 15 de diciembre de 2005. Aprobado: 27 de diciembre de 2005
Dr. Antonio A. Bencomo Hernández . Instituto de Hematología e Inmunología. Apartado 8070, Ciudad de La Habana, CP 10800, Cuba. Teléf (537) 578268, 578695, 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu














