Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.22 n.2 Ciudad de la Habana Mayo-ago. 2006
Instituto Finlay, La Habana
Purificación del factor IX recombinante expresado en leche de cerdas transgénicas
Lic. Armando Cádiz Lahens,1 Lic. Aniel Moya Torres,1 Dr. William Velander,2 Dr. Manuel Limonta Vidal,3 Lic. Lázaro Joo Sánchez,1 Lic. Alexandro Rodríguez Rojas,1 Lic. Laritza Solarana Tito,1 Lic. Alina Díaz Concepción,3 Lic. Patricia Caunedo Almagro,3 Dra. Dunia Castillo González3 y Dra. Delfina Almagro Vázquez3
Resumen
Se purificó a partir de la leche de cerdas transgénicas, factor IX recombinante, y se obtuvieron rendimientos entre 1 a 2 g de esta proteína por litro, lo que resulta una nueva vía para la obtención de este producto con una alta eficiencia, ya que su expresión es 1 000 veces superior a la del factor IX plasmático humano. Mediante la combinación de 2 pasos cromatográficos: intercambio iónico en DEAE-Shephadex A-50 y cromatografía de afinidad con heparina, se realizó la purificación del factor IX, con esta leche como material de partida. Se estudiaron diferentes métodos para la eliminación de las caseínas, contaminante principal del proceso, y se escogió finalmente la ultracentrifugación, por las numerosas ventajas que presenta con respecto a la precipitación isoeléctrica y la precipitación por sales. El factor IX puede ser purificado de la leche transgénica con una alta pureza utilizando métodos cromatográficos que no usan inmunoafinidad y son finalmente escalables en la producción industrial, lo cual proporciona nuevas perspectivas para el tratamiento de la hemofilia B mediante la preparación de posibles formulaciones orales.
Palabras clave: factor IX, purificación, hemofilia B.
La hemofilia B, enfermedad hereditaria de la coagulación sanguínea, afecta a 1 de cada 25 000 hombres y está causada por una deficiencia en la síntesis de factor IX, proteína esencial para una eficiente coagulación de la sangre.1
Durante los últimos 50 años, los hemofílicos B han sido tratados con plasma fresco y concentrados de factor IX purificados a partir de plasma, 2 con el riesgo de infecciones como el virus del VIH y los virus de las hepatitis B y C. En la década de los 90, fueron introducidos en la terapia de remplazo, preparados de factor IX recombinante altamente purificados, que mostraron buenos perfiles terapéuticos. Sin embargo, la tecnología del DNA recombinante es más costosa, añadido a deficiencias en algunas modificaciones como la remoción del propéptido, la gamma carboxilación, la Ser-fosforilación, y la glicosidación.3
La leche constituye un buen medio para la producción de proteínas recombinantes, pues se han acumulado suficientes conocimientos sobre la fisiología de las células mamarias en la producción de proteínas heterólogas, 4 y en el caso del factor IX de la coagulación, según la tecnología desarrollada por Velander y colaboradores. Los grandes niveles que se producen de estas proteínas en leche, representan una alternativa muy interesante para el tratamiento terapéutico y profiláctico de los pacientes hemofílicos.
Recientemente se logró mediante transgénesis, expresar en células mamarias de cerdas varias proteínas de la coagulación, entre ellas el factor IX, con un nivel de expresión en leche 1 000 veces superior (1 000-2 000 µg/mL) a como se encuentra en el plasma de individuos sanos.3 Este producto representa una alternativa muy novedosa y de un alto impacto mundial para el tratamiento de esta enfermedad. Contar con métodos de purificación escalables como el que desarrollamos en este trabajo, brindará una posibilidad importante para la obtención de factor IX, de elevada pureza y con una alta eficacia terapéutica.
Métodos
Obtención de la leche transgénica
Las cerdas transgénicas fueron inyectadas por vía intramuscular con 30-60 UI de oxitocina para estimular la salida de la leche. La leche fue transferida a botellas plásticas y transportada de la granja hacia el laboratorio para su procesamiento. En el laboratorio se almacenó a 4 ºC antes de dividirla en alícuotas de 250 mL. Todas las muestras fueron congeladas en recipientes plásticos, a –70 ºC hasta su uso posterior.
Eliminación de la caseína
La leche fue descongelada en baño de agua a 37 °C en un baño termostatado HAAKE W26, Germany. Un volumen de 250 mL fue ultracentrifugado a 45 000 g durante 30 minutos a 4 ºC , en ultracentrífuga Beckman L7-65. El suero obtenido se almacenó a –20 ºC y se tomaron muestras de leche transgénica y suero. El sedimento de caseínas, al igual que la capa de grasas, fue eliminado.
Cromatografía de intercambio iónico
A 100 mL de suero transgénico obtenido en la ultracentrifugación, se le añadieron 200 mL de solución tampón de equilibrio (20 mM de Tris, 150 mM de NaCl, 2 mM de EDTA, pH =7,4) y 5g de DEAE-Sephadex. Se mantuvieron en agitación moderada durante 1,30 h, a 4 °C en zaranda IKA-Labortechnick KS 250, Germany.
Posteriormente se realizó la filtración a vacío con un filtro de vidrio aglomerado. Los lavados de la resina se efectuaron con la solución tampón de equilibrio, hasta que la densidad óptica (DO) a 280 nm del lavado disminuyera a valores inferiores a 0,01, lo cual fue analizado en el espectrofotómetro Pharmacia LKB Ultrospec III.
La elución del material unido a la matriz se realizó con solución tampón de elución 15 mM de CaCl2 (20 mM de Tris, 150 mM de NaCl, 2 mM de EDTA, 15 mM de CaCl2, pH =7,4), obteniéndose una fracción enriquecida en factor IX que se almacenó a –20 °C. Se tomaron muestras del primer filtrado (material que no interaccionó con la matriz) y de la fracción eluida.
Ultra-diafiltración en Amicon
La fracción obtenida con 15 mM de CaCl 2 fue ultra-diafiltrada en un equipo AMICON 8050 con una membrana DIAFLO YM30, de tamaño nominal de poro de 30 kDa, para concentrar hasta 50 mL. Los lavados se realizan con solución tampón (0,1 M de Tris, 0,01M de ácido cítrico, pH = 7,4).
Cromatografía de afinidad con heparina
Los 50 mL de muestra obtenidos en la ultra-diafiltración en la solución tampón (0,1 M de Tris, 0,01M de ácido cítrico, pH =7,4), se pasaron por 8 mL de una matriz de heparina-Sepharose 6 FF en un sistema cromatográfico Pharmacia LKB, con un flujo de 0,5 mL/minuto y sensibilidad 0,1. Se empleó para la elución la solución tampón (0,1 M de Tris, 0,01 M de ácido cítrico y 0,45 M de NaCl, pH = 7,4). Se obtuvo un volumen de 24 mL que posteriormente se concentró hasta 12 mL y se lavó con solución tampón (0,1 M de Tris, 0,01 M de ácido cítrico, pH =7,4) mediante la ultra-diafiltración en AMICON 8050 con una membrana DIAFLO YM30, de tamaño nominal de poro de 30 kDa. Se tomaron muestras para su análisis posterior.
Electroforesis en geles de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE)
La electroforesis se realizó en condiciones de reducción, con una concentración de acrilamida de 12,5 %, una corriente de 35 mA y un voltaje de 250 V, utilizando una fuente Pharmacia LKB EPS 500/400. En cada pocillo se aplicaron 20 µg de muestra, se empleó un patrón Pharmacia (LMW Calibration Kit for SDS. 14 000-97 000 Da) y se realizó la tinción con nitrato de plata.
Estimación de la concentración de proteínas
La determinación de la concentración de proteínas se realizó por el método de Lowry.
Determinación de la actividad coagulante del factor IX
Se determinó la actividad biológica del factor IX, por la prueba del tiempo parcial de tromboplastina activado con caolín (TCP-C).
Resultados
Inicialmente se realizó una diaultrafiltración con una membrana Amicon YM 30, que su tamaño nominal de poro permitió eliminar proteínas y péptidos, con talla molecular inferior a 30 000 Da y por lo tanto, contribuir a la purificación del FIX, que queda retenido por tener un peso molecular superior (55 000 kDa), además de ser un paso interesante para la remoción de contaminantes. Mediante este paso se logró eliminar el CaCl2, y cambiar la solución tampón hacia las condiciones iniciales de corrida de la cromatografía de afinidad con heparina.
La heparina está compuesta por un glucosaminoglicano, con múltiples sitios de afinidad efectiva y de intercambio iónico con la molécula de FIX, específicamente en su dominio de factor de crecimiento. Este polímero formado por residuos alternados de ácido hexurónico y residuos de glucosamina, puede ser unido con la matriz de Sepharose y ser muy empleado en la purificación de factores de la coagulación, por la capacidad de estos de interactuar con este polímero. El FIX inactivo se une con la heparina con una fortaleza diferente a la del FIX activado, logrando por lo tanto la obtención del zimógeno por variación de la fuerza iónica del medio.5
En el cromatograma obtenido (fig. 1), se observan 2 picos bien definidos con diferentes tiempos de elución. El primero se obtuvo con solución tampón (0,1 M de Tris, 0,01 M de ácido cítrico) y corresponde al FIX activado y otros contaminantes. Para obtener el segundo pico, se añaden 0,45 M de NaCl a la solución anterior, lográndose la elución del FIX que se une más fuertemente con la heparina (FIX zimógeno).
Fig. 1. Perfil de elución del FIX transgénico en la cromatografía de afinidad con heparina. Se empleó una matriz cromatográfica de heparina-Sepharose 6FF. Se aplicaron 50 mL de la muestra eluida con CaCl 2 en DEAE Sephadex A-50. Buffer A: 0,1 M Tris; 0,01M de ácido cítrico, pH 7,4. Buffer B: 0,1 M de Tris; 0,01 M de ácido cítrico, 0,45 M de NaCl, pH 7.4. Flujo empleado 0,5 mL/min. Pico I: volumen de muestra no fijado; pico II: factor IX transgénico (zimógeno) eluido a 0,45 M NaCl.
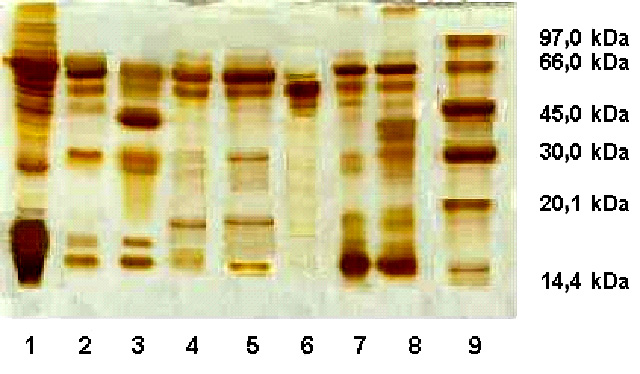
En el SDS-PAGE (fig. 2) correspondiente a la purificación, al observar la migración del pico II, encontramos una banda que coincide perfectamente, con la correspondiente al FIX, que aparece en los perfiles cromatográficos de las muestras de CCP y del MONONINE y en la región de aproximadamente 55 000 Da. Esta banda también se encuentra presente en las muestras de leche, suero y en la elución con 15 mM de CaCl2.
Fig. 2. Electroforesis en gel de poliacrilamida en condiciones de reducción con dodecil sulfato de sodio. Tinción con plata para proteínas: Línea 1: leche transgénica; línea 2: suero de leche transgénica; línea 3: fracción que no se unió al DEAE-Sephadex A-50; línea 4: fracción que se une al DEAE-Sephadex A-50 (elución con 15 mM CaCl 2 ); línea 5: pico I cromatografía heparina Sepharose; línea 6: pico II cromatografía heparina-Sepharose; línea 7: MONONINE (FIX humano comercial); línea 8: complejo protrombínico; línea 9: patrón de peso molecular de (LMW Pharmacia Kit).
La tabla muestra el resultado del proceso de purificación. Como puede observarse, de una muestra de 110 mL iniciales de leche con 200 mg/dL de FIX activo, se obtiene un producto final de FIX purificado con una concentración de 140 mg/dL, que representa una actividad específica de 300 U/mg. Durante la purificación se van obteniendo cada vez fracciones más puras de esta proteína, lográndose un producto con un alto grado de pureza.
Tabla. Análisis de la actividad específica de las distintas etapas del proceso de purificación
| Muestras | Volumen (mL) | Concentración de proteínas (mg/mL) | mg FIX/dL | Actividad específica (u/mg) |
| Leche | 110 | 62,1 | 200 | 322 |
| Suero | 100 | 33 | 175 | 5,30 |
| Fracción que no interaccionó con el DEAE | 185 | 4,2 | 1.5 | 0,64 |
| Fracción que interaccionó con el DEAE | 220 | 0,684 | 170 | 2,46 |
| Pico I (cromatografía con heparina) | 60 | 1,529 | 20 | 21,8 |
| Pico II (cromatografía con heparina) | 24 | 4,2 | 140 | 300 |
El proceso de purificación que se desarrolla en este trabajo, permite la obtención de un FIX transgénico de alta pureza, el cual tiene un alto valor para el tratamiento de la hemofilia B. La estrategia desarrollada, es una metodología sencilla y escalable para el procesamiento de grandes volúmenes de leche que expresen proteínas humanas de la coagulación.
Discusión
Los animales transgénicos se han reconocido como una alternativa ventajosa a la expresión de proteínas heterólogas; sirven como biorreactores vivientes para la producción de proteínas recombinantes de alto valor terapéutico,6 pueden producir altas concentraciones de productos recombinantes a un costo relativamente bajo.7 Por otra parte, las células de mamíferos pueden sintetizar proteínas con las apropiadas modificaciones postranscripcionales, lo que permite asegurar la actividad biológica de las proteínas recombinantes.8
La leche tiene como función biológica fundamental la nutrición y protección inmunológica del neonato. Por esta razón, está compuesta por azúcares, proteínas y lípidos, cuya proporción varía según la zona geográfica, el tipo de alimento, la talla, etc.
De todas las proteínas de la leche, las caseínas son los contaminantes más difíciles de eliminar en los procesos de purificación de proteínas transgénicas, por las características de sus moléculas de agruparse en soluciones acuosas formando micelas. Por tal razón, estas deben ser eliminadas en los pasos iniciales de cualquier estrategia de purificación.
Múltiples son las formas de desestabilizar las micelas de caseínas, ya sea empleando renina, pH ácido o eliminando los iones calcio o fosfato que la estabilizan.9 Sin embargo, en el caso del FIX transgénico a valores de pH bajos, se corre el riesgo de que la molécula pierda actividad biológica una vez que quede en el suero.
Nuestra experiencia demostró, que con un paso inicial de ultracentrifugación a 45 000 g, a 4 ºC durante 30 minutos, era posible eliminar en una sola etapa la mayor parte de las caseínas contenidas en la leche de cerdas transgénicas, debido a que las micelas en la leche se comportan como solución coloidal y pueden ser separadas a altas velocidades de centrifugación. En el SDS-PAGE correspondiente a las muestras tomadas a lo largo del proceso de purificación, al comparar la leche transgénica con el suero obtenido luego de la ultracentrifugación, podemos observar la disminución de las bandas correspondientes a las caseínas.
Luego de la ultracentrifugación se obtuvieron 3 fracciones principales: una en el fondo correspondiente al contenido celular, en el que se encuentran las células epiteliales que se desprenden por la manipulación durante la extracción de la leche y la caseína que precipita por el efecto de las altas velocidades de centrifugación; otra intermedia que corresponde al suero de leche, donde se encuentran las proteínas solubles; y una tercera en la parte superior, donde se agrupa el contenido lipídico. Este paso es importante porque permite eliminar las grasas, las cuales dificultan la interacción de las proteínas en los pasos cromatográficos subsiguientes.
El suero entonces obtenido en la fase intermedia se separa y se diluye con una solución tampón (20 mM de Tris, 150 mM de NaCL, 2 mM de EDTA, pH =7,4), condiciones que permiten lograr una alta solubilidad del FIX y desestabilizar las pequeñas micelas de caseína remanentes, por el efecto acomplejante que el EDTA ejerce sobre los iones calcio que estabilizan las micelas, liberando así el FIX que pudo haber quedado retenido en su interior.
Al suero diluido se le añadió DEAE-Sephadex A-50. Esta matriz cromatográfica junto al DEAE-Sepharose Fast Flow, está siendo muy empleada en la industria de hemoderivados para capturar los factores de la coagulación en los pasos iniciales de muchos protocolos de purificación, 10 a pesar de su empleo desde hace varios años como medio para obtener concentrados de factores de la coagulación.
En 1998, Johnson y colaboradores purificaron FIX obtenido en la leche de animales transgénicos, mediante cromatografía de intercambio iónico seguida de inmunoafinidad cromatográfica dependiente de metales.3
Al ser un intercambiador débil, permite la elución del FIX, que es relativamente lábil, sin afectar su estabilidad. Aunque la leche y la sangre son fluidos que difieren en cuanto a muchos de sus componentes, el FIX puede ser adsorbido por matrices intercambiadoras en ambos tipos de sustancias.
Se realiza una cromatografía en batch, porque independientemente de que no se obtenga la reproducibilidad y la alta resolución de una cromatografía en columna, se trabaja con mayor rapidez y es muy eficiente como paso inicial de purificación. El intercambio iónico permitió adsorber el FIX del suero transgénico y eliminar gran parte de la caseína, que por su heterogeneidad estructural no eluye completamente en el volumen de las proteínas no fijadas a la matriz (fig. 2). La elución del FIX fijado se logra con 15 mM de CaCl2, donde se obtiene todo el FIX que se une con la matriz, tanto activado como en forma de zimógeno. Se empleó el CaCl2 para la elución, porque el calcio produce ciertos cambios conformacionales en la molécula de FIX, disminuyendo la afinidad de los grupos carboxilos del dominio Gla de la enzima, que se unen con el calcio, con los grupos amino del intercambiador. También se produce un ligero aumento de la fuerza iónica de la solución, que permite que eluya preferentemente el FIX y no otras proteínas que también se unen con la matriz, pero que no eluyen a valores de fuerza iónica tan bajos.
En la fracción obtenida está presente tanto el FIX activado como el zimógeno; este último resulta realmente efectivo por acoplarse a la cascada de la coagulación. También se encuentran otras proteínas contaminantes.
Con este paso de purificación el FIX no se obtiene puro, pero se logra capturar todo el FIX que se encuentra en el suero, obteniéndose en una fracción de manera concentrada. No obstante, se necesita un paso cromatográfico posterior, donde la interacción con el FIX sea más específica; en este caso se realiza la cromatografía de afinidad con heparina-Sepharose.
Summary
Purification of recombinant factor IX expressed in milk of transgenic sows
Recombinant factor IX was purified from milk of transgenic sows, and yieldings between 1 and 2 g of this protein per liter were obtained. This is a new way to get this product with a high efficiency, since its expression is 1 000 times higher than of the human plasmatic factor IX. By combining 2 chromatographic steps (ion exchange in DEAE-Shephadex A-50 and affinity chromatography with heparin), the factor IX was purified, with this milk as a starting material. Different methods were studied to eliminate caseins, the main pollutant of the process, and ultracentrifugation was selected due to its numerous advantages over the isoelectric precipitation and salt precipitation. Factor IX may be purified from transgenic milk with an elevated purity by chromatographic methods that do not use immunoaffinity and are finally scalable in industrial production, which provides new perspectives for treating hemophilia B by preparing new oral formulations.
Key words: Factor IX, purification, hemophilia B.
Referencias bibliográficas
1. Wang L, Takabe K, Bidlingmaier S, Charles I, Inder V. Sustained correction of bleeding disorder in hemophilia B mice by gene therapy. Proc Natl Acad Sci 1999;96:3906-10.2. Burnouf T, Michalski C, Goudermand M, Huart J. Properties of a highly purified human plasma factor IX: therapeutic concentrate prepared by conventional chromatography. Vox Sang 1989;57:225-32.
3. Johnson J, Lubon H, Drohan L, Velander W. American Nat Red; expression of active human factor IX in mammary tissue of transgenic animals. 1998; WO 9835689.
4. Romagnolo D, Di Augustine RP. Transgenic approaches for modifying the mammary gland to produce therapeutic proteins. Environ Health Perspect 1994;102:846-51.
5. Lindsay M, Gil G, Cádiz A, Velander W, Zhang CH, Van Cott K. Purification of recombinant DNA-Derived factor IX produced in transgenic pig milk and fractionation of active and inactive subpopulations. J Chromatogr A 2004;1026:149-57.
6. Janne J, Alhonen L, Hyttinen JM, Peura T, Tolvanen M, Korhonen VP. Transgenic bioreactors. Biotechnol Ann Rev 1998;4:55-74.
7. Lubon H, Paleyanda RK, Velander WH, Drohan WN. Blood proteins from transgenic animal bioreactors. Transf Med Rev 1996;10:131-43.
8. Lynch TJ. Biotechnology: Alternatives to human plasma-derived therapeutic proteins. Clin Haematol 2000;13:669-88.
9. Hill AR. Chemical species in cheese and their origin in milk components. En: Chemistry of structure-function relationships in cheese. New York: Plenum Press; 1995.
10. Michalski C, Burnouf T. Preparation of high-purity human factor IX concentrate and other plasmatic proteins and their therapeutic use. Centre Regional of Transfusion 1995. US 545718.
Recibido: 20 de agosto de 2006. Aprobado: 13 de septiembre de 2006.
Lic. Armando Cádiz Lahens. Planta de Hemoderivados. Ave 51 No. 33235 Arroyo Arenas, La Lisa. Ciudad de La Habana, Cuba. e-mail: acadiz@hemod.sld.cu
1Instituto Finlay, Ciudad de La Habana, Cuba.
2Departamento de Ingeniería Química, Universidad de Nebraska, EE.UU.
3Instituto de Hematología e Inmunología, Ciudad de La Habana, Cuba.