Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.23 n.1 Ciudad de la Habana ene.-abr. 2007
Instituto de Hematología e Inmunología
Purificación de anticuerpos naturales anti banda 3 de la clase IgG
Lic. Julio César Merlín Linares, DrC. Rinaldo Villaescusa Blanco y Lic. Ada Amalia Arce Hernández
Resumen
Se purificaron anticuerpos naturales anti banda 3 de la clase IgG mediante cromatografía de afinidad con un aceptable nivel de pureza, rapidez y eficiencia, a partir de una mezcla de inmunoglobulinas humanas de uso parenteral. La obtención de estos anticuerpos naturales anti banda 3 permitirá abordar estudios posteriores acerca de su posible participación y potencial terapéutico en el fenómeno de vasooclusión en la drepanocitosis.
Palabras clave: anticuerpos naturales anti banda 3, cromatografía de afinidad, drepanocitosis, IgG, vasooclusión.
En los últimos años se han logrado avances en el conocimiento de las crisis vasooclusivas en la drepanocitosis, pero las bases de su control y prevención permanecen parcialmente desconocidas.1
Diversas investigaciones han permitido acumular información acerca de las moléculas de adhesión que se expresan tanto en eritrocitos SS como en el endotelio vascular, así como de los factores plasmáticos que participan en el fenómeno de oclusión.2-4 Ahora, no se ha logrado un concepto que unifique todos estos datos y permita un tratamiento efectivo. En la actualidad se trabaja en una dirección no considerada hasta el momento, la proteína banda 3 eritrocitaria (AE 1) y la presencia de anticuerpos naturales específicos contra la proteína banda 3 de la clase IgG.
En la drepanocitosis existe un aumento de agregados de AE 1 en la superficie del eritrocito como resultado de la oxidación aumentada y prematura, con la subsiguiente desnaturalización de la hemoglobina S, lo que trae como consecuencia su adhesión al endotelio vascular y además que dichos agregados sean reconocidos por los anticuerpos naturales anti banda 3, de ahí su importancia tanto en la etiología como en la solución de las crisis vasooclusivas en esta enfermedad.5-7 L os anticuerpos naturales específicos anti banda 3 son capaces de bloquear el fenómeno de adhesión al reconocer un área de la molécula de banda 3, ligando para su receptor endotelial.8,9
El objetivo de nuestro trabajo está relacionado con la purificación de anticuerpos naturales anti banda 3 eritrocitaria de la clase IgG a partir de una mezcla de inmunoglobulinas humanas.
Métodos
Cien gramos de una mezcla de IgG humana (Sandoglobulin, ZLB) se disolvieron en 1 L de buffer L0,05 (100 mM NaCl, 10 mM NaKHPO 4, 1mM MgCl 2, 50 m g/mL PMSF, 0,08 % azida sódica, 0,05 % Nonidet NP-40, pH 7,4) y se dializó durante la noche contra el mismo buffer ajustándose a una concentración de 30 mg IgG/mL. La mezcla de IgG se depletó de material reactivo a IgG mediante una cromatografía de afinidad en Affigel-10 (BioRad, CA), a la que se inmovilizó IgG agregada, obtenida calentando una solución de IgG a 63 0 C durante 30 min.10
Los anticuerpos naturales anti banda 3 se aislaron en una columna de Affigel-15 (BioRad, CA) a la que se fijó la banda 3 obtenida a partir de la membrana de eritrocitos humanos según se describió anteriormente.11 El volumen total eluido de la corrida en Affigel-10 se cromatografió a través de la columna conteniendo banda 3, a una velocidad de flujo de 15 mL/h. A continuación se lavó la columna con buffer L0,01 (10 mM NaHPO 4, 100 mM NaCl, 1 mM MgCl2, 50 m g/mL PMSF, 0,08 % NaN3 , 0,01 % NP 40, pH 7,4) durante la noche. Se eluyeron los anticuerpos anti banda 3 de la columna con 1 M NaCl, 0,1 M glicina, 0,01 % NP 40, pH 2,7. Las fracciones se colectaron en intervalos de 3 min en tubos conteniendo 25 m L 1 M Tris, pH 9,0. Las fracciones correspondientes al pico se mezclaron y dializaron contra PBS conteniendo 0,08 % NaN3.
Se controló el nivel de pureza y la actividad funcional de los anticuerpos aislados mediante electroforesis en gel de poliacrilamida, SDS-PAGE, de la banda 3 pura y del extracto de membrana de eritrocitos humanos e immunoblotting como sigue: el gel de la corrida electroforética se transfirió a un papel de nitrocelulosa y se incubó durante la noche con el anticuerpo anti banda 3 aislado y posteriormente con 125 I-proteína G según se describe anteriormente.12,13 La concentración de anticuerpos anti banda 3 purificados se determinó mediante el método de Lowry.14
Resultados
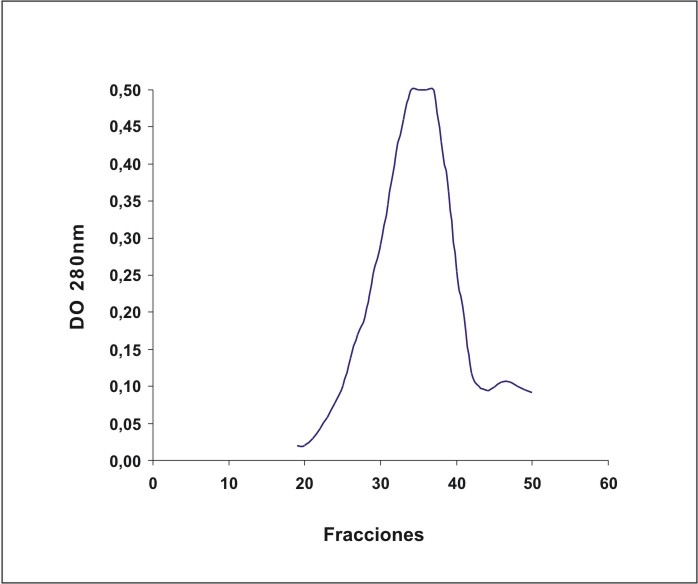
En la figura 1 se observa el fraccionamiento de la mezcla de IgG en la cromatografía de afinidad con Affigel – 15 con la proteína banda 3 acoplada.
En la figura 2 se muestra el resultado del inmunoblotting de los anticuerpos naturales anti banda 3 aislados, frente a la proteína banda 3 pura (2A) y la mezcla de proteínas del extracto de membrana de eritrocitos (2B). La concentración de anticuerpos naturales anti banda 3 de la clase IgG fue de 1,21 mg/mL.
Fig. 1. Fraccionamiento de la muestra de IgG por cromatografía de afinidad en Affigel-15 acoplada con la proteína de banda 3.
Fig. 2. Reactividad de los anticuerpos naturales aislados. A: contra proteína banda 3 pura; B: contra la mezcla de proteínas de la membrana.
Discusión
Los anticuerpos naturales han ganado un considerable interés en los últimos tiempos. Los mismos se encuentran en el suero normal a bajas concentraciones y presentan afinidades 2 ó 3 veces menores que las de los anticuerpos inducidos; resuelven su aparente debilidad y ganan en funcionabilidad empleando rutas no convencionales que involucran biespecificidad15,16 o estimulación de la vía alternativa del complemento.17,18 Las evidencias sugieren que los anticuerpos naturales participan en la homeostasis tisular; se ha demostrado el papel de los anticuerpos naturales anti banda 3 en la eliminación en eritrocitos senescentes y oxidativamente estresados.19-21
Kay22 desarrolló un método de aislamiento de anticuerpos naturales anti banda 3 mediante elución de eritrocitos humanos senescentes, y demostró que estos pertenecían fundamentalmente a la clase IgG, policlonales y dirigidos contra receptores alterados de la membrana eritrocitaria.
En nuestro trabajo los anticuerpos anti banda 3 se purificaron a partir de una mezcla de IgG humana mediante cromatografía de afinidad en Affigel-15, a la que se acopló la proteína banda 3 pura obtenida de membranas de eritrocitos humanos. La mezcla de IgG humana se pasó previamente por una columna Affigel-10 a la que se acopló IgG agregada para eliminar cualquier material capaz de unir la IgG, como factor reumatoideo o anticuerpos anti idiotípicos. Es de señalar que estos anticuerpos naturales existen en el suero de donantes individuales como anticuerpos circulantes fundamentalmente y no como inmunocomplejos, teniendo en cuenta que fueron demostrados en preparaciones de IgG empleadas por vía parenteral como sustitutos de inmunoglobulinas.
Consideramos que el método empleado posibilita la obtención de anticuerpos anti banda 3 de la clase IgG con rapidez, eficiencia y un aceptable nivel de pureza, lo que permitirá abordar estudios posteriores acerca de su posible participación y potencial terapéutico en el fenómeno de vasooclusión en la drepanocitosis.
Summary
Purification of natural anti-band 3 IgG antibodies
Natural anti-band 3 IgG antibodies were purified by affinity chromatography with an acceptable level of purity, rapidity and efficiency, starting from a mixture of human immunoglobulins of paren teral use. The attainment of these natural anti-band 3 antibodies will allow further studies on their possible participation and therapuetic potential in the phenomenon of drepanocytosis vasoocclusion.
Key words: natural anti-band 3 antibodies, affinity chromatography, drepanocytosis, IgG, vasoocclusion.
Referencias bibliográficas
1. Reed W, Vichinski EP. New considerations in the treatment of sickle cell disease. Ann Rev Med 1998;49:461-74.
2. Harlan JM. Introduction: anti-adhesion therapy in sickle cell disease. Blood 2000;95:365-7.
3. Ortiz A, Hugh-Davies TH, Hebbel RP, Solovey A. Circulating endothelial cells in sickle cell anemia. N Engl J Med 1998;338:1162-3.
4. Platt OS. Sickle cell anemia as an inflammatory disease. J Clin Invest 2000;106:337-8.
5. Thevenin BJ, Crandall I, Ballas SK. Band 3 peptides block the adherence of sickle cells to endothelial cells in vitro. Blood 1997;90:4172-9.
6. Hornig R, Lutz HU. Band 3 protein clustering on human erythrocytes promotes binding of naturally occuring anti - band 3 and anti – spectrin antibodies. Exp Geront 2000;35:1025-44.
7. Schluter K, Dreuckhahn D. Co-clustering of denatured hemoglobin with band 3: Its role in binding of autoantibodies against band 3 to abnormal and aged erythrocytes. Proc Natl Acad Sci USA 1986;83:6137-41.
8. Embury SH, Hebbel RP, Steinberg MH, Mohandas N. Pathogenesis of vasooclusion. En: Embury SH, Hebbel RP, Steinberg MH, Mohandas N, eds. Sickle cell disease: basic principles and clinical practice. New York : Raven Press; 1994. p. 311-26.
9. Hebbel RP. Blockade of adhesion of sickle cells to endothelium by monoclonal antibodies. N Engl J Med 2000;342:1910-2.
10. Lutz HU, Wipf G. Naturally occurring autoantibodies to skeletal proteins from human red blood cells. J Immunol 1982;128:1695-8.
11. Lukacovic MF, Feinstein MB , Shaafi RI , Perrie S. Purification of stabilized band 3 protein of the human erythrocyte membrane and its reconstitution into liposomes. Biochemistry 1981;20:3145-51.
12. Neville DM. Molecular weight determination of protein dodecyl sulfate complexes by gel electrophoresis in a discontinuous buffer system. J Biol Chem 1971;246:6328-31.
13. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrilamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA 1979;76:4350-4.
14. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem 1951;193:265-75.
15. Guigou V, Guilbert B, Moinier D, Tonnelle C, Boubli L, Avrameas S, et al. Ig repertoire of human polyspecific antibodies and B cell ontogeny. J Immunol 1991;146:1368-74.
16. McNeil HP, Hunt JE, Krilis SA. New aspects of anticardiolipin antibodies. Clin Exp Rheumatol 1990;8:525-7.
17. Lutz HU. Naturally occurring anti band 3 antibodies. Trans Med Rev 1992;6:201-11.
18. Okada N, Yasuda T, Tsumita T, Okada H. Activation of the alternative complement pathway by natural antibody to glycolipids in guinea-pig serum. Immunology 1983;50:75-84.
19. Kay MMB, Goodman J. Immunoregulation of cellular lifespan: Physiologic autoantibodies and their peptide antigens. Cell Mol Biol 2003;49:217-43.
20. Kay MMB. Isolation of the phagocytosis inducing IgG-binding antigen on senescent somatic cells. Nature 1981;289:491-4.
21. Lutz HU, Pfister M, Hornig R. Tissue homeostatic role of naturally occuring anti band 3 antibodies. Cell Mol Biol 1996;42:995-1005.
22. Kay MM. Role of physiologic autoantibody in the removal of senescent human red cells. J Supramol Struct 1978;9:555-67.
Recibido: 22 de diciembre del 2006. Aprobado: 15 de enero del 2007.
Lic. Julio César Merlín Linares . Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214, Fax (537) 442334. e -mail: ihidir@hemato.sld.cu