My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
Print version ISSN 0864-0289On-line version ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.25 no.3 Ciudad de la Habana sept.-Dec. 2009
ARTÍCULO ORIGINAL
Eficacia diagnóstica de sistemas de inmunoensayos para el virus de la hepatitis C en muestras de pacientes multitransfundidos
Diagnostic effectiveness of immunoassays systems for hepatitis C virus in samples from multi-transfusion patients
DrC. René A. Rivero Jiménez I; Lic. Julio C. Merlín Linares I; Lic. Madelín Blanco de Armas II; Dra. Leonor M. Navea Leyva II; Dra. Rosa M. Lam Díaz I; Dra. Dunia Castillo González I; DrC. Rinaldo Villaescusa Blanco I; Dr. Juan M. González González I; DrC. José M. Ballester Santovenia I
I Instituto de Hematología e Inmunología. Ciuidad de La Habana, Cuba.
II Laboratorio de Investigaciones del SIDA (LISIDA). Ciudad de La Habana, Cuba.
RESUMEN
La transmisión del virus de la hepatitis C (VHC) a través de la sangre constituye un problema de salud en Cuba y el mundo. Varios tipos de inmunoensayos diagnosticadores se han desarrollado para la certificación de sangre y generalmente cuentan con una elevada sensibilidad y especificidad diagnóstica en donantes sanos. Sin embargo, su comportamiento en muestras de pacientes multitransfundidos podría ser menos eficaz. Para evaluar la eficacia diagnóstica del inmunoensayo cubano UMELISA HCV 3er Gen. (TecnoSUMA SA, La Habana, Cuba) en muestras de pacientes multitransfundidos, se procesaron en paralelo 335 sueros de pacientes por los sistemas UBI® HCV EIA 4.0 (United Biomedical, EE.UU.) y UMELISA HCV 3er Gen., y las muestras con resultados incongruentes se confirmaron por el sistema de PCR COBAS AmpliScreen HCV Test, v2. (Roche, EE.UU.). Cuando se comparó el sistema UMELISA HCV 3er Gen. con el UBI® HCV EIA 4.0 se obtuvo una Sd de 95,8 % IC (95 %): 92,599,15 y Ed de 100 % IC (95 %): 99,7-100, con IY: 0,96 (0,93-0,99). k: 0,9582 ID (95 %): 0,9276-0,9888, p=0,000. Ambos sistemas de inmunoensayos fueron satisfactorios para el inmunodiagnóstico de pacientes multitransfundidos.
Palabras clave: hepatitis C, multitransfundidos, inmunoensayos, diagnosticadores.
ABSTRACT
Hepatitis C virus (CHV) blood-transmission is a health problem in Cuba and in the world. Some types of diagnostic immunoassays have been developed for the blood certification and in general have a high diagnostic sensitivity and specificity in healthy donors. However, its behavior in samples from multi-transfusion patients could by less effective. To assess the diagnostic effectiveness of the UMELISA HCV third generation Cuban immunoassay (TecnoSUMA, S.A. La Habana), Cuba) in samples from multi-transfusion patients, in parallel, 335 sera from patients were processed by UBI® HCV EIA 4.0 (United Biomedical, EE.UU) and UMELISA HCV third generation, and the samples with incongruous results were verified by PCR COBAS AmpliScreen HCV Test, v2 system (Roche, EE.UU.) Comparing the UMELISA HCV third generation system with the UBI® HCV EIA 4.0 it was achieved a Sd of 95,8% CI(95%): 92,5-99,15 and a Ed of 100% CI (95%): 99,7-100, with IY: 0,96 (0,93-0,99) with k: 0,0582 ID (95%): 0,9276-0,9888, p = 0,000. Both immunoassay systems were satisfactory for immunodiagnosis of multi-transfusion patients.
Key words: Hepatitis C, multi-transfusions, immunoassay, diagnostic methods.
INTRODUCCIÓN
La transmisión del virus de la hepatitis C (VHC) a través de la sangre constituye un problema de salud en Cuba y el mundo. Varias generaciones de ensayos inmunoenzimáticos (EIE) diagnosticadores se han desarrollado para la certificación de sangre y generalmente cuentan con una elevada sensibilidad y especificidad diagnóstica en donantes sanos.
En 1995, ya el 100 % de los donantes de sangre se chequeaban para anticuerpos contra el VHC C (Ac vs. VHC) con el empleo del sistema ultramicroanalítico UMELISA-HCV (TecnoSuma International SA, La Habana, Cuba). En 1998, una versión mejorada de tercera generación estuvo disponible para el pesquisaje en la red de bancos de sangre del país, con una especificidad (Ed) entre 99,5 99,8 % y una sensibilidad (Sd) del 99,4 100 % en donantes sanos (Centro de Inmunoensayo, Inserto del producto UMELISA HCV 3er gen, agosto 1998).1
Sin embargo, este EIE no está registrado por la FDA ni es recomendado por la OMS/OPS para estudios seroepidemiológicos internacionales.
Los niveles de prevalencia para Ac vs. VHC, antígeno de superficie del virus de la hepatitis B (HBsAg) y anticuerpos contra el virus de la inmunodeficiencia humana tipo 1 y 2 (Ac vs. VIH 1&2) entre los donantes de sangre, un año antes de comenzar la toma de muestras para este estudio, fueron de 0,71, 0,60 y 0,012 %, respectivamente; y los donantes reactivos fueron excluidos. No obstante, las infecciones con estos virus se han seguido encontrando en los receptores de sangre, probablemente asociadas con las varias causas, como el error humano, el período de ventana, una mala selección de donantes, errores intrínsecos a los sistemas de detección, y otros.
En la red cubana de bancos de sangre no se aplicaban al escrutinio de los donantes de manera sistemática, ni sistemas de detección de antígenos virales ni pruebas de ácidos nucleicos (NAT del inglés nucleic acid testing), debido fundamentalmente al elevado costo de importación que tienen los sistemas comerciales disponibles, encarecidos adicionalmente para Cuba como consecuencia del bloqueo norteamericano.
La utilidad del NAT para reducir el riesgo residual del VHC se ha demostrado en estudios llevados a cabo en otros países.2,3
Por ese motivo, los principales grupos de receptores de sangre, como los pacientes con enfermedades hematológicas crónicas (hemofilia A y B, anemia drepanocítica, b-talasemia) o malignas (leucemias, linfomas), y los pacientes con insuficiencia renal crónica (IRC) en hemodiálisis, podrían estar expuestos al riesgo de adquirir estas infecciones por la transfusión de sangre y hemocomponentes, o por la existencia de otros factores de riesgo diferentes a la sangre, como la transmisión sexual, nosocomial y otras.
En estos grupos de pacientes la eficacia diagnóstica del UMELISA HCV debe ser evaluada con cierta regularidad, tomando en cuenta que son pacientes multitransfundidos, en quienes la prevalencia de la infección podría ser más elevada que en los donantes sanos.
Para evaluar la eficacia diagnóstica en la detección de Ac vs. VHC del UMELISA HCV 3era generación, se empleó un grupo de muestras de pacientes multitransfundidos, clasificados según su enfermedad de base, con el objetivo de determinar la sensibilidad y especificidad diagnósticas (Sd y Ed), los valores predictivos de positividad y negatividad (VPP y VPN), el índice de validez (IV) y el índice de Youden (IY), así como el coeficiente de correlación kappa (k) en comparación con un sistema importado.4
MÉTODOS
Muestras: se analizaron en paralelo 335 sueros de pacientes hematológicos (con hemofilia, anemia drepanocítica, leucemias, linfomas) y no hematológicos (con insuficiencia renal crónica en hemodiálisis) que habían recibido 10 ó más unidades de sangre alogénica o el equivalente en componentes, al menos en 2 eventos transfusionales diferentes, 14 ó más días antes del reclutamiento. Los pacientes se reclutaron en diferentes centros asistenciales y provincias del país, como el Instituto de Hematología e Inmunología (IHI), el Instituto de Nefrología "Dr. Abelardo Buch López", el Hospital Clinicoquirúrgico "Hermanos Ameijeiras" (todos en La Habana); y los Hospitales Universitarios Provinciales (clinicoquirúrgicos o generales) y pediátricos de las provincias de Pinar del Río y Villa Clara.
Inmunoensayos: se aplicaron los sistemas de inmunodiagnóstico UBI VHC EIA 4.0 (United Biomedical Inc., EE.UU.) (prueba de referencia) y el UMELISA HCV 3er Gen (prueba de pesquisaje nacional). Las lecturas de la densidad óptica (DO) de los resultados de los EIE se llevaron a cabo en un espectrofotómetro vertical de tecnología cubana (SUMA Model 531, TecnoSuma International, SA, La Habana, Cuba). Las muestras se consideraron positivas para Ac vs. VHC si fueron reactivas en 2 corridas separadas del EIE empleado. En los casos con resultados incongruentes entre ambos diagnosticadores, se aplicó como prueba confirmatoria el sistema COBAS AmpliScreen HCV Test, versión 2.0, (ROCHE Diagnostics, EE.UU., considerada un estándar de oro en el diagnóstico molecular del VHC), que detecta RNA del VHC por PCR automatizado. En todos los casos se cumplió el procedimiento recomendado por los fabricantes.
Análisis estadístico: se calcularon la Sd y la Ed como parámetros tradicionales de la eficacia diagnóstica de una prueba, los VPP y VPN. Además, se calculó el IV o proporción correcta de aciertos, y el IY o versión 2 de la probabilidad corregida de detectar enfermedad. Para medir la correlación entre las pruebas, se empleó la determinación del índice de concordancia o acuerdo observado, el índice k de Cohen y los valores mínimo y máximo de k.4 Para la comparación de las pruebas diagnósticas se aplicó el software Edidat 3.1, desarrollado por la Junta de Galicia y la OPS para el cálculo de la Sd, Ed, VPP, VPN, IV, IY y otros parámetros dentro de un intervalo de confianza del 95 %, que indican la eficacia diagnóstica de los sistemas del EIE cubano a partir de los datos primarios insertados en tabla de contingencia 2 x 2 (tabla 1) y la prueba de concordancia kappa de Cohen.4
RESULTADOS
Los resultados comparativos en las 335 muestras evaluadas en paralelo con el sistema de referencia y la prueba UMELISA HCV para Ac vs. VHC se muestran en la tabla 2, donde se clasifican los pacientes según su grupo diagnóstico. En el grupo en que se detectó un mayor número de muestras con resultados incongruentes fue en los casos de IRC en hemodiálisis.
En la tabla 3 se observa la cantidad de muestras con resultados discrepantes por los sistemas UMELISA HCV y UBI HCV y cuántos de ellos fueron confirmados como positivos por el sistema de PCR AmpliSreen HCV.
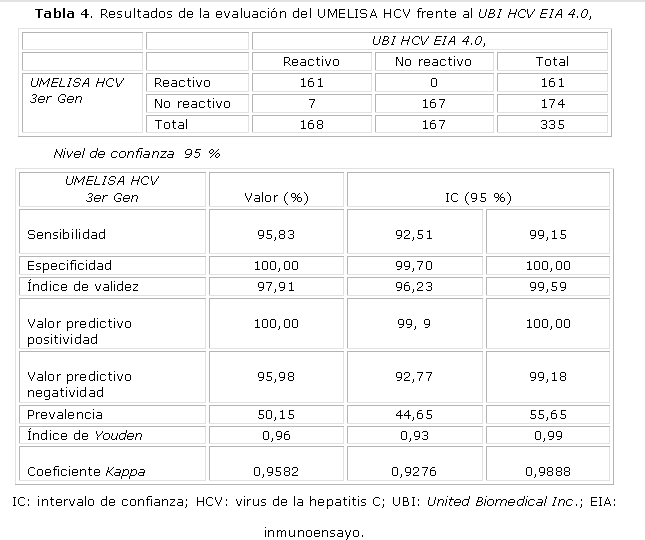
La tabla 4 resume la aplicación de una tabla de contingencia 2 x 2 para evaluar la Sd y la Ed, que permitió llegar a los resultados, donde se destaca una Sd de 95,3 % y una Ed del 100 % para el UMELISA en comparación con el sistema UBI.
La tabla 5 muestra los resultados de la evaluación del UMELISA HCV (3er Gen) al tomar en consideración los resultados obtenidos con este sistema con los datos de la prueba confirmatoria AmpliSreen HCV.
DISCUSIÓN
El sistema UMELISA HCV 3er Gen cumplió satisfactoriamente con todos los parámetros de eficacia diagnóstica, evaluada mediante la sensibilidad y la especificidad que son las medidas tradicionales y básicas del valor diagnóstico de una prueba según Yerushalmy, que introduce estos términos como indicadores estadísticos para evaluar el grado de eficacia inherente a una prueba desde 1947,5 y mide la discriminación en relación con un criterio de referencia que se considera la verdad. En estos sistemas, los valores cercanos al 100 % se consideran óptimos. En principio, estos indicadores permiten comparar directamente la eficacia de una prueba con la de otras y esperar resultados similares cuando son aplicadas en diferentes países, regiones o ámbitos.
La Sd indica la capacidad de la prueba para detectar a un sujeto enfermo, es decir, expresa cuán "sensible" es la prueba para detectar la presencia de la enfermedad, y la Ed indica la capacidad que tiene la prueba de identificar como sanos (no enfermos) a los que efectivamente lo son.6
El IV se define como la proporción de individuos clasificados correctamente y depende no solamente de la sensibilidad y la especificidad, sino también de la prevalencia de la enfermedad,7 por lo que es importante su cálculo en muestras como estas, donde hay una prevalencia mayor que en los donantes de sangre sanos. UMELISA HCV, finalmente, mostró un IV del 96 %.
En el caso del IY, que es una manera corregida de detectar enfermedad, se trata de una medida conjunta de la eficiencia del medio diagnóstico, fue propuesta por Youden en 1950 y refleja la diferencia entre la tasa de verdaderos positivos y la de falsos positivos. 7 Una buena prueba diagnóstica debe tener esta diferencia alta y teóricamente es igual a 1 solo cuando la prueba es perfecta, o sea, cuando Sd + Ed = 2, por lo que se puede decir que cuanto más cercano a 1, mejor es la prueba que se está evaluando. En este estudio, el sistema UMELISA HCV estuvo siempre por encima de 0,96. El IY tiene la ventaja de no estar afectado por la selección de la prevalencia y es preferido por la combinación de los sencillos valores de la Sd y la Ed.7,8
Por otra parte, la variación de un diagnosticador respecto a un estándar (o prueba de oro), se puede medir también por medio de la concordancia alcanzada al examinar y clasificar una serie de muestras biológicas, con el cálculo del índice de concordancia o acuerdo observado, el índice kappa de Cohen y los valores mínimo y máximo de kappa, 4 y en este estudio, los valores siempre resultaron superiores a 0,9582, que indica una correlación muy buena entre el inmunodiagnosticador cubano y el importado.
Según la información suministrada por el Centro de Inmunoensayos, fabricante del producto UMELISA HCV (Centro de Inmunoensayos, Inserto del producto, agosto 1998), este sistema HCV mostró una Sd y Ed de 97,11 y 99,10 %, respectivamente, frente a un panel de sueros de pacientes transfundidos, al comparase con otras técnicas inmunoenzimáticas en su evaluación pre-registro sanitario, por lo que se concluyó que los resultados que se encontraron en estas 335 muestras de pacientes multitransfundidos son muy similares a estos valores.
REFERENCIAS BIBLIOGRÁFICAS
1. Delgado G. Situación de la hepatitis C en Cuba. Unidad de Análisis y Tendencias de Salud (UATS). Reporte Técnico de Vigilancia 1999;4(1):1.
2. Orton SL, Stramer SL, Dodd RY, Alter MJ. Risk factors for HCV infection among blood donors confirmed to be positive for the presence of HCV RNA and not reactive for the presence of anti-HCV. Transfusion 2004;44:275-81.
3. Weber B, Mühlbacher A, Melchior W. Detection of an acute asymptomatic HBsAg negative hepatitis B virus infection in a blood donor by HBV DNA testing diagnostic. J Clin Virol 2005;32:67-70.
4. Shoukri MM. Measurement of Agreement. En: Armitage P, Colton T., eds. Encyclopedia of Biostatistics. Vol 1. Chichester: John Wiley & Sons; 1998. p. 103-17.
5. Fescina RH, Simini F, Belitzky R. Evaluación de los procedimientos diagnósticos. Aspectos metodológicos. Salud Perinatal 1985;2:39-43.
6. Knottnerus JA, Leffers P. The influence of referral patterns on the characteristics of diagnostic tests. J Clin Epidemiol 1992;45:1143-54.
7. Feinstein AR. Clinical biostatistics. XXXI. On the sensitivity, specificity and discrimination of diagnostic tests. Clin Pharmacol Ther 1975;17:104-16.
8. ————. Clinical Epidemiology: The Architecture of Clinical Research. W.B. Saunders Company; 1985.
Recibido: 14 de octubre del 2009.
Aprobado: 2 de noviembre del 2009.
DrC. René A. Rivero Jiménez. Instituto de Hematología e Inmunología. Apartado 8070. Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8695, fax (537) 644 2334. e-mail: ihidir@hemato.sld.cu