Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.25 n.3 Ciudad de la Habana sep.-dic. 2009
ARTÍCULO ORIGINAL
Significado biológico y clínico de la expresión de antígenos mieloides en la leucemia linfoide aguda pediátrica
Biological and clinical meaning of myeloid antigen expression in the acute lymphocytic leukemia in children
Dra. Vianed Marsán Suárez; Dra. Miriam Sánchez Segura; Lic. Bertha B. Socarrás Ferrer; Lic. Lázaro O. del Valle Pérez; DraC. Consuelo Macías Abraham; Dr. Aramís Núñez Quintana; Dr. Alejandro González Otero I; Dra. Rosa M. Lam Díaz I
I Instituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
En 238 niños con leucemia linfoide aguda (LLA) se estudió la posible asociación entre la expresión de antígenos mieloides con determinadas características biológicas y clínicas al debut de la enfermedad. El inmunofenotipaje celular se realizó mediante un método ultrainmunocitoquímico. Del total de LLA diagnosticadas, 21,8 % fueron LLA-Mi+. Se encontró un predominio de linfadenopatías (71,2 %), esplenomegalia (65,4 %) y hepatomegalia (57,7 %) en enfermos con LLA-Mi+, con diferencias altamente significativas p=0,003, p=0,0068 y p=0,000, respectivamente. Se observó además un ligero predominio de adenopatías mediastinales, infiltración del sistema nervioso central y manifestaciones hemorragíparas en enfermos con LLA-Mi+, sin significación estadística. Los resultados demostraron que en nuestros pacientes la expresión de antígenos mieloides sobre los blastos linfoides influyó en la aparición de determinadas características morfológicas y clínicas de presentación de la LLA en el niño.
Palabras clave: leucemia linfoide aguda, inmunofenotipaje celular, antígenos mieloides.
ABSTRACT
In 238 children presenting with acute lymphoid leukemia (ALL) authors studied the possible association between the myeloid antigens expression with determined biologic and clinic features at disease onset. The cellular immunophenotyping was performed by ultraimmunocytochemical method. From the total of diagnosed ALLs, the 21,8% were LLA-Mi+. There was a lymphadenopathies predominance (71,2%), splenomegaly (65,4%) and hepatomegaly (57,7%) in patients with LLA-Mi+ and very significant differences (p =0,003, p = 0,0068, and p = 0,000, respectively. There was also alight predominance of mediastinum adenopathies, CNS infiltration and hemorrahagic manifestations in patients with LLA-Mi+, no statistically significant. Results showed that in our patients the myeloid antigen expression on the lymphoid blasts influenced on appearance of determined presentation of morphologic and clinical features in children.
Key words: acute lymphoid leukemia, cellular immunophenotyping, myeloid antigen.
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) se caracteriza por una expansión clonal de células linfoides inmaduras transformadas que se originan en la médula ósea (MO) y que posteriormente se diseminan a sangre periférica (SP), bazo, ganglios linfáticos y al resto de los tejidos.1
El inmunofenotipaje de los linfoblastos leucémicos muestra que estos no son perfectas réplicas de sus contrapartes normales en los diferentes compartimientos y tejidos corporales.2
En algunas LLA, los blastos coexpresan antígenos mieloides (LLA-Mi+); esta aberración fenotípica es conocida como infidelidad o promiscuidad de linaje.3,4
El objetivo de nuestro trabajo fue analizar la frecuencia de la LLA-Mi+ pediátrica en nuestro medio y su posible asociación con las características biológicas y clínicas de presentación, en relación con aquellas LLA que no expresan antígenos mieloides.
MÉTODOS
Se estudiaron 238 pacientes pediátricos con LLA: 140 del sexo masculino y 98 del femenino, con una edad promedio de 6,12 años y un rango entre 4 meses - 17 años, diagnosticados en el Instituto de Hematología e Inmunología en el período comprendido desde enero de 1993 hasta abril del 2006.
El inmunofenotipaje celular (IFC) de muestras procedentes de MO se llevó a cabo mediante un ultramicrométodo inmunocitoquímico (UMICIQ),5 con la utilización del siguiente panel de anticuerpos monoclonales:
I. Dirigidos contra antígenos expresados por células B.
anti-CD10 (OKB-CALLA)
anti-CD19
anti-CD20 (B1)
anti-CD22 (Leu 14)
Hospital Clínico de Barcelona.
II. Dirigidos contra antígenos expresados por células T.
anti-CD1 (NA 134)
anti-CD7 (Leu 9)
Instituto de Investigación del Cáncer, Londres.
anti-CD2 (OKT 11)
anti-CD4 (OKT 4)
anti-CD8 (OKT 8)
anti-CD3 (OKT 3)
anti-CD5 (Cris-1)
Fundación Tettamanti, Italia
III. Dirigidos contra antígenos expresados por células mieloides.
anti-CD13 (My 7)
anti-CD33 (My 9)
anti-CD14
anti-CD15
Hospital Clínico de Barcelona.
Fundación Tettamanti, Italia.
IV. Otros:
anti-HLA-DR
anti-deoxi-nucleotidil transferasa terminal (Tdt)
Hospital Clínico de Barcelona
Para el diagnóstico de los diferentes subtipos inmunológicos de la LLA se utilizó la siguiente clasificación inmunológica:
LLA de fenotipo B:
pro-B: HLA-DR+, TdT+, CD19+, CD22cito+
común: HLA-DR+, TdT+, CD19+, CD22+, CD10+, CD20+
pre-B: HLA-DR+, TdT+, CD19+, CD22+, CD10+, CD20+, µ cito+
B: HLA-DR+, CD19+, CD20+, CD22+, IgS+
LLA de fenotipo T
temprana: CD7+, TdT+,CD2+,CD5+
cortical: CD7+, CD5+, CD2+, CD1+, CD4+/CD8+
tardía: CD7+, CD2+, CD5+, CD4+ ó CD8+
Las LLA que expresaron hasta 2 antígenos mieloides fueron clasificadas como LLA-Mi+. Las LLA que no expresaron antígenos mieloides fueron denominadas como LLA-Mi-.
Al inicio de la enfermedad, fueron analizadas las características biológicas: edad, sexo, color de la piel y número de leucocitos, así como las características clínicas: adenopatías, hepatomegalia, esplenomegalia, adenopatías mediastínicas, manifestaciones hemorragíparas e infiltración del sistema nervioso central (SNC), por datos que se obtuvieron de las historias clínicas y que se almacenaron posteriormente en una base de datos computadorizada en el sistema SPSS, versión 8.0.
El procesamiento de los datos se realizó en computadoras IBM-compatibles.
Para determinar la posible asociación entre el fenotipo leucémico con las diferentes variables, se utilizó el estadígrafo Chi cuadrado (X2).6
RESULTADOS
Del total de LLA estudiadas 52 (21,8 %) fueron diagnosticadas como LLA-Mi+. De estas, 40 (76,9 %) presentaron fenotipo B y 12 (23,1 %) fenotipo T.
Del total de LLA-B, 20,6 % expresaron antígenos mieloides: 31 (77,5 %) con la variedad común; 7 (17,5 %) pro-B y 2 (5 %) B madura. No se encontraron antígenos mieloides en enfermos con la variedad pre-B.
Los antígenos CD13 y CD33 fueron expresados en el 37,5 % de los enfermos con LLA-B. Los antígenos CD13/CD33 fueron coexpresados en el 50 % de los pacientes, mientras que CD15, CD14 y Glicoforina A se expresaron en el 10, 7,5 y 2,5 % de los enfermos, respectivamente.
Del total de LLA con fenotipo T, 27,3 % fueron Mi+: 2 (16,7 %) con la variedad temprana y 10 (83,3 %) con la madura. Los pacientes con variedad cortical no expresaron antígenos mieloides.
Los antígenos CD33, CD13 y CD15 se encontraron en el 41,7, 25 y 8,3 %, respectivamente. En 2 enfermos (16,7 %) fueron coexpresados los antígenos CD13/CD33.
En la tabla 1 se muestra la distribución de los pacientes estudiados de acuerdo con la edad, sexo, color de la piel y expresión de antígenos mieloides o carencia de ellos. Se observó una mayor incidencia (44,1 %) en el grupo de edad entre 2-5 años, con un ligero predominio del sexo masculino (58,8 %), con diferencias estadísticamente significativas: p=0,032 y p=0,002, respectivamente.Los niños blancos fueron los más afectados (54,2 %) en comparación con los mestizos (34 %) y negros (11,8 %), sin diferencias significativas.
Al comparar la distribución de los enfermos según la edad, fenotipo leucémico B o T y expresión de antígenos mieloides, se encontró que los niños con LLA-B predominaron en el grupo de edad de 2-5 años (48,5 %); y aquellos con LLA-T, en mayores de 5 años (5,9 %), independientemente de la expresión de antígenos mieloides o carencia de ellos.
Los varones blancos, en su mayoría, presentaron LLA de fenotipo B, mientras que los mestizos y negros, el fenotipo T, independientemente de la expresión de antígenos mieloides. Las características morfológicas y clínicas de presentación de la enfermedad atendiendo al fenotipo celular leucémico, se muestra en la tabla 2.
El 52,1 % de los enfermos mostraron leucocitos <20 x 109 /L al inicio de la enfermedad, con diferencias estadísticamente significativas (p=0,04).
Se encontró un predominio de linfadenopatías (71,2 %), esplenomegalia (65,4 %) y hepatomegalia (57,7 %) en los enfermos con LLA-Mi+, con diferencias altamente significativas: p=0,003, p=0,0068 y p=0,000, respectivamente (tabla 2).
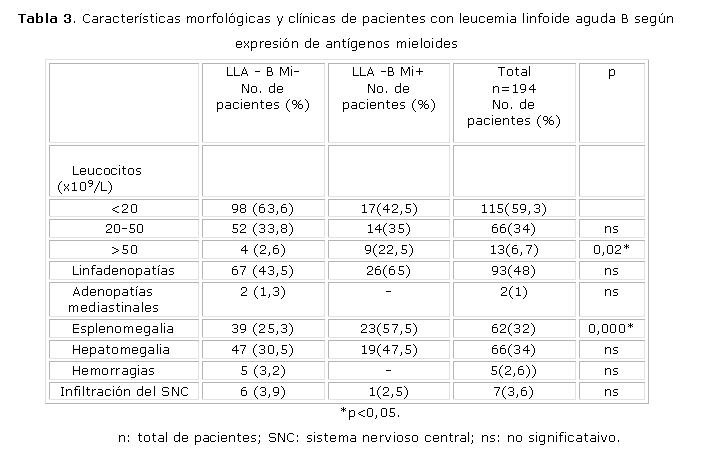
En pacientes con LLA-Mi+ se observó un ligero predominio de adenopatías mediastinales, infiltración del SNC y hemorragias, sin significación estadística (tabla 3).
Se encontraron diferencias estadísticamente significativas p=0,02 y p=0,000 al comparar la frecuencia de presentación de linfadenopatías y esplenomegalia en pacientes con LLA-B Mi+ en relación con las LLA-B Mi-. Se observó predominio de hepatomegalia (47,5 %) en las LLA-B Mi+, pero sin significación estadística (tabla 3).
De igual forma, los enfermos con LLA-T Mi+ presentaron una mayor frecuencia (91,7 %) de linfadenopatías, hepatomegalia y esplenomegalia, respectivamente, en relación con las LLA-T Mi+, sin diferencias significativas.
El 91,7 % de los enfermos con LLA-T Mi+ presentaron linfadenopatías, esplenomegalia y hepatomegalia, cuando se compararon con las LLA-B Mi+. Se encontraron diferencias estadísticamente significativas en aquellos enfermos con hepatomegalia (p=0,01).
DISCUSIÓN
Los estudios de IFC son importantes para definir el linaje celular y el estado de maduración de las células leucémicas y demostrar que la LLA es una enfermedad fenotípicamente heterogénea con subtipos clínicos diferentes.7
La LLA-Mi+ constituye una variedad inmunológica de la LLA que muestra una verdadera correspondencia entre la expresión de genes y proteínas que estos codifican.3
La incidencia de LLA-Mi+ es variable cuando se comparan los resultados de la literatura; esta oscila entre 5-48 % y se observa con mayor frecuencia en adultos que en niños.7-17 Este subtipo inmunológico fue encontrado en 21,8 % de nuestros pacientes.
La expresión de antígenos mieloides en la LLA de fenotipo B se reporta entre 20-40 %, lo cual coincide con lo expresado por nuestros enfermos (20,6 %), con un predominio en el fenotipo común (77,5 %). Resultados similares a los nuestros fueron reportados por Cabrera y otros;10 sin embargo, Pituch18 encontró una incidencia menor (34, 5 %) en la variedad común.
Se ha demostrado por estudios in vitro, que los blastos procedentes de enfermos con LLA-común Mi+ muestran una gran habilidad para proliferar y liberar espontáneamente interleucina-6 y factor de necrosis tumoral, y se comportan de forma similar a los blastos mieloides.18
El 27,3 % de los enfermos con LLA de fenotipo T expresaron antígenos mieloides, similar a lo encontrado por otros investigadores (19-50 %).15,18-20
Los antígenos mieloides CD13 y CD33 fueron los más expresados por los blastos linfoides, lo que coincide con lo encontrado por otros grupos de trabajo.8,12,20-3
El antígeno CD13 es selectivamente expresado en la LLA en respuesta a estímulos proliferativos. Este antígeno, en cooperación con el CD10 y quizás con otras enzimas de superficie celular, puede actuar como regulador de la concentración de moléculas en la membrana celular, e influir en el crecimiento de las células precursoras linfoides.20
La distribución de los enfermos según edad, sexo, color de la piel y fenotipo leucémico, no mostró asociación con la expresión de antígenos mieloides.
Resultados similares a los nuestros fueron encontrados por Kurec 14 y Ng 24 en sus pacientes. Por su parte, Cabrera y su grupo de trabajo 10 encontraron una mayor incidencia de LLA-Mi+ en niños menores de 2 años.
El 63,5 % de nuestros enfermos con LLA-Mi+ presentaron una cifra de leucocitos >20x109/L. Estos resultados coinciden con la mayoría de los autores,15,18,20 quienes han reportado la asociación de la expresión de antígenos mieloides en la LLA con hiperleucocitosis y un elevado porcentaje de blastos en SP. Sin embargo, un menor número de investigadores10,17 no encontraron esta asociación en sus enfermos.
En nuestro estudio se encontró un predominio de linfadenopatías, espleno y hepatomegalia en enfermos con LLA-Mi+, de forma similar a lo reportado por otros investigadores.8,13 Esta asociación se observó con mayor incidencia en la LLA de fenotipo T.
Actualmente, se observan diferencias en los resultados mostrados en la literatura en cuanto a la importancia de la expresión de antígenos mieloides en la evolución clínica de la LLA.
La mayoría de los investigadores no han encontraron asociación entre el pronóstico y la supervivencia de los niños con LLA, cuyos blastos expresaron antígenos mieloides, pero sí en adultos donde esta variedad adquiere un grupo de alto riesgo con una pobre respuesta al tratamiento. 8,11,13,21
Sin embargo, Kurec14 y Wiersma,15 en 2 grandes series de pacientes pediátricos estudiados, encontraron que la expresión de antígenos mieloides fue un importante factor predictivo de recaída en estos enfermos.
Estos resultados contradictorios pueden ser debido a la no existencia de un consenso en los criterios a estudiar, entre los que se encuentran: el tipo de población (niño o adulto), tipo y condiciones de la muestra procesada (MO o SP, fresca o congelada), técnica empleada (inmunocitoquímica, inmunofluorescencia o inmunohistoquímica) y la inclusión de antígenos de linaje no restringido.
Los resultados de este estudio demostraron que en nuestro medio, la expresión de antígenos mieloides sobre los blastos linfoides pudiera influir en determinadas características morfológicas y clínicas de presentación de la LLA en el niño.
REFERENCIAS BIBLIOGRÁFICAS
1. Farhi DC, Rosenthal NS. Acute lymphoblastic leukemia. Clin Lab Med 2000;20:17-28.
2. Mauer AM. Acute lymphocytic leukaemia. En: Beuthler E, Lichtman M, Coller B, Kipps Tm, eds. Williams Hematology. 5 ed. New York: Mc Graw-Hill; 1995. p. 1004-5.
3. Howard MR, Reid M. Expression of myeloid antigens in acute lymphoblastic leukemia. Br J Haematol 1994; 88:897-8.
4. Behm FG, Campana D. Immunophenotyping. En: Pui CH, ed. Childhood leukemias. New York: Cambrige University Press; 1999. p. 111-36.
5. Rivero RA, Bello M, Suárez LE, Cruz C, Martínez M, Palma L. Introducción de un ultramicrométodo inmunocitoquímico para la cuantificación de subpoblaciones identificadas con anticuerpos monoclonales. Rev Cubana Hematol Inmunol Hemoter 1995;11:46-56.
6. Argentina. Bancroft H. La prueba de c2. En Bancroft H; ed. Introducción a la Bioestadística. Buenos Aires: Universitaria; 1960. p. 172-4.
7. Del Vecchio L, Finizio O, Lo Pardo C, Pane N, Schiarone E, Vaca C, et al. Co-ordinate expression of T cell antigens on acute myelogenous leukemia and myeloid antigens on T acute lymphoblastic leukemia. Speculation on highly balanced bilinearity. Leukemia 1991;5:815-8.
8. Dresler HG, Theil E, Ludwing WD. Review of the incidence and clinical relevance of myeloid antigen positive in acute lymphoblastic leukemia. Leukemia 1991;5:637-45.
9. García JA, Monteserin MC, Delgado I, Benito L, Ona F. Aberrant immunophenotypes detected by flow cytometry in acute lymphoblastic leukemia. Leuk Lymphoma 2000;36:275-84.
10. Cabrera ME, Labra SG, Ugarte SU, Matutes E, Greaves MF. Inmunofenotipo, características clínicas y laboratorio de la leucemia linfoblástica aguda en Chile. Estudio de 500 niños y 131 adultos. Rev Med Chile 1996;124:293-9.
11. Piedras J, Barrales O, López Y. Classification of acute leukemias according to the First Latin-american Consensus Conference for the immunophenotyping of leukemias. Rev Invest Clin 2000;52:524-8.
12. Voskova D, Valekova L, Fedorova J, Hudecek J, Kubistz P. Leukemic cells and aberrant phenotypes in acute leukemia patients: A flow cytometric analysis. Neoplasma 2003;50:422-7.
13. Hsu PN, Tien HF, Wang CH, Chen YC, Shen MC, Lin KH. A subset of acute lymphoblastic leukaemia with co-expression of myeloid antigens: Prevalence and clinical significance. J Formos Med Assoc 1991:90:225-31.
14. Kurec AS, Belair P, Stefani C, Barreti Dubow RL, Davev FR. Significance of aberrant immunophenotypes in childhood acute lymphoblastic acute lymphoid leukaemia. Cancer 1991;67:3081-6.
15. Wiersma SR, Ortega J, Sohel E, Weinberg RI. Clinical importance of myeloid antigens expression in acute lymphoblastic leukemia of childhood. N Engl J Med 1991;325:1379-82.
16. Paredes R, Romero L, López N, Bravo A, Correa C, Joly E, et al. Inmunofenotipo de la leucemia aguda linfoblástica en niños mexicanos. Sangre 1999;44:188-94.
17. Zhu H, Niu T, Meng W, Xu C, Lei S. Immunophenotype of acute leukemia and its clinical significance. Hua Xi Yi Ke Da Xue Bao 2002;33:118-20.
18. Pituch A. Biological properties and sensitivity to induction therapy of differentiated cells expressing atypical immunophenotype in acute leukaemia of children. Folia Med Cracov 2001;42:5-80.
19. Rego EM, García AB, Viana SR, Falcao RP. Characterization of acute lymphoblastic leukaemia subtypes in Brazilian patients. LeuK Res 1996;20:349-55.
20. Vitale A, Guarini A, Ariola C, Meloni G, Perbellini O, Pizzuti M, et al. Absence of prognostic impact of CD13 and/or CD33 antigen expression in acute lymphoblastic leukaemia. Haematológica 2007;92:342-8.
21. Campana D, Behm FG. Immunophenotypic of leukemia. J Immunol Method 2000;243:59-76.
22. Pui CH, Behm FG, Crist WM. Clinical and biologic relevance of immunologic marker studies in childhood acute lymphoblastic leukemia. Blood 1993;82:343-62.
23. Howard MR, Thomas L, Reid MM. Variable detection of myeloid antigens in chidhood acute lymphoblastic leukaemia. J Clin Pathol 1994;48:186.
24. Ng SM, Lin HP, Arriffin WA, Zarnab AK, Lam SK, Chan LL, et al. Age sex, haemoglobin, and white cell count at diagnosis are important prognostic factors in children with acute lymphoblastic leukemia treated with BFM type protocol. J Trop Pediatric 2000;46:338-43.
Recibido: 15 de octubre del 2009.
Aprobado: 3 de noviembre del 2009.
Dra. Vianed Marsán Suárez. Instituto de Hematología e Inmunología. Apartado 8070. Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8695, 643 8268, Fax (537) 644 2334. e-mail: ihidir@hemato.sld.cu