Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.26 n.3 Ciudad de la Habana sep.-dic. 2010
ARTÍCULO ORIGINAL
Efecto in vitro de una solución de Zingiber officinale Rosc. (jengibre) sobre la respuesta de linfocitos humanos de donantes sanos y enfermos con inmunodeficiencia celular
In vitro effect of a solution of Zingiber officinale Rosc. (Ginger) on the response of human lymphocytes from healthy donors and patients with cellular immunodeficiency
Lic. Lázaro O. del Valle PérezI; Lic. Bertha B. Socarrás FerrerI; DraC. Consuelo Macías AbrahamI; Dra. Vianed Marsán SuárezI; Dra. Miriam Sánchez SeguraI; Dra. Rosa M. Lam DíazI; Lic. Julio C. Merlín LinaresI
IInstituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
El Zingiber officinale Rosc. (jengibre) es una especie que se ha utilizado por el hombre con diversos fines. Se estudió el efecto in vitro de una solución acuosa del rizoma de esta planta sobre los linfocitos de 30 donantes voluntarios de sangre y de 30 enfermos con diagnóstico de inmunodeficiencia celular, mediante la prueba de transformación linfoblástica, con el empleo de timidina tritiada, la técnica de formación de roseta activa y el ultramicrométodo inmunocitoquímico (UMICIQ). No se hallaron diferencias estadísticamente significativas entre las condiciones experimentales sin jengibre y con jengibre, con diluciones de este desde 1:2 hasta 1:2048 en la prueba de transformación linfoblástica. En la roseta activa y en los marcadores de activación HLA-DR y CD25 no se observaron diferencias estadísticamente significativas entre los linfocitos sin jengibre y los cultivados con la dilución 1:128, tanto en los donantes sanos como los enfermos.
Palabras clave: jengibre, Zingiber officinale Rosc, transformación linfoblástica, roseta activa, UMICIQ, marcadores de activación.
ABSTRACT
The Zingiber officinale Rosc (ginger) is a species used by man to different purposes. The in vitro effect of a aqueous solution from the rhizome of this plant on the lymphocytes of 30 volunteer blood donors and of 30 patients diagnosed with cellular immunodeficiency was studied by the lymphoblastic transformation test using tritiated thymidine, the technique of the rosette active formation and the immunocytochemical ultramicromethod (UMICIQ). There were not statistically significant differences among the experimental conditions with and without ginger with dilutions from 1:2 to 1:128 in the lymphoblastic transformation test. In the active rosette and in markers of the HLA-DR and CD25 activation there weren't statistically significant differences among lymphocytes without ginger and those cultured with a dilution 1:128 for healthy donors and for the patients.
Key words: Ginger, Zingiber officinale Rosc, lymphoblastic transformation, active rosette, UMICIQ, activation markers.
INTRODUCCIÓN
Desde los inicios de la humanidad el hombre ha utilizado las plantas como alimento y con fines medicinales, entre otros. Durante el transcurso de milenios, en su lucha por la supervivencia, el hombre ha aprendido a diferenciar las plantas beneficiosas de las que pueden causarle daño e incluso hasta la muerte. Pruebas evidentes de esta afirmación son los sistemas de medicina tradicional, de las más diversas culturas, que han llegado a nuestros días. En los últimos años, las plantas medicinales han alcanzado un notable florecimiento y el estudio de estas no solo abarca a aquellas consagradas por su uso popular, sino que se extiende a especies no estudiadas con anterioridad, en la búsqueda de nuevas sustancias biológicamente activas.1-3
El Zingiber officinale Rosc, especie perteneciente a la familia de las Zingiberáceas y conocida como ajengibre (jengibre en Cuba, jengibre dulce en Puerto Rico, ginger en EE.UU., gingembre en las Antillas Francesas), es una planta nativa del viejo mundo. Es una hierba con tallo hojoso de 60-90 cm de altura con rizomas ramificados y aromáticos. En la farmacopea americana y en otras se reconoce al jengibre (J) como droga oficial. Se usa como estimulante y carminativa y se administra en casos de dispepsia y cólicos. Tiene la propiedad de activar la secreción del sudor. Su rizoma tiene un olor agradable que se debe a la presencia de un aceite esencial y a un líquido amarillo al que se le ha dado el nombre de gingerol (4 hidroxi-5 metoxifeniletilcetona, con fórmula global C11H24O3). En Cuba le son reconocidas oficialmente por el Ministerio de Salud Pública, diversas propiedades, entre las que se encuentran, para el sistema digestivo: antiespasmódico, carminativo; sistema respiratorio: antitusígeno; sistema nervioso: antiemético (mareo por movimiento); sistémico: tónico.4-5 En estudios experimentales se ha planteado que el aceite esencial tiene actividad antimicrobiana contra bacterias gramnegativas y grampositivas y que el 6 gingerol tiene efecto analgésico y antiinflamatorio. Del J se han aislado más de 40 compuestos antioxidantes que tienen una función importante en la quimioprevención de diferentes enfermedades.6-10
Este trabajo se realizó para determinar el efecto in vitro de una solución de J sobre los linfocitos humanos de donantes sanos y de enfermos con diagnóstico de inmunodeficiencia celular.
MÉTODOS
Se estudió el efecto in vitro del J sobre los linfocitos procedentes de 30 donantes voluntarios de sangre del Departamento de Medicina Transfusional del Instituto de Hematología e Inmunología; y 30 enfermos con diagnóstico de inmunodeficiencia celular, que no habían recibido medicamento en el mes anterior a la obtención de la muestra. En cada caso, se extrajeron 15 mL de sangre heparinizada (15 UI/mL) con jeringuillas plásticas desechables. El aislamiento de células mononucleares se efectuó según el método de Böyum modificado, sobre un gradiente de Ficoll-Paque TM Plus (densidad 1,077g/mL) (Amersham Pharmacia, Suecia).11
Preparación de la solución de J: se trituró 1g de rizoma en 10 mL de RPMI 1640; se incubó una hora a 4 °C; se centrifugó a 2 500 rpm, 4 °C, 15 minutos. El sobrenadante se esterilizó (filtro 0,2 µm, NALGENE, EE.UU.) y la concentración final de la solución fue de 100mg/mL.
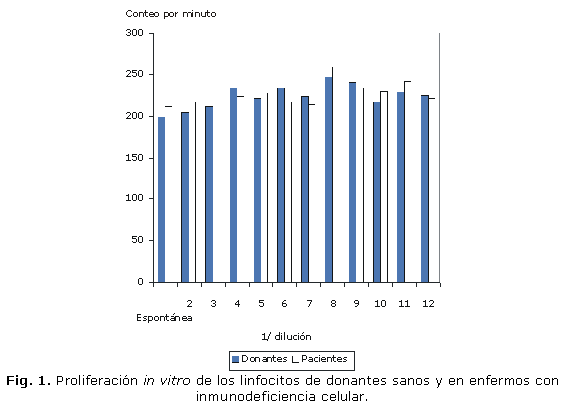
Para evaluar la respuesta al J se utilizó la prueba de transformación linfoblástica (PTL) con criterio de timidina tritiada en una concentración de 2 x 105 /pocillo en placas de 96 pozos (NUNC, Dinamarca) en 200µL de medio RPMI 1 640 al 20 % de suero fetal bovino (Sigma, EE.UU.), sin exposición al J y con diluciones dobles de este producto desde 1:2 hasta 1:2048 durante 72 horas a 37 °C, en atmósfera húmeda al 5 % de CO2 en una incubadora (ASSAB, Suecia). Para determinar la viabilidad celular se utilizó la técnica de exclusión del azul tripán que en todos los casos fue superior al 98 %. Seis horas antes de culminar el cultivo se le añadió a cada pozo 1 µCi de timidina tritiada (Amersham, Inglaterra), actividad específica 20Ci/mmol. Las placas se procesaron en un cosechador de células (Flow Laboratories, Inglaterra). La detección de partículas ß se realizó en un equipo RAK ß (LKB, Suecia).12 Los resultados se expresaron en conteos por minuto (cpm).
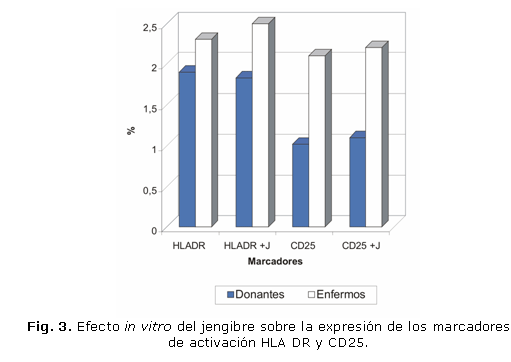
La determinación de los antígenos de activación HLA-DR y CD25 se realizó sin y con la estimulación de J (dilución óptima de 1:128) durante 72 horas, en las mismas condiciones empleadas para la PTL, y el porcentaje de estos antígenos se efectuó por el ultramicrométodo inmunocitoquímico (UMICIQ).13 El estudio del efecto del J sobre la formación de roseta activa (RA) se realizó sin incubación con J y con incubación (dilución óptima 1:128) a 4 °C durante las 24 horas previas.14 Para comparar los resultados obtenidos entre las muestras que se expusieron al J y aquellas en que no se usó este producto, se utilizó la prueba estadística t de Student para muestras pareadas.
Bioética: a los pacientes y a los donantes se les explicó el objetivo del estudio, los posibles beneficios derivados de los resultados y la ausencia de riesgos asociados. Se confeccionó una planilla para el consentimiento informado de los donantes y enfermos que participaron en el estudio.
RESULTADOS
En la PTL no se hallaron diferencias estadísticamente significativas entre los linfocitos cultivados con J y sin este, tanto en los donantes como en los enfermos con diagnóstico de inmunodeficiencia celular (fig. 1). Similares resultados se hallaron en la RA y en los marcadores de activación entre los linfocitos cultivados sin J y con J (dilución óptima 1:128), de los donantes y enfermos (figs. 2 y 3).
DISCUSIÓN
En estudios con inmunomoduladores inespecíficos se ha comprobado que algunos requieren de un sistema inmunológico funcional, otros tienen sus máximos efectos sobre un sistema inmunológico deprimido y están los que actúan tanto sobre sistemas normales como inmunodeprimidos. Por estas razones es que se han realizado los estudios in vitro con donantes sanos y con enfermos con defectos en la inmunidad celular.15
El J no produjo aumento de la proliferación de los linfocitos humanos procedentes de donantes sanos ni de enfermos con inmunodeficiencia celular y se utilizó como criterio la incorporación de timidina tritiada al ADN de nueva síntesis. Estos resultados coinciden con un estudio in vivo realizado en madres y sus hijos recién nacidos y en inválidos, para estudiar el efecto que tienen diferentes plantas sobre la inmunidad, donde se incluía el J. En un estudio realizado en peces para comprobar el efecto inmunoestimulante de extractos de varias plantas se halló que estimulan la fagocitosis.16,17
En contradicción con lo encontrado, se ha reportado que el J y el té verde tienen un efecto inhibidor sobre la inmunidad celular en PTL con PHA.18 No existió estimulación linfocitaria mediante la evaluación PTL, la RA y los marcadores de activación HLA-DR y CD25.
Lo anterior indica que se deben continuar los estudios para llegar a conclusiones acerca del empleo del J porque los resultados han sido algunos en estudios in vivo e in vitro y con diseños de investigación diferentes, los cuales no tienen que ser coincidentes. Se ha reportado que no existieron reacciones severas ni cambios hematológicos en voluntarios sanos que recibieron 28 mL de una infusión que contenía una mezcla de plantas empleadas como inmunoestimulante del cuerpo: energética, tónica y afrodisíaca. Sin embargo, se ha reportado que la tintura de yodo de J al 50 % puede producir reacciones severas con síntomas generales como mareos y malestar general.
El J administrado en forma de té y extracto en dosis de hasta 1 000 mg/kg/peso, a ratas gestantes durante el proceso de organogénesis, no causó toxicidad materna ni en el desarrollo de los embriones.19,20
En la literatura revisada no hemos hallado el estudio del efecto in vitro del J sobre los linfocitos de enfermos con diagnóstico de inmunodeficiencia celular e individuos sanos, donde se utilizaran marcadores de activación y la RA.
Teniendo en cuenta que el J es un medicamento y es utilizado como suplemento alimentario, es necesario continuar con los estudios preclínicos y clínicos necesarios, y sería interesante realizar estudios mediante la técnica de citometría de flujo para la determinación de moléculas en la membrana linfocitaria, sin estimulación y con estimulación con J.
AGRADECIMIENTOS
A las licenciadas Lourdes Palma Salgado y Mónica García Cuéllar, y a las técnicas Martha Ponce Sandoval, Yamila Junco y Gladys Graña Ayllón, por la colaboración brindada en la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Fuentes VR. Relación de plantas medicinales cubanas I. Boletín de Plantas Medicinales 1982;3:7-10.
2. Del Valle L, Macías C, Torres I, Socarrás B, Marsán V, Sánchez M. Efecto in vitro de la espirulina sobre la respuesta inmune. Rev Cubana Hematol Inmunol Hemoter 2002;18(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864 -02892002000200006&lng=es&nrm=iso
3. Del Valle LO, Socarrás B, Torres I, Marsán V, Macías C, Hernández P, et al. Efecto in vitro del VIMANG® sobre los linfocitos humanos. Rev Cubana Hematol Inmunol Hemoter. 2003;19(2-3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864 -02892003000200014&lng=es&nrm=iso
4. Roig JT. Plantas medicinales, aromáticas o venenosas de Cuba. La Habana: Ed. Científico-Técnica; 1988. p.536-9.
5. Ministerio de Salud Pública. Jengibre. En: Plantas medicinales. Fitomed 1994;2.
6. Ahmed RS, Suke SG, Seth V, Chakraborti A, Tripathi AK, Benergee BD. Protective effects of dietary ginger (Zingiber officinale Rosc.) on lindane-induced oxidative stress in rats. Phytother Res 2008;22:902-6.
7. Young HY, Luo YL, Cheng HY, Hsieh WC, Liao JC, Peng WH. Analgesic and anti-inflammatory activities of 6-gingerol. J Ethnopharmacol 2005;96:207-10.
8. Kuo PC, Damu AG, Cherng CY, Jeng JF, Teng CM, Lee EJ, et al. Isolation of a natural antioxidant, dehydrozingerone from Zingiber officinale and synthesis of its analogues for recognition of effective antioxidant and anti-tyrosine agents. Arch Pharm Res 2005;28:518-28.
9. Nakatomi N. Phenolic antioxidants from herbs and spices. Biofactors 2000;13:141-6.
10. Masuda Y, Kikuzaki H, Hisamoto M, Nakatani N. Antioxidant properties of gingerol related compounds from ginger. Biofactors 2004;21:293-6.
11. Böyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;10:1041-9.
12. Del Valle LO, Aranda RE, Rivero RA, Almagro D, Roque MC, Alfonso ME. Detección de anticuerpos antiplaquetarios por una técnica de transformación linfoblástica. Rev Cubana Hematol Inmunol Hemoter 1986;2:159-64.
13. Suárez L, Cruz C, Rivero RA. Ultramicrómetodo inmunológico. Titulación de anticuerpos utilizados para el inmunofenotipaje celular. Rev Cubana Hematol Inmunol Hemoter 1995;11:57-62.
14. Cruz C, Fernández ML, Bernal B, Hernández P, Ballester JM. Técnica de rosetas. La aplicación en pacientes con alteraciones inmunológicas. Rev Cubana Med 1981;20:379-87.
15. Stites D, Stobo J, Fudenberg HH, Well JV. Inmunología Básica y Clínica. La Habana: Ed. Científico-Técnica; 1987. p. 296-302.
16. Puri A, Sahai R, Singh KL, Saxena RP, Tandon JS, Saxena KC. Immunostimulant activity of dry fruits and plant materials used in Indian traditional medical system for mothers of child birth and invalids. J Ethnopharmacol 2000;71:88-92.
17. Dugenci SK, Arda N, Candan A. Some medicinal plants as immunostimulant for fish. J Ethnopharmacol 2003;888:99-106.
18. Wilasrusmeee C, Siddiqui J, Bruch D, Wilasrume S, Kittur S, Kittur DS. In vitro immunomodulatory effects of herbal products. Am Surg 2002;68:860-4.
19. Grzanna R, Lindmark L, Frondoza CG. Ginger-an herbal medicinal product with broad anti-inflammatory actions. J Med Food 2005;8:125-32.
20. Aweidner MS, Sigwart K. Investigation of the teratogenic potential of Zingiber officinale extract in the rat. Rep Toxicol. 2001;15:75-80.
Recibido: 18 de marzo del 2010.
Aprobado: 5 de abril del 2010.
Lic. Lázaro O. del Valle Pérez. Instituto de Hematología e Inmunología. Apartado 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8695, (537) 643 8268, Fax (537) 644 2334. e-mail: ihidir@hemato.sld.cu
Website: http://www.sld.cu/sitios/ihi