Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.26 n.4 Ciudad de la Habana oct.-dic. 2010
ARTÍCULO DE REVISIÓN
Características fenotípicas y funcionales de las células madre mesenquimales y endoteliales
Phenotypical and functional features of the mesenchymal and endothelial stem cells
DraC. Consuelo Macías-Abraham; Lic. Lázaro O. del Valle-Pérez; Prof. DrC. Porfirio Hernández-Ramírez; Prof. DrC. José M. Ballester-Santovenia
Instituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
RESUMEN
Se presentan los conceptos actuales sobre las células madre provenientes de la médula ósea y la importancia de las células estromales en la Medicina Regenerativa. Se describen, en particular, las características fenotípicas de las células madre mesenquimales y endoteliales, así como las de diferentes tipos celulares relacionados, sus propiedades funcionales y la importancia dada al uso de estas células en diversas aplicaciones terapéuticas. Se refieren los resultados de su estudio en distintos estados patológicos, las variaciones por la acción de drogas y de los factores de crecimiento, y su potencialidad futura en el diagnóstico y tratamiento de diferentes enfermedades.
Palabras clave: células madre, células progenitoras, medicina regenerativa, células mesenquimales, células endoteliales.
ABSTRACT
The current concepts on the stem cells from bone marrow and the significance of the stromal cells in Regenerative Medicine are showed. In particular, the phenotypical features of mesenchymal and endothelial stem cells are described, as well as the different related types of cells, its functional and the significance properties given to use of these cells in different therapeutic applications. The results of study in different pathologic states, the variations due to drugs action and of the growth factors are recounted as well as its future potential in diagnosis and treatment of different diseases.
Key words: Stem cells, progenitor cells, regenerative medicine, mesenchymal and endothelial cells.
INTRODUCCIÓN
Una de las bases fundamentales de la Medicina Regenerativa es el trasplante celular autólogo a tejidos lesionados, de células mononucleares provenientes de la médula ósea. Su objetivo es la reparación o disminución del daño hístico a partir de los diferentes mecanismos de acción de estas células implantadas en el tejido u órgano dañado.1
La célula madre hematopoyética (CMH) tiene la capacidad de reproducirse por sí misma, de diferenciarse a células maduras de la línea hematopoyética y, por su plasticidad, también a tejidos no hematopoyéticos como músculo, hígado, vasos, tejido nervioso y piel.1
El estroma de la médula ósea está constituido por una población heterogénea de células que incluye células endoteliales, fibroblastos, adipositos y células osteogénicas, una subpoblación que ejerce efectos reguladores positivos y negativos sobre la proliferación y diferenciación de las células hematopoyéticas.2,3 La población celular del estroma medular adherente contiene otras células no hematopoyéticas que son capaces de renovarse por sí mismas y diferenciarse en cartílago, músculo, tendón y grasa,4-6 por lo que la médula ósea que no ha sido sometida a métodos de depleción o extracción de poblaciones celulares específicas contiene ambos tipos de precursores, estromales y hematopoyéticos, y constituye la fuente celular principal para la implantación de células madre en otros tejidos.
En esta novedosa terapéutica se utilizan diferentes tipos celulares, y dentro de los mecanismos involucrados en sus beneficios clínicos, se encuentran: la reparación tisular y el aumento de la angiogénesis, la vascularización o ambos efectos.7 En la presente revisión se refieren de manera general las características fenotípicas y las propiedades funcionales de las células madre mesenquimales (CMM) y las células progenitoras endoteliales (CPE) humanas por su importancia en el desarrollo de la Medicina Regenerativa y otras aplicaciones clínicas.
CÉLULAS MADRE MESENQUIMALES
La médula ósea es la principal fuente de aislamiento de CMM, aunque se han aislado también del tejido adiposo, páncreas, hígado, músculo esquelético, dermis, membrana sinovial, hueso trabecular,8-11 sangre del cordón umbilical,12 tejido pulmonar,13 pulpa dental y ligamento periodontal.14 Aunque la médula ósea es la mejor fuente de obtención, solo 0,003 % de las células mononucleares de la médula ósea humana son CMM. Desde el año 2006, se conoce que existen algunos aspectos que dificultan su uso, como son: la limitada tasa de crecimiento, la capacidad de diferenciación de acuerdo con la edad del donante de la médula, y el riesgo en la toma de la muestra.8,10 Los progenitores mesenquimales son un grupo de células madre adultas caracterizadas por Friedenstein,15 aisladas de la médula ósea como células adherentes de morfología fibroblastoide, capaces de diferenciarse hacia células de origen mesodérmico como osteocitos, condrocitos y adipositos.15-18 Varios autores han asignado a este grupo celular diversos nombres como: células de estroma medular, unidades formadoras de colonias fibroblastoides, precursores estromales o células adultas progenitoras multipotentes o MAPCs (del inglés, multi-potent adult progenitor). La Sociedad Internacional de Terapia Celular (ISCT, del inglés: International Society of Cellular Therapy) en el año 2006, propuso 3 criterios para definir las CMM: 1) deben ser adherentes en cultivo; 2) expresar los antígenos CD73, CD90 y CD105 en ausencia de antígenos hematopoyéticos como CD34 y CD45, marcadores de monocitos, macrófagos y linfocitos B; y 3) diferenciarse in vitro en osteoblastos, adipositos y condrocitos, bajo condiciones estándares de cultivo.16,19-22 Además de lo propuesto por la ISCT se deben tener en cuenta 2 aspectos adicionales para clasificarlas como células madre: que las CMM realicen procesos de autorrenovación; durante la división celular solo una de las células hijas debe iniciar programas de diferenciación celular; y que sean capaces de desarrollar "plasticidad clonogénica" o diferenciación hacia tejidos de diferentes capas embrionarias como ectodermo y endodermo.23,24
Las CMM residentes de la medula ósea son designadas también como células estromales de la médula ósea, así como su progenie bien diferenciada localizada en los nichos perivasculares que tienen la capacidad de regenerar estroma medular, hueso, cartílago, tejido graso y músculo in vivo e in vitro.16,20,25 Por lo tanto, las CMM también residen en la pared de los grandes y pequeños vasos de diferentes tejidos y órganos que incluyen cerebro, bazo, hígado, riñón, pulmón, músculo, timo y páncreas. Lo anterior explica que la médula ósea y las CMM derivadas de célula madre embrionaria, CMM residentes en la pared vascular, así como la CMM derivadas de célula madre embrionaria de tejido fetal, cordón umbilical, placenta, músculo y de adipositos, puedan constituir la fuente celular para terapias de diferentes estados patológicos como diabetes, osteoporosis, artrosis, desórdenes degenerativos musculares, y para la regeneración de las paredes de los órganos y vasos sanguíneos después del daño tisular.25-28 Las CMM pueden también diferenciarse a células neuronales, pulmonares, islotes de células beta pancreáticas, células epiteliales corneales y cardiomiocitos ex vivo e in vivo, por lo que pueden usarse para el tratamiento de numerosos tejidos dañados y desórdenes degenerativos.29
En la actualidad es de gran interés el estudio de las células estromales de la médula ósea, ya que estas poblaciones celulares cultivadas son capaces de autorrenovarse y de diferenciarse como lo hace la CMH, de ahí que muchos investigadores se refieran a las células estromales como a las CMM y utilicen la determinación de fibroblastos formadores de colonias como un método funcional para cuantificar las células progenitoras estromales.30-32 Se ha referido que existe una fuerte correlación entre su potencial proliferativo y la edad, por lo que el envejecimiento celular se relaciona con la disminución de su actividad proliferativa.30,31 La función anormal de las células estromales se ha descrito en diversas enfermedades, y el trasplante de células no procesadas de la médula ósea puede restaurar la función del microambiente celular.32,33 Estas células precursoras del microambiente celular pueden ser lesionadas por la quimioterapia, las radiaciones y permanecen en muy baja concentración durante un tiempo después del trasplante.34 Ellas inducen estímulos reguladores a otras células y probablemente esto explica el retardo en la recuperación funcional inmunológica posterior al trasplante.35
CARACTERÍSTICAS FENOTÍPICAS
Las células estromales muestran un potencial de diferenciación hacia diferentes líneas celulares; estas son: CMM, células progenitoras mesodérmicas y células inducibles de multilinaje adultas aisladas de médula ósea, conocidas como MIAMI (del inglés, marrow isolated adult multilineage inducible), las que han sido caracterizadas usando paneles de anticuerpos monoclonales36 (tabla 1), aunque algunos autores consideran que estas células son similares. Recientemente se han descrito en la medula ósea y otros tejidos adultos, varias poblaciones de células madre no hematopoyéticas (tabla 2) que incluyen: CMM; células MAPCs, células MIAMI, células madre multipotentes adultas (MASCs; del inglés, multipotent adult stem cells), CPE, OmniCitos y células madre pequeñas parecidas a células embriónicas conocidas como VSELs (del inglés, very small embryonic like).37 Todas las anteriores pueden corresponder a poblaciones similares o a poblaciones superpuestas de células madre, denominadas de manera diferente por varios investigadores en diversas condiciones experimentales de aislamiento y expansión en cultivos. Estas poblaciones son derivadas de la fracción adherente de la medula ósea y potencialmente podrían asociarse o internalizar VSELs por un proceso de emperipolesis. Esta interacción entre VSELs y las mencionadas células madre más indiferenciadas, requiere de mayor conocimiento experimental.37
Tabla 1. Expresión de diferentes marcadores de membrana en poblaciones celulares del estroma medular
| Marcador | Células madre mesenquimales | Células madre mesodérmicas | Células MIAMI |
| CD34 | - | - | - |
| CD45 | - | - | - |
| CD4 | - | No descrito (nd) | nd |
| CD9 | + | nd | nd |
| CD10 | + | - | + |
| CD11a | - | nd | nd |
| CD13 | + | + | nd |
| CD14 | - | nd | nd |
| CD15 | - | nd | nd |
| CD18 | - | nd | nd |
| CD25 | - | nd | nd |
| CD29 | + | nd | + |
| CD31 | - | - | nd |
| CD36 | nd | - | - |
| CD38 | nd | - | nd |
| CD44 | + | + (bajo) | + |
| CD49a | + | nd | nd |
| CD49b | + | + | nd |
| CD49c | + | nd | nd |
| CD49d | - | nd | nd |
| CD49e | + | nd | + |
| CD50 | - | - | nd |
| CD51 | + | nd | nd |
| CD54 | + | nd | nd |
| CD56 | nd | nd | - |
| CD58 | + | nd | nd |
| CD61 | + | nd | nd |
| CD62e | - | - | nd |
| CD62L | + | nd | nd |
| CD62p | - | nd | nd |
| CD63 | nd | nd | + |
| CD71 | + | nd | nd |
| CD73(SH3 y SH4) | + | nd | nd |
| CD81 | nd | nd | + |
| CD90 | + | +(bajo) | + |
| CD102 | + | nd | nd |
| CD103 | nd | nd | + |
| CD104 | + | nd | nd |
| CD105 (SH2) | + | nd | nd |
| CD106 | + | - | nd |
| CD109 | nd | nd | - |
| CD113 | nd | nd | nd |
| CD117 | - | - | - |
| CD119 | + | nd | nd |
| CD120a | + | nd | nd |
| CD120b | + | nd | nd |
| CD121 | + | nd | nd |
| CD122 | nd | nd | + |
| CD123 | + | nd | nd |
| CD124 | + | nd | nd |
| CD126 | + | nd | nd |
| CD127 | + | nd | nd |
| CD140a | + | nd | nd |
| CD164 | nd | nd | + |
| CD166 | + | nd | nd |
| HLA clase I | nd | - | - |
| HLA-DR | nd | - | - |
| LNGRF | nd | nd | nd |
| H1P12 | nd | - | nd |
| Beta 2 microglobulina | nd | +(Bajo) | nd |
| KDR (RFCVE) | nd | +(Bajo) | +(Bajo) |
| Fit1 | nd | +(Bajo) | +(Bajo) |
| Antígeno de superficie de fibroblasto | nd | - | nd |
Tabla 2. Células madre en tejidos adultos humanos
| Células madre | Fenotipo |
| Células madre mesenquimales (CMM) a | CD133+, CD34+, c-kit (CD117)+, VE-cadherin+, VEGFR2+, CD146+, vWF+, CD31+ |
| Criterios de ISCT: CD105+, CD73+, CD90+, CD45-, CD34-, CD14-, CD11b-, CD79a-, CD19-, HLA-DR- | |
| Marcadores más indiferenciados: CXCR4, CD133, CD34 (?), p75LNGFR | |
| Células progenitoras endoteliales (CPE) | CD133+, CD34+, c-kit (CD117)+, VE-caderina+, VEGFR2+, CD146+, FvW+, CD31+ |
| Células progenitoras multipotentes adultas (MAPC) a | SSEA-1+, CD13+, Flk-1bajo, Thy-1bajo , CD34-, CD44-, CD45-, CD117(c-kit)-, MHC I-, MHC II- |
| Células inducibles de multilinaje adultas aisladas de médula ósea (MIAMI) a | CD29+, CD63+, CD81+, CD122+, CD164+, c-met+, BMPR1B+, NTRK3+, CD34-, CD36-, CD45-, CD117 (c-kit)-, HLA-DR- |
| Células madre multipotente adultas (MASCs) a | CD13+, CD49b+, CD90+, CD73+, CD44+, CD29+, CD49a+, CD105+, MHC I+, HLA-DR-, CD14-, CD34-, CD45-, CD38-, CD133-, c-kit (CD117)- |
| OmniCitos | CD34+, CD133+, CXCR4+, c-Met+, CD33bajo, CD38bajo, MHC-IIbajo |
| Células madre pequeñas parecidas a células embrionarias (del inglés, very small embryonic-like stem cells, VSEL) | CXCR4+, AC133+, CD34+, SSEA-4+, AP+, c-Met+, LIF-R+, CD45-, Lin-, HLA-DR-, MHC I-, CD90-, CD29-, CD105- |
as MAPCs han sido aisladas de una fracción de células mononucleares de la médula ósea como una población de fibroblastos adherentes de células CD45-GPA-A. Estas son células pluripotentes capaces de diferenciarse en células de las 3 capas germinales y contribuyen a la formación de todos los tejidos embrionarios cuando son inyectadas en el blastocito en desarrollo.37 Sin embargo, existen en la actualidad algunas dudas sobre su existencia.
Las células MIAMI son una población adherente de médula ósea adulta, sus colonias cultivadas expresan marcadores característicos de las 3 capas de líneas germinales.37 De manera similar, las MASCs han sido recientemente identificadas como una población de células adherentes de medula ósea capaces de diferenciarse en líneas mesodérmicas múltiples.37 Ellas fueron clonadas de médula ósea adulta así como de otros tejidos que incluyen hígado y corazón y expresan los típicos marcadores de CMM.37
El término OmniCitos se utiliza para referirse a una subpoblación de células madre CD34+ que constituye una pequeña fracción en sangre periférica, de características fenotípicas conocidas (tabla 2), y muy similares a otra subpoblación de células madre pequeñas (del inglés, small stem cells). Las CPE y las VSELs son células que se movilizan en respuesta al daño tisular 37 y tienen una alta similitud antigénica, por lo que pueden potencialmente ser aisladas conjuntamente.
En general, las células estromales cultivadas, independientemente del método de cultivo empleado, no expresan las moléculas CD45 y CD34, pero podrían expresar CD105 (SH2) y CD73 (SH3 y SH4) (tabla 3). Sin embargo, el fenotipo exacto de la célula precursora estromal (mesenquimal) en la médula ósea humana previo al cultivo, aún está en discusión. El aislamiento y enriquecimiento de las células mesenquimales se basa en el empleo de algunas de sus características más comunes, como la adherencia celular, o la estrategia de separación celular usando mezclas de anticuerpos monoclonales que eliminan de la médula ósea, poblaciones celulares específicas.38-40
| Moléculas de adhesión | |
| Superfamilia de las inmunoglobulinas ALCAM VLA-a1 | Marcador de membrana CD66 CD49a |
| Factores de crecimiento y receptores de citocinas | |
| IL-1R | CD 121 |
| | |
| Tetraspan | CD9 |
| | |
| Colágeno tipo l, II, IV y V | |
La molécula CD73 ó 5'ectonucleotidasa se considera un marcador de linaje para las CMM y se cree que esté relacionada con mecanismos de adhesión celular, ya que se ha encontrado co-expresada con moléculas tipo a2 integrinas, lo que ha caracterizado al CD73 como un mediador de adhesión celular en CMM.41,42 Las CMM aisladas de la médula ósea, también expresan la molécula CD90 ó Thy-1, una proteína de la superfamilia de las inmunoglobulinas y cuyo principal ligando es el CD45;43,44 se expresa entre el 10-40 % de las células CD34+ y en mayor proporción en el tejido conectivo. En células del estroma medular este antígeno es un marcador de precursores mesenquimales tempranos que pueden diferenciarse en osteoblastos. La molécula CD105, también conocida como endoglina, es una glicoproteína que forma parte del complejo del receptor del factor transformante de crecimiento-beta ó TGF-β,
Además de los antígenos referidos anteriormente, otros autores proponen moléculas como STRO-1, CD44 y CD166 para la tipificación de células mesenquimales. En 1991 se identificó a STRO-1 (por Simmons and Torok-Storb, de ahí sus siglas) como un antígeno específico para CMM aisladas de médula ósea.48 CD44 es una molécula de adhesión que actúa mediante la interacción con el ácido hialurónico, osteopontina, colágeno, anquirina, fibronectina y metaloproteinasas y participa en los procesos de adhesión, migración y proliferación de las CMM.49 Además de STRO-1 y CD44, se sugiere que la molécula CD166 o ALCAM (del inglés, activated leukocyte cell adhesion molecule) interviene en la hematopoyesis, involucra a las CMM y participa en el mantenimiento del estado indiferenciado de CMH y CMM.20,50 Si la población es de origen medular, este marcador es determinante en su identificación, lo que podría explicar en parte los resultados contradictorios que se encuentran publicados con respecto a la expresión de esta y otras proteínas en CMM.18,51
CARACTERÍSTICAS FUNCIONALES
Las CMM son una población celular con alto potencial autorrenovador que median mecanismos potentes para evitar el rechazo alogénico. Múltiples estudios han demostrado que evitan el alorreconocimiento, interfieren con las células dendríticas y la función de las células T e inducen un microambiente inmunosupresor local por la secreción de citocinas.52 El efecto inmunorregulador de las CMM humanas se incrementa cuando las células están expuestas a un medioambiente inflamatorio caracterizado por un aumento local de interferón (IFN) gamma.53
La demostración in vitro de que las células mesenquimales no expresan los antígenos del Sistema Principal de Histocompatibilidad de clase II y que suprimen la reacción de proliferación en el cultivo mixto de linfocitos, ha sugerido que estas células podrían suprimir las reacciones inmunes inducidas y constituyen un potencial terapéutico en la enfermedad de injerto contra huésped.54
Se ha demostrado que las CMM humanas liberan citocinas inmunosupresoras, como el factor de crecimiento del hepatocito, la interleucina 10 y el TGF-β1, en concentraciones que suprimen la alorrespuesta in vitro. También expresan las ciclooxigenasas 1 y 2 y producen prostaglandina E2 constitutivamente. Estudios de bloqueo con indometacina confirman que las prostaglandinas contribuyen a la alosupresión mediada por estas células.54-56 El IFN-gamma (citocina proinflamatoria) no es capaz de revertir la supresión que inducen las CMM sobre la proliferación linfocitaria por estimulación alogénica, pero sí es capaz de regular o revertir sus efectos sobre los factores de crecimiento del hepatocito y TGF-β1. Estudios de cocultivo o cultivo entre células alogénicas in vitro, tanto en modelos animales como humanos, en presencia de CMM, demuestran que los factores solubles derivados de estas últimas modulan la respuesta inmune y sugieren que esto genera un microambiente inmunosupresor capaz de modular la alorrespuesta aún en presencia de IFN-gamma.52-54
Tres mecanismos fundamentales contribuyen al efecto supresor sobre la reacción alogénica; 1) son hipoinmunogénicas, pues no expresan antígenos de clase II y otras moléculas coestimulatorias; 2) previenen la respuesta de las células T indirectamente a través de la modulación de las células dendríticas y actúan directamente inhibiendo la función de las células NK (inhibiendo la proliferación y producción de IFN) y las células T CD4+ (induciendo un fenotipo regulador); 3) inducen un microambiente supresor local a través de la producción de prostaglandinas e interleucina-10, así como por la expresión de indoleamina-2,3-dioxigenasa, que depleta de triptófano el medio local.52-54 Esta acción inmunorreguladora es comparable con la referida en la tolerancia materno-fetal y muy similar a la descrita en los mecanismos de las células tumorales para evadir a la respuesta inmunológica.54
Además de las propiedades regenerativas de las CMM, estas también afectan el funcionamiento del sistema inmune. Estudios realizados demuestran que las CMM pueden inhibir la proliferación de linfocitos inducida por aloantígenos,55 mitógenos como fitohemaglutinina y concavalina A,56 y anticuerpos anti CD3 y CD28.57 Durante la maduración de las células dendríticas, las CMM pueden inhibir la expresión de moléculas involucradas en la presentación de antígenos como CD1a, CD40, CD80, CD86 y HLA-DR58 y en co-cultivo con células mononucleares de sangre periférica, incrementan la proporción de subpoblaciones de linfocitos T con fenotipo de células reguladoras como CD4+/CD25alto, CD4+/CTLA-4+, CD4+/CD25+/CTLA-4+.59
El hecho de que las CMM son hipoinmunogénicas permite que sean utilizadas como matriz para la expansión de poblaciones enriquecidas de células CD34+, ya que no es necesaria la compatibilidad con el donante ni el hospedero. Lo anterior sugiere que las células hematopoyéticas expandidas sobre una matriz de células mesenquimales podrían retener las propiedades biológicas de las células más primitivas y no llegar a una diferenciación terminal, como se ha descrito hasta el momento para procederes ex vivo.60 En niños con osteogénesis imperfecta se han realizado trasplantes con células mesenquimales cultivadas y marcadas genéticamente. Los resultados beneficiosos obtenidos durante un año declinaron en el tiempo, probablemente por una diferenciación terminal.61
Existen hallazgos que confirman que la población celular no adherente procedente de cultivos de médula ósea es una fuente complementaria de CMM, y que ellas pueden ser colectadas de manera simple y poco costosa, lo que incrementa su número y permite reducir los tiempos de cultivo para su disponibilidad y aplicaciones clínicas.62
Las CMM tienen la capacidad de diferenciarse a células de diferentes tejidos, de regenerar tejidos deteriorados o lesionados17,63-65 y de modular reacciones inmunes en colagenopatías, la esclerosis múltiple y el trasplante de médula ósea.21 Una de sus principales aplicaciones clínicas consiste en la reparación de hueso, demostrada in vivo en ratones y en perros con defectos cráneo-faciales y defectos de huesos largos mediante la administración directa de CMM, con matrices como hidroxiapatita/fosfato tricálcico que han mostrado resultados satisfactorios.66,67
El conocimiento más profundo de la biología de poblaciones celulares específicas podría ser el fundamento de futuras terapias en muchas áreas más allá de la hematología y la oncología.
CÉLULAS PROGENITORAS ENDOTELIALES HUMANAS
El desarrollo del vaso sanguíneo es un proceso regulado que involucra proliferación, migración y remodelación de células endoteliales (CE) de vasos preexistentes (angiogénesis) o producto de la diferenciación de CPE o angioblastos procedentes de precursores mesodérmicos (vasculogénesis).68 Conocimientos precedentes sugerían que las CPE solo estaban presentes durante el desarrollo embrionario y en la actualidad existen evidencias suficientes que demuestran su persistencia en la vida adulta, lo que ha generado interés en su uso para la neovascularización de tejidos isquémicos o dañados y su uso clínico en individuos con factores de riesgo para enfermedades asociadas con un compromiso de la vascularización.68
CARACTERIZACIÓN FENOTÍPICA Y LINAJE DE LAS CPE
Los estudios de purificación y caracterización de las CPE procedentes de médula ósea o de sangre periférica no han sido exitosos por la ausencia de marcadores fenotípicos específicos o distintivos entre estas células y las CE derivadas de la pared vascular y de subpoblaciones de células hematopoyéticas (tabla 4).
en la Medicina Regenerativa
| Marcador | Células endoteliales | Células progenitoras endoteliales | Células hematopoyéticas | Otras células |
| CD34 | + | + | Subpoblaciones de células madre | Algunas células en tejido nervioso adulto y fetal |
| CD45 | - | | - | No descrito (ND) |
| CD14 | + sinusoide hepático | - | Monocitos, macrófagos y neutrófilos | |
| CD31(PECAM-1) | + | + | Plaquetas, monocitos, células NK, neutrófilos y subpoblaciones de células T | ND |
| CD36 | + (microvascular) | | Plaquetas, monocitos maduros, macrófagos y progenitores eritroides | |
| CD105 (Endoglin) | activadas | | Monocitos activados, macrófagos tisulares, células pre-B en médula fetal y precursores eritroides en médula ósea fetal y adulta | Células estromales de ciertos tejidos incluyendo médula ósea |
| CD106 (VCAM-1) | activadas | | Células dendríticas foliculares, ciertos macrófagos tisulares células interdigitantes | Células mesenquimales |
| CD133 | - | + | Subpoblaciones de células madre | |
| CD144 (VE-Caderina) | + | + | | |
| CD146 (Muc 18, S-ENDO) | + | | Subpoblaciones de células T activadas ¿ ? | |
| Receptor del FCVE2 (KDR) | + | + | Subpoblaciones de células progenitoras | Melanoma y músculo liso |
| FvW | + | | Plaquetas | |
| BS-1 | + | | Células mieloides | |
| UEA-1 | + | | Células mieloides | |
| LDL acetilado | + | + | Células mieloides | |
| Tie-2/Tek | + | + | Progenitoras ¿ ? | |
+: positivo; - : negativo; FCVE2: factor de crecimiento vascular endotelial tipo 2; FvW: factor von Willebrand.
Se considera que las células de médula ósea con un marcador de linaje negativo CD117+(c-kit+), podrían inducir neovascularización del miocardio isquémico y mejoramiento de la función cardíaca en el modelo de infarto de miocardio en el ratón, lo que sugiere que las CPE están contenidas en esta población.78 También se ha demostrado que las células MAPCs pueden formar células capaces de diferenciarse en células que expresan marcadores de endotelio maduro CD31+/CD36+/factor von Willebrand+.79 Estas células favorecen la angiogénesis tumoral y participan en preservar el estado de salud en el individuo sano. Se ha demostrado que las CPE se derivan de células de médula ósea cultivadas con una elevada capacidad proliferativa.79
AISLAMIENTO Y CULTIVO DE CPE
La mayoría de los estudios in vitro no han logrado definir un método de condiciones de cultivo estandarizado para aislar y cultivar las CPE.80 El método más frecuente consiste en el cultivo de células en plástico; tanto la fracción adherente como la no adherente contienen CPE, las células CD133+ o CD34+ son seleccionadas y cultivadas. Otros factores muestran gran variabilidad, como los factores de crecimiento utilizados: FCEV, factor de crecimiento de fibronectina-b y extracto de cerebro bovino, así como los sustratos de crecimiento, como la fibronectina, el colágeno tipo 1 y la gelatina, y el tiempo de cultivo.80
CPE Y ENFERMEDAD
Las CPE circulantes pueden participar en la formación de nuevos vasos, por lo que son utilizadas en el tratamiento de diversos trastornos vasculares por su capacidad migratoria en la circulación y su capacidad de diferenciarse a nuevas células endoteliales que contribuyen a la angiogénesis y a la reparación del endotelio en tejidos y órganos distantes.81 Por lo tanto, esto sugiere que la inducción in vivo de la movilización de CPE derivada de la médula ósea hacia la circulación periférica, o la activación de CPE residentes en la pared vascular o tejidos dañados, puede representar una promisoria estrategia para promover la reparación vascular de áreas lesionadas.
Se ha observado que la inyección de células humanas aisladas del tipo de la subpoblación CD34-/CD133+/RFCEV2+ /CD14- en ratones desnudos con daño carotídeo, se asentaron a nivel del endotelio de la arteria carotídea. Las CPE generaron CE maduras que se incorporaron a la pared endotelial, lo que permitió una reducción del tamaño de la lesión.82
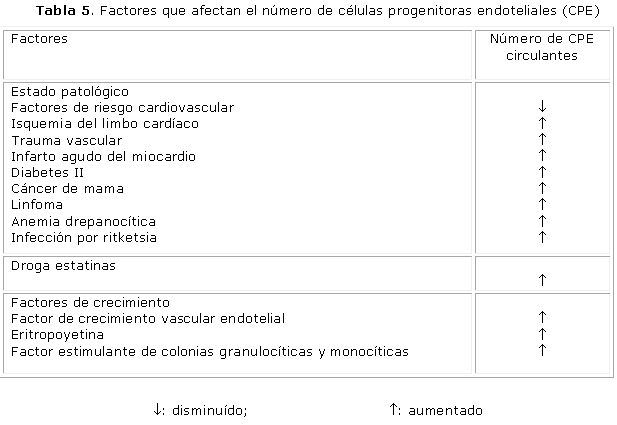
No existen cifras bien definidas de las CPE en los individuos sanos. Diferentes estudios han descrito la influencia de condiciones patológicas del uso de determinadas drogas y de factores de crecimiento sobre el número de CPE in vivo. Por ejemplo, el número de CPE circulantes se ha reportado como disminuido en pacientes con riesgo de enfermedad coronaria83,84 y en correlación negativa con el puntaje de riesgo cardiovascular, pero no se ha definido su valor pronóstico. Los niveles de CPE CD34+ KDR+ (KDR/flk-1 es el receptor que media la mayoría de los efectos angiogénicos y proliferativos del FCEV) están relacionados con la aparición de eventos y muerte de causa cardiovascular, y podrían ayudar a identificar a los pacientes con alto riesgo.85 Sin embargo, existe una limitada capacidad de las CPE infundidas en pacientes con lesiones cardiovasculares en la formación vascular, lo que ha provocado una redefinición del potencial biológico de estas células, y actualmente el origen, el potencial proliferativo y la capacidad de diferenciación de las células endoteliales capaces de formar colonias (unidades formadoras de colonias) procedentes de la médula ósea, es controvertido, y se ha definido como un nuevo grupo celular a las células endoteliales formadoras de colonias procedentes de sangre periférica que tienen la capacidad de formar vasos con elevada capacidad proliferativa y que constituyen una posibilidad terapéutica para la revascularización. Las CPE circulantes derivadas de la médula ósea RFCVE2+ no generan células endoteliales vasculares, no contribuyen a la angiogénesis y no favorecen el crecimiento tumoral.86,87
Las CPE de pacientes con diabetes mellitus tipo 2 se caracterizan por capacidad proliferativa disminuida, adhesión disminuida y capacidad reducida de formar vasos capilares in vitro. Los mecanismos responsables de estos hallazgos no se conocen, pero se atribuyen a una movilización disminuida de las CPE procedentes de la médula ósea, un incremento de su consumo o derivación hacia los sitios dañados o lesionados y una vida media reducida de las CPE.88
En contraste, la isquemia límbica (del septum cardíaco),89 el trauma vascular90 y el infarto agudo del miocardio91 están asociados con un incremento rápido de CPE en la circulación. El tratamiento con diferentes inhibidores del 3-hidroxi-3-metilglutaril Coenzima A o estatinas92,93 y factores de crecimiento, incluida la eritropoyetina,94 el FCVE 95 y el factor estimulante de colonias granulopoyéticas y monocíticas (FSC-GM),96 también incrementa el número de CPE in vivo. Las evidencias preliminares sugieren que ellos podrían actuar movilizando las CPE de la médula ósea y mejorando la supervivencia de las CPE por activación de la vía de la proteína cinasa 3/Akt (tabla 5).
En este campo de la investigación ya se observan avances significativos en la estandarización de procesos de aislamiento, caracterización fenotípica y cultivo de CPE, que podrían constituir la base de terapéuticas futuras. También la cuantificación de las diferentes poblaciones de CE pudiera ser un elemento de utilidad en el diagnóstico y el manejo de la prevención de diferentes enfermedades.
El aislamiento, la expansión en cultivo, la caracterización fenotípica, y las propiedades funcionales de las CMM, CPE y CE maduras, puede variar en dependencia de la interacción directa con otras células o de la liberación de factores solubles específicos de cada microambiente. En la actualidad, es de gran interés profundizar en el estudio de estos tipos celulares en el contexto de localizaciones anatómicas particulares; y la generalización de su uso terapéutico debe considerar las variaciones observadas según la fuente de obtención, el grado de diferenciación, el número de células utilizadas y el microambiente donde se desean utilizar.
El avance en la identificación de la actividad biológica de cada una de estas poblaciones y subpoblaciones in vivo y los mecanismos moleculares responsables de cada una de sus funciones, permitirá el uso de la Medicina Regenerativa, no solo como una alternativa terapéutica para mejorar la evolución y pronóstico, sino como una solución a largo plazo para una amplia variedad de enfermedades.
REFERENCIAS BIBLIOGRÁFICAS
1. Hernández Ramírez P. Medicina regenerativa y células madre. Mecanismos de acción de las células madre adultas. Rev Cubana Hematol Inmunol Hemoter 2009 Abr [citado 2009 Dic 15]; 25(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892009000100002&lng=es
2. Dexter TM, Allen TD, Lajtha LG. Conditions controlling the proliferation of haemopoietic stem cells in vitro. J Cell Phys 1977;91:335-44.
3. Verfaillie CM. Soluble factor(s) produced by human marrow stroma increase cytokine-induced proliferation and maturation of primitive hematopoietic progenitors while preventing their terminal differentiation. Blood 1993;82:1045-2053.
4. Bruder SP, Jaiswal N, Haynesworth SE. Growth kinetics, self-renewal, and osteogenic potential of purified human mesenchymal stem cells during extensive subcultivation and following cryopreservation. J Cell Biochem1997;64:278-94.
5. Mackay AM, Beck SC, Murphy JM, Barry FP, Chichester CO, Pittenger MF. Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow. Tissue Eng 1998;4:415-28.
6. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999;284:143-47.
7. Fridenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinet 1970;3:393-403.
8. Wexler S, Donaldson C, Denning P, Rice C, Bradley B, Hows J. Adult bone marrow is a rich source of human mesenchymal "stem" cells but umbilical cord and mobilized adult blood are not. Br J Haematol 2003;121:368-74.
9. Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells: Characterization, differentiation, and application in cell and gene therapy. J Cel Mol Med 2004;8:301-16.
10. Wagner W, Wein F, Seckinger A, Frankhauser M, Wirkner U, Krause U, et al. Comparative characteristics of mesenchymal stem cells from human bone marrow, adipose tissue, and umbilical cord blood. Exp Hematol 2005;33:1402-16.
11. Kern S, Eichler H, Stoeve J, Klüter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells 2006;24:1294-1301.
12. Bieback K, Kern S, Klüter H, Eichler H. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood. Stem Cells 2004;22:625-34.
13. Sabatini F, Petecchia L, Tavian M, Jodon V, Rossi GA, Brouty-Boye D. Human bronchial fibroblast exhibit a mesenchymal stem cell phenotype and multilineage differentiating potentialities. Lab Invest 2005;85:962-71.
14. Shi S, Bartold PM, Miura M, Seo BM, Robey PG, Gronthos S. The efficacy of mesenchymal stem cells to regenerate and repair dental structures. Orthod Craniofac Res 2005;8:191-99.
15. Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa S, Lueria E. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol 1974;2:83-92.
16. Beyer N, Da Silva L. Mesenchymal stem cells: Isolation in vitro expansion and characterization. Handb Exp Pharmacol 2006;174:249-82.
17. Krampera M, Pizzolo G, Aprili G, Franchini M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal repair. Bone 2006;39:678-83.
18. Chang Y, Tseng C, Hsu L, Hsieh T, Hwang S. Characterization of two populations of mesenchymal progenitor cells in umbilical cord blood. Cell Biol Int 2006;30:495-99.
19. Dominici M, Le Blanc K, Mueller I, Staper Cortenbach I, Marini F, Krause D, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006;8:315-17.
20. Bianco P, Riminucci M, Gronthos S, Robey P. Bone marrow stromal cells: Nature, biology, and potencial applications. Stem Cells 2001;19:180-92.
21. Rasmusson I. Immune modulation by mesenchymal stem cells. Exp Cell Res 2006;312:2169-79.
22. Deans RJ, Moseley AB. Mesenchymal stem cells: Biology and potential clinical uses. Exp Hematol 2000;28:875-84.
23. Lakshmipathy U, Verfaille C. Stem cell plasticity. Blood Rev 2005;19:29-38.
24. Rodríguez V. Células madre: conceptos generales y perspectivas de investigación. Universitas Scientiarum 2005;10:5-14.
25. Bernardo ME, Emons JAM, Karperien M, Nauta AJ, Willemze R, Roelofs H, et al. Human mesenchymal stem cells derived from bone marrow display a better chondrogenic differentiation compared with other sources. Connect Tissue Res 2007;48:132-40.
26. Chan J, Waddington SN, O'Donoghue K, Kurata H, Guillot PV, Gotherstrom C, et al. Widespread distribution and muscle differentiation of human fetal mesenchymal stem cells after intrauterine transplantation in dystrophic mdx mouse. Stem Cells 2007;25:875-84.
27. Yamada Y, Yokoyama S, Wang XD, Fukuda N, Takakura N. Cardiac stem cells in brown adipose tissue express CD133 and induce bone marrow nonhematopoietic cells to differentiate into cardiomyocytes. Stem Cells 2007;25:1326-33.
28. Wolbank S, Peterbauer A, Fahmer M, Hennerbichler S, van Griensven M, Stadler G, et al. Dose-dependent immunomodulatory effect of human stem cells from amniotic membrane: A comparison with human mesenchymal stem cells from adipose tissue. Tissue Eng 2007;13:1173-83.
29. Mimeault M, Hauke R, Batra SK. Stem cells: A revolution in therapeutics. Recent advances in stem cell biology and their therapeutic applications in regenerative medicine and cancer therapies. Clin Pharmacol Ther 2007;82:252-64.
30. Clarke E, Mc Cann SR. Age dependent in vitro stromal growth. Bone Marrow Transplant 1989;4:596-7.
31. Minguell JJ, Martínez J. Growth pattern and function of bone marrow fibroblasts from normal and acute lymphoblastic leukemia patients. Exp Hematol 1983;11:522-26.
32. Scopes J, Ismail M, Marks JK, Rutherford RT, Draycott GS, Pocock C, et al. Correction of stromal cell defect after bone marrow transplantation in aplastic anaemia. B J Haematol 2001;115:642-52.
33. Bourin P, Gadelorge M, Peyraffite JA, Fleury-Cappellesso S, Gomez M, Rage C, et al. Mesenchymal progenitor cells: Tissue origin, isolation and culture. Transfus Med Hemother 2008;35:160-67.
34. Galotto M, Berisso G, Delfino L, Podesta M, Ottagio L, Dallorso S, et al. Stromal damage as consequence of high-dose chemo/radiotherapy in bone marrow transplant recipients. Exp Hematol 1999;27:1460-66.
35. Witherspoon RP, Lum LG, Storb R. Immunologic reconstitution after human marrow grafting. Semin Hematology 1984;2:2-10.
36. D`Hippolito G, Diabira S, Howard GA, Menei P, Roos BA, Schiller PC. Marrow -isolated adult multilineage inducible (MIAMI) cells, a unique population of postnatal young and old human cells with extensive expansion and differentiated potential. J Cell Science 2004;117:2971-81.
37. Zuba-Surma EK, Kucia M, Ratajczak J, Ratajczak MZ. Small stem cells in adult tissues: Very small embryonic-like stem cells stand up! Cytometry Part A 2009;75A:4-13.
38. Reyes M, Lund T, Lenvik T, Aguiar D, Koodie L, Verfaillie CM. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood 2001;98:2615-25.
39. Clarke E, Wognum AW, Marciniak R, Eaves AC. Mesenchymal cell precursors from human bone marrow have a phenotype that is distinct from cultured mesenchymal cells and are exclusively present in a small subset of CD45lo, SH2+cells. Blood 2001;98:355a.
40. Jones EA, Kinsey SE, English A, Jones RA, Straszynski L, Meredety DM, et al. Isolation and characterization of bone marrow multipotential mesenchymal progenitors cell. Arthritis and Rheumatism 2002;46:3349-60.
41. Airas L, Niemelä J, Salmi M, Puurunen T, Smith DJ, Jalkanen S. Differential regulation and function of CD73, a Glycosyl-Phosphatidylinositol-linked 70-kD adhesion molecule, on lymphocytes and endothelial cells. J Cell Biol 1997;136:421-31.
42. Sträter N. Ecto- 5'-nucleotidase: Structure function relationships. Purinergic Signal 2006;2:343-50.
43. Craig W, Kay R, Cutler RL, Landsorp PM. Expression of Thy-1 on human hematopoietic progenitor cells. J Exp Med1993;177:1331-42.
44. Barboni E, Rivero BP, George AJ, Martin SR, Renoup DV, Hounsell EF, et al. The glycophosphatidylinositol anchor affects the conformation of Thy-1 protein. J Cell Sci 1995;108:487-97.
45. Cheifetz S, Bellon T, Cales C, Vera S, Bernabeu C, Massagué J, Letarte. Endoglin is a component of the transforming growth factor-β receptor system in human endothelial cells. J Biol Chem 1992;67:19027-30.
46. Fonsatti E, Maio M. Highlights on endoglin (CD105): From basic findings towards clinical applications in human cancer. J Transl Med 2004;2:18-24.
47. Roura S, Farre J, Soler-Botija C, Llach A, Hove-Madsen L, Cairo JJ, et al. Effect of aging on the pluripotential capacity of human CD105 (+) mesenchymal stem cells. Eur J Heart Fail 2006;8:555-63.
48. Gonçalves R, da Silva C, Cabra J, Zanjani E, Almeida-Porada G. STRO-1+ human universal stromal feeder layer to expand/maintain human bone marrow hematopoietic stem/progenitor cells in a serum-free culture system. Exp Hematol 2006;34:1353-59.
49. Zhu H, Mitsuhashi N, Klein A, Barsky L, Weinberg K, Barr M, et al. The role of the hyaluronan receptor CD44 in mesenchymal stem cell migration in the extracellular matrix. Stem Cells 2006;24:928-35.
50. Ohneda O, Ohneda K, Arai F, Lee J, Miyamoto T, Fukushima Y, et al. ALCAM (CD166): Its role in hematopoietic and endotelial development. Blood 2001;98:2134-42.
51. Erices A, Conget P, Minguell J. Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol 2000;109:235-42.
52. Ryan JM, Barry FP, Murphy JM, Mahon BP. Mesenchymal stem cells avoid allogeneic rejection. J Inflamm 2005;2:8.
53. _______. Interferon-gamma does not break, but promotes the immunosuppressive capacity of adult human mesenchymal stem cells. Clin Exp Immunol 2007;149:353-63.
54. Tse WT, Pendleton D, Beyer W, D`Andrea A, Guinan EC. Bone marrow derived mesenchymal stem cells (MSC) suppress T-cell activation without inducing anergy. Cytotherapy 2001;3:417a.
55._______, Egalka MC, Guinan EC. Suppresion of allogenic T-cell proliferation by human marrow stromal cells: Implications in transplantation. Transplant 2003;75:389-97.
56. Le Blanc K, Tammik L, Sundberg B, Haynesworth SE, Ringden O. Mesenchymal stem cells inhibit and stimulate mixed lymphocyte cultures and mitogenic responses independently of the major histocompatibility complex. Scand J Immunol 2003;57:11-20.
57. Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogenic immune cell responses. Blood 2005;105:1815-22.
58. Zhang W, Ge W, Li C, You S, Liao L, Han Q, et al. Effects of mesenchymal stem cells on differentiation, maduration, and function of human monocyte-derived dendritic cells. Stem Cells Dev 2004;13:263-3271.
59. Maccario R, Podesta M, Moretta A, Cometa A, Comoli P, Montagna D, et al. Interaction of human mesenchymal stem cells with cells involved in alloantigen -specific immune response favors the differentiation of CD4+ T-cell subsets expressing a regulatory / suppressive phenotype. Haematologica 2005;90:516-25.
60. Holyoake TL, Alcorn MJ, Richmond L, Farrell E, Pearson C, Green R, et al. CD34 positive PBPC expanded ex vivo may not provide durable engraftment following myeloablative chemoradiotherapy regimens. BM Transplant 1997;19:1095-1101.
61. Banfi A, Muraglia A, Dozin B, Mastrogiacomo M, Cancedda R, Quarto R. Proliferation kinetics and differentiation potential of ex vivo expanded human marrow stromal cells: Implications for their use in cell therapy. Exp Hematol 2000;28:707-15.
62. Wan C, He Q, McCaigue M, Marsh D, Li G. Nonadherent cell population of human marrow culture is a complementary source of mesenchymal stem cells (MSCs). J Orthop Res 2006;24:21-8.
63. Jiang Y, Jahagirdar BN, Rheinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, et al. Pluripotency of mesenchymal stem cells from adult marrow. Nature 2002;418:41-9.
64. Krampera M, Pasini A, Pizzolo G, Cosmi L, Romagni S, Annunziato. Regenerative and immunomodulatory potential of mesenchymal stem cells. Curr Opin Pharmacol 2006;6:435-41.
65. Kassem M, Kristiansen M, Abdallah B. Mesenchymal stem cells: Cell biology and potential use in therapy. Basic Clin Pharmacol Toxicol 2004;95:209-14.
66. Mankani MH, Kuznetsov SA, Fowler B, Kingman A, Robey PG. In vivo bone formation by human bone marrow stromal cells: Effect of carrier particle size and shape. Biotechnol Bioeng 2001;72:96-107.
67. Tsuchida H, Hashimoto J, Crawford E, Manske P, Lou J. Engineered allogeneic mesenchymal stem cells repair femoral segmental defect in rats. J Orthop Res 2003;21:44-53.
68. Schmeisser A, Strasser RH. Phenotypic overlap between hematopoietic cells with suggested angioblastic potential and vascular endothelial cells. J Hemat Stem Cell Res 2002;11:69-79.
69. Rafij R. Circulating endothelial precursors: Mistery, reality, and promise. J Clin Invest 2000;105:17-19.
70. Leucocyte Typing VI. White cell differentiation Antigens. Kishimoto T, et al., ed. NY: Garland Publishing; 1998.
71. Mancuso P, Burlini A, Pruneri G, Goldhirsch A, Martinelli G, Bertolini F. Resting and activated endothelial cells are increased in the peripheral blood of cancer patients. Blood 2001;97:3658-61.
72. Rafji S, Lyden D. Therapeutic stem and progenitor cells for organ vascularization and regeneration. Nat Med 2003;9:702-12.
73. Masuda H, AsaharaT. Post-natal endothelial progenitor cells for neovascularization in tissue regeneration. Cardiovasc Res 2003;58:390-8.
74. Peichev M, Naiyer AJ, Pereira D, Zhu Z, Lane WJ, Williams M, et al. Expression of VEGFR-2 and AC133 by circulating human CD34+ cells identifies a population of functional endothelial precursors. Blood 2000;95:952-8.
75. Asahara T, Murohara T, Sullivan A, Silver M, van der Zee R, Li T, et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science 1997;275:964-67.
76. Bryder D, Rossi DJ, Weissman IL. Hematopoietic stem cells: The paradigmatic tissue-specific stem cell. Am J Pathol 2006;169:338-46.
77. Pelosi E, Valtieri M, Coppola S, Botta R, Gabbianelli M, Lili V, et al. Identification of the hemangioblast in postnatal life. Blood 2002;100:3203-08.
78. Kocher AA, Schuster MD, Szabolcs MJ, Takuma S, Burkhoff D, Wang J, et al. Neovascularization of ischemic myocardium by human bone marrow- derived angioblasts prevents cardiomyocyte apoptosis, reduces remodelling and improves cardiac function. Nat Med 2001;7:430-6.
79. Reyes M, Dudek A, Jahagirdar B, Koodie L, Marker PH, Verfaillie CM. Origin of endothelial progenitors in human postnatal bone marrow. J Clin Invest 2002;109:337-46.
80. Kalka C, Masuda H, Takahashi T, Gordon R, Tepper O, Gravereaux E, et al. Vascular endothelial growth factor 165 gene transfer augments circulating endothelial progenitor cells in human subjects. Circ Res 2000;86:1198-1202.
81. Zengin E, Chalajour F, Gehling UM, Ito WD, Treede H, Lauke H, et al. Vascular wall resident progenitor cells: A source for postnatal vasculogenesis. Development 2006;133:1543-51.
82. Friedrich EB, Walenta K, Scharlau J, Nickenig G, Werner N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res 2006;98,E20-E25.
83. Vasa M, Fitchtlscherer S, Aicher A, Adler K, Urbich C, Martin H, et al. Number and migratory activity of circulating endothelial progenitors cells inversely correlate with risk factors for coronary heart disease. Cir Res 2001;89:e1-e7.
84. Hill JM, Zalos G, Halcox JP, Schenke WH, Waclawiw MA, Quyyumi AA, et al. Circulating endothelial progenitor cells, vascular function and cardiovascular risk. N Engl J Med 2003;348:593-600.
85. Werner N, Wassmann S, Alehrs P, Kosiol S, Nickenig G. Endothelial progenitor cells correlate with endothelial function in patients with coronary artery disease. Basic Res Cardiol 2007;102:565-71.
86. Yodre MC, Mead LE, Prater D, Krier TR, Mroueh KN, Li F, et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood 2007;109:1801-9.
87. Prater DN, Kase J, Ingram DA, Yoder MC. Working hyphothesis to redefine endothelial progenitors cells. Leukemia 2007;21:1141-9.
88. Tepper OM, Galiano RD, Capla JM, Kalka C, Gagne PJ, Jacobowitz GR, et al. Human endothelial progenitor cells from type II diabetic exhibit impaired proliferation, adhesion and incorporation into vascular structures. Circ 2002;106:2781-86.
89. Takahashi T, Kalka C, Masuda H, Chen D, Silver M, Kearney M, et al. Ischemia-and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med 1999;5:434-8.
90. Gill M, Dias S, Hattori K, Rivera ML, Hicklin D, Witte L, et al. Vascular trauma induces rapid but transient mobilization of VEGFR2+AC133+ endothelial precursors cells. Cir Res 2001;88:167-74.
91. Shintani S, Murohara T, Ikeda H, Ueno T, Honma T, Katoh A, et al. Mobilization of endothelial progenitor cells in patients with acute myocardial infarction. Circ 2001;103:2776-79.
92. Vasa M, Fitchtlscherer S, Adler K, Aicher A, Martin H, Zeiher AM, et al. Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease. Circ.2001;103: 2885-90.
93. Llevadot J, Murasawa S, Kureishi Y, Uchida S, Masuda H, Kawamoto A, et al. HMG-CoA reductase inhibitor mobilizes bone marrow-derived endothelial progenitor cells. J Clin Invest 2001;108:399-405.
94. Heeschen C, Aicher A, Lehman R, Fichtlscherer S, Vasa M, Urbich C, et al. Erythropoietin is a potent physiological stimulus for endothelial progenitor cells mobilization. Blood 2003;102:1340-46.
95. Kalka C, Masuda H, Takahashi T, Gordon R, Tepper O, Gravereaux E, et al. Vascular endothelial growth factor165 gene transfer augments circulating endothelial progenitors cells in human subjects. Cir Res 2000;1198-1202.
96. Carmeliet P. Angiogenesis in health and disease. Nat Med 2003;9:653-60.
Recibido: 15 de junio del 2010.
Aprobado: 2 de julio del 2010.
DraC. Consuelo Macías-Abraham. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. Ciudad de La Habana, Cuba. Tel (537) 643 8695, 8268. Fax (537) 644 2334. E-mail: ihidir@hemato.sld.cu