My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
Print version ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.1 Ciudad de la Habana Jan.-Mar. 2012
ARTÍCULO ORIGINAL
Impacto de la terapia celular en el síndrome del túnel carpiano
Impact of cell therapy in carpal tunnel syndrome
Dr. Rafael Mena-Pérez,I Dra. Norma Fernández-Delgado,II Dr. Fermín Garmendía-GarcíaIII
I Facultad de Ciencias Médicas "Enrique Cabrera". La Habana, Cuba.
II Instituto de Hematología e Inmunología. La Habana, Cuba.
III Hospital Pediátrico Docente "William Soler". La Habana, Cuba.
RESUMEN
Se expone una pequeña serie de pacientes con síndrome del túnel del carpo a quienes se les realizó implante de células mononucleares autólogas de sangre periférica para evaluar la factibilidad y seguridad de estas al sexto mes de realizado el proceder. Se incluyeron 6 pacientes atendidos en el Servicio de Ortopedia del Hospital General Docente "Enrique Cabrera". La mejoría de los síntomas comenzó a la semana de realizado el proceder. El dolor y el calambre fueron los primeros en desaparecer; la mejoría aumentó al mes y se mantuvo hasta el sexto mes de evaluados. Las manifestaciones clínico-neurológicas mejoraron en el 80,3 % de los pacientes con mejoría, además, en el estudio de conducción motora y sensitiva. No hubo reacción al implante. La mejoría de las manifestaciones clínicas y de los estudios de conducción apoyan la mediación de las células madre en la acción antiinflamatoria, la revascularización y la remielinización del nervio mediano, lo que se expresa en las respuestas favorables obtenidas.
Palabras clave: células madre, síndrome del túnel carpiano, medicina regenerativa, terapia celular.
ABSTRACT
We present a small series of patients with carpal tunnel syndrome who underwent implantation of autologous mononuclear cells from peripheral blood to assess the feasibility and safety of these in the sixth month after that procedure. We included 6 patients treated at the Department of Orthopedic in The Enrique Cabrera General Teaching Hospital. The improvement in symptoms began one week after the procedure. Pain and cramping were the first to disappear, the improvement increased one month after and it was maintained until the sixth month of evaluation. The clinical-neurological manifestations improved in 80.3 % of patients, as well as in the study of motor and sensory conduction. There was no reaction to the implant. The improvement of the clinical manifestations and conduction studies support the mediation of stem cells in inflammatory action, revascularization and remyelination of the median nerve, which is expressed in the positive responses obtained.
Key words: stem cells, carpal tunnel syndrome, regenerative medicine, cell therapy.
INTRODUCCIÓN
Las neuropatías por atrapamiento pudieran definirse como la presión, angulación, elongación o fricción que sufren los nervios en espacios anatómicamente estrechos. Algunas de estas neuropatías no están bien definidas.1 Entre ellas, tenemos las que se presentan en el miembro superior: el síndrome del agujero torácico superior (atrapamiento del plexo braquial), el codo de tenista (atrapamiento del interóseo posterior), el síndrome del pronador redondo (atrapamiento del nervio mediano en el antebrazo), y el síndrome del túnel carpiano (atrapamiento del nervio mediano en la región carpiana).
El nervio mediano se forma a partir de fibras de C6-T1, en su recorrido llega a nivel de la muñeca y pasa por debajo del ligamento anular del carpo, enfrente del intersticio que separa el tendón del palmar mayor del tendón del palmar menor, por lo que queda por delante del tendón superficial del índice y por fuera del tendón del dedo medio.
El ligamento anular anterior del carpo es una lámina fibrosa, gruesa, transversal, que se inserta por fuera en los tubérculos del escafoides y del trapecio. Es precisamente aquí donde mayormente se produce la compresión del nervio y desencadena los síntomas y signos del síndrome del túnel carpiano (STC), considerada la neuropatía por atrapamiento más frecuente,2 compresión que produce isquemia del nervio mediano, el cual está constituido, posiblemente en más de la mitad de sus fibras nerviosas, por fibras no mielinizadas del tipo C.3 Cuando la compresión se hace mantenida comienza la disfunción del nervio secundaria a la desmielinización, lo que llega a producir el cuadro clínico característico.2
La sensación de adormecimiento está dada por la pérdida de la sensibilidad de los 3 primeros dedos, donde abundan como terminación nerviosa los corpúsculos de Meisner, los cuales presentan fibras nerviosas mielinizadas del tipo Ab (altamente sensibles).3 El diagnóstico del STC es fundamentalmente clínico1,4 y los tratamientos medicamentoso y fisioterapéutico en muchas ocasiones no son efectivos, pues los síntomas o se mantienen o recidivan, por lo que se recurre a las infiltraciones con esteroides como opción prequirúrgica, aunque su efectividad no es tan duradera y está demostrado que una segunda infiltración no logra mejorías más allá de la alcanzada con la primera.5
En cuanto al tratamiento quirúrgico, es cierto que es efectivo en la mayoría de los casos, pero no está exento de complicaciones como cicatrices dolorosas, dehiscencia de la herida,6 enfermedad de Sudeck,6 con la consecuente demora de la recuperación del paciente. Por estas razones y el beneficio obtenido con la terapia celular en enfermedades neurológicas,7-16 se ha considerado el uso de las células madre (CM) como posible terapia en el STC.17
El objetivo de este artículo es exponer una serie de pacientes con STC a quienes se les realizó implante de células mononucleares autólogas de sangre periférica para evaluar su factibilida y seguridad.
MÉTODOS
Se evaluaron 6 pacientes adultos con diagnóstico clínico y por estudios de conducción nerviosa motora y sensitiva (ECNMS) de STC, remitidos a la consulta de Ortopedia del Hospital General Docente "Enrique Cabrera" en enero de 2010 y que cumplieron con los siguientes criterios de inclusión:
1. Pacientes con 15 o más años de edad.
2. Con diagnóstico clínico de STC y además, con un resultado neurofisiológico que evidencie compresión del nervio mediano.
3. Sin tratamiento previo o con ninguna respuesta al tratamiento convencional o poco beneficio con este.
4. Que hayan emitido el consentimiento informado para ser incluidos en la investigación.
Método de obtención de las células
La movilización a la sangre periférica de las células mononucleares autólogas derivadas de la médula ósea se realizó mediante la aplicación subcutánea del factor estimulador de colonias de granulocitos (Leukocim, CIMAB, SA, La Habana o Hebervital, Heber SA, La Habana). Este producto se administró en una dosis total 40 µg/kg de peso corporal, subdividida en 4 subdosis de 10 µg/kg de peso corporal cada 12 horas, la última aplicada entre 4 a 6 horas antes de la autodonación de sangre. Después de realizada la flebotomía se hizo la separación de las células, por el método desarrollado en el Instituto de Hematología e Inmunología (IHI).18
Técnica del implante
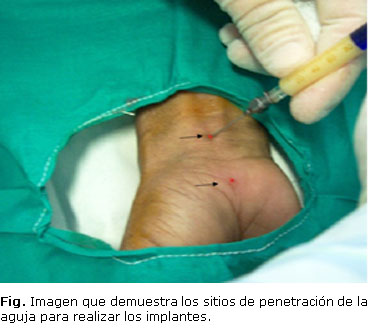
Las células mononucleares se implantaron en un volumen total de 0,6 mL en la región ventral de la muñeca, repartido en dos dosis de 0,3 mL, una proximal al pliegue de flexión de la muñeca y otra distal a esta, subdividido en cada lado en 0,1 mL sobre el nervio mediano; 0,1 mL a la derecha y 0,1 mL a la izquierda. Con posterioridad a cada implante se esperó 1 min para la retirada de la aguja.
Método de evaluación clínico-neurológico
Los pacientes fueron evaluados neurológicamente antes del implante por un examinador externo (especialista en Ortopedia y Traumatología), el examen clínico-neurológico posimplante lo realizó otro especialista en Ortopedia y Traumatología, sin conocimiento alguno de los datos previos al proceder. Las manifestaciones clínico-neurológicas analizadas fueron: dolor, sensaciones de adormecimiento, debilidad, calambre, frialdad, dificultad para sostener pequeños objetos, signo de flick (sacudida de la mano), signo de Tinell y de Phalen,2,19 hipoestesia en el territorio del mediano, debilidad para la pinza digital, hipotrofia tenar, cambios de coloración de la mano, dificultada para definir estímulos dolorosos en el dedo índice y edema.
Método para la realización de los ECNMS
Se hicieron con un electromiógrafo NEUROPACK SIGMA (MEB-5504K) con las condiciones de ganancia, sensibilidad, filtraje, tiempo de análisis y estimulación adecuada para este tipo de registro.20,21 Para la evaluación de la conducción motora se tomaron los parámetros siguientes: latencia de inicio, amplitud y velocidad de conducción, y para la conducción sensitiva: latencia al pico, amplitud y velocidad de conducción.
Como criterios evaluativos se tomaron los siguientes aspectos:
Evaluación de la respuesta:
1. Respuesta primaria: disminución de las manifestaciones clínico-neurológicas a partir del mes posimplante.
2. Respuesta avanzada: mejoría a las 24 semanas, comparadas con los resultados iníciales; y a las 4 semanas, de las variables: clínico-neurológicas, mejoría de los resultados del ECNSM. La mejoría a las 24 semanas se consideró como la mejoría obtenida a las 4 semanas en que se mantenía estable o que se incrementó; o bien la mejoría de aquellos parámetros que no la obtuvieron a las 4 semanas.
Grado de respuesta:
- Completa: desaparición de las manifestaciones clínico-neurológicas y mejoría en el ECNSM.
- Parcial: mejoría en el 50 % o más de los parámetros evolutivos evaluados.
- Mínima: mejoría al menos en el 25 % de los parámetros evolutivos evaluados.
- Ninguna: ausencia de mejoría de los parámetros analizados.
Recaída: incremento de los síntomas después que el paciente había logrado al menos una respuesta mínima. Esta se consideró temprana si ocurrió antes de las 24 semanas posimplantación y tardía si apareció después de las 24 semanas.
Fracaso terapéutico: ausencia al de menos respuesta mínima a las 24 semanas o recaída temprana.
Criterio de seguridad: ausencia de efectos adversos graves que el médico de asistencia atribuyera a la implantación celular y no a la propia enfermedad del paciente.
Criterio de efectividad: obtención al menos de respuesta parcial en más del 30 % de los pacientes incluidos en el estudio, a las 12 semanas posimplante celular y que se mantuvo o incrementó a las 24 semanas.
RESULTADOS
Se trataron 6 pacientes del sexo femenino cuya edad osciló entre los 43-60 años, con un promedio de 51,5 años. Según su oficio, 2 eran oficinistas, 2 obreras manuales y 2 amas de casa. Una paciente tenía menos de 6 meses de evolución de sus síntomas, una entre 6-12 meses, 3 entre 1 a 2 años y una tenía más de 3 años de evolución.
Cuatro pacientes tenían síntomas bilaterales, pero se decidió realizar el proceder solo en la muñeca más afectada (en 5 pacientes predominó la muñeca derecha). Como promedio se implantaron 48,7 x 106 células mononucleares autólogas.
Los síntomas predominantes fueron el dolor diurno y la sensación de calambres en todos los casos, seguidos por la sensación de debilidad en la pinza digital y la dificultad para sostener pequeños objetos (tabla 1). El signo de Tinnel, la pruba de Phalen y la hipoestesia en el territorio del mediano se encontraron en el 100 % de las pacientes (tabla 1) (Fig.).
Todas las pacientes refirieron comenzar a sentir mejorías a la semana del implante, siendo el dolor, seguido por la sensación de calambres, los primeros síntomas en desaparecer. Al mes de realizado el implante, las 5 primeras pacientes tuvieron una respuesta primaria parcial y la última tuvo una respuesta primaria mínima. Al sexto mes, las 5 primeras presentaban respuesta avanzada parcial y la última, respuesta avanzada mínima.
De forma general, a los 6 meses se normalizaron o mejoraron 57 de 71 manifestaciones clínico-neurológicas, para el 80,3 %, y persistieron 14 (19,3 %). No hubo recuperación en la sensación de frialdad de los dedos, la hipoestesia en el territorio del mediano, ni en la hipotrofia tenar, las manifestaciones que mejor evolucionaron fueron: el dolor, la sensación de calambre, la debilidad para la pinza digital y el edema (tabla 1).
En cuanto a los valores de la conducción nerviosa sensitiva, antes del implante la media de la latencia al pico estaba por encima de su valor normal, que mejoró con posterioridad al implante; la amplitud y la velocidad de conducción estaban por debajo de los parámetros normales, lo que mejoró a los 6 meses del proceder (tabla 2).
En la conducción motora solo la latencia de inicio estaba por encima de lo normal, con un discreto empeoramiento al sexto mes en 0,15 ms; los otros 2 parámetros estaban en cifras normales y mejoraron aún más posterior al implante (tabla 3).
No se registró reacción adversa alguna al implante de las células madre, solo refirieron dolor durante el proceder que cedió con dipirona por vía oral.
DISCUSIÓN
La velocidad de conducción nerviosa se relaciona con el diámetro del nervio y el estado de su mielina en el axón, una capa aislante que se forma alrededor de los nervios compuesta por proteína y sustancias grasas.22 La función de la mielina es transmitir rápida y eficientemente los impulsos.
En el STC la isquemia daña la mielina y los impulsos se retrasan, dando precisamente el cuadro clínico de las pacientes, relacionado con la disfunción del nervio mediano.
La casuística femenina, así como su edad promedio, coincide con lo revisado en la literatura.1,2,4,6,19,23 En cuanto al oficio, se plantea que la mayor incidencia es en oficinistas, que en ocasiones hacen uso de computadoras y colocan su muñeca en una posición forzada o inadecuada por largos ratos.4,24-27
El dolor y las parestesias son el resultado de la isquemia local;28 como estos fueron los primeros síntomas en desaparecer, nos dan la medida de la rápida acción de las células madre en la revascularización de la zona. Por otra parte, la mejoría del resto de los síntomas, sobre todo la debilidad y el entumecimiento de los dedos que se producen por compresión,28 sugieren una acción antiinflamatoria mediada por citocinas.29-31
La remielinización y regeneración axonal se reflejó en el resultado del ECNSM posimplante, que mostró cifras en recuperación sobre todo en la conducción sensitiva.
El aumento de la amplitud sensitivo-motor y la mejoría de la velocidad de conducción, son indicadores sugestivos de un aumento en el número de axones transmitiendo impulsos nerviosos y de signos de remielinización, respectivamente.
Debe destacarse que en los casos con manifestaciones bilaterales se evidenció recuperación del nervio mediano contralateral, a pesar de no habérsele implantado células madre en esa extremidad. Esa experiencia también la hemos tenido en la cirugía del túnel carpiano cuando se ha operado la mano predominante y los síntomas de la mano contraria desaparecen. Existe una publicación que reporta mejoría contralateral posquirúrgica del 92,8 %,32 que pudiera estar relacionado con las aferencias provenientes de las fibras nerviosas periféricas y su integración con el sistema nervioso central, o bien por la acción telecrina que pueden ejercer las células madre.33
Se conoce que en el conjunto de células mononucleares provenientes de la médula ósea se encuentran varios tipos de células madre con capacidad regenerativa, entre las que se destacan las hematopoyéticas y las mesenquimales. Por lo tanto, cuando se administran las células mononucleares sin fraccionar, como se ha hecho en nuestro trabajo, se hace en la práctica la implantación de un "cóctel" de células madre.33
La mejoría de las manifestaciones clínicas y de los ECNMS apoya la mediación de las células madre en la acción antiinflamatoria, la revascularización y la remielinización del nervio mediano, lo que se expresa en las respuestas favorables obtenidas. Atendiendo al pequeño número de casos evaluados, es recomendable ampliar la investigación con un número mayor de pacientes para poder llegar a conclusiones más fundamentadas.
Agradecimientos
Al Dr. Leonardo Dinza Zamora, especialista en Ortopedia y Traumatología del Hospital General Docente "Enrique Cabrera", por su colaboración en la realización del examen físico posimplante a los pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Dawson DM, Hallet M, Millender LH, eds. Introduction. En: Entrapment Neuropathies. Boston: Litlle, Brown and Company; 1990. pp. 1-3.
2. Bozek M, GaŸdzik TS. The value of clinical examination in the diagnosis of carpal tunnel syndrome. Ortop Traumatol Rehabil. 2001; 3(3):357-60. [Internet] [citado: 15 Abril 2009]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17687235?ordinalpos=10&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReport
Panel.Pubmed_RVDocSum
3. Guyton AC, Hall JE. Sensaciones somáticas: Organización general; los sentidos de tacto y de la posición. En: Guyton AC, Hall JE, eds. Tratado de Fisiología Médica. 10ma ed. Madrid: Interamericana McGraw-Hill; 2001. pp. 655-68.
4. Aparicio S. Comparación de la prevalencia del síndrome del túnel carpiano por manifestaciones clínicas y prueba de Tinell en operadores de computadoras de un diario escrito, La Paz, Bolivia. Revista Cubana de Salud y Trabajo 2008; 9(2) [Internet]. [citado: 22 Nov 2010]. Disponible en: http://bvs.sld.cu/revistas/rst/vol9_2_08/rst05208.html
5. Marshall S, Tardif G, Ashworth N. Local corticosteroid injection for carpal tunnel syndrome. Evid Based Med. 2008 Feb;13(1):16. [Internet]. [citado: 11 Feb 2011]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17443508?ordinalpos=7&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_ DefaultReportPanel.Pubmed_RVDocSum
6. Mendoza Santiesteban E, Rodríguez Loureiro JL, Rodríguez Ávila E. Cirugía del túnel carpiano. Técnica de mínimo acceso. [Internet]. [citado: 4 Mar 2011]. Disponible en: http://cencomed.sld.cu/neuro40/originalcarpiano.htm
7. García G, Arismendi I. Transplante de células madre autólogas en pacientes con isquemia crítica no revascularizable. Reporte de casos. Revista Colombiana de Cirugía Vascular. 2007;7(7):49-55.
8. Fischbach GD, Mckhann GM. Cell therapy for Parkinson's disease. N Engl J Med 2001;344:763-5.
9. Dunnett SB, Bjorklund A, LindvalL O. Celltherapy in Parkinson's disease - stop or go? Nat Rev Neurosci 2001;2:365-9.
10. Kerr DA, Llado J, Shamblott MJ, Maragakis NJ, Irani DN, Crawford TO, et al. Human embryonic germ cell derivatives facilitate motor recovery of rats with diffuse motor neuron injury. J Neurosci 2003;23:5131-40.
11. Wichterle H, Lieberam I, Porter JA, Jessell TM. Directed differentiation of embryonic stem cells into motor neurons. Cell 2002;110:385-97.
12. Ramón-Cueto A, Cordero MI, Santos-Benito FF, Ávila J. Functional recovery of paraplegic rats and motor axon regeneration in their spinal cords by olfactory ensheathing glia. Neuron 2000;25:425-35.
13. Hofstetter CP, Schwarz EJ, Hess D, Widenfalk J, EL Manira A, Prockop DJ, et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc Natl Acad Sci U.S.A. 2002;99:2199-2204.
14. Zurita M, Vaquero J. Functional recovery in chronic paraplegia after bone marrow stromal cells transplantation. Neuroreport 2004;5:1105-8.
15. Pluchino S, Quattrini A, Brambilla E, Gritti A, Salani G, Dina G, et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature 2003;422:688-94.
16. Arvidsson A, Collin T, Kirik D, Kokaia Z, Lindvall O. Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat Med 2002;8:963-70.
17. Mena Pérez R, Fernández Delgado N, Garmendia García F. Uso de la medicina regenerativa en el tratamiento del síndrome del túnel del carpo. Rev Cubana Hematol Inmunol Hemoter 2011;27(3), http://bvs.sld.cu/revistas/hih/vol27_3_11/hih06311.htm
18. Cortina Rosales L, Hernández Ramírez P, López De Roux MR, Artaza Sanz HM, Dorticós Balea E, Macías Abraham C, et al. Aislamiento de células mononucleares de sangre periférica para trasplante de células madre: Método simplificado. Rev Cubana Hematol Inmunol Hemoter [revista en la Internet]. 2008 Dic [citado 2011 Jun 07]; 24(3): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892008000300004&lng=es
19. Burke FD, Ellis J, McKenna H, Bradley M. Primary care management of carpal tunnel syndrome. Postgrad Med J 2003; 79:433-37 [Internet] [citado: 15 Abril 2009]. Disponible en: http://pmj.bmj.com/cgi/content/full/79/934/433
20. González Roig JL, Cubero Rego L, Santos Arozandia C. Estudios de comparación interna en el diagnóstico electrofisiológico del síndrome del túnel del carpo. Revista Cubana de Medicina Física y Rehabilitación. 2009; 1(2). [revista en Internet] [citado: 15 Abril 2009]. Disponible en: http://bvs.sld.cu/revistas/mfr/mfr109/mfr04109.htm
21. Kimura J. Nerve Conduction studies and electromyography. En: Dyck PJ, Thomas PK. Peripheral neuropathy. 3 ed. New York: WB Saunders; 1993. pp. 1:598-644.
22. MedlinePlus. Velocidad de conducción nerviosa. [Internet] [citado: 5 Abril 2010]. Disponible en: http://www.nlm.nih.gov/medlineplus/spanish/ency/article/003927.htm
23. Lorenzo M. Programa de ejercicios recomendados en la rehabilitación en el síndrome del túnel carpiano. Tribuna Médica. España. [Internet] [citado: 13 Oct 2008]. Disponible en: http://www.ibermutuamur.es/revista_bip_antigua/46/pdf/08_TriMed_bip46.pdf
24. Roel J, Arizo V, Ronda E. Epidemiología del síndrome del túnel carpiano de origen laboral en la provincia de Alicante, 1996-2004. Rev Esp Salud Pública 2006;80(4):395-409 [Internet] [citado: 15 Oct 2008]. Disponible en: http://scielo.isciii.es/pdf/resp/v80n4/10original.pdf
25. Roel J. Las patologías por movimientos y esfuerzos de repetición: Informe para un daño anunciado. [Internet] [citado: 15 Oct 2008]. Disponible en: http://www.istas.ccoo.es/descargas/bajar/Iforo6.pdf
26. De Santolo A. La mano dormida por compresiones nerviosas. Gac Méd Caracas 2005; 113(4):485-99 [Internet] [citado: 13 Oct 2008]. Disponible en: http://www.scielo.org.ve/scielo.php?pid=S0367-47622005000400005&script=sci_arttext
27. American Physical Therapy Association. Lo que usted necesita saber sobre el síndrome del túnel carpiano. Una perspectiva del fisioterapeuta. Alexandría. [Internet] [citado: 4 Mar 2007]. Disponible en: http://www.apta.org/AM/Images/APTAIMAGES/ContentImages/ptandbody /carpaltunnel/CarpalSpainish.pdf
28. Dawson DM, Hallet M, Millender LH, eds. Pathophysiology of nerve entrapment. En: Entrapment Neuropathies. Boston: Litlle, Brown and Co.; 1990. pp. 5-23.
29. Mironow V, Visconti R, Markwald R. What is regenerative medicine? Emergence of applied stem cell and developmental biology. Expert Opin Biol Ther 2004;4(6):773-81.
30. Hernández Ramírez P. Medicina regenerativa II. Aplicaciones, realidad y perspectivas de la terapia celular. Rev Cubana Hematol Inmunol Hemoter [revista en Internet]. 2006; 22(1) [citado 2011 Jun 07]. Disponible en: http://bvs.sld.cu/revistas/hih/vol22_1_06/hih02106.htm
31. Sinden JD, Rashid-Doubell F, Kershaw TR, Nelson A, Chadwick A, Jat PS, et al. Recovery of spatial learning by grafts of a conditionally immortalized hippocampal neuroepithelial cell line into the ischaemia-lesioned hippocampus. Neuroscience 1997 Dec;81(3):599-608.
32. Mendoza Santiesteban E, Rodríguez Loureiro JL, Rodríguez Ávila E. Cirugía del túnel carpiano. Técnica de mínimo acceso. [Internet] [citado: 5 Abril 2010]. Disponible en: http://cencomed.sld.cu/neuro40/originalcarpiano.htm
33. Hernández Ramírez P. Medicina regenerativa y células madre. Mecanismos de acción de las células madre adultas. Rev Cubana Hematol Inmunol Hemoter [revista en la Internet]. 2009 Abr [citado 2011 Jun 07]; 25(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892009000100002&lng=es
Recibido: 28 de septiembre del 2011.
Aprobado: 25 de octubre del 2011.
Dr. Rafael Mena-Pérez. Facultad de Ciencias Médicas "Enrique Cabrera", Altahabana. La Habana, Cuba. Correo electrónico: mena@fcmec.sld.cu Website: http://www.sld.cu/sitios/ihi