Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.28 no.3 Ciudad de la Habana jul.-set. 2012
ARTÍCULO DE REVISIÓN
Espectro funcional de las plaquetas: de la hemostasia a la medicina regenerativa
Platelet Functional spectrum: from Hemostasis to Regenerative Medicine
Dra. Norma Fernández-Delgado, Dr.Cs. Prof. Porfirio Hernández-Ramírez, MSc. Mariela Forrellat-Barrios
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
La aplicación terapéutica de los factores solubles que intervienen en los procesos biológicos es uno de los pilares en que se sustenta la medicina regenerativa. En los últimos años, múltiples investigaciones han mostrado la participación de los factores de crecimiento en la regeneración de diferentes tejidos. Las plaquetas pueden considerarse como una bomba o coctel de biomoléculas, por su contenido en factores de crecimiento que son liberados por los gránulos plaquetarios después de su activación. Desde hace más de 2 decenios, varios investigadores han publicado los beneficios del uso de los factores de crecimiento derivados de las plaquetas en la reparación y regeneración de diferentes tejidos, pero en los años recientes su uso se ha extendido con el empleo de diferentes métodos para su obtención y la utilización, tanto de plaquetas antólogas, como alogénicas. El procedimiento para su obtención es fácil, rápido y económico y los resultados referidos en la mayoría de las publicaciones son alentadores, sin que se hayan comunicado reacciones adversas.
Palabras clave: plaquetas, plasma rico en plaquetas, medicina regenerativa, factores de crecimiento, factores solubles.
ABSTRACT
One of the fundamental basis of regenerative medicine is the therapeutic application of soluble factors involved in biological processes. In recent years, many investigations have shown the involvement of growth factors in the regeneration of different tissues. Platelets can be considered as biological pump or cocktail, due to their content in growth factors which are released by the platelet granules upon activation. For more than two decades, several researchers have reported the benefits of the use of growth factors derived from platelets in the repair and regeneration of different tissues, but in recent years its use has been extended with the employment of different methods for their collection in both, autologous and allogeneic platelets. The procedure for obtaining platelet factor is easy, quick and inexpensive and the results reported in most publications are encouraging, without any reported adverse reactions.
Key words: platelets, platelet rich plasma, regenerative medicine, growth factors, soluble factors.
INTRODUCCIÓN
Las plaquetas son elementos sanguíneos anucleados derivados de la fragmentación de sus células precursoras: los megacariocitos. Tienen forma de disco biconvexo de 2-3 µm de diámetro, su concentración normal en sangre periférica es de 150 a 400 x 109/L y su vida media es de entre 7 y 10 días.1,2
Las características estructurales y funcionales de las plaquetas han sido un tema de gran interés científico, el que se ha mantenido con el paso de los años y que ha permitido adquirir progresivamente nuevos conocimientos sobre estos importantes elementos sanguíneos.
De los 3 elementos formes de la sangre, las plaquetas fueron las últimas en ser descubiertas; su identificación se atribuye al médico francés Alfred Donne, en 1842. Un análisis histórico hecho recientemente señala que el anatomista alemán Max Schultze confirmó la existencia de las plaquetas y fue el primero en hacer su descripción.3,4
Con posterioridad, los trabajos del médico francés George Hayem en 1878 y del patólogo italiano Giulio Bizzorero en 1882, aportaron más información sobre estos elementos. Sin embargo, las ideas de Hayem sobre el origen y desarrollo de las plaquetas estaban equivocadas, pues pensaba que contenían hemoglobina y eran precursoras de los hematíes. Bizzorero llamó piastrine, pequeñas placas, a estos nuevos corpúsculos identificados, que posteriormente fueron denominados plaquettes en francés, platelets en inglés y consecuentemente, plaquetas en español. Él los describió como unas "esférulas" menores que los hematíes, las que en ocasiones aparecían como agregados y podían participar en la formación de un material fibroso; además, demostró que estas estructuras no tenían núcleo ni contenían hemoglobina, como había pensado Hayem. La continuación de sus estudios logró aportar valiosa información sobre su intervención en el proceso de la coagulación sanguínea.4,5
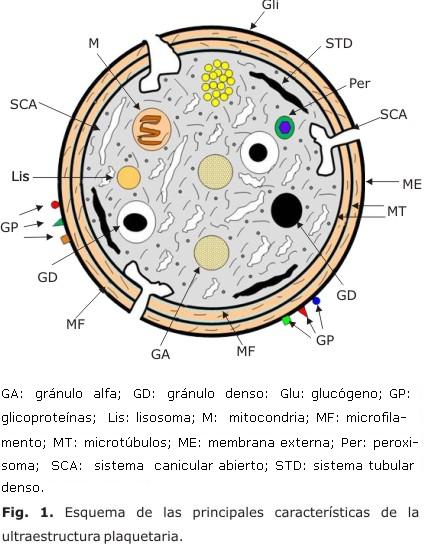
El estudio de la morfología de las plaquetas se facilitó con la aplicación de la microscopía óptica, pero los mayores avances se obtuvieron tiempo después con la introducción de la microscopía electrónica, fundamentalmente la de transmisión, que permitió una mejor caracterización de la estructura plaquetaria (fig. 1). El conocimiento de los elementos ultraestructurales visualizados en las plaquetas ha dado la posibilidad de correlacionarlos con algunas de sus funciones e ir descubriendo progresivamente el secretoma plaquetario.1
La membrana externa que recubre las plaquetas se ha llamado glicocáliz, por su riqueza en glicoproteínas, tanto derivadas de la propia membrana como adsorbidas del plasma. Debajo de esta membrana hay una banda circundante de microtúbulos, que entre otras funciones tiene la de contribuir a estabilizar la estructura normal. En la zona periférica externa submembranosa y mediante el empleo de algunas coloraciones especiales, se pueden ver en las plaquetas en reposo, algunos microfilamentos de actina.1
Entre las estructuras membranosas también se incluye el sistema canalicular abierto, que se comunica directamente con el exterior y por donde se emite la secreción de los productos solubles plaquetarios. Con frecuencia, cerca de este sistema se puede ver el sistema tubular denso, estructura membranosa en la que se desarrolla el metabolismo intraplaquetario del ácido araquidónico.
En el citosol de las plaquetas se pueden identificar distintos tipos de inclusiones, entre ellas, los gránulos alfa y los densos. Los primeros son estructuras grandes, ricas en macromoléculas, constituyen el 15 % del volumen total de la plaqueta; además, contienen glicoproteínas y moléculas de adhesión. Tienen una participación importante en la interacción entre las plaquetas y son determinantes en la función plaquetaria. La liberación de su contenido permite también su participación en la interacción con otras células y en los mecanismos de la regeneración hística 1,2
Los gránulos densos son estructuras con una zona periférica electro-clara que con frecuencia les da una imagen que algunos han llamado "ojos de buey". Estos gránulos tienen un elevado contenido de calcio y fósforo inorgánico, lo que les confiere una alta densidad electrónica. También contienen ADP, ATP y serotonina.6
En el interior de las plaquetas se pueden identificar, además, gránulos de glucógeno, mitocondrias y ocasionalmente lisosomas y peroxisomas. Estos últimos tienen una morfología heterogénea y en ocasiones puede observase en su interior una formación poliédrica secundaria a la cristalización de proteínas. Durante el proceso de la activación plaquetaria se secretan todas las sustancias granulares.1,6
Diversas han sido las investigaciones que se han realizado sobre la estructura y el funcionamiento de las plaquetas, actividad que ha adquirido un gran impulso en los últimos años, no solo porque son factores fundamentales en la cascada de eventos que participan en la hemostasia, sino también porque se ha ido conociendo cada vez más profundamente que estas constituyen una importantísima fuente de factores bioactivos que intervienen de forma destacada en la regeneración y reparación de distintos tejidos del organismo.
La participación de las plaquetas en los diferentes procesos de la hemostasia depende de 3 eventos fundamentales: la adhesión plaquetaria, el cambio de forma y la agregación plaquetaria.1,6 Se ha planteado que las plaquetas proporcionan, en cuestión de segundos, la primera respuesta celular del organismo después que se produce la ruptura de la integridad vascular, lesión de algún tejido o de ambos elementos. De esta forma, ellas pueden recubrir y sellar cualquier tipo de estas lesiones e iniciar por un mecanismo extra hemostático el proceso de curación de los sitios dañados.
Las plaquetas contienen múltiples proteínas que ejercen acciones sobre diferentes aspectos de la reparación tisular. Actualmente, son consideradas como una bomba o coctel de moléculas bioactivas (factores de crecimiento, citocinas, quimiocinas y otras moléculas, incluso algunas aún no descritas) y proteínas en proporciones fisiológicas. La hipótesis de que los factores solubles liberados por las células madre implantadas con fines regenerativos desempeñan una acción importante en la reparación y regeneración de los tejidos y las ventajas del uso de las plaquetas como fuente de FC, han sido señaladas en los últimos años.7-9
Como la función de las plaquetas en el mecanismo hemostático es bien conocida, el objetivo fundamental de este artículo es exponer el estado actual de la utilización de las plaquetas en medicina regenerativa, sus indicaciones y aplicaciones potenciales.
FACTORES DE CRECIMIENTO
Uno de los pilares que sustenta la medicina regenerativa es la utilización de los factores solubles que intervienen en los procesos biológicos. Múltiples investigaciones han mostrado la participación de los factores de crecimiento en la regeneración de diferentes tejidos y las plaquetas contienen una gran cantidad de factores de crecimiento (FC), que son liberados por los gránulos plaquetarios después de su activación.
Los FC son fragmentos proteicos con actividad biológica pertenecientes al grupo de las citocinas, cuyas funciones son estimular la proliferación mediante la regulación de las mitosis del ciclo celular, mantener la supervivencia y estimular la migración, diferenciación e incluso, la apoptosis de las células. Además, la producción de sustancias extracelulares regula el mantenimiento de la estabilidad del organismo y la reparación de los tejidos. Son sintetizados por células de todos los tejidos, pero se encuentran en mayor proporción en las plaquetas, los macrófagos y entre las proteínas plasmáticas. Tienen un mecanismo de acción similar y requieren de receptores específicos para interactuar con otras células. Actualmente se sabe que muchos de los FC son multifuncionales.
Los FC desempeñan su función a muy bajas concentraciones, en el orden de los picogramos. Ejercen su acción a través de la unión con receptores de la membrana celular. Las proteín-cinasas a las que se unen sufren una fosforilación y desencadenan así un sistema de transducción de señales que termina con la expresión de uno o más genes, que posteriormente cambian las características de la propia célula.8-10
Desde hace más de 10 años, algunos estudios comunicaron el incremento del crecimiento de tejidos en cultivos cuando se adicionaban plaquetas. Con posterioridad, resultados satisfactorios con el empleo del plasma rico en plaquetas (PRP) o el lisado plaquetario (LP) en diferentes especialidades, apoyan el criterio de la regeneración de tejidos por los FC y el resto de los factores solubles presentes en las plaquetas, nombrados por la mayoría de los investigadores como factores de crecimiento plaquetarios (FCP).11-17 Hasta donde conocemos, el primer trabajo que demostró la efectividad del uso de las plaquetas en úlceras cutáneas crónicas fue publicado en 1986 y en la década de los 90 del pasado siglo, su empleo se extendió a ortopedia y cirugía maxilofacial.18,19
Al producirse la activación plaquetaria y después de un fuerte estímulo, los gránulos se alargan y sufren una transformación estructural que propicia la liberación de su contenido al exterior. Los gránulos plaquetarios alfa contienen un número importante de moléculas bioactivas (proteínas adhesivas, factores de la coagulación, proteasas y antiproteasas, citocinas, quimiocinas, proteínas antimicrobianas, glicoproteínas de membrana, condroitina, albúmina, inmunoglobulinas y otras proteínas básicas como el factor 4 plaquetario, la btromboglobulina y endostatinas), que le confieren diferentes actividades biológicas. Entre ellas se encuentra la mayor cantidad de los FCP,1,6,7,16 los más conocidos y su actividad biológica se muestran en la tabla 1. Otros factores de crecimiento y sustancias biológicamente activas presentes en las plaquetas incluyen el FC del tejido conectivo, el FC gránulo-monocitario, el factor de necrosis tumoral alfa, el FC epitelial, FC de queratinocitos, FC del hepatocito, el factor derivado de la célula estromal (SDF-1, del inglés stromal cell derived factor 1), también conocido como CXCL12, la interleucina 1B, la interleucina 8 y otros que ya suman más de 60 y que pueden intervenir en la promoción de la proliferación y reclutamiento celular.16,17,20-22
Tabla 1. Principales factores de crecimiento plaquetarios
| Molécula bioactiva | Actividad biológica |
| Factor de crecimiento derivado de las plaquetas (FCDP) | - Potente mitógeno para fibroblastos, células musculares lisas arteriales, condrocitos, células epiteliales y endoteliales - Efecto quimiotáctico potente para células hematopoyéticas, mesenquimales, musculares y fibroblastos - Estimula quimiotaxis y activación de los macrófagos - Activa el factor transformante del crecimiento b para estimular macrófagos y neutrófilos - Síntesis de colágeno tipo I - Angiogénesis (por vía indirecta) |
| Factor de crecimiento endotelial vascular (FCEV) | - Estimula proliferación de las células del endotelio macrovascular - Potente angiogénico - Induce síntesis de metaloproteínas que degradan el colágeno insterticial |
| Factor de crecimiento transformante beta (FCTb) | - Estimula quimiotaxis fibroblástica, proliferación y síntesis de colágeno - Inhibe la formación de osteoclastos y la reabsorción ósea - Disminución de cicatriz dérmica - Inhibidor del crecimiento de los fibroblastos, células epiteliales, endoteliales, neuronales, algunos tipos de células hematopoyéticas y queratinocitos - Antagonista de la actividad biológica del FCE, el FCDP y el FCFa - Favorece angiogénesis |
| Factor de crecimiento parecido a la insulina tipos I y II (FCI-I y FCI-II) | - Crecimiento de fibroblastos - Mitogénesis y diferenciación de células mesenquimales y de revestimiento - Mitogénico ïn vitro para algunas células mesodérmicas - Promueve síntesis de colágeno y prostaglandina E2 en fibroblastos - Estimula colágeno y síntesis de la matriz por células óseas regulando el metabolismo del cartílago articular. |
| Factor de crecimiento fibroblástico ácido y básico (FCFa y FCFb) | FCFa: participa en la proliferación y diferenciación de osteoblastos e inhibición de osteoclastos - Favorece angiogénesis y migración celular - Mitógeno para queratinocitos derivados de piel, fibroblastos dérmicos y células endoteliales vasculares FCFb: estimula el crecimiento de fibroblastos, mioblastos, osteoblastos, células neuronales, endoteliales, queratinocitos y condorcitos - Aumenta producción de fibronectina - Estimula angiogénesis, proliferación de células endoteliales y síntesis de colágeno - Síntesis de matriz. Epitelización y producción de FC de queratinocitos y retracción de heridas |
| Factor de crecimiento epidérmico (FCE) | - Función mitogénica (proliferación, diferenciación y migración) de células epidérmicas, epiteliales, fibroblastos, células embrionarias. Además, células nasales, gliales a partir de células mesenquimales - Quimiotáctica de fibroblastos y células epiteliales - Estimula re-epitelización - Incrementa angiogénesis - Influye en la síntesis y renovación de la matriz extracelular - Proapoptósico |
El SDF-1 ejerce una poderosa quimioatracción de las células madre/progenitoras, específicamente de las CD34+, que expresan la molécula CXCR4 que es el receptor de este factor. De esta forma, las plaquetas adheridas a las paredes vasculares dañadas actúan como guía de las células madre/progenitoras circulantes CXCR4+ que por quimiotropismo positivo pueden llegar a los tejidos diana y allí integrarse al microambiente local y transdiferenciarse en células maduras de esos tejidos o fusionarse con ellas para contribuir a su regeneración; además, también liberan un número importante de moléculas bioactivas con acción paracrina sobre las células circundantes.1,22,23
La liberación de los FCP es desencadenada por la activación de las plaquetas, la que se puede lograr con la utilización de algunas sustancias como la trombina, el cloruro de calcio, el colágeno y el adenosín 5c-difosfato. Estas sustancias contribuyen a la formación de un coágulo o gel de plaquetas y su formación depende fundamentalmente de la activación del fibrinógeno y la formación de fibrina, y en menor proporción, del número de plaquetas de la muestra obtenida.7,16 Para su empleo tópico como fuente de factores, las sustancias deben agregarse PRP momentos antes de su aplicación.
MECANISMO DE ACCIÓN DE LOS FCP7,8,15,16,20,24-27
La combinación de los FC existentes en las plaquetas con otros de sus componentes bioactivos es idónea para lograr la regeneración de diferentes tejidos. Además, estos actúan sinérgicamente con los factores presentes en el plasma para activar una compleja cadena de funciones autocrinas que modulan la cicatrización. Las proteínas secretadas por las plaquetas ejercen múltiples acciones sobre diferentes aspectos de la reparación tisular, entre ellos, estimulan la mitosis, la quimiotaxis, la angiogénesis, así como el crecimiento y mineralización ósea, con una acción esencial en la migración, diferenciación y proliferación celular.
Las plaquetas inician la secreción 10 minutos después ser activadas, y en un período de una hora se libera más del 95 % de su contenido. Después de la liberación inicial, la síntesis y secreción de los FCP y el resto de las biomoléculas se mantiene por 5 a 10 días. La regeneración se realiza a través de las múltiples acciones que ejercen los FC y el resto de las proteínas contenidas en el PRP.
Cuando la acción de las plaquetas comienza a disminuir, la regulación de la reparación tisular es asumida por los macrófagos ya presentes en el tejido mediante la secreción de sus propios factores.
Clásicamente se ha planteado que las plaquetas son estáticas e incapaces de moverse después que se han adherido a un sitio vascular. Sin embargo, estudios recientes han mostrado que ellas pueden migrar sobre una superficie y trasmigrar a través de una membrana permeable y del endotelio hacia una fuente de SDF-1, acción que puede contribuir a su participación en la actividad regenerativa.
El efecto modulador de la respuesta inflamatoria y la acción antimicrobiana en el sitio de la aplicación ejercida por la aplicación del PRP, también ha sido reportado por diferentes investigadores.
Las plaquetas también secretan factores angiogénicos, proinflamatorios y antiinflamatorios. Ellas pueden interactuar directamente con virus, bacterias, hongos y protozoos mediante proteínas con propiedades microbicidas directas que intervienen significativamente en la defensa contra microorganismos patógenos. Entre ellas, se encuentran los péptidos llamados trombocidinas, que poseen actividad antibacteriana y antimicótica.
¿QUÉ ES EL PRP?
El PRP es una fracción del plasma con una concentración plaquetaria superior a la basal que se obtiene tras una centrifugación. La concentración plaquetaria de esta fracción es 3 a 8 veces la concentración fisiológica basal, lo que es ideal para asegurar un aporte óptimo de FC.7,21,22,28,29
Las preparaciones disponibles de PRP generalmente contiene entre 240 y 360 x 109 plaquetas suspendidas en 200 a 350 mL de plasma. Si las plaquetas son obtenidas por aféresis, contienen entre 200 y 400 x 109 plaquetas en 200 a 300 mL de plasma de un solo donante. Los índices de calidad apuntan a que estos preparados deben contener una cantidad de eritrocitos inferior a 3 x 109 y de leucocitos menor de 1 x 10.11,28
En la medicina regenerativa habitualmente no se requiere un gran volumen de PRP y las preparaciones se realizan usualmente extrayendo alrededor de 50 mL de sangre a la que se le añade citrato de sodio como solución anticoagulante y posteriormente esa sangre se centrifuga.
El procedimiento de centrifugación puede ser simple o doble. La centrifugación simple se realiza a 280 g durante 7 minutos para algunos, y a 160 g por 10 minutos para otros.30,31
Con el objetivo de incrementar la concentración plaquetaria, algunos autores recomiendan la centrifugación doble, la que puede realizarse a continuación de la primera a 400 g o realizar 2 centrifugaciones a 200 g por 10 minutos.30,32 Como resultado se obtiene una cantidad de plasma que puede dividirse en 3 porciones: la superior que contiene fibrinógeno y poca cantidad de plaquetas, que se denomina plasma pobre en plaquetas; una fracción intermedia; y una fracción inferior, que es el PRP. En dependencia del volumen requerido, las fracciones media e inferior son empleadas en la terapéutica.29,31 (Fig. 2).
La forma de presentación de las plaquetas para su aplicación terapéutica puede ser como PRP, concentrado de plaquetas obtenidas por aféresis, gel de plaquetas o como lisado plaquetario. Las 2 primeras presentaciones se obtienen según los procederes convencionales usados en los bancos de sangre.
El gel de plaquetas se prepara habitualmente concentrando las plaquetas y añadiéndoles después un agente activador para que se forme un coágulo, se activen las plaquetas y se liberen sus productos bioactivos. En este método se ha observado que el porcentaje de liberación está directamente relacionado con la concentración de la sustancia coagulante añadida.33-35
En la preparación del lisado, la desintegración plaquetaria se logra mediante crioconservación de las plaquetas entre 20 ºC y -80 ºC durante más de 1 hora y su descongelación posterior a temperatura ambiente momentos antes de su aplicación. Se ha planteado que cuando se realizan varios ciclos de congelación-descongelación ocurre una mayor liberación de las sustancias. Algunos autores han repetido estos ciclos de 6-12 veces, pero esta no es una conducta general. Lo más frecuente es emplear 3 ciclos, con lo que se puede conseguir el 100 % de liberación de las proteínas bioactivas. El lisado plaquetario es equivalente a una activación inmediata y permite la conservación de las plaquetas durante un tiempo más prolongado.24,36-38
El proceso de obtención del lisado varía de acuerdo con los diferentes investigadores. Así, para la congelación se han usado distintas temperaturas: -20 oC, -40 oC, -80 oC y hasta la introducción de la muestra en nitrógeno líquido durante un minuto. Después del tiempo de congelación fijado se procede a la descongelación en pocos minutos, la que se puede conseguir en solo 6 minutos con el empleo de un baño María.36,37 El lisado se puede centrifugar después para remover los desechos de las membranas rotas y el sobrenadante se recoge y se conserva, frecuentemente dividido en alícuotas, a -20 oC hasta su uso.
¿PLAQUETAS AUTÓLOGAS O ALOGÉNICAS?
Las plaquetas autólogas, por tratarse de un producto del propio paciente, no tienen efectos secundarios, reacciones inmunoalérgicas, ni transmisión de enfermedades. Además, permiten la utilización de los FC y otras sustancias biológicas del propio individuo. La extracción de sangre es proporcional a la cantidad necesaria de PRP, por lo que no hay afectación de la volemia del paciente. Se ha demostrado que reducen notablemente el tiempo de recuperación de fracturas, lesiones musculares, heridas, úlceras e intervenciones quirúrgicas de todo tipo. Por ello son las ideales para su uso clínico siempre que las condiciones del paciente lo permitan. También se ha comunicado la utilización de plaquetas autólogas lisadas, o bien mezcladas con un soporte cremoso vitaminado.21,39
La utilización de plaquetas alogénicas isogrupo ABO procedentes de los servicios de transfusiones, que mantienen la seguridad actual en la práctica pretransfusional, ha sido una modalidad empleada en la medicina regenerativa que permite el uso de plaquetas que hemostáticamente han disminuido su acción, pero que conservan su capacidad de secretar FCP y otros materiales bioactivos. Esto permitiría aprovechar un producto hasta hoy desechado.15,40,41
La aplicación de las plaquetas alogénicas puede ser considerada en situaciones de urgencia y cuando el paciente tiene alguna limitación o imposibilidad para la extracción de la sangre.29 Su desventaja fundamental es la posibilidad aún latente de transmisión de enfermedades, ya que por su modo de aplicación, generalmente local, las reacciones alérgicas tienen menos posibilidad de presentarse.
Actualmente algunas investigaciones han planteado la utilización de un gel de plaquetas obtenidas de sangre de cordón umbilical,9 y también una mezcla de plaquetas isogrupo que se divide en alícuotas pequeñas para su utilización tópica, que pueden ser conservadas hasta 6 meses a -80 ºC.29
Por todo lo anterior, la utilización de las plaquetas, fundamentalmente el PRP, ha demostrado tener efecto en diferentes tejidos y sus aplicaciones potenciales incluyen: regeneración ósea, estabilización de injertos, cierre de heridas (aproximación de colgajos), cicatrización de heridas (regeneración de tejidos blandos), osteointegración (útil en implantología) y mantienen parte de su acción en la hemostasia (detención del sangrado capilar y de potenciales hematomas).
Ante este conjunto de acciones extrahemostáticas puede decirse, en sentido figurado, que la llegada de las plaquetas a los sitios dañados pudiera considerarse como el arribo de enfermeras con los "primeros auxilios" para el apoyo a la regeneración, a lo que se podría añadir que también contribuyen a la formación de "una cabeza de playa" a la que acuden las diferentes células que directa o indirectamente participan en la reparación y regeneración de los tejidos lesionados.
Estas acciones extrahemostáticas han favorecido que en las últimas décadas el uso de las plaquetas se haya extendido en diferentes campos de la medicina.20-22,25,28,29,37,42-44 (Tabla 2).
Tabla 2. Aplicaciones clínicas de los factores de crecimiento plaquetarios
| Especialidad | Indicaciones |
| Ortopedia15,16,19,21,25,44-47 | - Osteoartrosis - Fascitis plantar - Defectos óseos - Inserciones óseas - Tendinitis y peritendinitis - Epicondilitis - Pseudoartrosis - Lesiones de ligamentos - Rupturas de meniscos - Lesiones musculares - Artrodesis de cuerpos vertebrales - Retraso de la consolidación de fracturas |
| Estomatología y cirugía maxilofacial12,14,29,31,48,49 | - Defectos periodontales (retracción gingival y otros) - Endodoncia - Regeneración alveolar - Cirugía dentoalveolar - Como adhesivo tisular - Implantología - Comunicaciones buconasales - Relleno de defectos óseos - Prevención de la alveolitis seca después de la exodoncia de terceros molares |
| Dermatología13,24,36,40,41,60 | - Cicatrización epitelial - Úlceras crónicas - Úlceras de decúbito. Escaras |
| Angiología7,11,13,40,50-52 | - Pie diabético - Úlceras vasculares - Insuficiencia arterial periférica |
| Cirugía estética7,17,19,29,42,43 | - Elevación de tejidos faciales - Ritidectomías - Blefaroplastias - Rejuvenecimiento facial - Reconstrucción mamaria |
| Oftalmología37,52-54 | - Lesiones de córnea - Ojo seco grave - Síndrome de disfunción de la superficie ocular tras cirugía refractiva - LASIK - Quemaduras oculares - Queratoconjuntivitis bacteriana - Queratitis recurrente. - Síndrome de Sjögren - Enfermedad injerto contra huésped oftálmica severa post trasplante de médula ósea |
| Medicina deportiva47 | - Lesiones de tendones y ligamentos - Lesiones musculares por sobre uso - Lesiones articulares |
| Otras7,15,20,29,39,46,54,56,60 | - Cicatrización de heridas - Pérdidas de tejidos blandos por traumas - Regeneración de tejido mamario post cirugía - Adhesivo tisular biológico - Quemaduras - Cierre de la pared torácica en cirugía cardiovascular |
ALGUNAS DE LAS INDICACIONES CLÍNICAS DE LAS PLAQUETAS
La hipótesis del efecto positivo del PRP en la regeneración y mineralización ósea ha sido la base de su aplicación en ortopedia, fundamentalmente en la consolidación de fracturas y en la implantología ósea. Se ha comunicado la formación de unión sólida en pacientes con fracturas de difícil consolidación. También se ha empleado en ruptura e inflamación de tendones y ligamentos, en pseudoartrosis y en función de la aceleración de la regeneración ósea.15,16,19,21,25,44,45 Recientemente en Cuba, en el Hospital General Docente "Roberto Rodríguez", de Morón, se observó acortamiento del período de consolidación ósea en pacientes con injertos óseos y sin estos; además, se trataron pacientes con pseudoartrosis, osteomielitis, fracturas de huesos largos y traumas raquimedulares. En todos los casos se usaron preparaciones plaquetarias.46
Las lesiones de tendones y ligamentos, así como las lesiones musculares, también se encuentran entre las beneficiadas, sobre todo en las lesiones por sobreuso en medicina deportiva, cuyas experiencias preliminares exponen resultados prometedores en esta esfera.47
Las especialidades de estomatología y cirugía maxilofacial han empleado ampliamente las plaquetas en diferentes afecciones; entre ellas se destacan los defectos periodontales y la adición de plaquetas a aloinjertos, y se comunica reducción del período de curación.12,19,29 Recientemente se ha planteado su uso en endodoncia y en el tratamiento de fisuras nasopalatinas junto con el injerto óseo autólogo en pacientes con antecedentes de paladar hendido.48,49
En cirugía estética se han comunicado menos edemas y dolor en las primeras 72 horas y una mejor hemostasia cuando se emplea el PRP. Se ha empleado con éxito en la resección de arrugas (ritides), conocida como ritidectomía o ridectomía. La utilidad de este tratamiento como adhesivo tisular es bien reconocida, donde se plantea que actúa como membrana biológica.7,29,42,43
En la rama de angiología mantienen su aplicación en las úlceras vasculares crónicas, como las del pie diabético, las venosas, las de presión y las mixtas.13,36,42,43,50 En en el Hospital General Docente «Enrique Cabrera» de La Habana, se ha empleado con resultados satisfactorios en el tratamiento del pie diabético y en los pacientes con claudicación por ateroesclerosis obliterante grado IIb de la clasificación de Fontaine, que mostraron evidencia de mejoría clínica en el total de los casos tratados. En el pie diabético, la aplicación intralesional de plaquetas a pacientes con lesiones mayores de 1 cm2 provocó mejoría clínica e histológica de la lesión.51,52 En el Hospital General Docente "Comandante Pinares" de la provincia de Artemisa, también se han comunicado resultados satisfactorios con la aplicación local de lisado plaquetario en pacientes con úlceras posflebíticas (datos no publicados).
En las últimas 2 décadas se ha incrementado progresivamente el uso de los FCP en la epitelización de la córnea, bien sea en forma de gel o colirio. Se considera esta terapéutica como una herramienta viable y efectiva para favorecer la epitelización en enfermedades de la superficie ocular. Recientemente se ha empleado en el tratamiento de úlceras latentes, en el síndrome del ojo seco severo o moderado, en la lesión secundaria a la queratomileusis in situ (en inglés LASIK) y en la reconstrucción de la superficie corneal asociada con fallo del injerto postrasplante de membrana amniótica o enfermedad injerto contra huésped oftálmica severa postrasplante de médula ósea.37,53,54
También se ha comunicado el uso de de las plaquetas en quemaduras, artrodesis de cuerpos vertebrales y en la cirugía de revascularización coronaria (torácica y venosa), donde se redujeron considerablemente las complicaciones posquirúrgicas como la infección y el drenaje en los sitios quirúrgicos.55,56
OTROS USOS DE LOS FCP
Al nivel de laboratorio, se han usado como un método práctico y eficaz para la sustitución de sueros de procedencia animal para el cultivo de células, por ejemplo, de las mesenquimales, en que habitualmente se han usado productos como el suero fetal bovino o el suero de bovino recién nacido, ya que el suero humano no aporta todos los elementos necesarios para el crecimiento y expansión in vitro de las células cultivadas. En estos cultivos libres de suero animal, las plaquetas han probado su seguridad y efectividad, usadas como PRP o como lisados plaquetarios.57,58
También se ha señalado recientemente la utilidad del PRP como soporte biológico de células estromales extraídas de la médula ósea y su posible uso en la terapia celular para la regeneración del sistema nervioso.59
Algunos trabajos experimentales llevados a cabo en diferentes modelos animales con lesiones óseas, musculares o tendinosas, han planteado que la aplicación de las plaquetas in situ ha favorecido la regeneración de los sitios afectados. Por otra parte, este tipo de tratamiento se ha introducido en la medicina veterinaria con resultados muy favorables. Se ha destacado la rápida y positiva respuesta obtenida en el tratamiento de gonartrosis femoro-tibiales avanzadas y refractarias en caballos deportivos y se ha comentado que esto apoya fuertemente la acción regenerativa de las plaquetas, pues en los animales se puede excluir el efecto placebo, que siempre se puede sospechar en los humanos.60
CONSIDERACIONES ACERCA DEL USO CLÍNICO DE LA PLAQUETAS
En la bibliografía revisada no se encontró ninguna comunicación ni referencia relacionada con la existencia de efectos adversos atribuidos a la utilización de las plaquetas en medicina regenerativa. No obstante, son prudentes algunas recomendaciones sobre su extracción y aplicaciones.
Las plaquetas autólogas no deben ser obtenidas de pacientes con trombocitopenia de cualquier causa, en el embarazo, en casos con disfunción plaquetaria o con estados de hipercoagulabilidad.60
Una acción desfavorable atribuida a las plaquetas es su vinculación con las células tumorales como promotores en la carcinogénesis. Se ha señalado que cuando pasan a la circulación células desprendidas de un tumor, se pueden formar agregados de células tumorales y plaquetas que las recubren y facilitarían la evasión del sistema inmune, la extravasación de las células malignas y su asentamiento en tejidos normales con el desarrollo de metástasis. Además se ha planteado que pueden facilitar el crecimiento tumoral mediante la liberación de factores estimuladores y particularmente por su actividad angiogénica.19,22,30,31 Esta posible acción es evitable excluyendo de los ensayos clínicos con FCP a pacientes con tumores malignos activos o existentes algunos años atrás, así como a pacientes con trastornos mieloproliferativos crónicos, de forma semejante a como se está haciendo en los protocolos terapéuticos en que se usan células madre adultas.
Además, se recomienda realizar un buen interrogatorio para detectar el uso de medicamentos que alteran la función plaquetaria, como el ácido acetil salicílico, el clopidogrel, la ticlopidina u otros con función similar, pues su uso podría disminuir la liberación de los factores solubles por los gránulos plaquetarios.
La producción de FC específicos, particularmente los recombinantes, tiene un elevado costo económico y además son necesarias dosis repetidas para conseguir el efecto terapéutico deseado.61
Como se ha comentado, la aplicación de las plaquetas en sus diferentes formas de preparación, representa una terapéutica biológica muy prometedora que aporta una nueva opción para el tratamiento de diferentes situaciones médicas, como las antes indicadas, u otras que se puedan beneficiar de este método. Se ha referido que el tratamiento con plaquetas es mucho más práctico, simple y fisiológico que cuando se usa un factor de crecimiento individual recombinante, pues con ellas, igual que con la aplicación de células madre adultas, se administra un "coctel" balanceado de múltiples moléculas bioactivas que interactúan en una cascada fisiológica de eventos que tiene una mayor similitud con el proceso de curación y regeneración hística natural. A esto se añade que por ser factores que generalmente proceden del propio paciente, se elimina el riesgo de hipersensibilidad que puede ocurrir con un producto farmacéutico y también se disminuyen los costos del tratamiento.
La exploración de nuevos campos de aplicación constituye un importante reto para el uso de los componentes plaquetarios. También se abren perspectivas para su asociación con el empleo de células madre62 o en una combinación en que se incluya la ingeniería de tejidos, particularmente in vitro. Estos procederes pueden representar métodos muy promisorios en el campo de la medicina regenerativa. La asociación plaquetas/células madre adultas autólogas procedentes de la médula ósea, pudiera ser muy beneficiosa y práctica, pues aparte de aportar elementos del propio paciente, añade un conjunto de células madre existentes en la médula ósea que pueden interactuar de forma favorable. De acuerdo con la acción paracrina inmediata de las plaquetas y de las células madre implantadas, puede lograrse un rápido efecto clínico y funcional, al que se añadiría más tarde la posibilidad de formación en el tejido dañado, de nuevas células funcionales secundarias a la transdiferenciación, fusión con las células del tejido huésped o por ambos mecanismos, que pueden ejercer las células madre adultas. Esta conducta pudiera constituir un tratamiento "rapilento" que sumaría los beneficios a corto y largo plazo.
REFERENCIAS BIBLIOGRÁFICAS
1. Lichtman MA, Beutler E, Kipps TJ, Seligsohn V, Kaushansky K, Prchal JT. Platelet morphology biochemistry and function. En: Williams Hematology. 7th ed. New York: McGraw Hill Medical Co.; 2007.
2. Campbell NA. Biology. 8th ed. London: Pearson Education; 2008. p. 912.
3. Donné A. De l'origine des globules du sang de leur mode de formation et leur fin. Compt Rend Acad Sci. 1842;14:3668.
4. Cañizares Proaño C. Las plaquetas. Su morfología, fisiología y patología. Consideraciones sobre las enfermedades hemorrágicas y trombóticas. 2da ed. Quito: Fundacyt; 1997.
5. Brewer DB. Mark Schultze (1865). G Bizzorero (1882) and the discovery of the platelet. Br J Haematol. 2006;133(3):2518.
6. Kerstin J, Kehrel BE. Platelets: physiology and biochemistry. Semin Thromb Hemost. 2005;31(4):381-92.
7. Montón-Echeverría J, Pérez-Redondo S, GómezBajo GJ. Experiencia clínica en el empleo de factores de crecimientos autólogos obtenidos de plasma rico en plaquetas. Cir Plast Iberolatinoam. 2007;33(3):155-61.
8. Hernández Ramírez P. Medicina regenerativa y células madre. Mecanismos de acción de las células madre. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet]. 2009 Abr; 25(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892009000100002&lng=es&nrm=iso&tlng=es
9. Parazzi V, Lazzari L, Rebulla P. Platelet gel from cord blood: a novel tool for tissue engineering. Platelets. 2010:21(7) 54954.
10. Wikipedia. Factor de crecimiento (visitada 04-08-2011 y actualizada 20-07-2011) Disponible en: http://es.Wikipedia.org/wiki/Factores_de_crecimiento
11. Weiser L. Bhargava M, Attia E, Torzilli PA. Effect of serum and platelet-derived growth factor on chondrocytes grown in collagen gels. Tissue Eng. 1999;5:533-44.
12. Ouyang XY, Qiao J. Effect of platelet-rich plasma in the treatment of periodontal intrabony defects in human. Chin Med J. (Engl) 2006;119(18):1511-21.
13. Martí -Mestre FX, Acosta-Gómez M, Bonell-Pascual A, Linares-Ruiz P, Romera A, Yñíguez-Navas C, et al. Resultados preliminaries de la aplicación de factores de crecimiento en el tratamiento de las úlceras vasculares. Angiología. 2005;57(4):335-43.
14. Whitman DH, Berry RL, Green DM. Platelet gel: an autologous alternative to fibrin blue with applcations in oral and maxillofacial surgery. J Oral Maxillofac Surg. 1997:55:1294-8.
15. Balbo R, Avonto I, Marenchino D, Maddalena L, Menardi G, Peano G. Platelet gel for the treatment of traumatic loss of finger substance. Blood Transfus. 2010;8(4):255-9.
16. Orozco- Delclós L. Nuevas aplicaciones clínicas del plasma rico en plaquetas en patologías musculoesqueléticas. Conferencia dictada en la Facultad de Medicina de la Universidad Nacional Autónoma de México en el Symposium: Células Madre: del laboratorio a la Clínica. 2006. Disponible en: http://www.google.com.cu/url?sa=t&rct=j&q=Orozco+Delclos+L%2C+2006&source=
web&cd=3&ved=0CDEQFjAC&url=http%3A%2F%2Fwww.itrt.es%2Fincludes%2Fdownload.asp%3Ff%3D93%26v%3D0&ei=fLBDT9K_FoTs0gGWxJiCCQ&usg=AFQjCNF7mG7sMmOq4nWpq5IZYg0TGDLWQg
17. Eppley BL, Pietrzak WS, Blanton M. Platelet-rich plasma: a review of biology and applications in plastic surgery. Plast Reconstr Surg. 2006;118(6):147e-59e.
18. Knighton DR, Ciresi KF, Fiegel VD, Austin LL, Butler EL. Classification and treatment of chronic nonhealing wounds. Successful treatment with autologous platelet-derived wound healing factors (PDWHF). Ann Surg. 1986 Sep;204(3):322-30.
19. Carrasco J, Bonete D, Gomar F. Plasma rico en plaquetas vs. Plasma rico en factores de crecimiento. Revista Española de Cirugía Osteoarticular. 2009;239(46):12740.
20. Rõzman P, Bolta Z. Use of platelet growth factors in treating wounds and softtissue injuries Acta Dermatoven APA. 2007;16(4):156-65.
21. Romo Rivera J, Gámez Sisaldre LG, Escriva Machado J. Factores de crecimiento en cirugia ortopédica. 2009:5(1): 88-92. Disponible en: http://www.medigraphic.com/pdfs/orthotips/ot -2009/oto91i.pdf
22. Stellos K, Kopf S, Paul A, Marquardt JU, Gawaz M, Huard J, et al. platelets in regeneration. Semin Thromb Hemost. 2010;36(2):175-84.
23. Stellos K, Gawaz M. Platelet interaction with progenitor cells: potential implications for regenerative medicine. Thromb Haemost. 2007 Nov;98(5):922-9.
24. Backly RE, Ulivi V, Tonachini L, Cancedda R, Descalzi F, Mastrogiacomo M. Platelet lysate induces in vitro wound healing of human keratinocytes associated with a strong proinflammatory response. Tissue Eng: Part A. 2011;17(13 y 14):1787-1800.
25. Mendieta-Archundia TR, AlvaradoSoriano JC, Negrete-Corona J. Utilidad del plasma rico en plaquetas y factores de crecimiento en defectos óseos, experiencia en el Hospital Regional Lic. Adolfo López Mateos del ISSSTE. Acta Ortopédica Mexicana. 2007;15(5):256-60.
26. Weyrich AS, Zimmerman GA. Platelets: signalling cells inside the immune continuum. Trends Immunol. 2004;25(9):489-95.
27. Tang YQ, Yeaman MR, Selsted ME. Antimicrobial peptides from human platelets. Infect Immun. 2002;70(12):6524-33 DOI:10.1128/IAI.70.12.6524-6533.2002.
28. Platelets Concentrates. Transfus Med Hemother. 2009;36(6):372-82. PMID: 21245968
29. González Lagunas J. Plasma rico en plaquetas. Rev Esp Cir Oral y Maxilofac. 2006;28(2):89-99.
30. Martínez González JM, Cano Sánchez J, Gonzalo Lafuente JC, Campo Trapero J, Esparza Gómez GC, Seoane Lestón JM. ¿Existen riesgos al utilizar los concentrados de plasma rico en plaquetas (PRP) de uso ambulatorio? Medicina Oral. 2002;7:375-90.
31. Beca T, Hernández G, Morante S, Bascones A. Plasma rico en plaquetas. Una revision biblografica. Avances en Periodoncia. 2007;19(1):39-52.
32. Landesberg R, Roy M, Glickman RS. Quantification of growth factor levels using a simplified method of platelet rich plasma gel preparation. J Oral Maxillofac Surg. 2000;58:297-300.
33. Appel TR, Pötzsch B, Muller J, von Linden JJ, Berge SJ, Reich RH. Comparison of three different preparations of platelet concentrates for growth factor enrichments. Clin Oral Implants Res. 2002;13:522-8.
34. Weibrich G, Kleis WK. Curasan PRP kit vs PCSS PRP system. Collection efficiency and platelet counts of two different methods for the preparation of platelet rich plasma. Clin Oral Implants Res. 2002;13:437-43.
35. López-Oliva Muñoz F, Vicario Espinosa R, Almoguera Villacañas JR. Plasma rico en plaquetas. Analisis comparativo de cuatro presentaciones comerciales. Patologia del Aparato Locomotor. 2003;1(1):5966.
36. Plöderl K, Strasser C, Hennerbichler S, Peterbauer-Scherb A, Gabriel C. Development and validation of a production process of platelet lysate for autologous use. Platelets. 2011;22(3):204-9.
37. Geremicca W, Fonte C, Vecchio S. Blood components for topical use in tissue regeneration: evaluation of corneal lesions treated with platelet lysate and considerations on repair mechanisms. Blood Transfus. 2010;8:107-12.
38. Zagai U, Fredriksson K, Rennard SI, Lundahl J, Sköld CM. Platelets stimulate fibroblast-mediated contraction of collagen gels Respir Res. 2003 Oct;4:13.
39. McAleer JP, Sharma S, Kaplan EM, Persich G. Use of autologous platelet concentrate in a nonhealing lower extremity wound. Advances in Skin & Wound Care. 2006;19(7):354-63. DOI:00129334-200609000-00010.
40. Greppi N, Mazzucco L, Galetti G, Bona F, Petrillo E, Smacchia C, et al. Treatment of recalcitrant ulcers with allogenic platelet gel from pooled platelets in aged hypomobile patients. Biologicals. 2011;39:73-80.
41. Perseghin P, Sciurelli G, Beletti D, Speranza T, Pogliani EM, Ferro O, et al. Frozen and thawed allogenic platelets gels for treating postoperative chronic wounds. Transfusion. 2005;45:1544-6.
42. Zenker S. Le plasma riche en plaquettes(PRP) pour la réjuvénation du visage. J. Med Esth Chir Derm. 2010;XXXVII(148):179-83.
43. Serra Renom JM, Muñoz del Olmo JL, Gonzalo-Caballero C. Uso de los factores de crecimiento plaquetar unidos a injertos de grasa para lipofiling facial en retidectomia. Cir Plas Iberolatinoam. 2006;36(3):191-8.
44. Peerbooms JC, van Laar W, Faber F, Schuller HM, van der Hoeven H, Gosens T. Use of platelet rich plasma to treat plantar fasciitis: desing of a multicentre radomized controlled trial. BMC Musculoskeletal Disorders. 2010;11:69. Disponible en: http://www.biomedcentral.com/1471-2474/11/69 doi:10.1186/1471-2474-11-69.
45. Chiang C, Su C, Huang C, Chen W, Chen T, Tzeng Y. Early experience and results of bone graft enriched with autologous platelet gel for recalcitrant nonunions of lower extremity. J Trauma 2007;63:655-61.
46. Collazo Álvarez H, Collazo Marin SY, Boada NM. Factores de crecimiento plaquetarios en lesiones traumáticas óseas y pseudotumorales. Rev Cubana Hematol Inmunol Hemoter. 2009;25 (1) Supl. A1. Resúmenes Orales Hematología. Resumen 3-3-21. Disponible en: http://bvs.sld.cu/revistas/hih/vol25-4-09/hih 02409.htm
47. Thanasas C, Papadimitriou,G, Charalambidis C, Paraskevopoulos I, Papanikolaou A. Platelet-rich plasma versus autologous whole blood for the treatment of chronic lateral elbow epicondylitis. A randomized controlled clinical trial. Am J Sports Med. 2011; Vol. XX, No. X DOI: 10.1177/0363546511417113.
48. Torabinejad M, Turman M. Revitalization of tooth with necrotic pulp and open apex by using platelet-rich plasma: a case report. JOE. 2011 February;37(2):265-8.
49. Jiménez- Barragán K, González-Sánchez JG. Uso de plasma rico en factores de crecimiento para disminuir la recurrencia de fístulas nasopalatinas en pacientes con antecedente de paladar hendido. AN ORL MEX. 2011;56(2):63-75.
50. Yuan NB, Wang C, Wang Y, Yu TT, Shu SQ, Liu M, et al. The preliminary application of autologous platelet-rich gel used to trat refractory diabetic termal ulcer. Sichuan Da Xue Xue Bao Yi Xue Ban. 2007;38(5):900-3.
51. Artaza H, García S, Hernández P, Fernández N, González AI, González T, et al. Implante de plaquetas en pacientes con insuficiencia arterial crónica de los miembros inferiores, estadio IIb. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet]. 2011;27(4). Resúmenes de la Jornada Científica conjunta del Instituto de Hematología e Inmunología (IHI) y el Hospital General Docente "Enrique Cabrera". Disponible en: http://bvs.sld.cu/revistas/hih/vol27_4_11 /hie11411.htm
52. García S, Artaza H, Hernández P, Blanco A, Goicoechea P, Atencio E, et al. Implante intralesional de plaquetas en el pie diabético isquémico. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet]. 2011;27(4). Resúmenes de la Jornada Científica conjunta del Instituto de Hematología e Inmunología (IHI) y el Hospital General Docente "Enrique Cabrera". Disponible en: http://bvs.sld.cu/revistas/hih/vol27_4_11/hie11411.htm
53. Márquez de Aracena R, Montero de Espinosa I, Muñoz M, Pereira G. Aplicación subconjuntival de concentrado de plaquetas plasmáticas en el tratamiento de quemaduras oculares. Resultados preliminares. Arch Soc Esp Oftalmol. 2007;82(8): ISSN 0365-6691 doi:10.4321/S0365-66912007000800005.
54. Alió JL, Arnalich-Montiel F, Rodriguez AE. The role of "Eye platelet rich plasma" (E-Prp) for wound healing in ophthalmology. Curr Pharm Biotechonol. 2011 Jul 8. (Epub ahead of print.) PMID: 21740369.
55. Landi A, Tarantino R, Marotta N, Ruggeri AG, Domenicucci M, Gludice L, et al. The use of platelet gel in postero-lateral fusion: preliminary results in a series of 14 cases. Eur Spine J. 2011 may;20(Suppl 1):S61-7.
56. Khalafi RS, Bradford DW, Wilson MG. Topical application of autologous blood products during surgical closure following a coronary artery bypass grafo. Eur J Cardiothorac Surg. 2008;34(2):360-4.
57. Doucet C, Ernou I, Zhang Y, Llense JR, Begot L, Holy X, et al. Platelet lysates promote mesenchymal stem cell expansion: a safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 2005 Nov;205(2):228-36.
58. Castegnaro S, Chieregato K, Maddalena M, Albiero E, Visco C, Madeo D, et al. Effect of platelet lysate on the functional and molecular characteristics of mesenchymal stem cells isolated from adipose tissue. Curr Stem Cell Res Ther. 2011 Jun 2;6(2):105-14.
59. Zurita M, Aguayo C, Vaquero J. Utilidad del plasma rico en plaquetas como soporte de células estromales en terapias regenerativas del Sistema Nervioso. Trauma Fund MAPFRE. 2011;22(1):38-46.
60. Chie Niimura del Barrio M, AtenciaFernández S. Tratamiento con factores de crecimiento plaquetario de una rotura parcial del flexor digital superficial en un caballo de carreras. RCCV. 2007;1(2):208.
61. Lacci KM, Dardik A. Platelet-rich plasma: support for its use in wound healing. Yale J Biol Med 2010;83:1-9.
62. Torricelli P, Fini M, Filardo G, Tschon M, Pischedda M, Pacorini A, et al. Regenerative medicine for the treatment of musculoskeletal overuse injuries in competition horses. Int Orthop. 2011;35(10):1569-76.
Recibido: 15 de junio del 21012.
Aprobado: 15 de julio del 2012.
Dra. Norma Fernández-Delgado. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: rchematologia@infomed.sld.cu
Website: http://www.sld.cu/sitios/ihi